燃料油中的硫化物燃烧会产生SOx, 形成酸雨和空气污染, 已经是一个世界公认的环境污染问题.为了减少空气中硫化物的排放, 各国均出台严格的标准控制成品油的硫含量[1-2].传统的加氢脱硫技术能够高效的脱除硫醇、硫醚和二硫化物, 但是难以脱除芳香族类硫化物, 而且脱硫条件苛刻[3-6].芳香族类硫化物的脱除技术又称深度脱硫技术.近年来, 研究者开发了许多新的深度脱硫技术, 如氧化脱硫[7-8]、萃取脱硫[9-10]、吸附脱硫[11-12]、仿生脱硫[13]、离子液体脱硫[14-15]等, 其中, 氧化脱硫技术是一种很有前景的深度脱硫技术.过氧化氢又是一种常用的氧化剂, 具有廉价、绿色、无腐蚀的特点[16-17].对于氧化脱硫技术, 催化剂的存在可以有效的提高脱硫效率, 因此, 提出了催化氧化脱硫技术[18].根据催化剂的种类分为均相催化、非均相催化和生物催化等, 非均相催化剂由于催化剂具有易于回收的特点, 而被广泛的采用[19-20].过渡金属如Ti、Cr、Fe、Co、V、Mo、W等常作为非均相催化剂的活性组分, 吸引了大量研究者关注和研究[21].常用的催化剂载体包括单金属氧化物、复合金属氧化物和分子筛等[22], 然而这些催化剂大多制备方法复杂, 或成本高昂.近年来非贵金属Cu作为氧化脱硫活性组分已有报道, 但制备的催化剂活性不高, 脱硫率较低, 活性组分易流失[23], 作者前期研究也证实这一点.
CeO2是很好的催化剂助剂, 具有很强的储氧能力, 添加入催化剂中可以提高催化剂活性组分的分散性和催化活性.为了提高SiO2-CuO脱硫活性, 我们以硝酸铈为铈源, 通过CeO2对SiO2-CuO催化剂进行改性, 以氧化脱硫反应为探针, 双氧水为氧化剂, 考察制备方法、焙烧温度、负载量等因素对SiO2-CuO-CeO2氧化脱硫活性的影响, 结合相应的表征, 探寻简单的制备方法、最佳的焙烧温度和适宜的负载量.
1 实验部分 1.1 实验试剂石油醚, 无水碳酸钠, 乙腈, 30% H2O2, 均为天津市致远化学试剂有限公司生产;正硅酸乙酯, 天津市登科化学试剂有限公司生产;硝酸, 盐酸, 四川西陇化工有限公司生产;硝酸铜, 硝酸铈, 上海山浦化工有限公司生产;苯并噻吩, 比利时Acros Organics生产;正庚烷, 天津市富宇精细化工有限公司生产;所有试剂均为分析纯.
1.2 催化剂的制备溶胶-凝胶法:按一定的比例配置正硅酸乙酯、无水乙醇和硝酸溶液, 搅拌均匀, 向其中逐滴滴加硝酸铜和硝酸铈的水溶液, 滴加完全后, 搅拌一定时间, 室温老化24 h, 干燥12 h后, 在500 ℃焙烧一定时间, 即制得SiO2-0.1CuO-xCeO2, 其中x为催化剂中Ce与Si的摩尔比.
上述方法中, 省去硝酸铈后, 制得的催化剂, 即为SiO2-0.1CuO催化剂.
浸渍法:称量计算量的硝酸铈溶于蒸馏水中, 搅拌至完全溶解, 加入自制的SiO2-0.1CuO, 搅拌一定时间, 静置过夜, 蒸干, 干燥12 h后, 在500 ℃焙烧一定时间.
机械混合法:按照Ce与Si的摩尔比0.02, 计算称量一定量的SiO2-0.1CuO和硝酸铈于研钵中, 充分研磨混合.
1.3 催化剂表征XRD表征采用德国布鲁克D8 Advance, 电压40 kV, 电流40 mA, 步长0.02°. SEM表征采用日本日立电子S4800, 冷场发射扫描电镜, 加速电压5 kV. N2吸附-脱附采用NOVA 2000e型比表面积孔径快速分析仪, 液氮为吸附质, 吸附温度为77 K, 样品在20 mL/min的纯N2中100 ℃下预处理30 min. TG-DSC测定采用美国TA公司SDT Q600 DSC Q2000联用测定, 空气气氛, 升温速率10 ℃/min. H2-TPR表征在常压微型石英管反应器上进行, 试样用量为0.050 g, 升温速率10 ℃/min, 以H25%为还原气, 流速15 mL/min, 热导检测耗氢量.
1.4 氧化脱硫反应依次向反应体系中 (锥形瓶反应器) 加入模拟油10 mL、溶剂3 mL、催化剂0.050 g、氧化剂0.1 mL, 在反应温度65 ℃下, 持续搅拌反应60 min, 取反应体系中的油相层进行燃灯法硫含量分析 (GB/T380).模拟油的组成为: 500 mg·L-1(按S计) 的苯并噻吩.在反应过程中, 硫化物首先被溶剂乙腈萃取出来, 然后被氧化成相应的亚砜和砜.总脱硫率是两步共同作用的结果.
根据下式计算脱硫率:
| ${\rm{Desulfurization}}\;{\rm{rate = }}\frac{{{C_0}-C}}{{{C_0}}} \times 100\% $ |
式中: C0为模拟油中的硫含量;C为反应处理后的模拟油中的硫含量.
2 催化剂的表征 2.1 XRD表征 2.1.1 不同方法制作的催化剂的XRD谱图图 1为不同方法制备的SiO2-0.1CuO-0.02CeO2催化剂的XRD谱图.由图 1可知, 3种催化剂中均存在的CuO的特征衍射峰, 对比发现浸渍法的衍射峰强度最强, 其次是溶胶凝胶法, 最弱的是机械混合法;图中2θ=28°、32.5°、47.5°、57°、68°、76°、78°是CeO2的特征衍射峰, 机械混合法和浸渍法制得的催化剂中均出现了CeO2的衍射峰, 机械混合法的峰强度最高, 浸渍法的峰强度其次, 两者有CeO2晶相形成, 溶胶凝胶法无明显的衍射峰, 无CeO2晶相形成, 分散度较高.虽然机械混合法制备的CuO的特征衍射峰弱于溶胶凝胶法, 但是由于混合不均, 造成催化剂内有大量的CeO2晶体形成, 呈聚集体状态, 这可能抑制了CuO晶粒的形成, 形成了大量CuO弥散峰, 最终导致催化剂氧化活性略差, 氧化效果不好, 图 7也证实了这一点.浸渍法制备的催化剂, 由于CeO2的特征衍射峰较弱, 形成的CeO2团聚体较少, 分散度较好, 部分CeO2没有起到抑制CuO聚集的作用, CuO特征衍射峰较强且尖锐, 说明CuO晶体发生聚集, 分散度不好.溶胶-凝胶法制备催化剂具有脱硫效果较好, 这可能是因为CuO和CeO2特征衍射峰强度均较弱, 两者之间存在相互作用, 此时达到最佳.

|
图 1 不同方法制备的SiO2-0.1CuO-0.02CeO2s催化剂的XRD谱图 Figure 1 XRD patterns of SiO2-0.1CuO-0.02CeO2 catalyst prepared by different methods (① Mechanical mixing method; ② Sol-gel method; ③ Impregnation method) |

|
图 2 不同焙烧温度制得的SiO2-0.1CuO-0.02CeO2催化剂XRD谱图 Figure 2 XRD patterns of SiO2-0.10CuO catalysts with different calcination temperature (①-400 ℃; ②-450 ℃; ③-500 ℃; ④-600 ℃) |
|
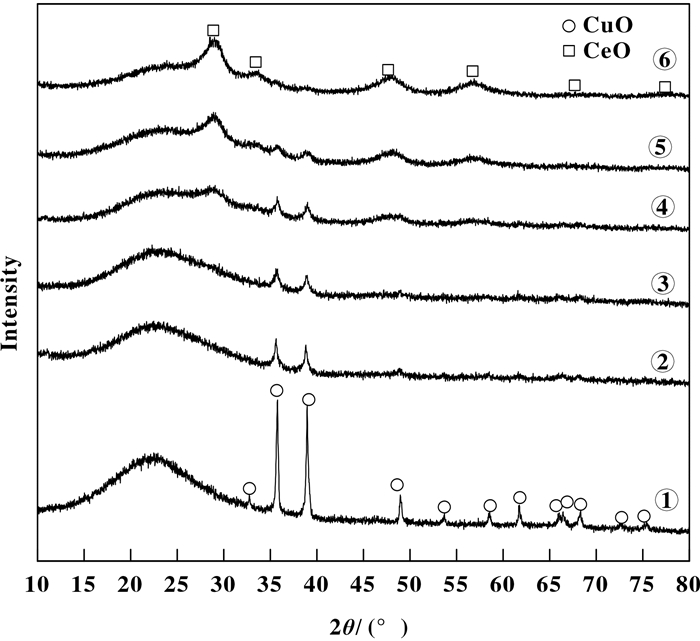
图 3 不同Ce/Si摩尔比的SiO2-0.1CuO-xCeO2催化剂的XRD谱 Figure 3 XRD patterns of SiO2-0.1CuO-xCeO2 catalysts with different Ce/Si molar ratio (① x=0.00; ② x=0.01; ③ x=0.02; ④ x=0.04; ⑤ x=0.06; ⑥ x=0.1) |

|
图 4 (a) SiO2-0.1CuO的SEM图 (b) SiO2-0.1CuO-0.02CeO2的SEM图 Figure 4 SEM images of catalysts SiO2-0.1CuO (b) SEM images of catalysts SiO2-0.1CuO-0.02CeO2 |
|
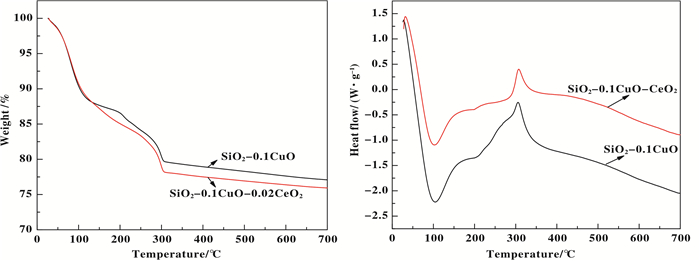
图 5 样品SiO2-0.1CuO和SiO2-0.1CuO-0.02CeO2焙烧前的TG-DSC图 Figure 5 TG-DSC anlysis of SiO2-0.1CuO and SiO2-0.1CuO-0.02CeO2 before calcining |

|
图 6 催化剂的SiO2-0.1CuO和SiO2-0.1CuO-0.02CeO2的H2-TPR谱图 Figure 6 H2-TPR anlysis of SiO2-0.1CuO and SiO2-0.1CuO-0.02CeO2 |

|
图 7 不同方法制备SiO2-0.1CuO-0.02CeO2催化剂的脱硫率 Figure 7 Desulfurization rate of SiO2-0.1CuO-0.02CeO2 prepared by different methods |
图 2为采用溶胶-凝胶法制备的催化剂在不同焙烧温度制得的SiO2-0.1CuO-0.02CeO2催化剂的XRD谱图.由图 2可以看出, 不同焙烧温度制备出来的复合氧化物, 均出现CuO特征衍射峰, 未见CeO2的特征衍射峰, CuO的峰强度大小顺序为④ > ③ > ① > ②, 即600 ℃最高, 450 ℃的最低, 这说明500 ℃焙烧制得的催化剂中形成较多的CuO, 分散度较好, 600 ℃焙烧制得的催化剂中CuO发生聚集或者烧结, 活性组分的分散度较差, 400和450 ℃焙烧, 温度较低, 可能硝酸盐分解不够完全, 造成催化剂内、外表面上CuO晶粒数量偏少, 虽其衍射峰强度较低, 晶粒较小, 但CuO在催化剂中的分散度还是偏低.
2.1.3 不同负载量的催化剂的XRD谱图 3为采用溶胶-凝胶法制备的不同Ce/Si摩尔比的催化剂的XRD谱图.由图 3可知, 2θ=32°、35°、39°、48°、53°、57.5°、66°、68°、72.5°、75°是CuO的特征衍射峰 (见图 3①), 添加助剂铈之后 (见图 3②), 除了CuO的特征衍射峰未见其它衍射峰, 而且CuO的峰强度明显弱于SiO2-0.1CuO, 这说明, Ce添加到催化剂中, CeO2在催化剂中高度分散[24];作为隔离剂, 阻止了CuO在催化剂内部形成聚集体, 抑制了CuO的烧结和聚集[25-26], 提高了CuO的分散度.随着Ce添加量的增加, CuO的衍射峰峰强度在逐渐减弱, 但CeO2的衍射峰峰强度逐渐增加.在Ce与Si的摩尔比为0.04时, 催化剂上出现了微弱的CeO2衍射峰, 由此可见, Ce与Si摩尔比 < 0.04时, 随着Ce含量的增加, CuO的衍射峰强度逐渐降低, 未发现CeO2的特征峰, 这可能是Ce含量较少, 或者CeO2分散度较高, 阻碍了CuO在活性位上聚集形成晶相[27], CuO在催化剂上的分散度增强;而当Ce与Si的摩尔比≥0.04时, 随着Ce含量的增加, CuO的衍射峰强度持续降低, CeO2峰强度逐渐增强, 但仍成弥散峰, 这说明随着Ce含量的增加, 催化剂会形成弥散CeO 2晶相, 这可能是因为CuO也是CeO2的阻隔剂, 阻碍CeO2聚集形成明显的CeO2聚集体, 抑制了CeO2晶粒的长大[25-26].可见, CeO2和CuO的配比可能存在最佳值, 这可能是因为两者存在协同作用[28].
2.2 SEM表征SiO2-0.1CuO和SiO2-0.1CuO-0.02CeO2SEM照片如图 4所示.从图 4(a)可以看出, CuO:SiO2=0.1:1的比例加入SiO2晶体中, 由图可知一次粒子直径大小约为0.2~0.6 μm.进一步观察发现SiO2-0.1CuO的一次粒子具有较严重的聚集现象, 几十个一次粒子团聚形成无规则的二次粒子, 而且二次粒子之间存在很多形状各异的孔.由此可见, 用溶胶凝胶法制备的催化剂是多孔性物质.催化剂出现团聚现象, 说明催化剂活性组分分散性不好.
从图 4(b)可以看出, 以Si:Ce=1:0.02的比例引入相应比例的CeO2, 添加Ce的催化剂中CuO的分散性较好, 与图 4(a)对比可知, SiO2-0.1CuO-0.02CeO2复合氧化物的表面形成了一层覆盖物, 上面仍有一定的空隙, 表明SiO2-0.1CuO的孔洞并没有完全阻塞, 有利于提高催化剂的比表面积;SiO2-0.1CuO-0.02CeO2表面的颗粒粒径减小 (0.1~0.5 μm), 而且分散的更均匀, 说明引入Ce改善了催化剂的表面形态, 提高了CuO在SiO2中的分散度, 这有利于提高催化剂的活性.
2.3 TG-DSC表征样品SiO2-0.1CuO和SiO2-0.1CuO-0.02CeO2焙烧前的TG-DSC图, 如图 5所示.由图 5可以看出, CeO2改性前后的催化剂的TG和DSC曲线趋势变化不大.在TG曲线上, 当温度小于100 ℃, 曲线斜率较大, 失重较快;100~300 ℃之间, 曲线斜率变小, 失重较慢, 但是在300 ℃时, CeO2改性后的SiO2-0.1CuO-0.02CeO2的失重率高于未改性的催化剂, 这可能是因为改性后的催化剂, 增加了硝酸铈的分解过程;当温度高于300 ℃, 曲线斜率变小, 失重率变化不大.对应在DSC曲线上, 我们发现两者在100 ℃均左右出现一个的明显吸热峰, 为物理吸附水失去过程, 但是, 改性后的催化剂的吸热峰小于未改性的催化剂吸热峰, 这可能是添加CeO2后, 改善了催化剂的内部结构, 导致吸附的水量减少, 导致TG曲线此处的失重率比未改性的催化剂略高;在200 ℃左右均出现一个微弱的吸热峰, 为催化剂中结合水和硝酸盐结晶水失去过程;在300 ℃左右均出现一个强烈的放热峰, 这是催化剂表面有机物燃烧放热[29-30]以及硝酸盐的分解[31-32], 由于改性后的催化剂在制备过程中, 新加入了一定量的硝酸铈, 其分解过程放热, 导致此时的吸热峰强度高于未改性的催化剂;在500 ℃左右均出现一个微弱的放热峰, 可能是CuO的晶化峰和剩余未分解的NO3-分解峰[30, 33].
2.4 BET表征表 1为SiO2、SiO2-0.10CuO和SiO2-0.10CuO-0.02CeO2的BET表征结果.由表 1可知, SiO2的比表面积为737 m2·g-1, 在SiO2中负载CuO上后比表面积降低为591 m2·g-1, 孔径略有增加, 从2.40增加到2.43 nm.这可能是因为负载CuO后, 催化剂出现晶粒团聚现象. CeO2的添加可以提高催化剂比表面积和孔径, 分别为686 m2·g-1和2.5 nm, 但是比表面积仍然低于纯载体SiO2, 孔径略高, 进一步证实了CeO2可以提高CuO在载体表面的分散度, 但可能由于是双金属负载, 仍有少量CuO聚集, 堵塞了催化剂孔道, 导致催化剂的比表面积降低;制备过程中新引入的少量硝酸铈在焙烧过程中, 可能起到了增强扩孔作用, 导致孔径略有增加.
| 表 1 催化剂的BET数据 Table 1 BET results of the catalysts |
SiO2-0.1CuO和SiO2-0.1CuO-0.02CeO2焙烧前的H2-TPR谱图, 如图 6所示.由图 6可以看出, 改性前后的催化剂在300 ℃处均只出现一个还原峰.未改性的SiO2-0.1CuO在谱图上, 在300 ℃处出现一个明显的还原单峰, 应该归属于CuO, 与文献[34]报道一致, 说明催化剂上只有一个铜物种. CeO2改性前后的催化剂的H2-TPR在300 ℃处出现一个还原单峰, 峰宽、峰高及峰面积均小于SiO2-0.1CuO, 初始还原温度略有增加, 这说明CeO2的添加, 还原所需要的氢气量减少, 这可能是改性后的催化剂中少量的Cu进入到了催化载体或者CeO2晶格中, 形成了固溶体结构, 增强了金属之间或者金属与载体之间的相互作用, 提高了活性组分的分散度.改性后的催化剂仅有一个CuO的还原峰, 这可能存在两个原因:一方面CeO2的含量较少, 还原峰较弱, 在谱图上很难发现;另一方面, CeO2与CuO或者与SiO2形成了强烈的相互作用, 导致未出现Ce的还原峰, 从改性后的催化剂的初始还原温度升高, 还原峰向右微移也证实了这一点.
3 氧化活性评价 3.1 不同制备方法对脱硫率的影响.图 7是SiO2-0.1CuO-0.02CeO2催化剂的脱硫率图.由图 7可知, 用浸渍法制得的催化剂氧化脱硫性能最差, 脱硫率为60.4%;溶胶凝胶法制得的催化剂性能最好, 脱硫率达到81.6%;机械混合法制得的催化剂性能居中, 脱硫率为77.5%. XRD表征结果表明溶胶-凝胶法制备的SiO2-0.1CuO-0.02CeO2复合氧化物CuO和CeO2晶相峰强度较弱, 两者的分散度较好, 催化剂具有较高的活性 (见图 1).所以, 选择溶胶-凝胶法作为催化剂的制备方法.
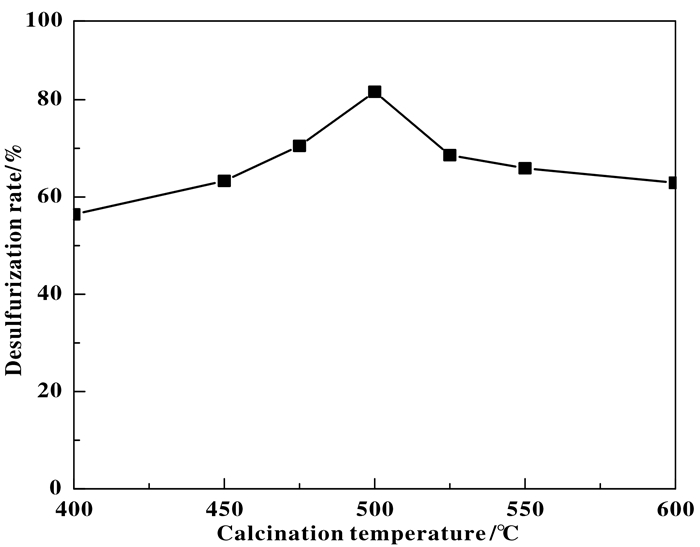
3.2 不同焙烧温度制备的催化剂对脱硫率的影响图 8不同焙烧温度制备的SiO2-0.1CuO-0.02CeO2催化剂的脱硫率图, 由图 8可知, 随着焙烧温度的增加, CuO活性相逐渐增多 (见图 2和图 5), 脱硫率逐渐增加, 焙烧温度为500 ℃时, 活性相数量最佳, 脱硫率为81.6%;继续增加焙烧温度, 由于焙烧温度的的增加, CeO2抑制CuO烧结作用减弱, 增强CuO分散性的作用减弱, 出现明显的CuO烧结聚集现象, 因此, 脱硫率逐渐减低. 500 ℃制得的催化剂氧化脱硫效果最好.
|
图 8 不同焙烧温度制备的SiO2-0.1CuO-0.02CeO2催化剂的脱硫率 Figure 8 Desulfurization rate of SiO2-0.1CuO-0.02CeO2 with different calcination temperature |
图 9为不同Ce/Si摩尔比的SiO2-0.1CuO-xCeO2催化剂的脱硫率图.由图 9可以看出, 添加适量的CeO2 可以提高脱硫率, 这主要是因为CeO2可以提高CuO分散度, 在催化剂中起到了“氧缓冲器”的作用, 从而提高催化剂的活性[35-36], 进而提高了脱硫率.最佳Ce/Si摩尔比为0.02, 脱硫率为81.6%.结合XRD和SEM表征, CeO2的引入, 提高CuO的分散度, 从而提高催化剂的活性.然而继续提高CeO2添加量时, 催化剂活性却显着下降.由XRD分析结果可知, CeO2负载量较高时在催化剂的表面会形成较大颗粒的CeO2结晶物种, 可能覆盖催化剂的活性中心, 降低催化剂的活性, 导致脱硫率下降 (见图 4).

|
图 9 不同Ce/Si摩尔比SiO2-0.1CuO-xCeO2催化剂的脱硫率 Figure 9 Desulfurization rate of SiO2-0.1CuO-xCeO2 with different Ce/Si molar ratio (Si:Cu:Ce mole ratio: 1:0.1:0.00; 1:0.1:0.01; 1:0.1:0.02; 1:0.1:0.04; 1:0.1:0.06; 1:0.1:0.1) |
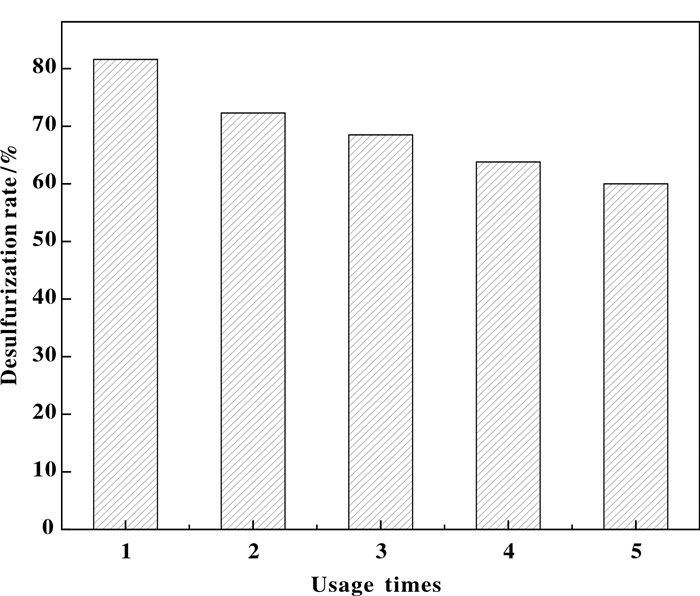
催化剂的再生:将每次反应完的液体经多次过滤、洗涤后进行干燥, 余下的催化剂在500 ℃焙烧, 备用. 图 10为催化剂的不同使用次数的脱硫率.由图 10可知, 对催化剂SiO2-0.1CuO-0.02CeO2进行回收, 经过5次使用, 脱硫率由81.6%降到了60.0%, 催化剂具有良好的重复使用性能.
|
图 10 催化剂不同使用次数的脱硫率 Figure 10 Desulfurization rate of SiO2-0.1CuO-0.02CeO2 with different cycles |
CeO2改性的SiO2-CuO-CeO2复合氧化物催化剂, 采用溶胶-凝胶法制备的催化剂脱硫率最高, 可达到81.63%.焙烧温度过高或者过低均会影响CuO的形成, 500 ℃焙烧制得的催化剂中CuO的分散度较好, 活性最好.自制的SiO2-0.1CuO复合氧化物是多孔的团聚体, 粒径0.2~0.6 μm, Cu主要以CuO的形式存在.改性后的催化剂, 粒径降低到0.1~0.5 μm, Cu仍然主要以CuO的形式存在. CeO2和CuO的配比可能存在最佳值, 两者可能存在协同作用.适当的添加助剂CeO2后, CuO在SiO2中的分散度提高、比表面积和孔径增大, 催化剂的活性提高, 脱硫率可达81.6%.催化剂的重复使用5次, 脱硫率仍可达到60.0%.
| [1] | Abdullah W N W, Bakar W A W A, Ali R, et al. Oxidative desulfurization of commercial diesel catalyzed by tert-butyl hydroperoxide polymoybdate on alumina: optimization by boxbehnken design[J]. Clean Techn Environ Policy, 2014, 16(3): 661–666. DOI:10.1007/s10098-013-0668-5 |
| [2] | Babich I V, Moulijn J A. Science and technology of novel processes for deep desulfurization of oil refinery streams: a review[J]. Fuel, 2003, 82(6): 607–631. DOI:10.1016/S0016-2361(02)00324-1 |
| [3] | Khan M R, Al-Sayed E. Hydrocarbon desulfurization to clean fuels by selective oxidation versus conventional hydrotreating[J]. Energy Sour Part A, 2007, 30(3): 200–217. DOI:10.1080/02713680701638788 |
| [4] | Lu H Y, Gao J B, Jiang Z X, et al. Ultra-deep desulfurization of diesel by selective oxidation with [C18H37N (CH3)3]4[H2NaPW10O36] catalyst assembled in emulsion droplets[J]. J Catal, 2006, 239(2): 369–375. DOI:10.1016/j.jcat.2006.01.025 |
| [5] | Ko N H, Lee J S, Huh E S, et al. Extractive desulfurization using Fe-Containing ionic liquids[J]. Energy & Fuels, 2008, 22(3): 1687–1690. |
| [6] | He L N, Li H M, Zhu W S, et al. Deep oxidative desulfurization of fuels using peroxophosphomolybdate catalysts in ionic liquids[J]. Indus & Engineer Chem Res, 2008, 47(18): 6890–6895. |
| [7] |
a. Campos-Martin J M, Capel-Sanchez M C, Perez-Presas P, et al. Oxidative processes of desulfurization of liquid fuels[J]. J Chem Technol Biotechnol, 2010, 85 (7): 879-890. b. Zhao San-ping (赵三平), Xi Hai-ling (习海玲), Zuo Yan-jun (左言军), et al. Oxidation kinetics and products of methyl phenyl sulfide, a sulfur mustard simulant by sodium molybdate catalyzed hydrogen peroxide solution (Na2MoO4催化H2O2氧化芥子气模拟剂苯甲硫醚的动力学与产物) [J]. J Mol Catal (China)(分子催化), 2015, 29 (1): 45-51. c. Zhao Kun (赵堃), Han Wei-liang (韩维亮), Zhang Guo-dong (张国栋), et al. Review of metal oxide catalysts for diesel exhaust purification (柴油车SCR脱硝金属氧化物催化剂研究进展) [J]. J Mol Catal (China)(分子催化), 2015, 29 (5): 494-504. d. Wang Zhi-cheng (王志成), Xi Hai-ling (习海玲), Kong Ling-ce (孔令策), et al. Iron (Ⅱ)-catalyzed oxidation of HD simulant CEES in ionic liquids [EMIm]NTf2 ([EMIm]NTf2中Fe2+催化氧化芥子气模拟剂CEES研究) [J]. J Mol Catal (China)(分子催化), 2016, 30 (4): 354-362. |
| [8] | Zhang J, Wang A J, Li X, et al. Oxidative desulfurization of dibenzothiophene and diesel over [Bmim]3 PMo12O40[J]. J Catal, 2011, 279(2): 269–275. DOI:10.1016/j.jcat.2011.01.016 |
| [9] | Yu G R, Li X, Liu X X, et al. Deep desulfurization of fuel oils using low-viscosity 1-ethyl-3-methylimidazolium dicyanamide ionic liquid[J]. Indus & Engineer Chem Res, 2011, 50(4): 2236–2244. |
| [10] | Mokhtar W N A W, Bakar W A W A, Ali R, et al. Deep desulfurization of model diesel by extraction with N, N-dimethylformamide: Optimization by Box-Behnken design[J]. J The Taiwan Ins Chem Engin, 2014, 45(4): 1542–1548. DOI:10.1016/j.jtice.2014.03.017 |
| [11] | Kwon J M, Moon J H, Bae Y S, et al. Adsorptive desulfurization and denitrogenation of refinery fuels using mesoporous silica adsorbents[J]. ChemSusChem, 2008, 1(4): 307–309. DOI:10.1002/(ISSN)1864-564X |
| [12] | Peralta D, Chaplais G, Simon-Masseron A, et al. Metalorganic framework materials for desulfurization by adsorption[J]. Energy & Fuels, 2012, 26(8): 4953–4960. |
| [13] | Torkamani S, Shayegan J, Yaghmaei S, et al. Study of the first isolated fungus capable of heavy crude oil biodesulfurization[J]. Indus & Engineer Chem Res, 2008, 47(19): 7476–7482. |
| [14] | Li F, Wu B, Liu R, et al. An inexpensive N-methyl-2-pyrrolidone-based ionic liquid as efficient extractant and catalyst for desulfurization of dibenzothiophene[J]. Chem Engineer J, 2015, 274: 192–199. DOI:10.1016/j.cej.2015.04.027 |
| [15] | Zhou M D, Meng W Y, Li Y, et al. Extractive and ca-talytic oxidative desulfurization of gasoline by methyltrioxorhenium in ionic liquids[J]. Energy & Fuels, 2014, 28(1): 516–521. |
| [16] | Yan X M, Mei P, Xiong L, et al. Mesoporous titania-silica-polyoxometalate nanocomposite materials for catalytic oxidation desulfurizationof fuel oil[J]. Catal Sci & Technol, 2013, 3(8): 1985–1992. |
| [17] | Zhang H X, Gao J J, Meng H, et al. Catalytic oxidative desulfurization of fuel by H2O2 in situ produced via oxidation of 2-propanol[J]. Indus & Engineer Chem Res, 2012, 51(13): 4868–4874. |
| [18] | Antony Stanislaus, Abdulazeem Marafi, Mohan S. Rana. Recent advances in the science and technology of ultra low sulfur diesel (ULSD) production[J]. Catalysis Today, 2010, 153(1): 1–68. |
| [19] | Sainan Wei, Huijun He, Yan Cheng, et al. Performances, kinetics and mechanisms of catalytic oxidative desulfurization from oils[J]. RSC Adv, 2016, 6(105): 103253–103269. DOI:10.1039/C6RA22358C |
| [20] | Liu Xian-jun(刘先军), Wang Bao-hui(王宝辉), Liu Shu-zhi(刘淑芝), et al. Research progress of oxidative desulphurization catalyst of diesel oil(柴油氧化脱硫催化剂的研究进展)[J]. Appl Chem Indus(应用化工), 2011, 40(6): 1089–1091. |
| [21] | Zapata B, Pedraza F, Valenzuela M A. Catalyst scree-ning for oxidative desulfurization using hydrogen peroxide[J]. Catal Today, 2005, 106(1): 219–221. |
| [22] | Wang Guan-gjian(王广建), Cui Hui-jie(崔会杰), Feng Qing-ji(冯庆吉), et al. Research progress in H2O2 /solid catalyst carrier for oxidative desulfurization(H2O2/固体催化剂氧化脱硫体系中载体的研究进展)[J]. Chem Indus Engineer Pro(化工进展), 2015, 34(7): 1858–1865. |
| [23] | Xu Kang-wen(徐康文), Feng Li-juan(冯丽娟), Wang Jing-gang(王景刚), et al. Oxidation-adsorption desulfurization of gasoline by mesoporous CuO/SiO2(介孔CuO/SiO2用于汽油氧化-吸附脱硫)[J]. Acta Petro Sin (Petrol Pro Sec)(石油学报 (石油加工)), 2012, 28(4): 561–565. |
| [24] | Hu Ju(胡菊), Pan Ya-lin(潘亚林), Li Han-sheng(黎汉生), et al. Preparation and properties of cerium modified Cu-based catalysts for methanol synthesis(铈改性甲醇合成铜基催化剂的制备及其性能)[J]. J Chem Indus Engineer (China)(化工学报), 2014, 65(7): 2770–2775. |
| [25] | Yang Zhi-qiang(杨志强), Mao Dong-sen(毛东森), Wu Ren-chun(吴仁春), et al. Preparation of CuO-Ce0.6Zr0.4O2 by microwave heating decomposition and its catalytic property for CO oxidation(微波加热分解法制备CuO-Ce0.6Zr0.4O2及其催化CO氧化性能)[J]. Acta Phys-Chim Sin(物理化学学报), 2011, 27(5): 1163–1168. |
| [26] | Wang Qian(王倩), Mao Dong-sen(毛东森), Fang Zhen-ni(方珍妮), et al. Effect of aluminum addition on performance of CuO-CeO2 catalyst for oxidation of CO(铝掺杂对铜铈复合氧化物催化一氧化碳氧化性能的影)[J]. Chin J Inorg Chem(无机化学学报), 2010, 26(9): 1639–1645. |
| [27] | Yang Zhi-qiang(杨志强), Mao Dong-sen(毛东森), Yang Chao-jie(杨超杰), et al. Effect of preparation method on catalytic performance of CuO-CeO2/ZrO2 for CO oxidation(制备方法对CuO-CeO2/ZrO2催化CO氧化性能的影响)[J]. Chin J Inorg Chem(无机化学学报), 2012, 28(7): 1353–1359. |
| [28] | Fei Z Y, Liu H Y, Dai Y, et al. Efficient catalytic oxidation of HCl to recycle Cl2 over the CuO-CeO2 composite oxide supported on Y type zeolite[J]. Chem Engineer J, 2014, 257: 273–280. DOI:10.1016/j.cej.2014.07.033 |
| [29] | Su Wei(苏伟), Dou Tian-jun(窦天军), Fan Xian-ping(樊先平), et al. Synthesis of porous silica gel and study on the adsorption of cerium(SiO2 多孔凝胶的制备及对铈的吸附性能研究)[J]. Chem Res Appl(化学研究与应用), 2011, 23(5): 610–614. |
| [30] | Cassano A E, Alfano O M. Reaction engineering of suspended solid heterogeneous photocatalytic reactiors[J]. Catal Today, 2000, 58(2): 167–196. |
| [31] | Yin Sheng(尹盛), Cao Juan(曹娟), Xu Hui(许晖), et al. The photocatalytic activity of CuO/BiVO4 composites under visible light(可见光响应型CuO/BiVO4的光催化活性研究)[J]. Environ Poll Cont(环境污染与防治), 2010, 32(4): 20–24. |
| [32] | Ding Z, Marten S W, Fros T R. Thermal activation of copper nitrate[J]. J Mater Sci Lett, 2002, 21(18): 1415–1417. DOI:10.1023/A:1019962632204 |
| [33] | Li Bin(李彬), Xiao Hong(肖红), Zhang Wei-gang(张维刚). Research on synthesis of luminescent glass-ceramic materials by sol-gel method(溶胶-凝胶法合成发光玻璃陶瓷材料的研究)[J]. J Chin Cera Soc(硅酸盐学报), 1990, 18(5): 414–421. |
| [34] | Espinos J P, Morales J, Barranco A, et al. Interface effects for Cu, CuO, and Cu2O deposited on SiO2 and ZrO2. XPS determination of the valence state of copper in Cu/SiO2 and Cu/ZrO2 catalysts[J]. J Phys Chem B, 2002, 106(27): 6921–6929. DOI:10.1021/jp014618m |
| [35] | Luo M F, Yan Z L, Jin L Y. Structure and redox properties of CexPr1-xO2-δ mixed oxides and their catalytic activities for CO, CH3OH and CH4 combustion[J]. J Mol Catal A: Chem, 2006, 260(1/2): 157–162. |
| [36] | Radhakrishnan R, Willigan R R, Dardas Z, et al. Water gas shift activity of noble metals supported on ceria-zirconia oxides[J]. AICHE J, 2006, 52(5): 1888–1894. DOI:10.1002/(ISSN)1547-5905 |
 2017, Vol. 31
2017, Vol. 31


