有机化学在飞速发展的同时, 也面临着许多的问题:有机合成不仅消耗了大量的不可再生资源, 也使环境污染日益严重.因此大力发展绿色化学, 走可持续发展道路的理念就逐渐成为有机化学工业发展的核心[1-2].在有机化学领域, 将伯醇氧化成羧酸是最基础的反应之一[3], 羧酸类物质可以用来生产各种增塑剂, 减冲血剂, 防腐剂[4].工业上, 往往使用过量的氧化剂来完成伯醇氧化得到羧酸的反应.在使用均相催化剂催化该反应时, 也是在有机溶剂的环境下得到羧酸产物, 使用的均相催化剂体系难以分离和难以循环使用[5-6], 并且反应结束后对氧化剂和有机溶剂的处理会对环境造成危害.
近几年来, 负载型的多相纳米金属催化剂 (如Au, Pd, Pt等) 实现了在水相中, 使用氧气完成了对醇氧化得到羧酸的反应[7].有文献报道, Au的催化活性和其纳米粒子的尺寸有非常密切的联系, 当Au的尺寸减少到10 nm以内时, 催化活性会急剧的增加[8-9].其中纳米粒子的尺寸又与其在载体中的分散状态有直接的联系, 所以载体的设计影响着催化的效果.以MgO/MgFe2O4, CeO2, TiO2和NaY等作为载体的纳米金属催化剂在催化伯醇氧化时, 条件更温和, 反应效率更高, 也更符合绿色化学的目标[4, 10-12].相比之下, 均相催化剂和多相催化剂有它们各自的优点和缺点.均相催化剂催化效率很高, 但存在催化体系难以分离和循环使用, 催化剂寿命通常较短的缺点; 多相催化剂是利用各种载体的大量表面或孔道, 将催化剂的活性组分高度分散并固定活性位不均一, 活性和选择性相对较低.准均相催化剂中的纳米粒子处于高度分散状态, 不仅拥有均相催化剂的高活性和高选择性, 还有多相催化剂的容易分离和可循环使用的优点, 在发展绿色化学方面起着极为重要的作用[13].
聚酰胺酸是合成聚酰亚胺的前驱体, 聚酰胺酸的合成工艺简单且成熟, 然而将它作纳米催化剂的保护剂的应用很少.聚酰胺酸成盐溶解于水成为一类新颖的准均相催化剂载体, 聚酰胺酸盐稳定的催化剂结合了多相催化剂和均相催化剂的优点, 可以在水相中催化各类有机反应.我们之前成功制备出了聚酰胺酸盐稳定的纳米银催化剂, 将该催化剂应用于腈类水合反应, 发现聚酰胺酸盐稳定的纳米银催化剂比同类银的多相催化剂和均相催化剂表现出了更高的催化活性[14].为了进一步探究该类准均相催化剂的应用, 我们使用一锅法制备了聚酰胺酸盐稳定的纳米金催化剂, 并将该催化剂用于伯醇的氧化反应.
1 实验部分 1.1 实验原料3, 3’, 4, 4’-二氨基二苯醚 (ODA), 上海嘉辰化工有限公司, 分析纯; 4, 4’-二苯酮四酸二酐 (BTDA), 北京马尔蒂科技有限公司, 分析纯; 氯金酸 (HAuCl4), Sigma-Aldrich公司, ACS reagent, ≥49.0% Au; 去离子水, ρ > 13 MΩ·cm; 盐酸 (HCl), 湖南汇虹试剂有限公司, 分析纯; 苯甲醇, 4-氟苯甲醇, 4-氯苯甲醇, 4-溴苯甲醇, 4-甲基苯甲醇, 4-甲氧基苯甲醇, 1-萘甲醇, 糠醇, 百灵威科技有限公司, 98%; N, N-二甲基甲酰胺 (DMF), 三乙醇胺 (TEA), 硼氢化钠 (NaBH4), 乙酸乙酯, 国药集团化学试剂有限公司, 分析纯.
1.2 催化剂的表征紫外-可见光光谱测试采用紫外-可见分光光度计 (Shimadzu UV-2450), 测试时扫描速率为1 nm/s. Au纳米粒子的晶体结构和结晶状态使用X射线衍射仪 (D/max 2500/PC) 进行分析, 样品通过使用酸沉析AuNPs-PAAS复合溶液, 用丙酮和去离子水反复洗涤, 将沉淀物直接涂覆于XRD载玻片, 压平, 室温真空干燥即可. Au纳米粒子的形貌和尺寸使用透射电子显微镜 (TITAN G2 60-300) 进行观察, 样品通过将AuNPs-PAAS复合溶液滴加于碳膜铜网上并室温晾干而得.
1.3 催化剂的制备首先, 由ODA, BTDA在极性溶剂DMF中经缩聚反应得到质量分数为15%的聚酰胺酸 (PAA) 溶液 (25 ℃下特性粘度为1.5~1.7 dLg-1), 随后往PAA溶液中加入丙酮, 充分浸泡之后过滤, 真空干燥制得PAA粉末.将等摩尔的PAA粉末和三乙醇胺加入到水中混合得到聚酰胺酸盐 (PAAS) 水溶液.冰浴条件下, 将PAAS (10 mmol/L, 基于PAA分子量, 5 mL) 水溶液, HAuCl4溶液 (20 mmol/L, 2.5 mL) 和去离子水 (35 mL) 混合后快速搅拌, 同时快速注入新配置的NaBH4溶液 (10 mmol/L, 7.5 mL), 搅拌30 min得到50 mL聚酰胺酸盐负载的金纳米粒子浓度为1 mmol/L催化剂.将制得的催化剂的水溶液置于4 ℃的冰箱保存使用.
图 1为PAAS水溶液制备金属纳米粒子的原理图, 首先, 金离子与三乙醇胺盐在水中发生离子交换进入到聚酰胺酸 (PAA) 分子链形成PAA-Au-N配合物[15].金离子迅速被NaBH4还原成零价的金, 随后形核, 长大成为金纳米粒子. PAA分子强大的网状配位能力和空间位阻效应, 可以起到稳定金纳米粒子的作用[16-17], 放置6个月还非常稳定, 没有任何沉淀.上述方法操作简单, 适合短时间制备几百毫升的催化剂.

|
图 1 PAAS水溶液中制备金纳米粒子的原理图 Figure 1 Schematic diagram for the synthesis of PAAS-stabilized AuNPs |
取AuNPs-PAAS溶液 (1 mmol/L, 2 mL) 置于反应瓶中, 加入0.2 mmol伯醇和0.4 mmol KOH, 在一个大气压的空气中, 一定温度下剧烈搅拌反应.催化剂的性能使用气相色谱仪 (GC-2014C) 进行监测, 用商业的苯甲酸作为标准物质对催化反应进行校对.使用Wondacap 17型号的GC毛细管色谱柱, 进样器温度260 ℃, 检测器温度280 ℃, 柱箱初始温度为60 ℃, 保持1 min, 之后以40 ℃/min的速率升温至280 ℃.
1.5 产物分离与催化剂的回收反应结束后, 将反应溶液的pH调至5左右, 羧酸产物即与水相分层, 过滤得到羧酸产物, 继续降低溶液pH值为2, 催化剂与水分离, 通过过滤或离心的方法可将催化剂回收, 将沉淀出的固体与2 mL去离子水混合, 并用KOH调节pH值到9重分散AuNPs-PAAS, 重分散后的AuNPs-PAAS溶液用于下一次催化.
2 结果与讨论 2.1 催化剂的表征AuNPs-PAAS的紫外-可见光谱图如图 2所示, 可以看出, 没有加还原剂时, 金离子在紫外-可见光范围内没有任何吸收峰, 当加入NaBH4还原后, 将溶液进行紫外-可见光检测, 在516 nm出现了一个微弱的吸收峰, 对应的是金属态金的等离子体共振吸收峰[18-19], 峰的位置和粒子的粒径有一定的关系, 粒子尺寸越小, 在紫外-可见光谱图上的位置会蓝移[20], 图中表明实验中成功制备出了金纳米粒子, 最大吸收峰的位置为516 nm, 估计其尺寸在10 nm以内.

|
图 2 AuNPs-PAAS的紫外-可见光光谱图 Figure 2 The UV-vis spectra of AuNPs-PAAS |
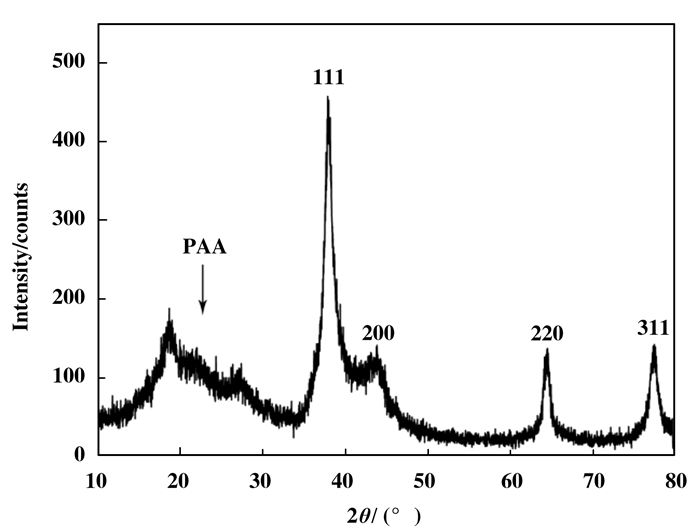
图 3是AuNPs-PAAS的XRD的表征结果, 从图中可以看到, 在2θ=20°附近的宽的漫射峰是高分子的非晶衍射峰, 即PAAS的衍射峰.而在2θ= 38.5°, 44.6°, 64.8°和77.8°的衍射峰对应的是面心立方金的 (111), (200), (220) 和 (311) 晶面, 这个结果表明实验中的金离子被还原成金单质, 且金的衍射峰有明显的宽化现象, 晶粒呈纳米分散状态, 使用谢乐公式初步估算粒子的粒径约为5 nm.
|
图 3 AuNPs-PAAS的XRD的表征结果 Figure 3 X-ray diffraction pattern of the AuNPs-PAAS |
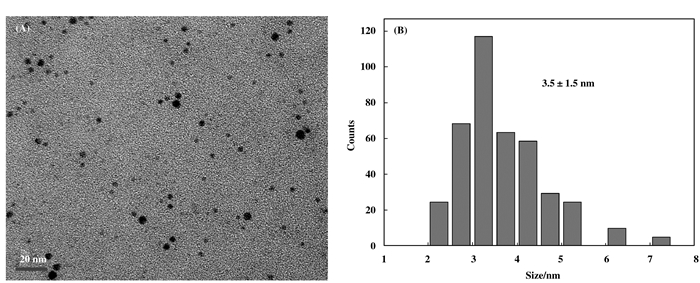
图 4为AuNPs-PAAS的透射电镜照片和金属的粒径分布, 从图中可以看出, 金纳米粒子的形状为球形, 且纳米粒子在聚酰胺酸盐溶液中高度分散, 从粒径分布图可以看出, 纳米粒子的平均尺寸为3.5±1.5 nm, 与用XRD估算的尺寸一致.
|
图 4 AuNPs-PAAS的TEM照片和金属的粒径分布 Figure 4 (A) TEM image, (B) size distribution of PAAS-stabilized AuNPs |
首先以苯甲醇的氧化反应作为模型反应, 来研究各种条件对AuNPs-PAAS催化剂催化效果的影响.如表 1所示, 在没有AuNPs-PAAS催化剂的情况下反应不能发生 (编号1), 只有当AuNPs-PAAS催化剂加入之后, 底物才开始转化, 但是单独的AuNPs-PAAS转化效率很低, 只有6%左右.随后尝试了加无机碱助催化, K2CO3对反应具有明显的助催化作用, 随着K2CO3当量的增加, 相同的反应时间里, 苯甲醇转化率不断提高 (编号2-4), 对苯甲醛的选择性逐渐降低, 对苯甲酸的选择性逐渐升高.以K2CO3为助催化剂时, 虽然转化率可以达到85%, 但对于苯甲醛、苯甲酸和苯甲酸苄酯的选择性均不高.苯甲酸苄酯在碱性条件下很容易水解为苯甲酸和苯甲醇, 强碱的加入会抑制苯甲酸苄酯的生成, 所以实验中将K2CO3换成KOH, 不仅提高了底物的转化率, 同时也提高了反应的选择性, 能够高产率的得到苯甲酸 (编号5).
| 表 1 AuNPs-PAAS催化苯甲醇的氧化反应 Table 1 The PAAS-stabilized AuNPs catalyzed oxidation of benzyl alcohol |
由表 1的优化实验得到的最优条件进行了伯醇的底物拓展, 如表 2所示, 几乎所有伯醇都能够全部氧化成相应的羧酸, 除了4-溴苯甲醇和糠醇的氧化产物中仍有少量中间产物 (主要是醛).此外, 4-氯苯甲醇和4-溴苯甲醇需要稍微提高反应温度到50 ℃, 主要是因为这两种醇的水溶性比较差.从催化的结果来看, 催化剂对底物的适应性很好.在水相中, 以常压空气为氧化剂, AuNPs-PAAS为催化剂, 伯醇可以高产率的氧化成羧酸, 而不需要用到氧气和有机溶剂, 是一种非常绿色的方法.
| 表 2 AuNPs-PAAS催化伯醇的氧化合成羧酸 Table 2 Oxidation of diverse primary alcohol catalyzed by AuNPs-PAAS |
表 3是不同的催化剂对苯甲醇催化氧化的对比, 以不同载体负载的金催化剂对苯甲醇的氧化反应时, 多相负载的催化剂需要在氧气的氛围中, 甚至需要加压, 反应才能进行, 反应温度也较高. Au/NaY和3Au1Pd/CeO2催化剂对苯甲醇氧化的选择性较高, 但是其反应温度较高, 氧气压力也比较大, Au/NaY需要在80 ℃的反应温度, 10个标准大气压的氧气压力下才能有效的催化苯甲醇的氧化, 3Au1Pd/CeO2双金属催化剂需要180 ℃的高温才能反应[21]. Au/MgO/MgFe2O4, Au-CeO2@SBA-15和Au/TiO2等金属氧化物为载体的催化剂对该反应的转化率和选择性较差, 且反应温度均为90 ℃以上.使用其它贵金属, 如Pd和Pt等, 在反应的活性和选择性方面与Au不同, Pd和Pt在对苯甲醇催化氧化时, 倾向于生成苯甲醛, 且转化率偏低, Pd/HZSM-5-N催化剂在120 ℃下, 使用通入氧气的方法, 最高的转化率为66.7%[22], 而FeOx-Pt/CNT催化剂在75 ℃下通氧气反应最大的转化率仅为26%[23].使用PAAS稳定的Ag纳米催化剂对伯醇催化氧化, 由表 3的结果可知, 在室温条件下, 该反应几乎没有发生.通过对比发现, 使用PAAS负载的Au纳米催化剂在室温条件, 水相中就可以催化伯醇氧化成羧酸, 而不需要使用氧气, 且转化率和选择性都大于99%, 金纳米粒子在溶液中的高分散性和较小的粒子粒径是该催化剂活性较高的原因.
| 表 3 各类催化剂的对苯甲醇催化氧化的活性对比 Table 3 Comparison of catalytic activity of the AuNPs-PAAS catalyst in the oxidation of benzyl alcohol with previously reported systems |
通过调节催化剂溶液的pH值, PAAS稳定的的Au纳米粒子能够实现沉降和重分散的转化, 可以实现AuNPs-PAAS的回收和循环催化. 表 4是AuNPs-PAAS对苯甲醇氧化的重复催化结果, 可以看出, 在前3次的重复催化中, 苯甲醇都能高转化率的转化为羧酸产物, 说明催化剂保持了较好的催化活性.对催化结束后的催化剂, 将其酸化离心, 取上层清液做ICP-OES分析, 结果显示, 清液中残留的金属浓度仅为10-2mmol/L, 重分散之后的催化剂中金属浓度为0.99 mmol/L, 即催化剂几乎能完全回收.但是在第4次催化时, 反应的转化率突然下降到64%.排除是因为催化剂的损失带来的影响, 随后, 对第4次反应结束后回收的催化剂进行了形貌和Au粒径大小的表征, 从图 5可以看出, Au纳米粒子的形貌和尺寸均发生了变化, 形貌与催化之前比较变得不规整, 尺寸也偏大, 最主要的是纳米粒子发生了团聚现象, 导致了催化剂活性的丧失.
| 表 4 AuNPs-PAAS对苯甲醇氧化的重复催化 Table 4 Recycling of AuNPs-PAAS in the in the oxidation of benzyl alcohol |

|
图 5 循环催化后的AuNPs-PAAS的TEM照片 Figure 5 TEM image of AuNPs-PAAS after recycling |
使用一锅法成功制备了水溶性的聚酰胺酸盐稳定的纳米金催化剂, 金纳米粒子在聚酰胺酸盐溶液中高度分散, 尺寸约为5 nm.将该准均相催化剂应用于伯醇的催化氧化, 羧酸最高产率大于99%, 与同类金催化剂比较, 反应条件更加温和.通过调节溶液的pH, 可以很容易的实现产物与反应体系分离和催化剂的回收和重复利用, 体现了准均相催化剂的优势.从制备到催化应用, 都在水相中使用一锅法完成, 为绿色合成和绿色催化.
| [1] | Min Enze(闵恩泽), Fu Jun(傅军). Progress of green chemistry(绿色化学的进展)[J]. Chem Bull (China)(化学通报), 1999, 63(1): 11–16. |
| [2] | Zhu Qingshi(朱清时). Green chemistry(绿色化学)[J]. Prog Chem(化学进展), 2000, 12(4): 410–414. |
| [3] |
a. Schmidt A K C, Stark C B W. TPAP-catalyzed direct oxidation of primary alcohols to carboxylic acids through stabilized aldehyde hydrates[J]. Org Lett, 2011, 13 (16): 4164-4167. b. Zhang Li-na (张丽娜), Deng You-quan (邓友全), Shi Feng (石峰). Preparation of Fe-doped TiO2 for the selective oxidation of aromatic alcohols with oxygen under visible light irradiation (Fe掺杂改性TiO2的制备及其可见光催化醇氧化性能研究) [J]. J Mol Catal (China)(分子催化), 2015, 29 (2): 179-187. c. Huo Wen-ge (霍文阁), Yang Mei (杨美), Zhai Lin (翟琳), et al. Synthesis of β-cyclodextrin supported 2, 2, 6, 6-tetramethylpiperidine-1-oxyland its catalytic performance on the oxidation of alcohols with molecular oxygen as oxidant (β-环糊精负载四甲基哌啶氮氧化物的合成及其在分子氧氧化醇反应中的催化性能) [J]. J Mol Catal (China)(分子催化), 2016, 30 (4): 307-316. d. Wu Cang-cang (吴藏藏), Zheng Li (郑丽), Xu Xiu-feng (徐秀峰). Selective catalytic oxidation of benzyl alcohol over Mn-Al and Cu-Mn-Al composite oxide catalysts (Mn-Al和Cu-Mn-Al复合氧化物催化苯甲醇选择氧化反应) [J]. J Mol Catal (China)(分子催化), 2016, 30 (6): 532-539. |
| [4] | De Moura E M, Garcia M A S, Goncalves R V, et al. Gold nanoparticles supported on magnesium ferrite and magnesium oxide for the selective oxidation of benzyl alcohol[J]. RSC Adv, 2015, 5(20): 15035–15041. DOI:10.1039/C4RA16159A |
| [5] | Qiu J C, Pradhan P P, Blanck N B, et al. Selective oxoammonium salt oxidations of alcohols to aldehydes and aldehydes to carboxylic acids[J]. Org Lett, 2012, 14(1): 350–353. DOI:10.1021/ol203096f |
| [6] | Mannam S, Sekar G. CuCl catalyzed selective oxidation of primary alcohols to carboxylic acids with tent-butyl hydroperoxide at room temperature[J]. Tetrahedron Lett, 2008, 49(15): 2457–2460. DOI:10.1016/j.tetlet.2008.02.031 |
| [7] | Mallat T, Baiker A. Oxidation of alcohols with molecular oxygen on solid catalysts[J]. Chem Rev, 2004, 104(6): 3037–3058. DOI:10.1021/cr0200116 |
| [8] | Buonerba A, Cuomo C, Sanchez S O, et al. Gold nanoparticles incarcerated in nanoporous syndiotactic polystyrene matrices as new and efficient catalysts for alcohol oxidations[J]. Chem Eur J, 2012, 18(2): 709–715. DOI:10.1002/chem.v18.2 |
| [9] | Goodman D W. Chemistry-Precious little catalyst[J]. Nature, 2008, 454(7207): 948–949. DOI:10.1038/454948a |
| [10] | Wang T, Yuan X, Li S R, et al. CeO2-modified Au@SBA-15 nanocatalysts for liquid-phase selective oxidation of benzyl alcohol[J]. Nanoscale, 2015, 7(17): 7593–7602. DOI:10.1039/C5NR00246J |
| [11] | Yang X M, Wang X N, Liang C H, et al. Aerobic oxidation of alcohols over Au/TiO2: An insight on the promotion effect of water on the catalytic activity of Au/TiO2[J]. Catal Commun, 2008, 9(13): 2278–2281. DOI:10.1016/j.catcom.2008.05.021 |
| [12] | Zhou L P, Yu W J, Wu L, et al. Nanocrystalline gold supported on NaY as catalyst for the direct oxidation of primary alcohol to carboxylic acid with molecular oxygen in water[J]. Appl Catal, A, 2013, 451: 137–143. DOI:10.1016/j.apcata.2012.11.003 |
| [13] | Xiao Chaoxian(肖超贤), Yan Ning(颜宁), Kou Yuan(寇元). Quasi-homogeneous catalysis: Towards green and efficiency(准均相催化:走向绿色和高效)[J]. Chin J Catal(催化学报), 2009, 30(8): 753–764. |
| [14] | Li J, Tang G N, Wang Y C, et al. Poly (amic acid) salt-stabilized silver nanoparticles as efficient and recyclable quasi-homogeneous catalysts for the aqueous hydration of nitriles to amides[J]. New J Chem, 2016, 40(1): 358–364. DOI:10.1039/C5NJ02497H |
| [15] | Qi S L, Shen X Y, Lin Z W, et al. Synthesis of silver nanocubes with controlled size using water-soluble poly (amic acid) salt as the intermediate via a novel ion-exchange self-assembly technique[J]. Nanoscale, 2013, 5(24): 12132–12135. DOI:10.1039/c3nr03212d |
| [16] | Li J, Fang Y C, He G W, et al. Preparation and characterization of poly (amic acid)-stabilized silver nanoparticles[J]. J Cent South Univer, 2013, 20(6): 1475–1481. DOI:10.1007/s11771-013-1637-1 |
| [17] | Du N A, Wong C, Feurstein M, et al. Flexible poly (amic acid) conducting polymers: Effect of chemical composition on structural, electrochemical, and mechanical properties[J]. Langmuir, 2010, 26(17): 14194–14202. DOI:10.1021/la101314j |
| [18] | Link S, Wang Z L, El-Sayed M A. Alloy formation of gold-silver nanoparticles and the dependence of the plasmon absorption on their composition[J]. J Phys Chem B, 1999, 103(18): 3529–3533. DOI:10.1021/jp990387w |
| [19] | Aryal S, Remant B K C, Dharmaraj N, et al. Spectroscopic identification of S-Au interaction in cysteine capped gold nanoparticles[J]. Spectrochim Acta, Part A, 2006, 63(1): 160–163. DOI:10.1016/j.saa.2005.04.048 |
| [20] | Yoo E J, Li T, Park H G, et al. Size-dependent flocculation behavior of colloidal Au nanoparticles modified with various biomolecules[J]. Ultramicroscopy, 2008, 108(10): 1273–1277. DOI:10.1016/j.ultramic.2008.04.051 |
| [21] | Zhang Z Y, Wang Y, Li X, et al. Synergistic effect on Au-Pd bimetallic catalyst during oxidation of benzyl alcohol to sodium benzoate[J]. Chin J Catal(催化学报), 2014, 35 (11): 1846-1857. |
| [22] | Wang Yubao (王玉宝), Chen Yujing (陈玉静). Preparation of novel Pd/HZSM-5-N catalysts and their applications in benzyl alcohol oxidation[J]. Synth Chem (China) (合成化学), 2016, 24 (5): 409-413. |
| [23] | Zhou C M, Chen Y T, Guo Z, et al. Promoted aerobic oxidation of benzyl alcohol on CNT supported platinum by iron oxide[J]. Chem Commun, 2011, 47(26): 7473–7475. DOI:10.1039/c1cc12264a |
 2017, Vol. 31
2017, Vol. 31




