2. 广西壮族自治区固体废物管理中心, 广西 南宁 530028
2. Guangxi solid waste management center, Nanning 530028, China
V2O5-WO3/TiO2(锐钛) 催化剂NH3选择性催化还原NO (NH3-SCR) 是电厂等固定源和柴油车移动源应用最为广泛的De-NOx技术之一, 其在300~400 ℃之间具有90%以上的NOx转化率, 以及较好的抗SO2中毒能力等[1-5].但是该催化技术在我国火电厂等工程应用中依然存在某些问题, 其中主要是较低温反应窗口窄和生产成本较高等.近十几年来, 研究者一直致力于对V2O5-WO3/TiO2催化剂的掺杂改性研究, 部分替代催化剂中成本较高的组分, 特别是含量达到8%~10%WO3组分, 以谋求SCR性能相近, 但更具性价比的脱硝催化剂.
V2O5/TiO2催化剂引入大量的WO3组分, 其中一个重要的原因是为了防止锐钛矿TiO2(A) 向金红石相TiO2(R) 转变, 以防止催化剂表面积下降和分散态VOx物种团聚生成V2O5晶相而降低活性[3].然而, 有趣的是, 一些研究结果表明, TiO2中引入SnO2组分后生成了金红石结构的SnTiOx复合型氧化物[6-7], 其具有与锐钛矿型TiO2相比相近的比表面积和更好的热稳定性[8-9], 并且以SnTiOx复合型氧化物为载体负载制备的V2O5/Sn0.5Ti0.5Ox和V2O5-WO3/Sn0.5Ti0.5Ox催化剂亦表现出了较好的SCR活性[10-11].如Sun等[10]报道, 以Sn0.5Ti0.5Ox氧化物为载体负载V2O5和WO3的催化剂具有很大的比表面积, 并使表面活性物种得到较好的分散, 在200~350 ℃之间取得了较好的SCR活性.另外, Dong等[11]发现, 金红石结构的Sn0.5Ti0.5Ox复合型氧化物上负载V2O5活性组分后, 催化剂表面的VOx物种能得到很好的分散, 以及产生较多B酸位中心, 从而导致其具有很高的SCR催化活性.可见, TiO2中掺杂SnO2组分后, 尽管促进生成了金红石结构的SnTiOx复合型氧化物, 但负载V2O5和WO3后催化剂均具有较好的SCR活性.然而, 现有文献结果缺乏对不同SnO2组分掺杂量对V2O5-WO3/TiO2催化剂结构及性能的影响研究以及SnO2在催化剂中的作用机制深入探讨.因此, V2O5-WO3/TiO2催化剂的SnO2掺杂改性研究是非常有意义的, 仍然值得进一步深入研究探讨.
我们拟通过利用共沉淀法将SnO2组分引入到V2O5-WO3/TiO2催化剂载体TiO2中, 主要研究SnO2组分对催化剂结构结构、表面分散物种和SCR活性的影响.
1 实验部分 1.1 催化剂制备锐钛矿型TiO2制备[12]:在冰水浴和搅拌情况下, 将14 mL TiCl4缓慢滴入500 mL水中, 配置0.25 mol/L TiCl4溶液.以2 mol/L氨水为沉淀剂, 滴加至上述溶液中至pH>9后继续搅拌1 h, 静置老化24 h.所得沉淀经过抽滤洗涤至1 mol/L AgNO3溶液检测不出Cl-为止. 100 ℃干燥过夜, 500 ℃空气气氛下焙烧4 h.锐钛矿型TiO2标记为TiO2(A).
x%SnO2-TiO2复合氧化物制备:在0.25 mol/L TiCl4溶液中加入适量SnCl4·5H2O, 以2 mol/L氨水为沉淀剂, 滴加至上述溶液中至pH > 9后继续搅拌1 h, 静置老化24 h.所得沉淀经过抽滤洗涤至1 mol/L AgNO3溶液检测不出Cl-为止. 100 ℃干燥过夜, 600 ℃空气气氛下焙烧4 h. x%SnO2-TiO2复合型氧化物标记为xSnTi.
采用共浸渍法, 以上述TiO2氧化物和复合氧化物SnO2-TiO2载体分别负载1%V2O5和5%WO3活性组分.将上述TiO2或SnO2-TiO2复合氧化物加入到15 mL的0.5 mol/L H2C2O4水溶液中 (含有偏钒酸铵、钨酸铵), 80 ℃水浴蒸干, 100 ℃干燥过夜, 500 ℃空气气氛下焙烧4 h. 1%V2O5、5%WO3、x%SnO2为其在催化剂中所占的质量百分数.所制的1%V2O5-5%WO3/TiO2催化剂标记为VW/Ti, 1%V2O5-5%WO3/x%SnO2-TiO2催化剂标记为VW/xSnTi.
金红石型TiO2制备[12]:在冰水浴和搅拌情况下, 将14 mL TiCl4缓慢滴入500 mL水中, 配置0.25 mol/L TiCl4溶液.将TiCl4水溶液在50 ℃水浴温度下搅拌24 h, 抽滤洗涤水解产物, 100 ℃干燥过夜, 500 ℃焙烧4 h. SnO2制备:将适量的SnCl4·5H2O直接在500 ℃焙烧4 h.金红石型TiO2标记为TiO2(R)
1.2 催化剂表征X射线衍射分析 (XRD):所用仪器为Philips X′ pert pro X射线衍射仪, 测定条件为Cu靶, Ni滤波片, 管压40 kV, 管流40 mA.扫描角度10°~80°.
比表面积 (BET):所用仪器为ST2000B, 200 ℃氮气氛下预处理1 h, 测试条件-196 ℃氮气吸附, 催化剂用量0.3 g.
激光拉曼光谱 (Raman):所用仪器为Thermo Fisher Scientific DXR, 测定条件为, 激光器波长为532 nm, 分辨率为1 cm-1, 扫面范围为61~1 800 cm-1.
程序升温还原 (H2-TPR):取0.1 g催化剂样品置于U型石英管中, 用 (H2+Ar) 混合气 (含H2 5%) 流经催化剂样品, 流速为20 mL/min.升温速率10 ℃/min.热导池响应耗氢信号, 得到H2-TPR谱图.用CuO作外标对TPR谱图中的耗氢峰面积进行标定, 以定量地计算催化剂的耗氢量.
X射线光电子光谱 (XPS):所用仪器为ESCALAB 250Xi (美国热电公司). MgKα为X光源, 以污染碳C 1s=284.6 eV作为校准样品荷电效应.
NH3吸附-原位漫反射红外光谱 (NH3-DRIFTS):采用赛默飞 (ThermoFisher) IS10傅里叶原位红外光谱仪, 波速范围400~4 000 cm-1, 扫描次数为16次, 分辨率为4 cm-1, 原位池窗片为KBr.取25 mg催化剂粉末, 在N2气流 (30 mL/min) 中300 ℃恒温处理0.5 h, 降至50 ℃后通入1%NH3/N2 (30 mL/min) 气至吸附饱和, 切换N2气流 (30 mL/min) 吹扫1 h, 以10 ℃/min速率升温至100 ℃, 在不同温度下记录样品的红外光谱, 得NH3-DRIFTS谱.
NH3吸附-程序升温脱附 (NH3-TPD):取催化剂样品约0.25 g置空气流 (20 mL/min) 中升温至300 ℃处理0.5 h, 切换N2气流 (20 mL/min) 降至100 ℃, 再切换纯NH3气流经样品约0.5 h.重新切换N2气流 (20 mL/min) 吹扫至热导池信号基线平稳, 以5 ℃/min速率升温至500 ℃, 热导池检测器响应脱附NH3信号, 得NH3-TPD谱图.
1.3 催化剂SCR活性评价催化剂粉末样品经研磨、压片和破碎, 取粒径0.450~0.280 mm样品, 用量0.24或0.72 g.反应前催化剂样品预先经500 ℃空气流处理0.5 h.反应条件: 150~450 ℃, 0.1 MPa, 原料气组成NO 0.075%、NH3/NO (mol ratio) =1.06和O2 3.1%, 其余为N2.混合气流量450 mL/min (空速1.11×105 mL/(g·h) 或3.75×104 mL/(g·h)).用Saltzman法 (GB/T 15436-1995) 测定反应前后NOx浓度[13-14].
2 结果与讨论 2.1 催化剂SCR活性为了消除外扩散的影响, 以使催化活性尽可能处在本征动力学区域, SCR性能评价采用了较高的空速11.13×104 mL/(g·h) 条件, 催化剂NO转化率评价结果见图 1.从图 1A中可见, 300 ℃反应温度下, VW/2.5SnTi催化剂NO转化率为27%.当SnO2的负载量介于2.5%~12.5%之间时, 随着SnO2负载量提高, VW/SnTi催化剂NO转化率逐渐从27%提高至63%;但是在SnO2负载量较高的12.5%~20%时, NO转化率递增速率减弱而趋于平缓.如图 1B所示为10SnTi、V/10SnTi、W/10SnTi和VW/10SnTi催化剂在300 ℃下的平衡转化率. 10SnTi复合氧化物其NO转化率为2%, 几乎不显活性.利用浸渍法分别对10SnTi复合氧化物负载VOx和WOx物种后, 催化剂NO转化率均有所提升, 且V/10SnTi (18%)>W/10SnTi (8%).另外, VW/10SnTi催化剂 (46%) SCR活性优于V/10SnTi催化剂 (18%), 表明在将WO3加入到V/10SnTi催化剂中能提高催化剂NO转化率. VW/10SnTi催化剂 (46%) NO转化率优于VW/Ti催化剂 (25%).此外, 从图 1C中可见, 与VW/Ti催化剂相比, VW/10SnTi催化剂的最佳转化率窗口从374拓展至285 ℃、T50窗口从275拓展至211 ℃, 显示了更佳的低温反应性能, 在150~450 ℃之间拥有更宽的反应窗口.这说明以SnTi复合氧化物为载体的V2O5-WO3催化剂具有更好的SCR活性.通常活性组分与载体之间的相互作用将影响到其在催化反应中的性能[15].因此, 将SnO2引入到VW/Ti催化剂载体TiO2中时, 可能提高了VOx和WOx物种的性能以及促进了VOx物种与WOx物种之间的相互作用, 从而提高了其催化性能, 但是当SnO2组分达到一定程度, 无法再有效提高催化剂NO转化率.
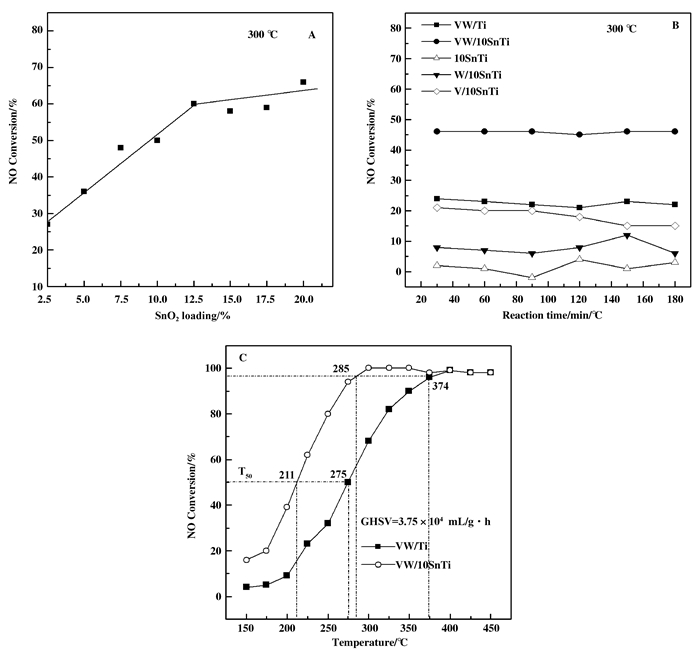
|
图 1 掺杂SnO2的VW/Ti催化剂SCR性能的影响 Figure 1 NO conversion of SnO2-modified VW/Ti catalysts |
掺杂SnO2的VW/Ti催化剂X射线衍射图谱 (XRD) 和比表面积如图 2和表 1所示.从图 2可见, VW/Ti催化剂XRD图谱中仅见TiO2(A) 衍射峰, 没有观察到V2O5和WO3的衍射峰, 说明VOx物种与WOx物种在催化剂表面高度分散. VW/SnTi催化剂XRD图中可见新增TiO2(R) 衍射峰, 表明催化剂有TiO2(R) 生成; 同时, 没有观察到SnO2、V2O5和WO3晶相衍射峰, 说明VOx物种和WOx物种在VW/SnTi催化剂表面均匀分散.随着SnO2在TiO2中负载量的增加, 25.3°处TiO2(A)-101面衍射峰逐渐减弱, 27.3°处TiO2(R)-110面衍射峰逐渐增强.通过Eq1方程计算TiO2(R) 在催化剂中所占含量[6], 其结果见表 1.
| ${X_R} = \frac{1}{{1 + \left( {0.8{I_A}/{I_R}} \right)}}$ | (1) |
式中, XR为TiO2(R) 为在样品中质量百分数, IA、IR样品中TiO2(A)-101面和TiO2(R)-110面衍射峰强度.当SnO2的负载量为2.5%时, VW/2.5SnTi催化剂中TiO2(R) 占有量为27.4%;随着SnO2负载量的增加, VW/SnTi催化剂中TiO2(R) 占有量逐渐增多, TiO2(A) 占有量逐渐减少; 掺杂量至15%Sn时催化剂中已全部转变为TiO2(R), 说明SnO2组分掺入到TiO2中能促进TiO2(R) 的生成.利用谢乐公式[8]计算TiO2(A)-101面和TiO2(R)-110面粒径结果见表 1, 随着SnO2负载量的提高, TiO2(A) 和TiO2(R) 粒径均呈现减小趋势, 表明元素Sn的掺入能抑制TiO2(A) 和TiO2(R) 的晶粒的生长.鉴于Sn4+(0.071 nm) 离子半径与Ti4+(0.068 nm) 离子半径相接近, 因此, 不论是锐钛矿型TiO2还是金红石型TiO2, 大量Sn离子能够成功插入到TiO2晶格中替换部分Ti4+, Sn、O、Ti 3者之间存在键合作用, 造成TiO2晶格扭曲和收缩, 抑制TiO2晶型生长[6-9].由于锐钛矿型TiO2是不稳定的体系, 在任何外在因素影响下都有转化为热力学稳定的金红石型结构趋势[16].根据相关报道, V2O5/TiO2和MnO2/TiO2催化剂中V4+和Mn4+插入到TiO2晶格中并取代部分Ti4+离子生成M—O—Ti键 (MV和Mn) 从而导致TiO2(A) 向TiO2(R) 转变[13, 17].另外, Gao等[7]对纯TiO2和SnTi氧化物研究发现, SnTi复合氧化物表面生成金红石型TiO2时对应的温度显著低于纯TiO2.因此, 当采用共沉淀法将元素Sn掺入到TiO2中时, 元素Sn与Ti之间以Sn—O—Ti键的方式相互作用, 降低了TiO2晶型转变温度, 促进锐钛矿型TiO2向金红石型TiO2转变.
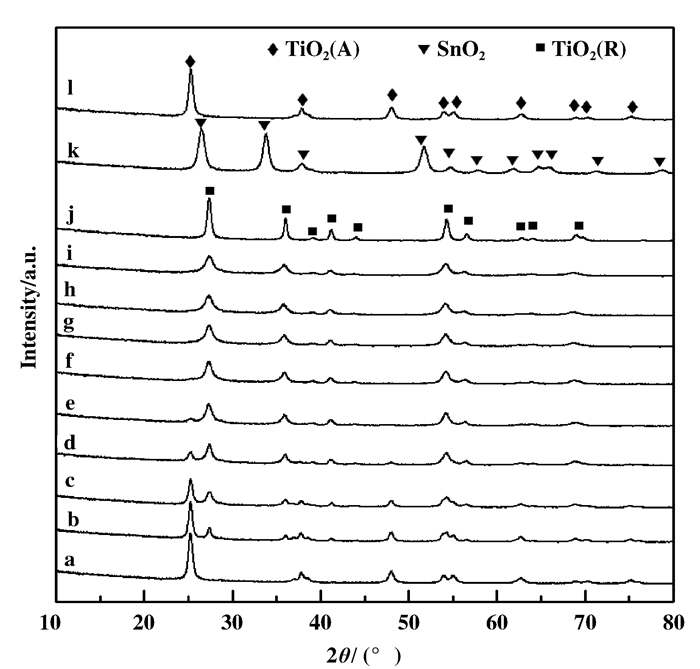
|
图 2 掺杂SnO2的VWT催化剂XRD图谱 Figure 2 XRD patterns of SnO2-modified VWT catalysts a. VW/Ti; (b~i) VW/xSnTi: b. 2.5%; c. 5%, d. 7.5%; e. 10%; f. 12.5%; g. 15%; h. 17.5%; i. 20%; j. TiO2(R); k. SnO2; l. TiO2(A) |
| 表 1 载体和催化剂的结构数据 Table 1 The textural data of supports and catalysts |
从表中1可见, VW/2.5SnTi催化剂比表面积为61.3 m2/g, 将SnO2的负载量提高至12.5%时, 催化剂比表面积从61.3 m2/g下降至44.4 m2/g; 但是将SnO2负载量继续提高至20%时, VW/SnTi催化剂比表面积不再继续下降, 反而从44.4 m2/g提高至60.2 m2/g.由于金红石型TiO2比表面积远小于锐钛矿型TiO2.因此当SnO2负载量位于2.5%~12.5%时, 催化剂比表面积逐渐减小, 主要归因于锐钛矿TiO2向金红石型TiO2转变, 金红石型TiO2在催化剂中占有量增多所致; 当SnO2负载量位于12.5%~20%时, 催化剂比表面积的增大主要归因于当SnO2掺入量为12.5%时, VW/SnTi催化剂中锐钛矿型TiO2已基本转变成金红石型TiO2, 继续对其提高SnO2负载量时, 由于元素Sn与Ti之间强相互作用抑制TiO2(R) 晶粒生长, 从而提高TiO2的比表面积.
2.3 催化剂拉曼光谱分析 (Raman)图 3为掺杂SnO2的VW/Ti催化剂的Raman图谱.从图 3中可见, VW/Ti催化剂中仅观察到146、400、518和641 cm-1处锐钛矿型TiO2拉曼特征峰[18], 表明催化剂中只存在锐钛矿型TiO2.与VW/Ti催化剂相比, VW/5SnTi催化剂在450和613 cm-1处可见新增金红石型TiO2拉曼特征峰[18], 表明在VW/5SnTi催化剂中同时存在两种晶相结构TiO2.随着SnO2在TiO2中掺入量的提高, 与VW/5SnTi催化剂相比, 锐钛矿型TiO2拉曼特征峰明显减弱, 而金红石型TiO2拉曼特征峰显著增强; 当SnO2负载量提高至15%时, VW/15SnTi催化剂Raman图谱中仅观察到金红石型TiO2拉曼特征峰, 表明在VW/15SnTi催化剂中只存在金红石型TiO2.同时, 当SnO2负载量介于12.5%~20%时, 随着SnO2负载量的增加, 金红石型TiO2拉曼特征峰强度减弱, 金红石型TiO2有序度下降.另外, 在VW/SnTi催化剂中均未在324、634和775 cm-1处观察到与晶相SnO2相关的拉曼特征峰.由此可知, 不论是锐钛矿型TiO2还是金红石型TiO2, Sn4+离子能够进入到TiO2晶格中以Sn—O—Ti键方式相互作用, 且促进锐钛矿型TiO2向金红石型TiO2转变, 与XRD分析结果一致.
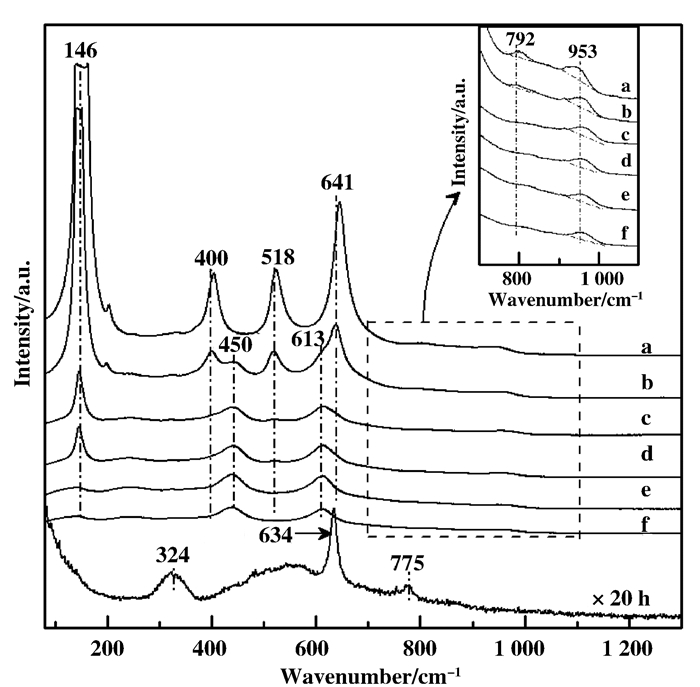
|
图 3 掺杂SnO2的VW/Ti催化剂Raman光谱 Figure 3 Raman spectra of SnO2-modified VW/Ti catalysts a. VW/Ti; b. VW/5SnTi; c. VW/10SnTi; d. VW/12.5SnTi; e. VW/15SnTi; f. VW/20SnTi |
从图 3中可见, VW/Ti催化剂W—O和WO的特征峰分别位于792和953 cm-1, 表明WOx物种以四面体和八面体形式存在[19].加入SnO2组分后, 随着负载量的提高, W—O和WO的特征峰未见明显偏移, 但是其特征峰强度逐渐减弱, 表明催化剂中部分八面体WOx物种向四面体WOx物种转变[19].
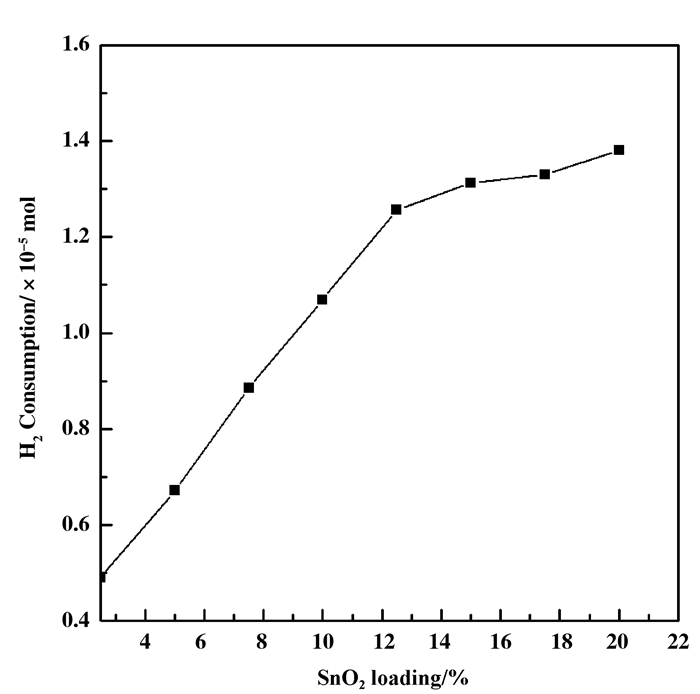
2.4 催化剂的可还原性 (H2-TPR)掺杂SnO2的VW/Ti催化剂的H2-TPR图谱如4所示. 10SnTi复合氧化物在572和800 ℃存在两个还原峰, 分别与金红石型TiO2中556 ℃处Ti4+→Ti3+的还原峰和SnO2中796 ℃处Sn4+→Sn2+还原峰相对应.加入WO3后, 10SnTi复合氧化物还原峰未见明显偏移.将V2O5组分负载到10SnTi氧化物上后, 10SnTi氧化物中Ti4+和Sn4+还原峰分别往低温方向偏移至566和774 ℃.同时, 与10SnTi和W/10SnTi催化剂相比, V/10SnTi催化剂在287 ℃处生成一个新的还原峰, 应为催化剂表面VOx物种的还原[10, 40]. VW/Ti催化剂分别在522和827 ℃存在两个还原峰, 分别为催化剂表面V5+离子和W6+离子的还原[20].将SnO2组分引入到VW/Ti催化剂载体TiO2中后, 在790 ℃处生成一个Sn4+离子的还原峰.随着引入量的提高, Sn4+离子还原峰耗氢量增大且往低温方向偏移至770 ℃, 与VW/SnTi催化剂中582 ℃处新生成的Ti4+的还原峰叠加.同时, 尽管高温段VOx物种还原峰从522偏移至548 ℃, 且耗氢量逐渐减少, 但是相应的在200~450 ℃之间处生成了一个新的VOx物种还原峰. 图 5为VW/SnTi催化剂VOx物种耗氢量与SnO2负载量的关系.当SnO2组分掺入量介于2.5%~15%时, 低温段VOx物种还原峰从339偏移至310 ℃, 耗氢量从0.49×10-5 mol提高至1.26×10-5 mol; 继续提高掺杂量至20%时, 低温段VOx物种还原峰峰顶温度基本维持在312 ℃, 且耗氢量递增速率减弱趋于平缓.由此可知, 元素Sn掺入到催化剂的载体TiO2中, 能提高催化剂VOx物种的可还原能力, 但是当SnO2组分掺入量达到一定程度后, 无法再大幅度提高其可还原能力.
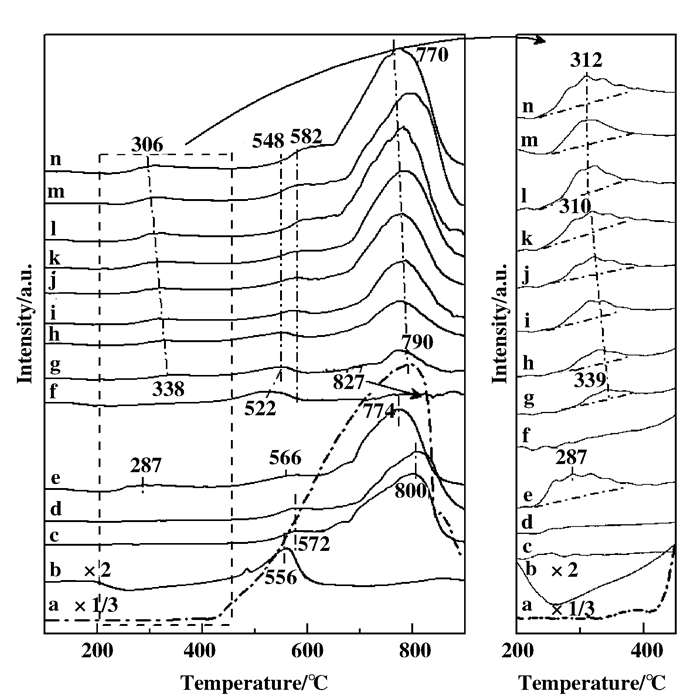
|
图 4 掺杂SnO2的VW/Ti催化剂H2-TPR图谱 Figure 4 H2-TPR profiles of SnO2-modified VW/Ti catalysts a) SnO2, b) TiO2(R), c)10SnTi, d) W/10SnTi, e) V/10SnTi, f) VW/Ti, (g~n) VW/xSnTi: g. 2.5%; h. 5%; i. 7.5%; j. 10%; k. 12.5%; l. 15%; m. 17.5%; n. 20% |
|
图 5 VW/SnTi催化剂VOx物种耗氢量与SnO2负载量的关系 Figure 5 H2 consumption of VOx species over VW/SnTi catalysts with SnO2 loading |
图 6分别为VW/Ti催化剂掺杂SnO2的XPS图谱.从Ti 2p图谱中可见, TiO2样品中, Ti 2p3/2态能级分裂峰位于458.43 eV, 表明TiO2中主要是以Ti4+为主[1, 6]. 10SnTi氧化物Ti 2p3/2态能级分裂峰位于458.34 eV, 比TiO2样品的Ti 2p3/2态能级结合能458.43低了0.09 eV, 说明将元素Sn掺入到TiO2中后, 元素Sn与Ti之间存在强相互作用, 导致部分Ti4+离子被还原成Ti3+离子[6], 与XRD和Raman结果一致.利用浸渍法对10SnTi氧化物分别负载VOx和WOx物种后, Ti 2p3/2态能级分裂峰位从458.3 eV分别迁移到458.4和458.6 eV, 表明VOx和WOx物种与元素Ti之间以V—O—Ti和W—O—Ti键方式相互作用, 降低了Ti离子周围的电子云密度.利用共浸渍法将VOx物种和WOx物种负载到10SnTi氧化物上后, Ti 2p3/2态能级分裂峰位从458.34迁移至458.46 eV. VW/SnTi催化剂中Ti 2p3/2态能级相较于与W/10SnTi催化剂, 低了0.09 eV.

|
图 6 掺杂SnO2的VW/Ti催化剂XPS图谱 Figure 6 XPS spectra of SnO2-modified VW/Ti catalysts |
从Sn 3d图谱中可见, 利用浸渍法分别对10SnTi氧化物负载VOx和WOx之后, Sn 3d5/2态能级结合能级分别从485.91迁移至485.98和486.21 eV, 表明VOx物种与WOx和元素Sn之间存在较强的相互作用, 部分电子转移到V和W离子周围, Sn离子周围电子云密度降低.利用共浸渍法将VOx物种和WOx物种负载到SnTi氧化物中后, Sn 3d5/2态能级结合能级从485.91迁移至486.12 eV, 介于V/10SnTi和W/10SnTi催化剂之间.由此可知, 在VW/SnTi催化剂表面VOx物种与WOx物种之间发生了相互作用, 可能以V—O—W的键合形式相互作用, 并减弱了VOx物种与WOx物种和载体SnTi氧化物之间的相互作用.
由于V—O—W键的形成势必对催化剂表面的WOx物种结合能态势产生影响.从W 4f图谱中可见, W/Ti和VW/Ti催化剂W 4f5/2态能级分别为37.20和37.28 eV, 相差了0.08 eV. W/10SnTi和VW/10SnTi催化剂W 4f5/2态能级分别为37.33和37.50 eV, 差值从0.08提高至0.17 eV.由此可知, VW/SnTi催化剂表面WOx与VOx物种之间的相互作用强于VW/Ti催化剂.
从V 2p图谱中可见, VW/Ti和VW/SnTi催化剂V 2p3/2态XPS峰位在514.03 ~518.50 eV范围, 表明催化剂中VOx物种分别以V5+、V4+和V3+离子的形式存在[21-22]. VW/Ti催化剂中V5+/(V5++V4++V3+) 占比为30%. SnO2组分引入到催化剂载体TiO2中, 当元素Sn负载量介于0~15%时, V5+/(V5++V4++V3+) 占比从30%提高至44%, 但是继续提高至20%时, V5+物种含量从44%提升至46%, 仅提升了2%, 递增速率减弱趋于平缓.
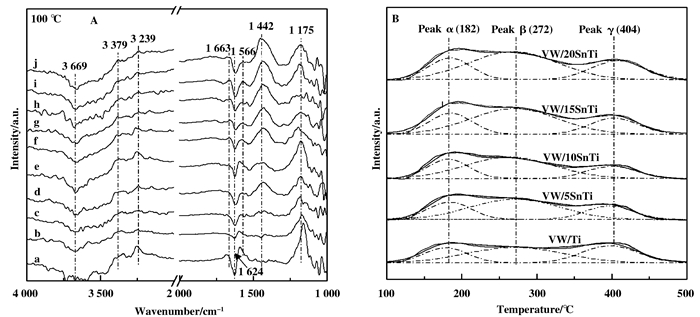
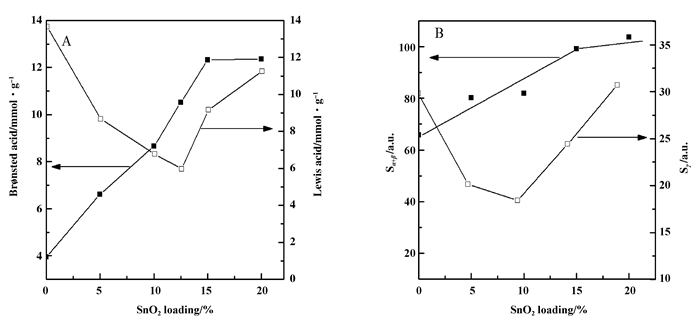
2.6 催化剂表面酸性图 7A为掺杂元素Sn的VW/Ti的100 ℃下NH3吸附-原位漫反射红外光谱 (NH3-in situ DRIFTS), 可以认为, 此时催化剂表面吸附的NH3为化学吸附态.从图 7A中可见, 1 442和1 663 cm-1处为NH3吸附在催化剂表面B酸位上形成的对称以及非对称NH4+伸缩振动, 1 175、1 566、3 239和3 379 cm-1处为NH3吸附在L酸位上形成的N—H伸缩振动, 1 624和3 669 cm-1处为吸附NH3化学反应消耗羟基所致[1, 23-25].利用1 442和1 175 cm-1处振动峰面积代入经验方程中估算VW/SnTi催化剂B酸量和L酸量和SnO2负载量之间的关系[25, 43], 其结果列于表 2, 并如图 8A所示.锐钛矿型TiO2表面仅见L酸位 (1 175 cm-1), 对其负载SnO2后, 10SnTi复合氧化物未见有B酸位生成, 表明SnO2掺入到锐钛矿型TiO2中后不会提供B酸位.利用浸渍法分别将V2O5和WO3负载到10SnTi复合氧化物上, 在1 442 cm-1处均生成新的B酸位, 表明VOx物种和WOx物种能提供B酸位.将SnO2组分引入到催化剂载体TiO2中后, 当掺杂量介于0%~15%时VW/SnTi催化剂表面B酸量逐渐从3.94递增至12.33;但是将掺杂量继续提高至20%时, VW/15SnTi和VW/20SnTi催化剂表面B酸量分别为12.33和12.36, 催化剂表面B酸量递增速率减弱趋于平缓.同时, 将SnO2组分掺入到催化剂的载体TiO2中后, 当SnO2掺入量介于2.5%~12.5%时, 随着SnO2负载量的增加, VW/SnTi催化剂表面L酸位逐渐减弱, 但是将SnO2负载量从12.5%提高至20%时, 催化剂表面L酸位不再继续减弱, 反而逐渐增强.
|
图 7 掺杂SnO2的VW/Ti催化剂NH3-DRIFTS和NH3-TPD图谱 Figure 7 NH3-DRIFTS and NH3-TPD spectra of SnO2-modified VW/Ti catalysts a. TiO2; b. 10SnTi; c. V/10SnTi; d. W/10SnTi; e. VW/Ti; (f~i) VW/xSnTi: f. 5%; g. 10%; h. 12.5%; i. 15%; j. 20% |
| 表 2 VW/SnTi催化剂表面酸特征与SnO2负载量的关系 Table 2 Acidity feature of the VW/SnTi catalyst with SnO2 loading SnO2 Loading |
|
图 8 VW/SnTi催化剂表面酸量与SnO2负载量的关系 Figure 8 Acidity feature of the VW/SnTi catalyst with SnO2 loading A) The amount of Bronsted acid and Lewis acid of NH3-DRFTIR; B) The area of weak acid (Peak α+Peak β) and strong acid (Peak γ) of NH3-TPD |
图 7B为SnO2掺杂的VW/Ti催化剂的NH3-TPD图谱, 分峰积分结果见表 2和图 8A所示.从图 7B可见, VW/Ti催化剂和VW/SnTi催化剂上存在两个弱酸峰, 其峰顶温度分别为182和272 ℃, 以及404 ℃处的强酸峰.从图 8B中可见, 将SnO2组分加入到VW/Ti催化剂中, 当SnO2负载量低于15%时, 催化剂中弱酸酸量增加; 但是持续提高至20%时, 弱酸酸量递增速率减弱趋于平缓. NH3-TPD和NH3-DRFTIR结果表明元素Sn掺入到催化剂载体中能提高催化剂B酸酸量, 但是当SnO2组分达到一定掺入量后无法再大幅度提高B酸酸量.另可见, 随着SnO2负载量的提高, VW/SnTi催化剂中强酸酸量则先减少后递增, 并且与锐钛矿型TiO2相比, 10SnTi复合氧化物表面L酸位减弱.对比图 8中NH3-DRFTIR和NH3-TPD结果可见, 催化剂表面弱酸酸量及强酸酸量随SnO2负载量的变化趋势分别与催化剂表面B酸和L酸的变化趋势相一致.这说明, VW/SnTi催化剂上强酸位主要为L酸, 而弱酸位主要为B酸, 并存在二种强度的B酸.前述XRD、Raman和XPS等结果表明, SnO2组分掺入到TiO2中时, 元素Sn与Ti之间以Sn—O—Ti形式相互作用, 促使锐钛矿型TiO2向金红石型TiO2转变.由于锐钛矿型TiO2比金红石型TiO2具有更多的酸性中心[26], 因此, 当SnO2负载量较低时, 催化剂表面L酸位减少, 主要归因于TiO2晶型转变导致金红石型TiO2在催化剂中占比增多所致. SnO2负载量较高时, 催化剂表面L酸增强, 主要归因于元素Sn与金红石型TiO2以Sn—O—Ti键形式相互作用, 提供了新的L酸位中心.
2.7 SnO2组分掺杂的催化作用探讨已有文献结果表明, 当金红石型TiO2具有较大的比表面积且VOx物种负载量低于表面分散容量时, 与V2O5/TiO2(A) 催化剂相比, V2O5/TiO2(R) 催化剂在制备过程中若使用草酸溶液, 可使得VOx物种能均匀分散在金红石型TiO2表面并具有较好的可还原性, 从而提高SCR活性[27-28]; 另外, Jehng等[29]报道, 由于V2O5/SnO2催化剂表面VOx物种较V2O5/TiO2催化剂具有更好的可还原能力, V2O5/SnO2催化剂表现出更好的SCR活性; V2O5基催化剂中掺杂SnO2组分后VOx物种可还原性能的提高, 其主要原因为VOx物种与SnO2组分之间存在强电子作用[30]. XRD和Raman等结果表明, 将SnO2组分引入到催化剂载体TiO2中后, Sn与Ti以Sn—O—Ti键合方式发生了相互作用, 促进了锐钛矿型TiO2向金红石型TiO2转变.根据XPS结果, VW/SnTi催化剂表面VOx物种和WOx物种与载体SnTi复合氧化物以V—O—Ti (Sn) 和W—O—Ti (Sn) 的形式相互作用, 这种相互作用不仅提高了VW/SnTi催化剂上VOx物种可还原性, 也使得催化剂中V5+物种占比提高, 进而导致VW/SnTi催化剂表面VOx物种能够提供更多的B酸位[31].另外, 基于前人的结果, 当TiO2(R) 具有较大的比表面积和MoOx物种负载量低于表面分散容量情况下, MoOx/TiO2(R) 催化剂中MoOx物种主要以四面体物种形式存在且具有更多的B酸量[32], 而WOx和MoOx物种在载体TiO2上分散时具有相似的结构和形态特征[33-34]. SnO2组分引入到催化剂载体TiO2中促进了金红石型TiO2的大量生成, 这使WOx物种更易于以四面体形式分散, 同时Sn与W之间的相互作用也能促使四面体WOx物种的生成, 因此, VW/Ti催化剂中掺SnO2组分后促进四面体WOx物种生成, 这也是VW/SnTi催化剂上B酸酸性和酸量增加的原因之一[19, 35, 41].
根据上述VW/SnTi催化剂表面酸性的考察结果, VW/SnTi催化剂上存在两种强度的弱酸, 且弱酸位主要由B酸构成.由于TiO2和SnO2不提供B酸位, 因此, 吸附NH3脱附温度较低 (峰顶温度182 ℃) 的弱酸位应主要为VOx物种上的B酸构成, 较高脱附温度 (峰顶温度272 ℃) 的弱酸位应主要为WOx物种的存在而产生的B酸构成.从表 2和图 8B可见, VW/SnTi催化剂上表面VOx物种与Sn的相互作用使得催化剂中V5+物种占比提高而导致的B酸增加是有限的, 变化幅度较小.因此, 原位NN3-IR吸附显示的催化剂表面B酸变化, 应较大程度地来源于WOx物种的存在而产生的B酸变化.根据H2-TPR和XPS结果, VW/SnTi催化剂表面WOx与VOx物种之间的相互作用强于VW/Ti催化剂, 亦即掺杂Sn后VW/SnTi催化剂表面VOx物种与WOx物种相互作用增强, 说明在SnTiOx复合氧化物表面, VOx物种与WOx物种更易于相互作用, 并以V—O—W键合方式提供更多的桥式B酸位, 这应是VW/SnTi催化剂上B酸酸性和酸量增加的其中原因之一.
综上所述, 尽管以共沉淀法在TiO2载体中掺入Sn组分后, TiO2晶型由锐钛矿向金红石型转变, 但是VOx物种和SnTi之间的相互作用, 却增强了VW/SnTi催化剂上VOx物种可还原性, 并使得催化剂中V5+物种占比提高, VOx物种能够提供的B酸位更多.更为重要的, SnO2组分引入到催化剂载体TiO2后, 催化剂表面的WOx物种更易于形成具有更多B酸量的四面体形式分散, 以及WOx与VOx物种之间的相互作用增强并以V—O—W键合方式提供更多的桥式B酸位.由于VOx物种的可还原性提升有利于对吸附态NH3物种的氧化脱氢反应[36], 同时, 据Topsøe等提出的B酸反应机理, SCR反应主要在催化剂表面B酸位中心上进行[37].因此, 本研究工作中共沉淀法掺入Sn组分的VW/SnTi催化剂较VW/Ti催化剂具有更好的SCR活性.可以推测的是, 共沉淀法掺入Sn组分的VW/SnTi催化剂上发生的SCR反应过程应遵循E-R机理, 当NH3强吸附在与V2O5相互作用的WO3位上形成储氨中心, 再通过更快的表面扩散过程将NH3转移至V活性位, 从而显著提高催化剂活性[38-39, 42].当然, VW/SnTi催化剂中SnO2负载量达到一定程度后, 催化剂表面VOx可还原性和B酸量递增速率减弱趋于平缓, 使得其催化活性无法大幅度的提高.
3 结论采用共沉淀法将SnO2组分引入到VW/Ti催化剂载体TiO2中, Sn离子进入到TiO2晶格中以Sn—O—Ti的形式相互作用, 促使锐钛矿型TiO2向金红石型TiO2转变.在特定条件下, VOx和WOx物种与SnTi复合氧化物之间以V—O—Ti (Sn) 和W—O—Ti (Sn) 的形式相互作用, 促使VOx物种可还原能力的提升以及八面体WOx物种向四面体WOx物种转变. V5+物种和四面体WOx物种的生成提高了催化剂B酸酸量. VW/SnTi催化剂表面VOx物种与WOx物种之间相互作用强于VW/Ti催化剂.因此, 以SnTi复合氧化物为载体的V2O5-WO3催化剂拥有更好的SCR活性.
| [1] | Chen L, Li J H, Ge M F. Promotional effect of Ce-doped V2O5-WO3/TiO2 with low vanadium loading for selective catalytic of NOx by NH3[J]. J Phys Chem C, 2009, 113(50): 21177–21184. DOI:10.1021/jp907109e |
| [2] | Cheng K, Liu J, Zhang T, et al. Effect of Ce doping of TiO2 support on NH3-SCR activity over V2O5-WO3/CeO2-TiO2 catalyst[J]. J Environ Sci, 2014, 26(10): 2106–2113. DOI:10.1016/j.jes.2014.08.010 |
| [3] | Busca G, Lietti L, Ramis G, et al. Chemical and mechanistic aspects of the selective catalytic reduction of NOx by ammonia over oxide catalysts: A review[J]. Appl Catal B: Environ, 1998, 18: 1–36. DOI:10.1016/S0926-3373(98)00040-X |
| [4] |
a. Yu Rui (喻瑞), Zhao Zhen-chao (赵侦超), Zheng Zhen-yu (张振宇), et al. Effects of modification and reaction atmosphere on the catalytic performance of Cu/Al-rich beta zeolite in selective catalytic of NO by NH3 (Pt修饰和反应气氛对富铝Cu-Beta分子筛NH3-SCR反应性能的影响) [J]. J Mol Catal (China) (分子催化), 2016, 30 (5): 428-434. b. Zhao Kun (赵堃), Han Wei-liang (韩维亮), Zhang Guo-dong (张国栋), et al. Review of metal oxide catalysts for diesel exhaust purification (柴油车SCR脱硝金属氧化物催化剂研究进展) [J]. J Mol Catal (China)(分子催化), 2015, 29 (5): 494-504. |
| [5] |
a. Song Zhong-xian (宋忠贤), Ning Ping (宁平), Li Hao (李昊), et al. Effect of Ce/Mn molar ratio on the low-temperature catalytic activity of CeO2-MnOx catalyst for selective catalytic reduction of NO by NH3 (不同Ce/Mn摩尔比对CeO2-MnOx催化剂低温NH3选择性催化还原NO的影响) [J]. J Mol Catal (China) (分子催化), 2015, 29 (5): 422-430. b. Su Qian (苏潜), Huang Yan (黄妍), Zhang Yin (张颖), et al. Effects of copper sources on selective catalytic reduction of NO with NH3 of Cu-SAPO-34(铜源对Cu-SAPO-34氨催化还原NO性能的影响) [J]. J Mol Catal (China)(分子催化), 2016, 30 (2): 151-158. c. Guo Zhi-min (郭志敏), Yuan Jian (袁坚), Peng Xiao-jin (彭小晋), et al. The effect of sodium salts on catalytic activity of V2O5-WO3/TiO2 over NH3-SCR reaction (钠盐对V2O5-WO3/TiO2催化剂NH3-SCR反应活性的影响) [J]. J Mol Catal (China)(分子催化), 2016, 30 (6): 547-556. |
| [6] | Kaleji B K, Sarraf-Mamoory R. Nanocrystalline sol-gel TiO2-SnO2 coating: Preparation, characterization and photo-catalytic performance[J]. Mater Res Bull, 2012, 47(2): 362–369. DOI:10.1016/j.materresbull.2011.11.002 |
| [7] | Gao Y Q, He T, Zhao L S, et al. Structure and phase transition behavior of Sn4+-doped TiO2 nanoparticles[J]. J Phys Chem C, 2009, 113(42): 18121–18124. DOI:10.1021/jp9069288 |
| [8] | Zhang L, Li L L, Xiong Y, et al. Promotional effect of doping SnO2 into TiO2 over a CeO2/TiO2 catalyst for selective catalytic reduction of NO by NH3[J]. Catal Sci Technol, 2015, 5(4): 2188–2196. DOI:10.1039/C4CY01412J |
| [9] | Dong L H, Tang YX, Li B, et al. Influence of molar ratio and calcination temperature on the properties of TixSn1-xO2 supporting copper oxide for CO oxidation[J]. Appl Catal B-Environ, 2016, 180(10): 451–462. |
| [10] | Sun C Z, Dong L H, Yu W J, et al. Promotion effect of tungsten oxide on SCR of NO with NH3 for the V2O5-WO3/Ti0.5Sn0.5O2 catalyst: Experiments combined with DFT calculation[J]. J Mol Catal A-Chem, 2011, 346(1): 29–38. |
| [11] | Dong L H, Sun C Z, Tang C J, et al. Investigation of surface VOx species and their contributions to activities of VOx/Ti0.5Sn0.5O2 catalysts toward selective catalytic reduction of NO by NH3[J]. Appl Catal A-Gen, 2012, 431(29): 126–136. |
| [12] | Li Y Z, Xu B L, Fan Y N, et al. The effect of titania polymorph on the strong metal-support interaction of Pd/TiO2 catalysts and their application in the liquid phase selecive hydrogenation of long chain alkadienes[J]. J Mol Catal A-Chem, 2004, 216(1): 107–114. DOI:10.1016/j.molcata.2004.02.007 |
| [13] | Zhuang K, Qiu J, Tang F S, et al. The structure and catalytic activity of anatase and rutile supported manganese oxide catalysts for selective catalytic reduction of NO by NH3[J]. Phys Chem Chem Phys, 2011, 13(10): 4463–4469. DOI:10.1039/c0cp02288h |
| [14] | Tang FS, Xu B L, Shi H H, et al. The poisoning effect of Na+ and Ca2+ ions doped on the V2O5/TiO2 catalysts for selective catalytic reduction of NO by NH3[J]. Appl Catal B-Environ, 2010, 94(1): 71–76. |
| [15] | Kang Li-na(亢丽娜), Guo Jiang-yuan(郭江渊), Zhang Hong-xi(张鸿喜), et al. Activity and stability of Ni/SiO2-Al2O3 catalyst in the aqueous phase hydrogenation system(Ni/SiO2-Al2O3催化剂在水相加氢体系中的活性既稳定性研究)[J]. J Mol Catal (China)(分子催化), 2014, 28(2): 119–125. |
| [16] | Hurum D C, Agrios A G, Gray K A. Explaining the enhanced photocatalytic activity of degussa P25 mixed-phase TiO2 using EPR[J]. J Phys Chem B, 2003, 107(19): 4545–4549. DOI:10.1021/jp0273934 |
| [17] | Martinez-Huerta M V, Fierro J L G, Banares M A. Monitoring the states of vanadium oxide during the transformation of TiO2 anatase-to-rutile under reactive environments: H2 reduction and oxidative dehydrogenation of ethane[J]. Catal Commun, 2009, 11(1): 15–19. DOI:10.1016/j.catcom.2009.08.002 |
| [18] | Li J G, Ishigaki T, Sun X D. Anatase, brookite, and rutile nanocrystals via redox reactions under mild hydrothermal conditions: Phase-selective synthesis and physicochemical properties[J]. J Phys Chem C, 2007, 111(13): 4969–4976. DOI:10.1021/jp0673258 |
| [19] | Shin B, Dung T W, Lee H. Structure, surface acidity and catalytic activity of WO3-TiO2 catalyst for NH3-SCR of NOx[J]. J Ceram Process Res, 2014, 15(2): 125–129. |
| [20] | Wang C Z, Yang S J, Chang H Z, et al. Dispersion of tungsten oxide on SCR performance of V2O5-WO3/TiO2: Acidity, surface species and catalytic activity[J]. Chem Eng J, 2013, 225(6): 520–527. |
| [21] | Xu Yang-yang(徐阳阳), Liu Zi-li(刘自力), Xiong Xiao-long(熊小龙), et al. V-Mo-O catalyst performance and catalytic oxidation of toluene to benzaldehyde(V-Mo-O催化剂的制备及催化甲苯合成甲醛的研究)[J]. J Mol Catal (China)(分子催化), 2014, 28(1): 39–46. |
| [22] | Li Q, Hou X X, Yang H S, et al. Promotional effect of CeOx for NO reduction over V2O5/TiO2-carbon nanotube composites[J]. J Mol Catal A-Chem, 2012, 356: 121–127. DOI:10.1016/j.molcata.2012.01.004 |
| [23] | Shan W P, Liu F D, He H, et al. A superior Ce-W-Ti mixed oxide catalyst for the selective catalytic reduction of NOx with NH3[J]. Appl Catal B-Environ, 2012, 115(4): 100–106. |
| [24] | Michalow-Make K A, Lu Y, Kowalski K, et al. Flame-made WO3/CeOx-TiO2 catalysts for selective catalytic reduction of NOx by NH3[J]. ACS Catal, 2015, 5(10): 5657–5672. DOI:10.1021/acscatal.5b01580 |
| [25] | Peng Y, Li K Z, Li J H. Identification of the active sites on CeO2-WO3 catalysts for SCR of NOx with NH3: An in situ IR and raman spectroscopy study[J]. Appl Catal B-Environ, 2013, 141(2): 483–492. |
| [26] | Habuta Y K, Narishige N, Okumura K, et al. Catalytic activity and solid acidity of vanadium oxide thin layer loaded on TiO2, ZrO2, and SnO2[J]. Catal Today, 2003, 78(1): 131–138. |
| [27] | Satsuma A, Takenake S, Tanaka T, et al. Studies on the preparation of supported metal oxide catalysts uding JRC-reference catalysts Ⅱ. Vanadia-titania catalyst: effect of strating solution and phase of titania[J]. Appl Catal A-Gen, 2002, 232(2): 93–106. |
| [28] | Cai Y P, Ozkan U S. Vanadia/titania catalysts in selective catalytic reduction of nitric oxide with ammonia[J]. Appl Catal, 1991, 78: 241–255. DOI:10.1016/0166-9834(91)80109-A |
| [29] | Jehng J M. Dynamic States of V2O5 Supported on SnO2/SiO2 and CeO2/SiO2 mixed-oxide catalysts during methanol oxidation[J]. J Phys Chem B, 1998, 102(30): 5816–5822. DOI:10.1021/jp980622v |
| [30] | Fu Y H, Ma H C, Wang Z L, et al. Characterization and reactivity of SnO2-doped V2O5/γ-Al2O3 catalysts in dehydrogenation of isobutane to isobutene[J]. J Mol Catal A-Chem, 2004, 221(1): 163–168. |
| [31] | Liu X, Li J H, Li X, et al. NH3 selective catalytic reduction of NO: A large surface TiO2 support and its promotion of V2O5 dispersion on the prepared catalyst[J]. Chin J Catal, 2016, 37(6): 878–887. DOI:10.1016/S1872-2067(15)61041-5 |
| [32] | Zhu H Y, Shen M M, Wu Y, et al. Dispersion behaviors of molybdena on titania (Rutile and/or Anatase)[J]. J Phys Chem B, 2005, 109(23): 11720–11726. DOI:10.1021/jp050890a |
| [33] | Liu Z M, Zhang S X, Li J H, et al. Promoting effect of MoO3 on the NOx reduction by NH3 over CeO2/TiO2 catalyst studied with in situ DRIFTS[J]. Appl Catal B-Environ, 2014, 144(1): 90–95. |
| [34] | Koh H L, Park H K. Characterization of MoO3-V2O5/Al2O3 catalysts for selective catalytic reduction of NO by NH3[J]. J Ind Eng Chem, 2013, 19(1): 73–79. DOI:10.1016/j.jiec.2012.07.003 |
| [35] | Solis J L, Frantti J, Lantto V. Characterization of phase structures in semiconducting SnWO4 powders by mossbauer and raman spectroscopies[J]. Phys Rev B, 1998, 57(21): 13492–13500. |
| [36] | Tang F S, Zhaung K, Yang F, et al. Effect of dispersion state and surface properties of supported vanadia on the activity of V2O5/TiO2 catalysts for the selective catalytic reduction of NO by NH3[J]. Chin J Catal, 2016, 33(4): 933–940. |
| [37] | Topsøe N Y. Mechanism of the selective catalytic reduction of nitric oxide by ammonia elucidated by in situ on-line fourier transform infrared spectroscopy[J]. Science, 1994, 265(5176): 1217–1219. DOI:10.1126/science.265.5176.1217 |
| [38] | Alemany L J, Lietti L, Ferlazzo N, et al. Reactivity and physicochemical characterization of V2O5-WO3/TiO2 De-NOx catalysts[J]. J Catal, 1995, 155(1): 117–130. DOI:10.1006/jcat.1995.1193 |
| [39] | Paganini M C, Acqua L D, Giamello E, et al. An EPR study of the surface chemistry of the V2O5-WO3/TiO2catalyst: Redox behaviour and state of V (Ⅳ)[J]. J Catal, 1997, 166(2): 195–205. DOI:10.1006/jcat.1997.1492 |
| [40] | Dong L H, Zhang L L, Sun C Z, et al. Study of the properties of CuO/VOx/Ti0.5Sn0.5O2 catalysts and their activities in NO+CO reaction[J]. ACS Catal, 2011, 1(5): 468–480. |
| [41] | Maksimov G M, Litvak G S, Budneva A A, et al. WO3/MO2(M=Zr, Sn, Ti) heterogeneous acid catalysts: Synthesis, study, and use[J]. Kinel Catal, 2006, 47(4): 581–588. |
| [42] | Kleemann M, Elsener M, Koebel M, et al. Investigation of the ammonia adsorption on monolithic SCR catalysts by transient response analysis[J]. Appl Catal B-Environ, 2000, 27(4): 231–242. DOI:10.1016/S0926-3373(00)00158-2 |
| [43] | Emeis C A. Determination of integrated molar extinction coefficients for infrared absorption bands of pyridine adsorbed on solid acid catalysts[J]. J Catal, 1993, 141: 347–354. DOI:10.1006/jcat.1993.1145 |
 2017, Vol. 31
2017, Vol. 31


