2. 三峡库区生态环境教育部工程研究中心 (三峡大学), 湖北 宜昌 443002;
3. 三峡地区地质灾害与生态环境湖北省协同创新中心 (三峡大学), 湖北 宜昌 443002;
4. 湖北兴发化工集团股份有限公司, 湖北 宜昌 443002
2. China Engineering Research Center of Eco-environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang, 443002, China;
3. Collaborative Innovation Center for Geo-Hazards and Eco-Environment in Three Gorges Area, Hubei Province, China Three Gorges University, Yichang, 443002, China;
4. Hubei Xingfa Chemicals Group Limited by Share Ltd, Yichang, 443711, China
溴氧化铋 (BiOBr) 是一种极具潜力的可见光催化剂, 其理论禁带宽度 (Eg) 较小, 能够有效利用可见光[1-2]; 其独特的开放式结构和间接跃迁模式有利于光生载流子的分离和电荷转移[3-4]. BiOBr能够在可见光下催化活化O2产生大量的活性物种 (ROS)[5], 对底物的矿化程度高; 对不同种类的有机污染物, 如藻毒素[6]、抗生素[7]、腐殖酸[8]等都具有较强的降解活性.
研究表明, 对催化剂进行阴离子界面修饰可以调控光催化反应过程, 许多惰性的无机 (有机) 阴离子 (F-、PO43-、SO42-、CF3COOH、Nafion等) 都能够用于表面阴离子改性[9-13].目前, 科研工作者主要对TiO2的阴离子修饰改性进行研究.在TiO2表面修饰F-、PO43-等其它阴离子后, 催化剂表面形成库仑电场, 提高了光生载流子的分离效率, 促进了空穴向表面的迁移进而促进了其对水的氧化; 同时加快了质子向反应中心的输送, O2的还原途径由连续的单电子途径转变为协同的四电子/四质子还原途径, 还原效率显著提高[9-10]. Minero等[14]研究发现, 当TiO2表面吸附F-后, 对苯酚的降解速率提高了3倍; 氧化路径也随之改变.在空白体系中, 90%的苯酚氧化是由于·OH的作用, 10%是由于空穴的直接氧化, 而在F-吸附体系中, 几乎所有的苯酚氧化都是由于·OH进攻所致. Wang等[15]研究发现, 当TiO2被一定浓度的HF溶液刻蚀后, 其对RhB的吸附模式由阴离子基团-COO-转变为阳离子基团[-C=N (Et)2]+; 吸附增强和平带电位变低使得RhB的降解动力学加速, 氧化断键方式由生色团断裂转变为助色团脱落.
近来, 研究者提出了大量BiOBr的修饰改性方法[16-17], 但对于其阴离子改性仍鲜见报道.我们采用NaF溶液对BiOBr进行处理, 运用SEM (扫描电镜)、XRD (X-射线衍射)、XPS (X-射线光电子能谱) 等技术对催化剂的物理结构及性质进行表征探究F-修饰对BiOBr形貌、结构和光催化性能及机理等方面的影响.
1 材料与方法 1.1 主要试剂与仪器五水硝酸铋 (Bi (NO3)3·5H2O, AR)、溴代十六烷基吡啶 (CPB, AR)、罗丹明B (RhB, AR)、氟化钠 (NaF, AR)、氢氧化钠 (NaOH, AR)、高氯酸 (HClO4, AR)、乙醇 (C2H5OH, AR), 其它实验试剂也均为分析纯, 实验用水为反渗透 (RO) 水.
Lambda 25紫外-可见分光光度计 (伯金-埃尔默, 美国)、F-4500荧光分光光度计 (日立, 日本)、JXF12-100均相反应器 (松岭化工设备, 烟台)、XPA系列光化学反应仪 (胥江机电厂, 南京)、Jw-Bk112比表面积及孔径分析仪 (精微高博, 北京)、D/max2500 X-射线衍射仪 (日本理学公司, 日本)、XL30扫描电子显微镜 (飞利浦公司, 荷兰)、ESCALab220i-XL型电子能谱仪 (赛默飞世尔科技, 美国)、X Series 2电感耦合等离子体-质谱联用仪 (赛默飞世尔科技, 美国).
1.2 BiOBr的合成及氟化A液:将0.004 mol Bi (NO3)3·5H2O加入到30 mL甘露醇溶液 (0.1 mol/L) 中并搅拌均匀.
B液:将0.004 mol溴代十六烷基吡啶 (CPB) 加入到50 mL水中并搅拌使其完全溶解.
将A液用注射器分批注入B液中, 然后用NaOH溶液将pH调至中性后超声30 min.将反应液转入到100 mL水热反应釜中, 170 ℃下反应17 h后自然冷却到室温.减压过滤分离产物, 并用乙醇和蒸馏水多次洗涤.最后在60 ℃下鼓风干燥数小时得到BiOBr催化剂.
将BiOBr以10 g/L的用量分别加入到0.01、0.1和0.3 mol/L的NaF溶液中, 用HClO4将溶液pH值调至3.3, 然后连续搅拌9 h.减压过滤分离出催化剂, 用大量水洗涤后在60 ℃下空气干燥数小时.将以上不同浓度NaF浸泡的催化剂依次命名为BiOBr-F0.01、BiOBr-F0.1、BiOBr-F0.3.在浸泡过程中, 每隔一定时间取1.5 mL混合液, 在14 000 r/min下离心20 min分离出上清液, 稀释一定倍数后采用ICP-MS (电感耦合等离子体-质谱联用仪) 分析Bi元素含量的变化.
1.3 催化剂的物理表征催化剂的晶相及结构采用X-射线衍射 (XRD) 进行表征; 形貌特征采用扫描电镜 (SEM) 进行表征; 元素价态及化学组成采用X-射线光电子能谱 (XPS) 进行表征; 禁带宽度 (Eg) 采用紫外-可见漫反射 (UV-Vis DRS) 光谱测定, 其中以光谱级BaSO4片作为参比物; 空穴 (hVB+) 及电子 (eCB-) 的复合程度采用荧光发射光谱 (FL) 测定, 激发波长为315 nm, 发射波长范围为400~500 nm.
1.4 O2的光催化活化分别取40 mL的氯化硝基四氮唑蓝溶液 (NBT, 1.25×10-5 mol/L) 以及对苯二甲酸 (TA, 2.5×10-4 mol/L)-氢氧化钠 (NaOH, 10-3 mol/L) 混合液于光反应管中, 加入10 mg催化剂, 在暗反应箱中连续搅拌1 h达到吸附-脱附平衡后, 放入光反应仪中, 打开循环冷却水.以400 W钨灯 (用滤波片滤去紫外光) 作为光源, 在磁力搅拌下进行反应, 每隔一定时间取样2 mL, 在8 000 r/min下离心15 min分离出上清液.在260 nm波长处测定NBT溶液的吸光度值A; 测定TA-NaOH溶液在激发波长 (λEXC) 为315 nm, 发射波长 (λEMI) 为630 nm处的荧光强度值F[5].
1.5 RhB的光催化降解采用染料RhB作为底物来评价催化剂在可见光下的光催化活性并研究反应机理.取40 mL RhB (10 mg/L-1) 于光反应管中, 加入10 mg催化剂.吸附-脱附平衡后放入光反应仪中进行反应, 每隔一定时间取2 mL反应液, 在8 000 r/min下离心10 min分离出上清液.在200~700 nm范围内做上清液的紫外-可见光谱.取554 nm对应的吸光度值A作动力学曲线.
取RhB水溶液于光反应管中, 加入10 mg催化剂, 在吸附-脱附平衡后放入光反应仪中进行反应, 每隔一定时间取2 mL反应液, 用0.22 μm水相滤膜过滤后收集清液, 测定总有机碳 (TOC) 的含量.
1.6 捕获实验为证明各中间活性物种对光催化反应的影响, 在BiOBr光催化降解RhB的反应体系中加入一定量的异丙醇 (IPA)、对苯醌 (BQ) 和乙二胺四乙酸二钠 (Na2-EDTA) 分别作为羟基自由基 (·OH)、超氧自由基 (O2·-) 和空穴 (hVB+) 的捕获剂[18], 控制反应体系中捕获剂的浓度为10-4mol/L.比较各反应体系与空白组的动力学变化.
2 结果与讨论 2.1 催化剂的物理表征结果 2.1.1 催化剂的结构分析图 1是催化剂的X-射线衍射 (XRD) 图谱.单纯BiOBr的XRD图谱衍射峰较少, 峰型不够尖锐, 实验合成的催化剂为不定形态[19].通过对比发现BiOBr与BiOBr-F0.01的衍射峰基本一致; 而在BiOBr-F0.1和BiOBr-F0.3中出现了较强的新衍射峰, 且峰形尖锐, 其中一部分对应于BiOF的特征衍射峰[20], 说明F插入到了晶格中; 同时还有BiOBr的衍射峰出现[6-8], 说明催化剂在浸泡中有新的晶面展露, 表明经浸泡处理后的催化剂可能是BiOBr和其它物种的复合物.

|
图 1 催化剂的X-射线衍射 (XRD) 图谱 Figure 1 XRD patterns of as-prepared catalysts |
溶液中Bi元素在浸泡处理过程中的变化情况如表 1.由于F-半径小, 电负性强, 而BiOBr的层状结构单元[-Br-Bi-O-O-Bi-Br-]之间不存在化学键, 仅在范德华力的作用下相互结合[21], 因此容易受到F-进攻使化学键断裂, 离子溶出在溶液中, 游离态的离子通过进一步的反应使BiOBr的结构发生改变.当NaF溶液浓度越大时, 溶液中Bi元素浓度越大 (表 1), 说明F-对BiOBr的作用越强烈, 使其氟化程度更高.
| 表 1 BiOBr浸泡过程中Bi元素含量的变化 Table 1 Changes of Bi element contents during soaking treatments to BiOBr |
为进一步确定催化剂的化学组成, 对BiOBr和BiOBr-F0.1进行XPS测定,所得结果如图 2所示.实验制得的BiOBr中, O 1s、Br 3d、Bi 4f5/2、Bi 4f7/2的结合能分别为529.57、68.13、164.25和158.94 eV.说明O、Br、Bi 3种元素分别以-2、-1、+3的价态存在[1-2, 5]; 当BiOBr经NaF浸泡处理后, 可以检测出-1价态的F元素, Br (3d) 的结合能几乎没有变化, 而O 1s、Bi 4f5/2、Bi 4f7/2的结合能都有一定程度的降低, 说明F原子的取代使得O和Bi的成键方式发生变化, F的强电负性使结合能降低.
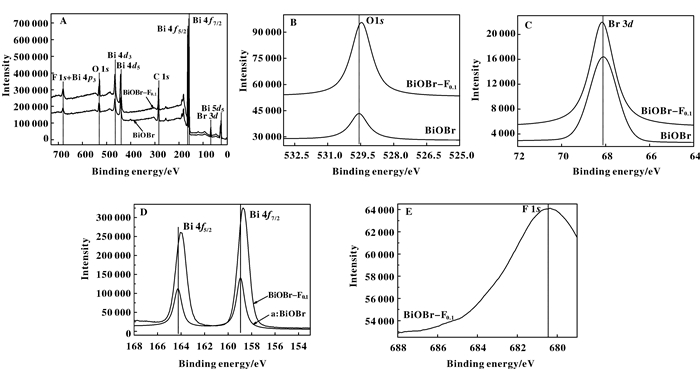
|
图 2 催化剂的X-射线光电子能谱 (XPS) Figure 2 XPS spectra of as-prepared catalysts |
图 3为催化剂的扫描电镜 (SEM) 图谱.实验制备的BiOBr呈层状, 当NaF浓度较小时, 表面的层状结构被破坏, 催化剂呈“熔融”状, 当浓度继续增大时, 层状结构被完全破坏, 形成不规则的块状结构. NaF溶液浸泡使催化剂的形貌发生改变.

|
图 3 催化剂的扫描电镜 (SEM) 图谱 Figure 3 SEM images of as-prepared catalysts |
同时通过能量色散谱 (EDS) 对各催化剂中主要元素的质量比和摩尔比的变化情况进行分析, 结果如表 2.随着氟化程度增大, Bi、Br、F元素的相对丰度发生了变化, 其中F元素的质量比和摩尔比不断增大, 说明NaF浸泡处理使得BiOBr产生了氟化作用.
| 表 2 催化剂中各元素的质量比和摩尔比 Table 2 Mass ratios and mole ratios of each element in catalysts |
对光的响应范围及强度是影响催化剂活性的重要因素.无机半导体催化剂对光的吸收主要是由于价带电子的禁带跃迁所致, 禁带宽度越小, 催化剂对可见光的响应就越强[23-24]. 图 4为催化剂的紫外-可见漫反射光谱.随着氟化程度增大, 催化剂的吸收阈值出现一定的蓝移, BiOBr、BiOBr-F0.01、BiOBr-F0.1和BiOBr-F0.3的边缘吸收波长分别为506、494、443和410 nm, 对可见光的响应越来越弱.
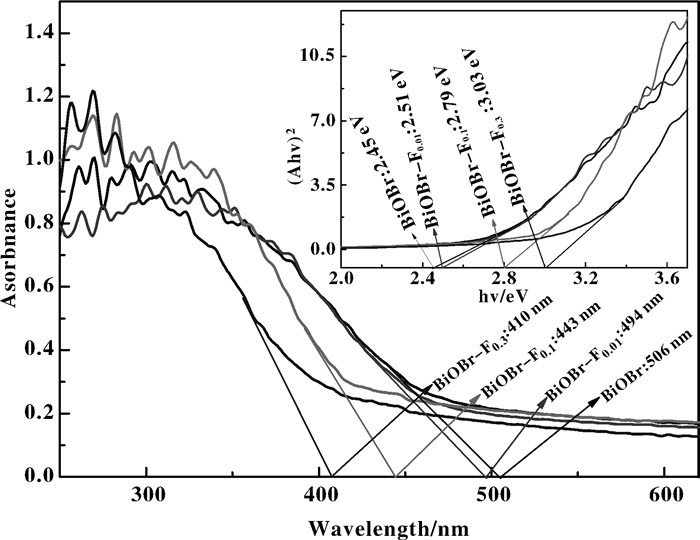
|
图 4 催化剂的紫外-可见漫反射 (UV-vis DRS) 光谱 Figure 4 UV-Vis DRS spectra of as-prepared catalysts |
| $ {E_g} = \frac{{1{\rm{ }}240}}{\lambda } $ | (1) |
Eg为禁带宽度, λ为边缘吸收波长.
根据公式 (2) 以 (Ahν)2对hν作图 (图 4嵌入图), 根据切线横截距确定禁带宽度[23-24].
| $ {\left( {Ah\nu } \right)^2} = h\nu - {E_g} $ | (2) |
Eg为禁带宽度, A为吸光度值, h为普朗克常数, ν为光电子频率.
研究表明BiOX (X = F, Cl, Br, I) 的导带主要由Bi6p轨道贡献, 而价带主要由O 2p和Xnp(n = 2, 3, 4, 5) 轨道贡献[3-4, 21-22]. BiOBr的能级结构在氟化过程中发生变化, 价带位置降低, 禁带宽度增大.通过计算可得BiOBr、BiOBr-F0.01、BiOBr-F0.1和BiOBr-F0.3的禁带宽度分别为2.45、2.51、2.79和3.02 eV, 随氟化程度加大而增大.
2.1.4 光生载流子的分离效率价带电子在光催化反应过程中吸收光子的能量跃迁到导带变成激发态, 同时在价带形成空穴, 导带电子和价带空穴分别在反应过程中作为优质的还原剂及氧化剂.当电子和空穴复合时, 催化反应过程就会受阻, 催化活性降低[23-24]. 图 5为催化剂在激发波长λEXC=315 nm时的荧光发射光谱.从图中可以看出, 催化剂的最大发射峰值随氟化程度增大而增大, 即氟化使得催化剂的载流子分离效率降低. BiOBr属于间接带隙跃迁, 因此激发电子必须穿过某些k层才能到达价带, 激发电子和空穴再复合的几率大大降低; 而BiOF属于直接带隙跃迁, 电子和空穴的复合几率大[20-21].

|
图 5 催化剂的荧光 (FL) 发射光谱 Figure 5 Fluorescence emission spectra of as-prepared catalysts |
RhB在不同催化剂作用时于可见光下光催化降解RhB的动力学曲线如图 6所示.由图可知, 在暗反应阶段, BiOBr、BiOBr-F0.01、BiOBr-F0.1和BiOBr-F0.3的比表面积不断减小 (见表 3), 使吸附能力减弱.光反应过程均符合一级反应动力学, 速率常数k见表 3, 其中BiOBr-F0.1的降解速率最快.
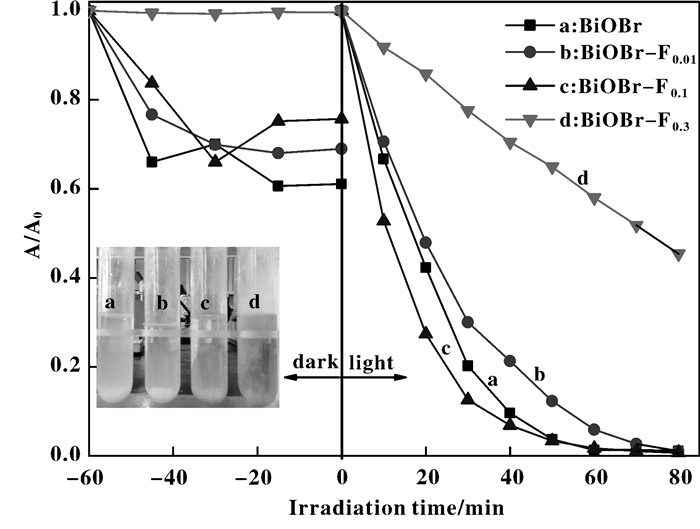
|
图 6 光催化降解RhB的动力学曲线 Figure 6 Kinetic curves for photocatalytic degradation of RhB [RhB] = 10 mg/L; [Cat] = 0.25 g/L; Visible light |
| 表 3 催化剂的比表面积及RhB光催化降解反应速率常数 Table 3 Specific surface areas of catalysts and reaction rate constants to photocatalytic degradation for RhB |
通过观察80 min后反应液的颜色 (图 6嵌入图) 发现, BiOBr/RhB及BiOBr-F0.01/RhB体系的反应液趋近无色, 说明产物只存在无色小分子; 而在BiOBr-F0.1/RhB体系中, 产物呈荧光绿[25], 说明仍存在较大的有机共轭结构, 即BiOBr-F0.1对RhB的降解不甚彻底; BiOBr-F0.3/RhB体系的反应液仍然呈较深的红色, RhB的降解速率很慢.进一步研究各反应体系的总有机碳 (TOC), 如图 7所示, 催化剂对RhB的矿化能力随氟化程度加大而逐渐减弱, 这一结果与表观动力学相悖, 但同时说明一定程度的氟化能加快BiOBr对RhB的催化脱色.
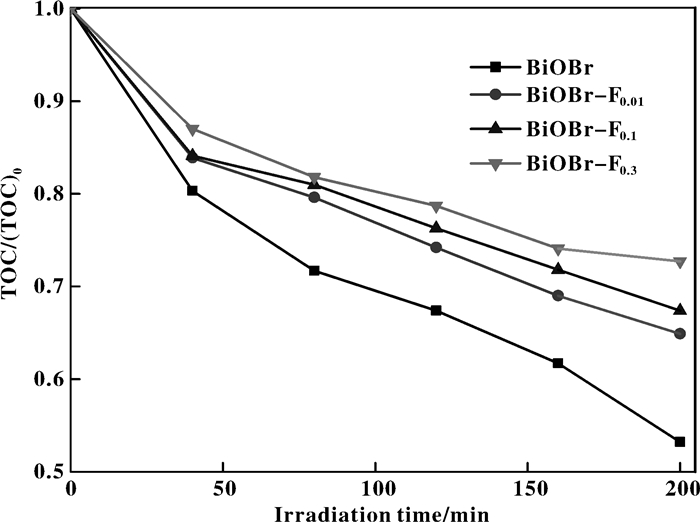
|
图 7 RhB降解过程的TOC变化 Figure 7 The TOC removal of RhB during degradation process [RhB] = 10 mg/L; [Cat] = 0.25 g/L; Visible light |
图 8为4种催化剂在光催化降解RhB过程中不同时间点产物的紫外-可见吸收光谱.由图可知, 在BiOBr/RhB体系中, 随着反应时间的推移, RhB的最大吸收峰虽发生一定程度的蓝移, 但峰值下降明显且260 nm左右苯环的特征吸收[26]不断减弱, 在80 min时, 250~700 nm内的吸收很弱, RhB分子中的共轭结构, 即生色团断裂, 体系中只残留了部分小分子[27-28]; 在BiOBr-F0.1/RhB体系中, 随着反应时间的推移, RhB的最大吸收峰快速蓝移, 但峰值及260 nm左右苯环的特征吸收[25]在一定时间后变化较慢, 在60 min后, 最大吸收峰蓝移至500 nm处, 此为罗丹明的特征吸收, 说明RhB分子中的助色团发生脱烷基化生成罗丹明[29-30]; 而在BiOBr-F0.3/RhB体系中, 最大吸收峰蓝移及以各个特征吸收带的变化均不明显, 说明催化剂对RhB的催化氧化作用较弱.
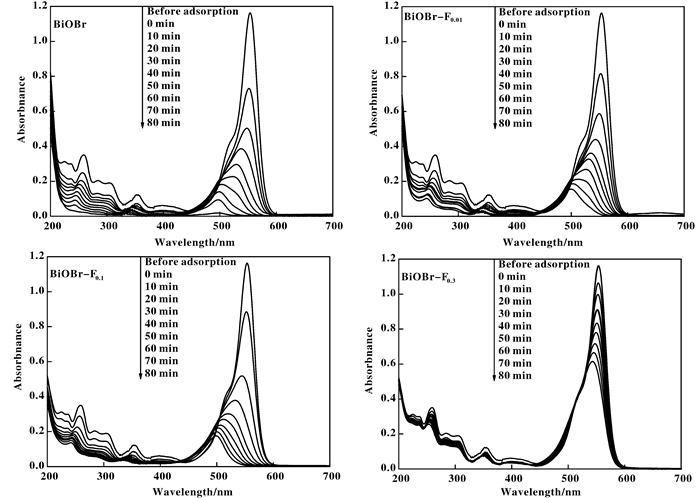
|
图 8 RhB降解中间产物的紫外-可见吸收光谱 Figure 8 UV-Vis absorption spectra of intermediate products of photocalytic degradation for RhB |
当催化剂长期使用时, 会出现中毒现象, 影响其催化活性.催化剂稳定性及可循环利用性是衡量其科研与实用价值的重要指标之一. 图 9反映BiOBr经浸泡处理后活性最好的BiOBr-F0.1的循环催化降解实验结果.从图中可以看出, BiOBr-F0.1在循环使用5次后仍然具有较好的光催化活性, 说明其稳定性较好, 具有一定的研究价值[23-24].

|
图 9 BiOBr-F0.1循环降解的稳定性 Figure 9 Cycling degradation of BiOBr-F0.1 under visible light irradiation [RhB] = 10 mg/L; [BiOBr-F0.1] = 0.25 g/L; Visible light |
O2可以结合导带电子[31], 抑制其与空穴的复合并通过一定的反应过程生成活性氧化物种 (ROS), 如·OH和O2·-, 对有机污染物的光催化降解具有极其重要的作用[5].氯化硝基四氮唑蓝 (NBT) 可以和O2·-发生特征反应, 实验中常作为探针检测O2·-的相对产量[32].
图 10是NBT在不同催化剂的作用下于可见光下的降解率[(A0-A)/A0]随时间t的变化情况.随着氟化程度加大, 催化剂的比表面积减小, 使O2的吸附量降低, 禁带宽度增大使可见光利用率降低, 电子和空穴的复合程度加大使导带电子还原能力减弱, 其还原O2生成O2·-的能力减弱.

|
图 10 光催化活化O2生成O2·- Figure 10 Photocatalytic O2 activation activity for O2·-generation by catalysts [NBT] = 1.25×10-5 mol/L; [Cat] = 0.25 g/L; Visible light |
·OH是光催化反应过程中O2生成的另一种重要的活性产物, 氧化性极强, 仅次于F2[32].由于Bi5+/Bi3+的标准氧化还原电位为+1.59 V, 比·OH/OH-的标准氧化还原电位+1.99 V要低, 即铋系光催化剂通过空穴氧化H2O生成·OH这一反应的吉布斯 (Gibbs) 自由能为正值, 因此这一过程违背了热力学规律, 在热力学上是禁阻的[34].因此·OH在铋系光催化体系中只能由O2·-通过双电子还原过程生成[5].对苯二甲酸 (TA) 可以和·OH生成荧光配合物TA-OH, 在一定的激发波长下, 会发射荧光信号[35].
从图 11可以看出, 可见光条件下, 对苯二甲酸 (TA) 与光催化反应过程中生成的·OH作用生成了荧光配合物, 从而证明·OH可以在光催化反应过程中通过双电子还原过程生成.不同催化剂光催化生成·OH的能力随氟化程度增大而减弱, 这与各个催化剂在可见光作用下催化生成O2·-的能力和对RhB的矿化情况是相吻合的, 进一步说明·OH由O2·-双电子还原生成, 并在光催化反应过程中发挥着重要作用[36].

|
图 11 光催化活化O2生成·OH Figure 11 Photocatalytic O2 activation activity for ·OH generation by catalysts [TA] = 2.5×10-4 mol/L; [NaOH] = 10-3 mol/L; [Cat] = 0.25 g/L; Visible light |
图 12为捕获实验结果, 分别在BiOBr/RhB反应体系中加入一定量异丙醇 (IPA)、对苯醌 (BQ) 和乙二胺四乙酸二钠 (Na2-EDTA) 后, RhB的光催化降解速率明显变慢.说明捕获剂与活性中间产物作用使催化反应被抑制, 证明RhB在BiOBr光催化降解过程主要涉及的活性物种为空穴 (hVB+)、超氧自由基 (O2·-) 及羟基自由基 (·OH)[37].

|
图 12 活性物种捕获实验 Figure 12 Scavenging experiment of active species [RhB]= 10 mg/L; [Cat] = 0.25 g/L; [Scavenger]= 10-4 mol/L; Visible light |
在可见光辐射下, BiOBr光催化降解RhB的反应途径可能如下:价带电子吸收特定频率光子的能量变为激发态而跃迁至导带, 同时在价带形成带正电的空穴, 导带电子通过单电子还原反应历程还原吸附在BiOBr表面的O2生成O2·-, O2·-再和吸附在BiOBr表面由H2O弱电离出的质子 (H+) 通过双电子还原反应历程生成·OH; 以上活性中间产物进攻RhB使其氧化分解[5].
| $ {\rm{BiOBr}}\left( {\rm{F}} \right) + {\rm{h}}\nu \to {\rm{BiOBr}}\left( {\rm{F}} \right)({\rm{e}}_{{\rm{CB}}}^ - + {\rm{h}}_{{\rm{VB}}}^ + ) $ | (eq. 1) |
| $ {{\rm{e}}^ - } + {{\rm{O}}_2} \to {{\rm{O}}_2}^{\cdot - } $ | (eq. 2) |
| $ {{\rm{O}}_2}^{\cdot - } + 2{{\rm{H}}^ + } + 2{{\rm{e}}^ - } \to \cdot{\rm{OH}} + {\rm{O}}{{\rm{H}}^ - } $ | (eq. 3) |
| $ {\rm{RhB}} + {{\rm{h}}^ + } + {{\rm{O}}_2}^{\cdot - } + \cdot{\rm{OH}} \to {\rm{Degraded}}\;{\rm{Products}} $ | (eq. 4) |
经过NaF溶液浸泡处理后的BiOBr由于F-进入其晶格形成新键, 导致BiOBr-F系列催化剂对可见光响应能力都变弱, 电子空穴复合加快, 最终使其矿化能力都有所减弱; 其中BiOBr-F0.1催化剂加快了RhB脱乙基过程, 可能与表面位点被F占据有关[15].

|
图 13 RhB光催化降解的反应路径 Figure 13 The possible photocatalytic degradation paths of RhB |
采用水热法合成了BiOBr, 并用不同浓度的NaF溶液对其进行浸泡处理.通过物理表征发现, NaF溶液浸泡使得BiOBr的结构及性质均发生了显著变化; 由RhB的光催化降解过程发现, 浸泡浓度越大, 催化剂对RhB的矿化能力越弱, 而一定浓度的浸泡处理可以使降解动力学加速, RhB的氧化断键的位置发生改变.通过以上工作, 进一步研究了阴离子对光催化反应的调控作用, 探究了光催化剂修饰改性的新方法.
| [1] | Wang S L, Wa W H, Fan Y F, et al. Bismuth oxybromide promoted detoxificationof cylindrospermopsin under UV and visible light illumination[J]. Appl Cataly B-Environ, 2014, 150. |
| [2] |
a. Fang Y F, Ma W H, Huang Y P, et al. Exploring the reactivity of multicomponent photocatalysts: Insight into the complex valence band of BiOBr[J]. J Eur Chem, 2013, 19(9): 3224-3229. b. Cao Ya-ya (曹亚亚), Huang Shao-bin (黄少斌), Yin Jia-zhi (尹佳芝). Study on the ohotocatalytic activities of n-p type CeO2/BiOBr composite prepared at different calcination temperatures (不同煅烧温度制备的n-p型CeO2/BiOBr光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2016, 30(2): 159-168. |
| [3] | Chang X F, Huang J, Cheng C, et al. BiOX (X=Cl, Br, I) photocatalysts prepared using NaBiO3 as the Bi source:Characterization and catalytic performance[J]. Catal Comm, 2010, 11(5): 460–464. DOI:10.1016/j.catcom.2009.11.023 |
| [4] | An H Z, Du Y, Wang T M, et al. Photocatalytic properties of BiOX (X=Cl, Br and I)[J]. Rare Met, 2008, 3(27): 243–250. |
| [5] | Su Y R, Ding C H, Dang Y L, et al. First hydrothermal synthesis of Bi5O7Br and its photocatalytic properties for molecular oxygen activation and RhB degradation[J]. Appl Surf Sci, 2015, 346: 311–316. DOI:10.1016/j.apsusc.2015.04.021 |
| [6] | Fang Y F, Huang Y P, Chen G W, et al. Unique ability of BiOBr to decarboxylate d-Glu and d-Me Asp in the photocatalytic degradation of microcystin-LR in water[J]. Environ Sci & Technol, 2011, 45(4): 1593–1600. |
| [7] | Zhang X X, Li R P, Jia M K, et al. Degradation of ciprofloxacin in aqueous bismuth oxybromide (BiOBr) suspensions under visible light irradiation:A direct hole oxidation pathway[J]. J Chem Engineer, 2015, 274: 290–297. DOI:10.1016/j.cej.2015.03.077 |
| [8] | Fang Y F, Yang H W, Zhou W, et al. BiOBr photocatalyzed decarboxylation of glutamic acid:reaction rates, intermediates and mechanism[J]. RSC Adv, 2015, 5(69): 55727–55730. DOI:10.1039/C5RA09528J |
| [9] |
a. Sheng H, Ji H W, Chen C C, et al. Activation of water in titanium dioxide photocatalysis by formation of surface hydrogen bonds: An In situ IR spectroscopy study[J]. Angew Chem Int Ed, 2015, 54(20): 5905-5909. b. Zhang Jian-qi (张剑琦), Li Li (李莉), Liu Di (柳迪), et al. Preparation of three-dimensionally ordered macroporous composite ZrO2-TiO2 and its photocatalytic degradation of organic pollutantsunder multiple modes 3DOM (TiO2-ZrO2复合材料制备与多模式光催化降解有机污染物)[J]. J Mol Catal(China)(分子催化), 2015, 29(4): 348-358. c. Li Cao-long (李曹龙), Lei Zi-qiang (雷自强), Wang Qi-zhao (王其召), et al. Synthesis of TiO2(B) nanobelts photocatalyst for water splitting to H2 (TiO2(B) 纳米带光催化剂的制备及分解水产氢性能)[J]. J Mol Catal(China)(分子催化), 2015, 29(4): 382-389. d. Ma Lin (马琳), Kang Xiao-xue (康晓雪)), Hu Shao-zheng (胡绍争), et al. Preparation of Fe, P Co-dopedGraphitic carbon nitride with enhanced visible-light photocatalytic activity (Fe-P共掺杂石墨相氮化碳催化剂可见光下催化性能研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(4): 359-368. |
| [10] |
a. Sheng H, Ji H W, Chen C C, et al. Direct four-electron reduction of O2 to H2O on TiO2 surfaces by pendant proton relay[J]. Angew Chem Int Ed, 2013, 52(37): 9686-9690. b. Wang Xu (王旭), Bai Sagala (萨嘎拉), Bao Zhaorigetu (照日格图). Hydroxylation of benzene to phenol by photocatalysis on NiOx/meso hangjin2# clay (NiOx/介孔杭锦2#土的制备及其对苯羟基化光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(3): 266-274. c. Sun Sheng-nan (孙圣楠), Li Chun-hu (李春虎), Yang Wei-wei (杨微微), et al. Photocatalytic removal of NO from flue gas by TiO2 loaded on semi-coke prepared by sol-gel method (溶胶-凝胶法制备TiO2负载活化半焦光催化烟气脱硝)[J]. J Mol Catal(China)(分子催化), 2015, 29(2): 188-196. d. Li Ling (李灵), Huang Ying-ping (黄应平), Zhang Ai-qing (张爱清), et al. Synthesis and visible-light photocatalysis performance research of BiVO4/Bi6O6(OH)3(NO3)3 composite photocatalyst (BiVO4/Bi6O6(OH)3(NO3)3复合光催化剂的制备及光催化性能研究)[J]. J Mol Catal(China)(分子催化), 2016, 30(5): 470-479. |
| [11] | Zhang H L, Yu H G, Zheng A M, et al. Reactivity enhancement of 2-propanol photocatalysis on SO42-/TiO2:Insights from solid-state NMR spectroscopy[J]. Environ Sci & Technol, 2008, 42(14): 5316–5321. |
| [12] | Yu J C, Ho W K, Yu J G, et al. Effects of trifluoroacetic acid modification on the surface microstructures and photocatalytic activity of mesoporous TiO2 thin films[J]. Langmuir, 2003, 19(9): 3889–3896. DOI:10.1021/la025775v |
| [13] | Yang H, Chen L F, Tao L, et al. Preparation of Nano-Titania/Nafion hybrid membrane and its photocatalytic degradation to 2, 4, 5-Trichlorobiphenyl[J]. Rare Metal Mat & Engineer, 2012, 41(6): 643–646. |
| [14] | Minero C, Pelizzetti E, Maurino V, et al. Photocatalytic transformation of organic compounds in the presence of inorganic anions. 1.Hydroxyl-mediated and direct electron-transfer reactions of phenol on a titanium dioxide-fluoride system[J]. Langmuir, 2000, 16(6): 2632–2641. DOI:10.1021/la9903301 |
| [15] | Wang Q, Chen C C, Zhao D, et al. Change of adsorption modes of dyes on fluorinated TiO2 and its effect on photocatalytic degradation of dyes under visible irradiation[J]. Langmuir, 2008, 24(14): 7338–7345. DOI:10.1021/la800313s |
| [16] | An Jia-wei(安伟佳), Cui Wen-quan(崔文权), Liu Li(刘利), et al. Bismuth oxyhalides compound photocatalyst(卤氧化铋光催化剂的复合改性)[J]. J Mol Catal(分子催化), 2013, 27(5): 483–492. |
| [17] | Wang Yan-qin(王燕琴), Feng Hong-wu(冯红武), Cheng Xiao-fang(程小芳), et al. Research progress in bismuth oxyhalide compounds photocatalysts(卤氧化铋光催化剂的研究进展)[J]. Chem Ind Engineer Prog(化工进展), 2014, 3(33): 660–667. |
| [18] | Zhou Wei(周薇), Hu Xiao-long(胡晓龙), Fang Yan-fen(方艳芬), et al. Preparation of graphene-BiOBr Composite and the enhanced photocatalytic activity under visible-light irradiation(石墨烯-溴氧化铋复合物的制备及可见光光催化性能研究)[J]. J Mol Catal(分子催化), 2014, 28(4): 367–375. |
| [19] | Cheng X, Zhang H Y, Ye K Q, et al. Morphology-dependent fluorescence ON/OFF of a beryllium complex:ACQ in amorphous solids, AEE in crystalline powders and the dark/bright fluorescence switch[J]. J Mat Chem C, 2013, 1(45): 7507–7512. DOI:10.1039/c3tc31554a |
| [20] | Su W Y, Wang J, Huang Y X, et al. Synthesis and ca-talytic performances of a novel photocatalyst BiOF[J]. Sci Mat, 2010, 62(6): 345–348. |
| [21] | Zhao Z Y, Dai W W. Structural, electronic, and optical properties of Eu-Doped BiOX (X=F, Cl, Br, I):A DFT+U Study[J]. Inorg Chem, 2014, 53(24): 13001–13011. DOI:10.1021/ic5021059 |
| [22] | Huang W L, Zhu Q S. Electronic structures of relaxed BiOX (X=F, Cl, Br, I) photocatalysts[J]. Comp Mat Sci, 2008, 43(4): 1101–1108. DOI:10.1016/j.commatsci.2008.03.005 |
| [23] | Wu Chun-hong(吴春红), Fang Yan-fen(方艳芬), Jia Man-ke(贾漫珂), et al. Preparation of Ag-BiVO4 composite and its photocatalytic oxidation mechanism(Ag-BiVO4复合光催化剂的制备及其可见光光催化机理的研究)[J]. J Mol Catal(分子催化), 2015, 29(4): 369–381. |
| [24] | Li Xin-yu(李新玉), Fang Yan-fen(方艳芬), Xiong Shi-wei(熊世威), et al. Preparation of Fe-dopped BiOBr using different bromine source and visible-light photocatalytic activity(不同溴源制备铁掺杂BiOBr及其可见光光催化活性研究)[J]. J Mol Catal(分子催化), 2013, 27(6): 575–584. |
| [25] | Chang X F, Du M P, Ji G B, et al. Photodegradation of rhodamine B over unexcited semiconductor compounds of BiOCl and BiOBr[J]. J Coll & Inter Sci, 2012, 377(1): 291–298. |
| [26] | Wang Chun-ying(王春英), Zhu Qing-jiang(朱清江), Gu Chuan-tao(谷传涛), et al. Investigation of rhodamine B photocatalytic degradation by Ce3+ doped Bi2WO6(稀土Ce3+掺杂Bi2WO6光催化降解罗丹明B的研究)[J]. Chin Environ Sci(中国环境科学), 2015, 35(9): 2682–2689. |
| [27] | Wang Ai-min(王爱民), Qu Jiu-hui(曲久辉), Song Ling-ling(宋玲玲), et al. Electrochemical generation of hydroxyl radicals for acid red B gegradation by activated carbon fiber electrodes(活性炭纤维电极生成羟基自由基降解酸性红B)[J]. Acta Chim Sin(化学学报), 2006, 64(8): 767–771. |
| [28] | He Z, Sun C, Yang S, et al. Photocatalytic degradation of rhodamine B by Bi2WO6with electron accepting agent under microwave irradiation:Mechanism and pathway[J]. J Hazard Mat, 2009, 162(2/3): 1477–1486. |
| [29] | Hu Jin-shan(胡金山), Wang Huan(王欢), Liang Ying-hua(梁英华), et al. Preparation of highly efficient Ag@AgBr plasmonic photocatalyst and its photocatalytic performance under visible light(高效Ag@AgBr等离子体光催化剂的制备及可见光活性研究)[J]. J Mol Catal(分子催化), 2013, 27(5): 452–458. |
| [30] | Wu J M, Zhang T W. Photodegradation of rhodamine B in water assisted by titania films prepared through a novel procedure[J]. J Photochem & Photobiol A Chem, 2004, 162(1): 171–177. |
| [31] | Li Y, Wen B, Chen C C, et al. Photocatalytic degradation of aromatic pollutants:a pivotal role of ecb- in distribution of hydroxylated intermediates[J]. Environ Sci & Technol, 2012, 46(9): 5093–5099. |
| [32] | Xu X L, Duan X, Yi Z G, et al. Photocatalytic production of superoxide ion in the aqueous suspensions of two kinds of ZnO under simulated solar light[J]. Catal Comm, 2010, 12(3): 169–172. DOI:10.1016/j.catcom.2010.09.006 |
| [33] | Sun Yan-hui(孙艳辉), Wang Wei-long(王卫龙), Wu Lin-sheng(吴霖生), et al. Studies on the oxidation of tyrosine induced by hydroxyl radical with fluorescence spectroscopic method(荧光光谱法研究羟基自由基诱导的酪氨酸氧化)[J]. Spectro & Spec Anal(光谱学与光谱分析), 2011, 31(7): 1838–1841. |
| [34] | Wei W, Dai Y, Huang B B. First-principles characte-rization of Bi-based photocatalysts:Bi12TiO20, Bi2Ti2O7, and Bi4Ti3O12[J]. J Phys Chem C, 2009, 113(14): 5658–5663. DOI:10.1021/jp810344e |
| [35] | Zhang Wen(张雯), Wang Xu-xu(王绪绪), Lin Hua-xiang(林华香), et al. Influence of magnetic field on the formation rate of hydroxyl radical in photocatalysis(磁场对光催化反应羟基自由基生成速率的影响)[J]. Acta Chim Sin(化学学报), 2005, 63(18): 1765–1768. DOI:10.3321/j.issn:0567-7351.2005.18.024 |
| [36] | Jin X L, Ye L Q, Wang H, et al. Bismuth-rich strategy induced photocatalytic molecular oxygen activation pro-perties of bismuth oxyhalogen:The case of Bi24O31Cl10[J]. Appl Catal B, 2015, 165: 668–675. DOI:10.1016/j.apcatb.2014.10.075 |
| [37] | Lu Guang(陆光), Zhang Shuang(张爽), Lun Zi-shuai(伦子帅), et al. Effect of solvents on structural performance and photocatalytic degradation of RhB over BiOBr samples(溶剂对BiOBr结构和光催化降解RhB的影响)[J]. J Mol Catal(分子催化), 2016, 30(4): 383–390. |
 2017, Vol. 31
2017, Vol. 31


