2. 西华师范大学 化学化工学院, 四川 南充 637002;
3. 兰州大学 化学化工学院 功能有机分子化学国家重点实验室, 甘肃 兰州 730000;
4. 中国科学院大学, 中国 北京 100049
2. College of Chemistry and Chemical Engineering, China West Normal University, Nanchong 637002, China;
3. State Key Laboratory of Applied Organic Chemistry, College of Chemistry and Chemical Engineering, Lanzhou University, Lanzhou 730000, China;
4. University of Chinese Academy of Sciences, Beijing 100049, China
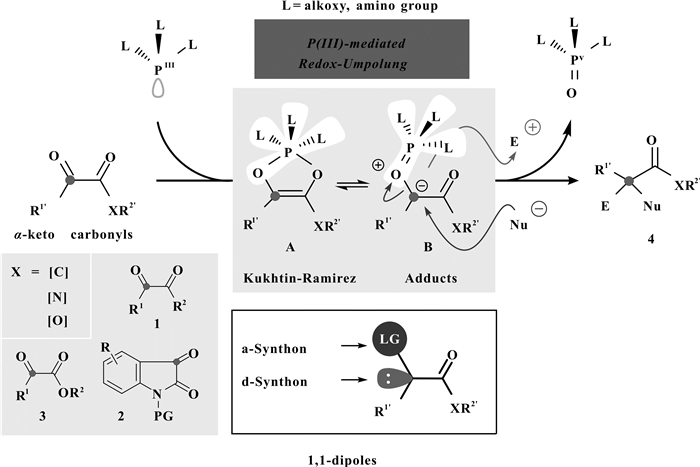
众所周知, 三价磷化合物因其磷中心含有不等性sp3杂化孤对电子而展现出了独特的亲核性, 被广泛用作有机金属配体和亲核性有机催化剂, 如手性联萘双二苯基膦 (BINAP)、三苯基膦及其双功能有机膦等, 此类研究极大地促进了有机化学相关领域的发展及其工业化应用[1].三价磷化合物除了具有上述提及的亲核性之外, 其本身固有的还原性也是有机合成中许多重要反应研究的基础, 如Michaelis-Arbuzov反应、Mitsunobu反应、Staudinger反应等[2].
20世纪50年代, Kukhtin与Ramirez[3]分别先后发现三价磷类化合物 (PL3), 如亚磷酸酯或亚磷酰胺, 可与α-羰基酮化合物1/2/3发生还原性加成、重排, 原位生成Kukhtin-Ramirez中间体 (图 1).该中间体通常以等量的“烯醇式二氧环磷戊烯A”与“季鏻内盐离子对B”两种形式存在于反应体系中.在原位生成Kukhtin-Ramirez中间体的过程中, 由于三价磷的固有还原性, 可以使原本亲电性的“酮羰基碳中心”发生极性反转成为亲核中心 (d-Synthon); 与此同时, 由于具有离去基团性质的季鏻盐结构 ([—O=PL3]+) 的原位引入, 该碳中心还兼有亲电性质 (a-Synthon), 即在酮羰基极性反转的碳中心同时形成一个氧化态离去基团 (LG).因此, 从化学性质上来讲, 该活性中间体相当于一个1, 1-偶极子 (1, 1-Dipoles), 易于发生一系列亲核、亲电反应.从形式上看, 该类转化是α-羰基酮化合物的酮羰基被三价磷还原脱除氧原子, 并在酮羰基的碳中心形成两个新的化学键, 其中三价磷化合物作为还原剂被氧化生成易溶于水的磷酰胺、磷酸酯等五价磷酸衍生物.
|
图 1 三价磷介入的Kukhtin-Ramirez反应 Figure 1 Phosphorus (Ⅲ)-mediated Kukhtin-Ramirez reaction |
三价磷介入的Kukhtin-Ramirez反应是有机化学中一类非常重要的极性反转反应, 但其早期研究仅主要集中于: (1) 醛酮的环丙化反应, 合成环氧丙烷化合物[4]; (2) 缺电子烯烃的环丙化反应, 合成环丙烷衍生物[5]; (3) S—Cl键形式插入反应, 合成α位硫代羰基化合物[6].除此之外, 关于Kukhtin-Ramirez中间体的化学研究报道不多.令人欣慰的是, 随着现代极性反转化学合成重要性的不断显现, 自20世纪末特别是2010年之后, Kukhtin-Ramirez反应在有机合成中应用与研究受到了极大的关注.我们就近5年来有关Kukhtin-Ramirez中间体在极性化学键插入、还原性加成以及成环反应研究方面的一些重要进展进行综述性介绍.
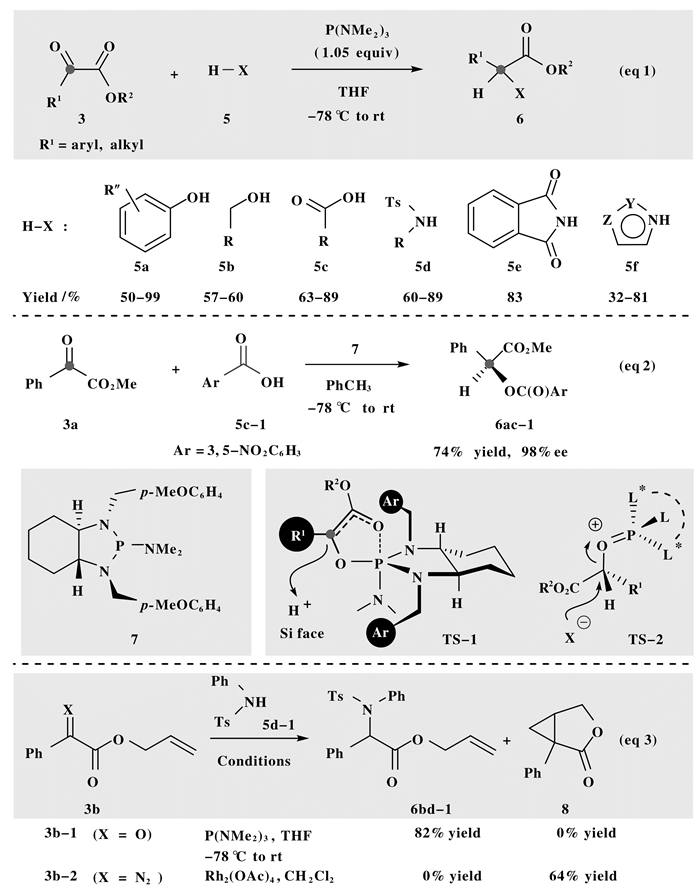
1 极性X—H插入反应2012年, Radosevich等[7]发现N, N, N-六甲基亚磷酰胺 (P (NMe2)3) 可催化α-酮酸酯3对酚O—H键的插入反应 (图 2, eq 1), 并以高达99%的收率合成了一系列α位酚氧取代的酯类化合物6.若以其它含有活泼氢的化合物 (如醇5b、酸5c、磺酰胺5d、酰亚胺5e、氮杂环5f) 代替酚类化合物5a时, 该转化也可生成对应的α位氧取代、氮取代的酯类产物 (eq 1).为了探讨可能的反应历程, 以苯甲酰甲酸甲酯3a与3, 5-二硝基苯甲酸5c-1为模型底物, 在计量 (1R, 2R)-环已二胺衍生的手性亚磷酰胺7的存在下, 对O—H键插入过程进行了研究 (图 2, eq 2), 值得一提的是, 该反应以74%产率、98%ee得到目标产物α-芳甲酰氧基苯乙酸甲酯6ac-1.由于在金属铑催化下重氮化合物极易生成卡宾中间体, 其也能与带质子的亲核试剂发生插入反应.因此他们设计了一组对照实验 (图 2, eq 3), 在金属铑催化体系中, 苯乙酸重氮烯丙酯3b-2与苯磺酰胺5d-1反应, 但只得到环丙烷化产物8, 而并未监测到酯基α位官能团化的产物6bd-1; 但在P (NMe2)3低温催化体系中, 相应的酮酸酯化合物3b-1与5d-1反应, 却可以82%产率分离到酯基α位官能团化产物6bd-1.根据这些实验结果, 作者认为三价磷促进的α-酮酸酯O—H/N—H插入反应的实际历程并非卡宾中间体直接介入的X—H键插入过程, 而应是首先在过渡态TS-1中发生高活性Kukhtin-Ramirez中间体的立体选择性质子化, 再发生TS-2中SN2型亲核取代, 经非协同分步过程生成酯基α位官能团化产物.

|
图 2 极性O—H键、N—H键插入反应 Figure 2 Insertion reaction of polar O—H and N—H bonds |
2015年, Zhao等[8]还实现了该类转化的Kukhtin-Ramirez催化反应 (图 3).在硅氢还原剂的作用下, 催化量环丁膦酰胺10可原位还原生成环膦催化剂11, 然后与α-酮酸酯3发生偶极反转反应, 生成Kukhtin-Ramirez中间体, 再经酸5c捕获, 生成酯基α位酰氧化产物9.当α-酮酸酯底物分子内引入羧酸基团时, 通过该转化还可获得相应的环状内酯化合物13与14.
|
图 3 极性O—H键催化插入反应 Figure 3 Catalytic insertion reaction of polar O—H bonds |
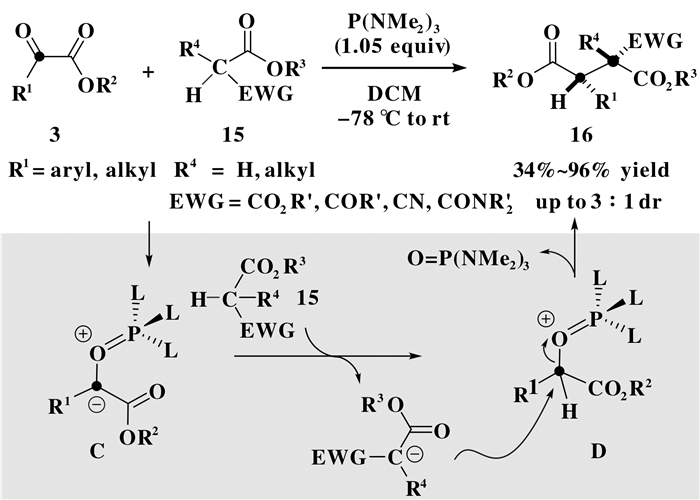
随后, Radosevich等[9]又将α-酮酸酯衍生的Kukhtin-Ramirez活性中间体成功地应用于具有α-酸性氢的羰基化合物的C—H键插入反应 (图 4), 其中含有活性氢的底物主要是易于烯醇化的酯类化合物15, 如丙二酸酯、1, 3-酮酸酯、氰基乙酸酯及丙二酸单酯单酰胺.通过此类C—H键插入反应, 可以方便地合成一系列1, 4-二羰基化合物16, 为药用分子及天然产物中广泛存在的1, 4-二羰基结构单元的快速构建提供了新方法.从反应途径上来看, 该C—H键插入反应是首先经Kukhtin-Ramirez中间体C的质子化形成D, 然后再与酯的烯醇亲核体的进行SN2取代, 最后生成以碳亲核取代反应为主的1, 4-二羰基产物.值得一提的是, 基于取代酯类底物 (R4 = alky) 的使用, 该反应还可以高达3:1的非对映选择性合成一些含有手性季碳中心的1, 4-二羰基化合物.

|
图 4 极性C—H键插入反应 Figure 4 Insertion reaction of polar C—H bonds |
由此可见, 涉及Kukhtin-Ramirez反应中间体的各类插入反应操作简单、条件温和[7-9], 可以避免传统合成方法中贵重金属催化剂或者亲电型氧化试剂的使用, 为羰基化合物α位官能团化提供了一种基于极性反转过程的有效方法.
2 还原性加成反应2014年, Ashfeld等[11]报道了N, N, N-六甲基亚磷酰胺 (P (NMe2)3) 促进的α-酮酸酯3与芳基亚硝基化合物17的还原性加成反应.在该反应研究中, 酮羰基的碳中心发生极性反转, 由亲电中心变为亲核碳中心, 而后与亲电性的芳基亚硝基发生加成反应, 伴随着N, N, N-六甲基磷酰胺 (O=P (NMe2)3) 的脱除离去, 一步生成具有重要合成价值的N-芳基硝酮化合物18(图 5, eq 1).若以二苯基乙二酮1a以及环状酮酰胺2a作为Kukhtin-Ramirez中间体的前体, 该反应也能以中等收率生成对应的目标产物.需要指出的是, 硝酮类化合物是非常重要的1, 3-偶极合成子, 可与烯烃发生[3+2]偶极环加成反应, 合成一系列含有异噁唑烷骨架的杂环化合物19.
|
图 5 涉及亚硝基、偶氮化合物的还原加成反应 Figure 5 Reductive addition with nitroso and azo compounds |
随后, 他们[12]又将上述α-酮酸酯经过极性反转形成的Kukhtin-Ramirez中间体用于亲电性偶氮二羧酸酯的反应体系.在P (NMe2)3的存在下, α-酮酸酯3与偶氮二羧酸酯类化合物20发生还原性加成反应, 以52%~95%的收率生成相应的酮腙产物21(图 5, eq 2).
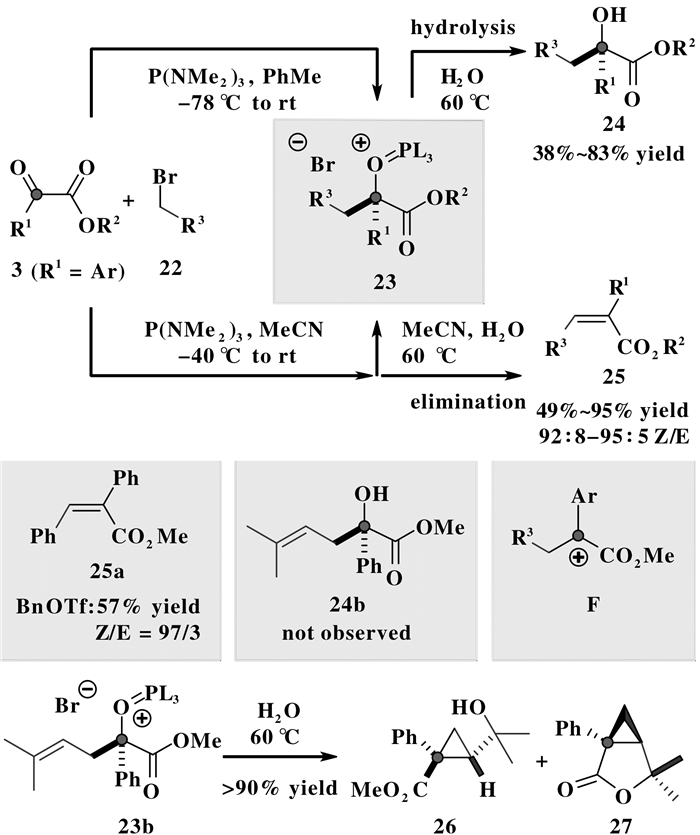
2015年, Radosevich等[10]基于三价磷介入的极性反转反应, 发现P (NMe2)3能够促进α-酮酸酯3与取代苄溴或者取代烯丙溴22发生还原性加成反应, 经过Kukhtin-Ramirez中间体, 一步生成可分离的烷氧基季鏻盐产物23(图 6).在低温干燥惰性气体氛围中, 该固体季鏻盐能存放数月, 但在含水、加热条件下该化合物易于发生水解、消除反应.例如, 在零下78 ℃至室温的甲苯体系中, 反应生成的季鏻盐23经过滤分离后, 以水为溶剂, 升温至60 ℃, 反应2 h可得到水解产物的α-羟基羧酸酯24; 若在零下40 ℃乙腈体系中, 反应恢复至室温后, 直接向反应体系加入水 (少量水), 升温至60 ℃, 加热反应2 h后则主要得到热力学稳定的消除产物——Z式三取代烯烃25.为了排除Wittig反应竞争性生成烯烃的可能性, 作者单独制备了Wittig反应前体季鏻盐 ({(Me2N)3P-Bn}+Br—), 但在平行条件下并没有得到与α-酮酸酯3反应的相应烯烃产物25.值得一提的是, 在低温条件下, 反应体系中也未监测到P (NMe2)3与苄溴直接加成的季鏻盐的存在.此外, 为了进一步排除P (NMe2)3与苄溴发生“亲卤置换反应 (Halophilic Displacement)”生成苄基负离子中间体参与反应的可能性, 作者在相关对照实验中用三氟甲磺酸苄酯 (BnOTf) 替代苄溴, 结果发现在平行条件下仍可生成相应的烯烃产物25a(57%产率, 97:3 Z/E), 该实验事实表明此三价磷试剂促进的还原性加成反应不同于经典的烷基卤代物与羰基化合物的Barbier类型加成反应.

|
图 6 涉及卤代物的还原加成反应及其转化 Figure 6 Reductive addition with halides and its transformations |
对于上述还原性加成反应得到的烷氧基季鏻盐23(图 6) 的水解过程, 作者提出了阳离子中间体F参与的可能性.作为支持性实验之一, 在异戊烯基取代的季鏻盐23b的水解反应中, 通过NMR监测分析, 并未观测到直接水解产物24b, 而是反应生成了阳离子亲电环化产物26/27(1:1, 90%产率), 其中化合物27为顺式环化/内酯化产物.该实验结果在一定程度上有力地支持了N, N, N-六甲基磷酰胺 (O=P (NMe2)3) 作为离去基团生成阳离子中间体F参与相应水解、消除过程的反应性.
结合上述实验事实, 推测该反应的主要历程可能为:三价磷试剂P (NMe2)3与α-酮酸酯3首先反应得到Kukhtin-Ramirez中间体, 然后与苄溴发生烷基化加成反应, 生成季鏻盐23; 在加热条件下, 该极性季鏻盐中的磷鎓离子结构单元离去形成芳基稳定的“类三级碳正离子中间体”, 然后再发生SN1取代反应或E1消除反应, 生成水解产物24或消除产物25.
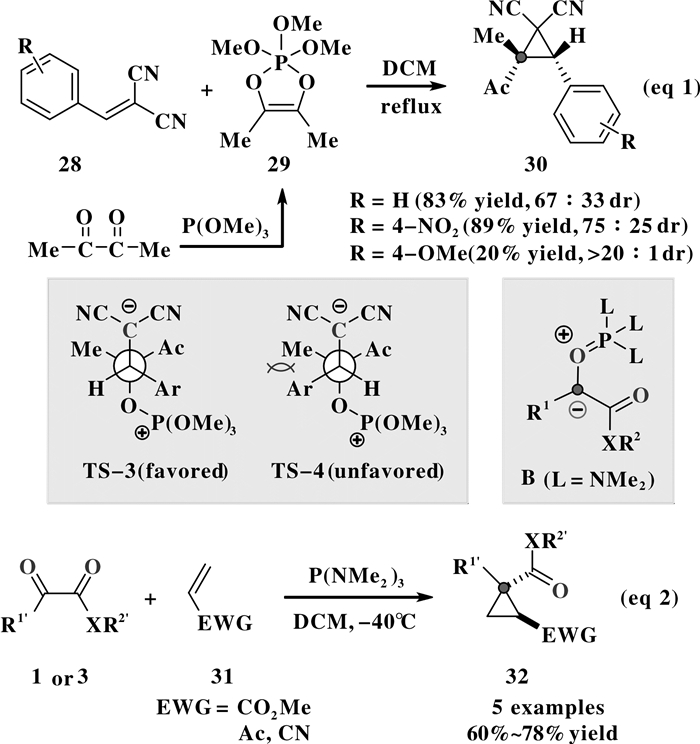
3 形式[2+1]环加成反应早在1971年, Foucaud等[5a]就发现缺电子烯烃28可与二氧环磷烯29经过形式[2+1]环加成反应, 一步生成多取代的环丙烷化合物30(图 7, eq 1).该反应中的二氧环磷烯29是通过丁二酮与亚磷酸三甲酯预先反应制得, 属于典型的Kukhtin-Ramirez反应中间体之一.相比于亚磷酰胺 (P (NR2)3) 生成的偶极反转Kukhtin-Ramirez中间体, 二氧环磷烯29可以稳定分离, 其较高的环丙化反应温度 (二氯甲烷回流) 也显示出了该中间体反应活性较低的化学性质.
|
图 7 涉及缺电子烯烃的形式[2+1]环加成反应 Figure 7 Formal [2+1] cycloaddition with electron-deficient olefins |
1980年,Burgada等[5b]发现:在低温条件下, P (NMe2)3活化α-羰基酮1或3原位生成活性较高的Kukhtin-Ramirez中间体B, 再与缺电子共轭烯烃31发生形式[2+1]环加成反应 (图 7, eq 2).从可能的反应途径上来看, 此类转化是首先经Kukhtin-Ramirez中间体对缺电子烯烃发生共轭加成, 然后经分子内亲核取代而实现环丙烷化过程.对于多取代烯烃的[2+1]成环反应 (eq 1), 为了减少分子内SN2取代过程中的不利空间位阻作用, 成环反应会优先以过渡态TS-3的方式发生取代环化, 生成苯基 (Ph) 与乙酰基 (MeCO) 处于同侧的cis-环丙烷主要异构体.需要指出的是, 此类基于Kukhtin-Ramirez反应中间体的缺电子烯烃形式[2+1]环加成是经典的金属卡宾参与的环丙烷化反应的重要补充.
环丙基取代的足球烯化合物在有机光电材料中有较为重要的用途[13]. 2011年, Bogdanov等[14]利用P (NEt2)3促进的形式[2+1]环加成, 将萘二乙酮1b与C60足球烯通过环丙化进行共价组装, 并以40%的收率合成了环丙烷足球烯产物 (图 8).当使用蒽二乙酮1c、靛红2b-2d等环状邻二羰基化合物时, 足球烯的环丙烷化也能顺利进行, 并生成C60足球烯[6, 6]并环双键上的环丙烷化产物33, 相应产物结构由单晶衍射确认.
|
图 8 涉及C60富勒烯的形式[2+1]环加成反应 Figure 8 Formal [2+1] cycloaddition with [60] fullerene |
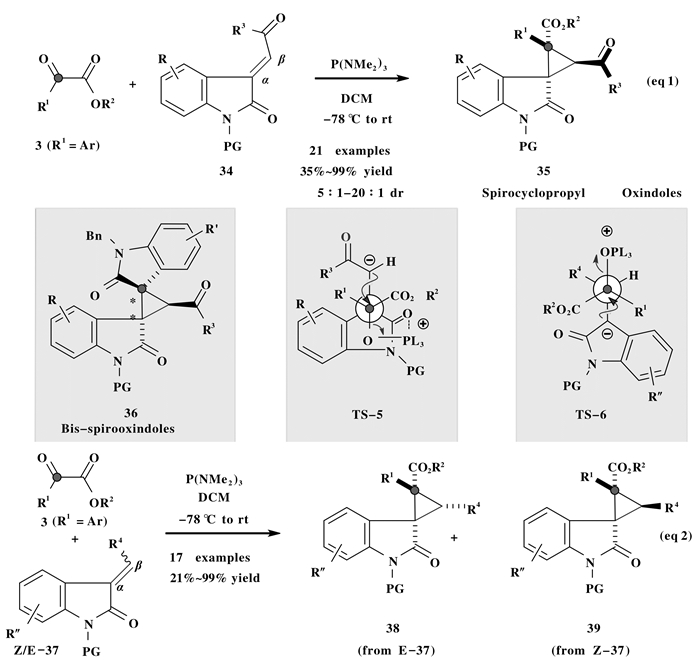
2014年, Zhou等[15]利用P (NMe2)3促进的形式[2+1]环加成反应, 以α-酮酸酯3与E-吲哚烯酮34为底物, 合成了一系列“吲哚酮螺环丙烷”类化合物35(图 9, eq 1), 反应显示出了较好的非对映选择性.在该成环转化中, 活性Kukhtin-Ramirez中间体首先与缺电子吲哚烯酮34的α位加成, 然后再与其β位发生亲核取代, 经过TS-5过渡态立体选择性地得到环丙化产物35.若以靛红为Kukhtin-Ramirez活性中间体的前体化合物与吲哚烯酮34进行环丙烷化, 则最后可生成结构复杂的双螺吲哚酮36.

|
图 9 涉及吲哚烯酮的形式[2+1]环加成反应 Figure 9 Formal [2+1] cycloaddition with 3-alkylidene oxindoles |
随后, Ashfeld等[16]又报道了以β-烷基/芳基取代的吲哚烯酮37为环化受体底物的Kukhtin-Ramirez环丙化反应, 在P (NMe2)3的作用下, 合成了一系列吲哚酮螺环丙烷产物38与39(图 9, eq 2).由于受体底物分子中π键电性分布的变化, Kukhtin-Ramirez中间体先与吲哚烯酮37的β位加成, 然后再经过渡态TS-6与其α位发生亲核取代.在此反应中, 吲哚烯酮的构象对环丙烷产物的立体选择性影响较大, 对于E-式吲哚烯酮底物E-37, 得到以38为主的非对映异构体产物 (up to > 98:2 dr); 而对于Z-式吲哚烯酮底物Z-37, 则得到以39为主的非对映异构体 (39/38 2:1 dr).
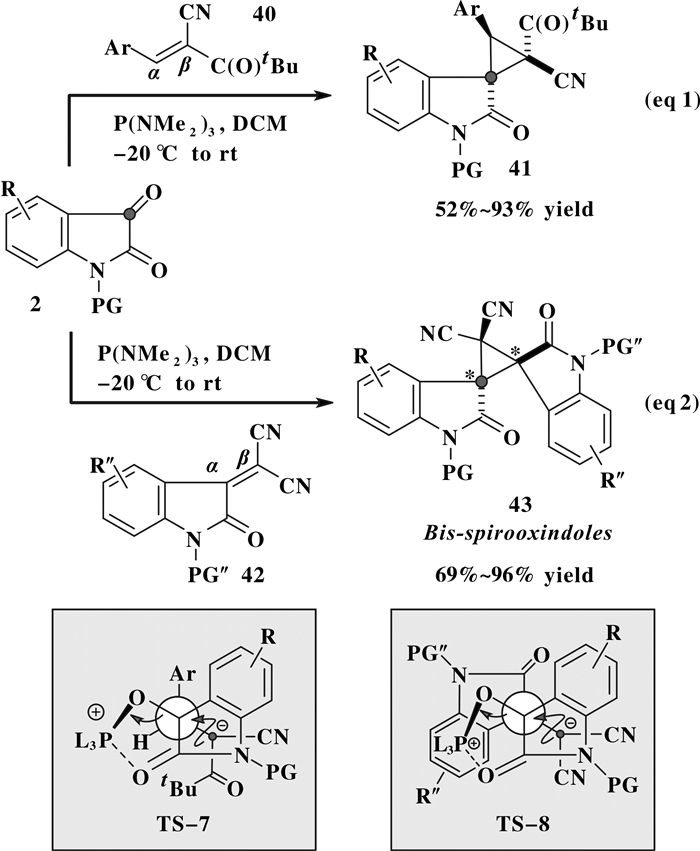
2016年, Han等[17]利用P (NMe2)3促进的靛红衍生物2的极性反转, 生成活性Kukhtin-Ramirez中间体 (图 10), 与叔丁酮取代的烯烃40发生形式[2+1]环加成反应, 高度非对映选择性地得到环丙烷螺吲哚酮产物41.当与四取代的吲哚烯酮42反应, 可以得到含有“双螺双吲哚酮环丙烷骨架”的全取代环丙烷产物43.
|
图 10 基于靛红类化合物极性反转的形式[2+1]环加成反应 Figure 10 Formal [2+1] cycloaddition based on the umpolung of isatin-type compounds |
除了上述缺电子烯烃环丙化, Kukhtin-Ramirez中间体参与的形式[2+1]环加成反应在“杂环丙烷”的合成中也有应用.文献[4]较早利用Kukhtin-Ramirez中间体来实现杂环丙烷化的报道是羰基化合物的环氧化反应.当反应温度高于零下40 ℃时, 高活性的Kukhtin-Ramirez中间体极易与其前体羰基酮加成、环化, 生成二聚式的环氧丙烷[10, 16, 18].需要说明的是, 此类环氧化过程在Kukhtin-Ramirez反应的之前研究中通常被视为应尽量避免的副反应.
作为环氧丙烷类似物的氮杂环丙烷, 具有与其相似的合成及反应特性, 是有机合成中的重要合成砌块[19].最近Lu等[20]利用P (NMe2)3与芳甲酰甲酸酯3原位反应产生活性Kukhtin-Ramirez中间体, 再与磺酰亚胺44反应合成氮杂环丙烷45(图 11), 反应收率与非对映选择性可以分别高达99%与20:1.对于该形式[2+1]环加成反应, 首先Kukhtin-Ramirez中间体经过渡态TS-9与亚胺发生加成, 然后再经TS-10发生分子内取代, 实现立体选择性的氮杂环丙烷化过程.从反应可能的过渡态TS-9与TS-10分析来看, 如果芳基上取代基团R1 (R1 = Ar) 或亚胺R3基团体积较大, 将明显导致R1 (R1 = Ar) 与R3之间的位阻增加, 从而导致成环反应的非对映选择性降低甚至反转.
|
图 11 涉及亚胺的形式[2+1]环加成反应 Figure 11 Formal [2+1] cycloaddition with imines |
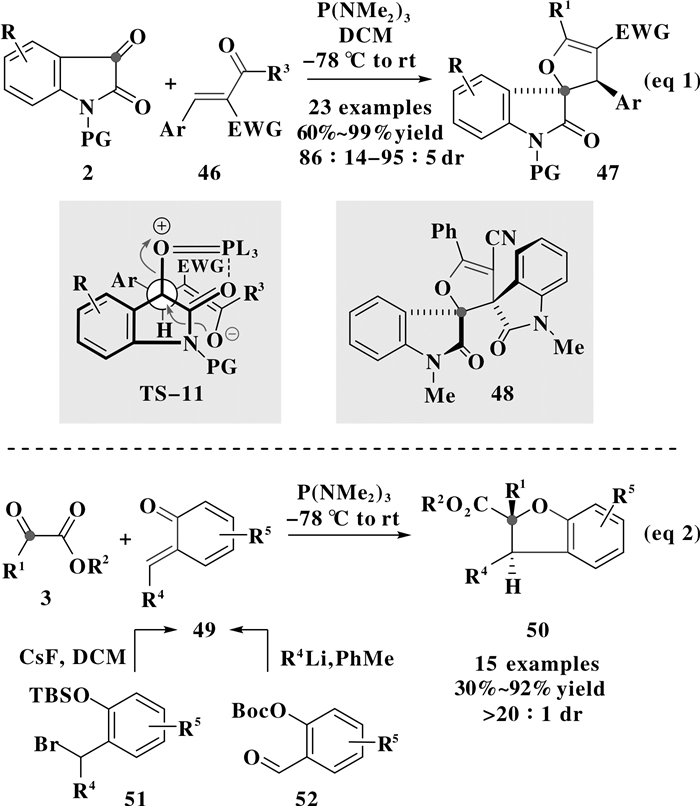
2015年, Zhou等[22]以靛红衍生物2与芳基烯酮46为底物, 在P (NMe2)3作用下, 经过形式[4+1]环加成反应, 可以高达99%的收率和95:5的非对映选择性得到了一系列吲哚酮螺二氢呋喃47 (图 12, eq 1).在该转化中, 烯酮化合物存在竞争性的环丙烷化反应.为了提高[4+1]成环产物的收率, 芳基烯酮的C3位需要带有吸电子基团, 以此吸电子基团的引入有效稳定过渡态TS-11中的烯醇负电荷, 从而利于氧端发生分子内亲核取代.另外, C3位吸电子基团的引入不仅可以降低C3位碳中心的亲核性, 而且还可以增加碳中心的位阻, 从而在一定程度上避免[2+1]环丙化反应的竞争性发生.如果以四取代的3-吲哚烯酮为成环受体底物, 反应能以62%的收率和10:1的非对映选择性生成结构新颖的“吲哚酮/螺二氢呋喃/螺吲哚酮”化合物48.

|
图 12 涉及不饱和羰基化合物的形式[4+1]环加成反应 Figure 12 Formal [4+1] cycloaddition with unsaturated carbonyls |
2016年, Ashfeld等[23]将该转化进行了更加深入的研究.他们利用P (NMe2)3与芳甲酰甲酸酯3的极性反转反应产生活性Kukhtin-Ramirez中间体, 与邻亚甲基苯醌49发生形式[4+1]环加成反应, 可以高达92%的收率和大于20:1的非对映选择性合成了一系列“苯并二氢呋喃”化合物50(图 12, eq 2).在该报道中, 当利用溴代硅基保护的苯酚51作为底物时, 反应中需要添加碱性CsF以原位生成邻亚甲基苯醌底物49; 而对于Boc保护的水杨醛52而言, 各种不同金属锂试剂 (R4—Li) 的使用为原位合成具有不同C4取代基的邻亚甲基苯醌49提供了可能.
2016年, Zhou等[21]还发现在碱性条件下, 活性Kukhtin-Ramirez中间体可与二氰基取代的双烯化合物53反应, 生成多官能团化的环戊烯酮亚胺54(图 13).环戊烯酮亚胺54通过水解可生成热力学稳定的官能团密集的环戊烯酮55.结合实验数据分析, 该反应转化主要是经过渡态TS-12发生Kukhtin-Ramirez中间体与缺电烯烃的区域选择性1, 6-共轭加成、分子内环化, 再在碱性条件下经过渡态TS-13去质子化, 从而导致环丙烷C1—C2键断裂开环, 最后经TS-14发生分子内亲核加成, 完成形式[4+1]环化反应.
|
图 13 涉及缺电子双烯的形式[4+1]环加成反应 Figure 13 Formal [4+1] cycloaddition with electron-deficient dienes |
2013年, Radosevich等[24]报道了P (NMe2)3促进的取代亚甲基丙酮酸酯56的自身形式[4+2]环加成反应.在该成环反应中, 原位生成的活性Kukhtin-Ramirez中间体通过电荷离域可以共振形成1, 1-偶极体 (1, 1-Dipoles) 与1, 3-偶极体 (1, 3-Dipoles).该1, 3-偶极体首先与一分子的取代亚甲基丙酮酸酯56发生Michael加成引发的分步形式[4+2]环加成反应, 形成中间体G后再与另一分子的取代亚甲基丙酮酸酯56发生环丙化反应得到中间体H, 然后经过环丙烷开环、异构化形成中间体J, 最后经过N, N, N-六甲基磷酰胺 (O=P (NMe2)3) 的消除, 可得到三分子芳基亚甲基丙酮酸酯缩合的“多官能团化二氢吡喃”化合物57(图 14).在该转化中, Kukhtin-Ramirez中间体一方面作为1, 3-偶极体直接构筑二氢吡喃环, 另一方面又作为1, 1-偶极体参与环丙基结构单元的形成、开环和质子迁移异构等过程, 这充分体现了Kukhtin-Ramirez中间体在有机合成中的独特反应性.

|
图 14 涉及取代亚甲基丙酮酸酯的形式[4+2]环加成反应 Figure 14 Formal [4+2] cycloaddition with alkylidene pyruvates |
综上所述, 三价磷介入的Kukhtin-Ramirez反应自从上个世纪50年代被首次报道以来, 经过跨越半个多世纪的发展, 从早期为数不多的几例反应研究, 到近期许多报道的陆续涌现, 充分显示了其在现代极性反转化学研究中不断增加的重要性. Kukhtin-Ramirez反应具有原料易得、反应条件温和、操作简单等特点, 其活性中间体在“极性X—H键插入、还原性加成、形式[2+1]环加成、形式[4+1]环加成、形式[4+2]环加成”等方面展现了1, 1-偶极子的独特化学反应性, 为一系列高度官能团化的链状、环状合成砌块 (如酯、烯烃、硝酮、腙、环丙烷、氮杂环丙烷、环戊烯酮 (亚胺)、氢化呋喃、氢化吡喃) 的高效构建提供了新途经.这些反应研究不仅丰富了羰基亲电碳中心的极性反转内容, 而且极大地拓展了极性反转化学在方法学设计中的研究模型, 是现代有机合成化学中值得关注的研究亮点.
但此类三价磷促进的极性反转反应仍有诸多主题有待于进一步探讨, 如:
(1) 设计新的底物模型, 发展新的极性反转串联反应, 为多官能团化合成砌块提供新的多样性合成方法;
(2) 发展新的催化体系, 实现三价磷与五价磷之间的催化循环, 提高三价磷的反应利用率;
(3) 实现Kukhtin-Ramirez反应的不对称催化, 为相关手性化合物的催化合成提供新策略;
(4) 探究Kukhtin-Ramirez反应的极性反转机理, 洞悉电子转移机制, 为了解认识相关反应性、选择性的化学本质奠定基础.
我们相信随着极性反转化学研究的深入, 三价磷促进的Kukhtin-Ramirez反应在有机合成中的研究与应用将会取得更多令人瞩目的重要进展.
| [1] |
a. Yang Li-jun (杨丽军), Ma Jun-an (马军安). New advances on nucleophilic phosphine-triggered annulation reactions of allenoates (亲核叔膦促进的联烯酸酯环加成反应研究进展)[J]. Acta Chim Sin(化学学报), 2016, 74(2): 130-148. b. Wang T, Han X, Zhong F, et al. Amino acid-derived bifunctional phosphines for enantioselective transformations[J]. Acc Chem Res, 2016, 49(7): 1369-1378. c. Fu W, Tang W. Chiral monophosphorus ligands for asymmetric catalytic reactions[J]. ACS Catal, 2016, 6(8): 4814-4858. d. Ren Xin-yi (任新意), Zhang Lei (张磊), Wang Zheng (王正), et al. Rh-Catalyzed Hydroformylation of Alkynes to α, β-Unsaturated Aldehydes (铑催化炔烃氢甲酰化反应合成α, β-不饱和醛)[J]. J Mol Catal(China)(分子催化), 2016, 30(6): 497-504. e. Liao Ben-ren (廖本仁), Fan Man-man (范曼曼), Gong Lei (龚磊), et al. Studyon hydroformylation of butene with diphosphite and diphosphine mixed-ligands modified catalysts (双亚磷酸酯和双膦混合配体在丁烯氢甲酰化反应中的应用研究)[J]. J Mol Catal(China)(分子催化), 2015, 29(1): 19-26. |
| [2] | Swamy K C K, Kumar N N B, Balaraman E, et al. Mitsunobu and related reactions:advances and applications[J]. Chem Rev, 2009, 109(6): 2551–2651. DOI:10.1021/cr800278z |
| [3] |
a. Ramirez F. Oxyphosphoranes[J]. Acc Chem Res, 1968, 1(6):168-174. b. Nifantiev E E, Grachev M K, Burmistrov S Y. Amides of trivalent phosphorus acids as phosphorylating reagents for proton-donating nucleophiles[J]. Chem Rev, 2000, 100(10):3755-3799. c. Osman F H, El-Samahy F A. Reactions of α-diketones ando-quinones with phosphorus compounds[J]. Chem Rev, 2002, 102(3):629-677 and references therein. |
| [4] | Harvey R G, Schneider J F. Hexamethylphosphorous triamide.e-EROS Encyclopedia of Reagents for Organic Synthesis[M]. John Wiley and Sons, Inc, 2013. |
| [5] |
a. Corre E, Foucaud A. Synthesis of 2-acetyl-3-aryl-1, 1-dicyano-2-methyl-cyclopropanes[J]. J Chem Soc D, 1971, (11):570a-570a. b. Fauduet H, Burgada R. A convenient synthesis of polysubstituted cyclopropanes[J]. Synthesis, 1980, (8):642-644. c. Afonso A, Hon F, Weinstein J, et al. A new synthesis of penems, the oxalimide cyclization reaction[J]. J Am. Chem Soc, 1982, 104(22):6138-6139. |
| [6] |
a. Harpp D N, Mathiaparanam P. Synthesis of β-keto sulfides[J]. J Org Chem, 1971, 36(17):2540-2541. b. Harpp D N, Mathiaparanam P. 1, 3, 2-Dioxaphospholene-sulfenyl chloride condensation. scope and mec-hanism[J]. J Org Chem, 1972, 37(9):1367-1374. |
| [7] | Miller E J, Zhao W, Herr J D, et al. A nonmetal approach to α-heterofunctionalized carbonyl derivatives by formal reductive X-H insertion[J]. Angew Chem, Int Ed, 2012, 51(42): 10605–10609. DOI:10.1002/anie.201205604 |
| [8] | Zhao W, Yan P K, Radosevich A T. A phosphetane ca-talyzes deoxygenative condensation of α-keto esters and carboxylic acids via P (Ⅲ)/P (Ⅴ)=O redox cycling[J]. J Am Chem Soc, 2015, 137(2): 616–619. DOI:10.1021/ja511889y |
| [9] | Zhao W, Fink D M, Labutta C A, et al. A Csp3-Csp3 bond forming reductive condensation of α-keto esters and enolizable carbon pronucleophiles[J]. Org Lett, 2013, 15(12): 3090–3093. DOI:10.1021/ol401276b |
| [10] | Wang S R, Radosevich A T. P (NMe2)3-Mediated umpolung alkylation and nonylidic olefination of α-keto esters[J]. Org Lett, 2015, 17(15): 3810–3813. DOI:10.1021/acs.orglett.5b01784 |
| [11] | Chavannavar A P, Oliver A G, Ashfeld B L. An umpo-lung approach toward N-aryl nitrone construction:a phosphine-mediated addition of 1, 2-dicarbonyls to nitroso electrophiles[J]. Chem Comm, 2014, 50(74): 10853–10856. DOI:10.1039/C4CC05044D |
| [12] | Haugen K C, Rodriguez K X, Chavannavar A P, et al. Phosphine-mediated addition of 1, 2-dicarbonyls to diazenes:an umpolung approach toward N-acyl hydrazone synthesis[J]. Tetra Lett, 2015, 56(23): 3527–3530. DOI:10.1016/j.tetlet.2015.01.030 |
| [13] | He D, Du X, Xiao Z, et al. Methanofullerenes, C60(CH2)(n) (n=1, 2, 3), as building blocks for high-performance acceptors used in organic solar cells[J]. Org Lett, 2014, 16(2): 612–615. DOI:10.1021/ol4035275 |
| [14] | Romanova I P, Bogdanov A V, Mironov V F, et al. Deoxygenation of some α-dicarbonyl compounds by tris (diethylamino) phosphine in the presence of fullerene C60[J]. J Org Chem, 2011, 76(8): 2548–2557. DOI:10.1021/jo102332e |
| [15] | Zhou R, Yang C, Liu Y, et al. Diastereoselective synthesis of functionalized spirocyclopropyl oxindoles via P (NMe2)3-mediated reductive cyclopropanation[J]. J Org Chem, 2014, 79(21): 10709–10715. DOI:10.1021/jo502106c |
| [16] | Wilson E E, Rodriguez K X, Ashfeld B L. Stereochemical implications in the synthesis of 3, 3'-spirocyclopropyl oxindoles from β-aryl/alkyl-substituted alkylidene oxindoles[J]. Tetrahedron, 2015, 71(35): 5765–5775. DOI:10.1016/j.tet.2015.06.004 |
| [17] | Qi W-J, Han Y, Yan C-G. Diastereoselective synthesis of functionalized spiro[cyclopropane-1, 3'-indolines] and spiro[indoline-3, 1'-cyclopropane-2', 3″-indolines][J]. Tetrahedron, 2016, 72(33): 5057–5063. DOI:10.1016/j.tet.2016.06.020 |
| [18] | Musin L I, Bogdanov A V, Krivolapov D B, et al. Effect of the substituent on the phosphorus atom on the reaction of aminophosphines with 1-alkylisatins[J]. Russ J Org Chem, 2014, 50(6): 822–828. DOI:10.1134/S1070428014060116 |
| [19] |
a. Callebaut G, Meiresonne T, De Kimpe N, et al. Synthesis and reactivity of 2-(carboxymethyl) aziridine derivatives[J]. Chem Rev, 2014, 114(16):7954-8015. b. Ohno H. Synthesis and applications of vinylaziridines and ethynylaziridines[J]. Chem Rev, 2014, 114(16):7784-7814. c. Zhu Y, Wang Q, Cornwall R G, et al. Organocataly-tic asymmetric epoxidation and aziridination of olefins and their synthetic applications[J]. Chem Rev, 2014, 114(16):8199-8256. |
| [20] | Jiang J, Liu H, Lu C D, et al. P (NMe2)3-Mediated aziridination of imines with α-ketoesters for synthesis of aziridine-2-carboxylates[J]. J Org Chem, 2017, 82(1): 811–818. DOI:10.1021/acs.joc.6b02669 |
| [21] | Zhou R, Zhang K, Han L, et al. Unusual formal[1+4] annulation through tandem P (NMe2)3-mediated cyclopropanation/base-catalyzed cyclopropane rearrangement:facile syntheses of cyclopentenimines and cyclopentenones[J]. Chem Eur J, 2016, 22(17): 5883–5887. DOI:10.1002/chem.201505047 |
| [22] | Zhou R, Zhang K, Chen Y, et al. P (NMe2)3-mediated reductive[1+4] annulation of isatins with enones:A facile synthesis of spirooxindole-dihydrofurans[J]. Chem Comm, 2015, 51(78): 14663–14666. DOI:10.1039/C5CC03676C |
| [23] | Rodriguez K X, Vail J D, Ashfeld B L. Phosphorus (Ⅲ)-mediated stereoconvergent formal[4+1]-cycloannulation of 1, 2-dicarbonyls ando-quinone methides:A multicomponent assembly of 2, 3-dihydrobenzofurans[J]. Org Lett, 2016, 18(18): 4514–4517. DOI:10.1021/acs.orglett.6b02122 |
| [24] | Wang S R, Radosevich A T. Reductive homocondensation of benzylidene-and alkylidenepyruvate esters by a P (NMe2)3-mediated tandem reaction[J]. Org Lett, 2013, 15(8): 1926–1929. DOI:10.1021/ol400576e |
 2017, Vol. 31
2017, Vol. 31


