2. 南京工业大学 化工学院, 江苏 南京 210009
2. College of Chemistry and Chemical Engineering, Nanjing Tech University, Nanjing 210009, China
Cl2作为重要的基础原料, 广泛应用于石油化工、农化品、建筑材料以及医药制剂等行业[1].然而在许多涉氯生产的制造过程中副产生成大量的HCl或者氯化物, 造成了氯资源的严重浪费以及环境污染[2-3].催化氯化氢氧化制氯是目前实现工业副产氯化氢循环使用的有效途径[4-5].本世纪初, 日本Sumitomo Chemical首先开发了RuO2基工业催化剂, 使得该工艺得到了里程碑式的重大突破.区别于早期的铜基以及铬基工业催化剂, Sumitomo Chemical开发的钌钛金红石催化剂具有最为优异的HCl氧化活性以及稳定性.随后德国BASF及Bayer公司也对RuO2基催化剂展开了一系列的工业研究与探索[6-7]. RuO2基催化剂是催化氧化工艺目前唯一成功实现工业化并投产多年的催化剂, 但是贵金属Ru存在价格昂贵受市场影响价格波动较大等诸多问题限制了其进一步大规模的应用[8].为此在催化性能满足工业化要求的前提下, 通过对催化剂制备方法的改进以降低活性组分RuO2的负载量仍然尤为重要.
在对RuO2基催化剂的研究中发现, 采用同晶系的氧化物(如:金红石型TiO2、SnO2)作为载体, 利用其晶体结构相同、晶格间距相近的特点[8], 在界面发生化学键合形成外延生长结构, 将会显著提升RuO2的稳定性以及反应活性. Seki等[9]在对Sumitomo Chemical开发的RuO2/Rutile-TiO2催化剂研究中发现, 与RuO2纳米颗粒在TiO2-anatase表面均匀分散不同, 由于RuO2与TiO2-rutile之间存在强相互作用, RuO2在金红石型载体表面会外延生长形成接近单晶胞厚度的薄膜层, 使得该催化剂表现出很高的HCl氧化活性和热稳定性.可见对于RuO2基催化剂而言, 其存在明显的载体效应.
我们采用湿法浸渍法制备了多种不同焙烧温度下的金红石型TiO2为载体的RuO2/TiO2催化剂, 考察了载体的焙烧温度对催化剂活性的影响, 采用XRD、HRTEM、N2吸附-脱附及H2-TPR等手段对催化剂进行表征, 并对其催化HCl氧化性能进行研究, 以探求催化剂结构与其性能之间的关系.
1 实验材料与方法 1.1 催化剂制备RuO2/TiO2催化剂采用湿法浸渍法制备, 合成方法和条件如下:以偏钛酸(TiO(OH)2), 山东西亚化学工业有限公司, 98%)为前驱体, 取一定量的金红石晶种偏钛酸粉末放入马弗炉中, 分别在450、550、650及750 ℃下焙烧, 得到不同结晶度的金红石型二氧化钛作为载体备用, 记为TiO2-C(C为焙烧温度).称取水合三氯化钌(RuCl3·xH2O) 0.24 g(同济大学, 化学纯, ≤38%)于烧杯中, 分别加入25 mL蒸馏水, 搅拌至RuCl3·xH2O完全溶解, 再秤取6 g不同温度下焙烧的载体TiO2-C加入烧杯中, 室温下搅拌5 h, 将悬浊液转移至茄型烧瓶中, 85 ℃下旋转蒸发, 将得到的初步干燥的催化剂放入100 ℃烘箱中干燥过夜, 再将干燥后的催化剂放入马弗炉中250 ℃下焙烧16 h.将制得的催化剂命名为RuO2/TiO2-C(C=450、550、650及750 ℃).其中RuO2占TiO2-C的质量百分数为2%.
1.2 催化剂表征XRD在日本Rigaku公司的SarmtLab衍射仪进行检测, Cu Kα靶(λ = 0.154 nm), 管电压40 kV, 管电流100 mA, 扫描步长0.02°, 扫描速率0.05 s/step, 10°~80°扫描; 比表面积(BET测试在日本BEL公司的BELSORP-Ⅱ型吸附仪上进行,采用N2吸附法进行, 样品在200 ℃下真空预处理3 h, 然后再-196 ℃下进行吸脱附实验; TEM是在日本JEOL公司的JEM-100型透射电子显微镜上进行的; H2-TPR实验在Micomeritics公司(美国)的Auto ChemⅡ2920仪器上进行, 样品秤取50 mg置于石英反应管中, 在高纯Ar的氛围下200 ℃恒温预处理1 h, 然后降至50 ℃, 等检测器基线平稳后, 通入H2(10%)-Ar(90%)的混合还原气, 开始程序升温还原至900 ℃.混合气气体流量为50 mL·min-1, 温度升温速率为10 ℃·min-1, 利用热导检测器(TCD)检测还原过程中的耗氢量.
1.3 催化剂性能评价催化剂性能评价装置采用实验室常压微型固定床反应系统, 采用内径为24 mm的石英管为反应器, 热电偶管外径为4 mm.催化剂装填量为3 g, 粒径为0.45~1.25 mm, 用十倍石英砂对催化剂进行稀释, 将其装填于石英管反应器中部.反应温度为330 ℃, 反应气体为HCl和O2, HCl的体积流量控制在48 mL·min-1, V(O2):V(HCl) =1:1.催化剂动力学测试过程氯化氢转化率限制在5%~20%, 催化剂用量为1 g, N2为平衡气, 总气体进料流速为300 mL·min-1.
反应产物用KI溶液进行吸收后, 用碘量法及酸碱滴定法测定生成的氯气及未反应的氯化氢, 计算出氯化氢的转化率(XHCl):
| $ {X_{HCl}} = \frac{{{C_{N{a_2}{S_2}{O_3}}}{V_{N{a_2}{S_2}{O_3}}}}}{{{C_{N{a_2}{S_2}{O_3}}}{V_{N{a_2}{S_2}{O_3}}} + {C_{NaOH}}{V_{NaOH}}}} \times 100\% $ | (1) |
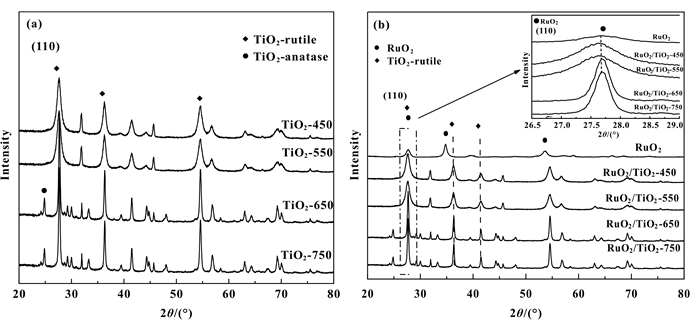
图 1(a)为不同焙烧温度下的TiO2样品的XRD谱图, 当载体焙烧温度的升高, TiO2相应的金红石型衍射峰逐渐增强, 这表明TiO2晶粒在高温焙烧下逐渐聚集长大, 且结晶程度不断提高.当焙烧温度达到和超过650 ℃时, 样品中出现少量归属于锐钛矿型的TiO2特征峰, 这可能是由于偏钛酸在高温下发生相变过程形成的, 根据R值法计算的杂峰质量含量小于4.5%.
|
图 1 (a)TiO2-C样品的XRD谱图, (b)RuO2和RuO2/TiO2-C催化剂的XRD谱图 Figure 1 (a)XRD patterns of the TiO2-C samples, (b)XRD patterns of the RuO2 and RuO2/TiO2-C catalysts |
RuO2/TiO2-C催化剂的XRD谱图如图 1(b)所示, 可以发现RuO2/TiO2-C属于四方晶系结构. RuO2/TiO2-C催化剂中只出现TiO2的晶相, 而未检测到晶相RuO2的特征峰, 表明Ru物种在载体TiO2表面呈高度分散状态[10].对比RuO2和RuO2/TiO2-C的XRD衍射峰可以发现, RuO2(110) 与RuO2/TiO2-C (110) 的衍射峰位置均处在27.6°左右, 从图 1(b)中的插图可以看出, 随着焙烧温度的逐渐升高, 归属于TiO2(110) 的衍射峰位置向接近于RuO2(110) 峰位置的高角度偏移(表 1).
| 表 1 RuO2、RuO2/TiO2-C催化剂的物理化学性质 Table 1 The physical chemical properties of the RuO2、RuO2/TiO2-C catalysts |
结合X射线衍射数据计算得到的TiO2(110) 晶胞参数值可知, 随着焙烧温度的提高, 四方相的a、b值越来越小, 逐步接近RuO2(110) 晶胞参数a、b轴的值, 且RuO2的(110) 晶面的表面能量最低且最稳定, 最易于在TiO2(110) 表面形成外延生长的纳米薄层[11-13].
2.1.2 HR-TEMHR-TEM测试可以较好地研究RuO2/TiO2-C催化剂(图 2(a-h))的微观表面形貌结构和分散度.从图 2(a-d)可以明显观察到当载体的焙烧温度逐步升高, TiO2出现团聚现象导致其粒径逐渐长大.结合图 2(e, f, g, h)的表面均能明显观察到在载体TiO2的表面均匀分布着颜色较深的RuO2纳米颗粒.

|
图 2 RuO2/TiO2-C催化剂的HRTEM图及RuO2粒径分布 Figure 2 HRTEM images and RuO2 particle size distribution of RuO2/TiO2-450 (a)(e), RuO2/TiO2-550 (b)(f), RuO2/TiO2-650 (c)(g), RuO2/TiO2-750 (d)(h) |
对图 2(e,f,g,h)粒径分布分析发现RuO2/TiO2-650催化剂中的RuO2颗粒平均粒径最小, 其主要的分布范围为0.2~1.4 nm, 平均粒径为0.91 nm, 表明RuO2/TiO2-650的分散度优于其他RuO2/TiO2催化剂.结合XRD的结果, 发现当RuO2负载于在较低的焙烧温度(X≤650 ℃)下得到的TiO2上时, 载体金红石型TiO2的110晶面与RuO2的110晶面晶胞参数匹配度会随着载体的焙烧温度的升高越来越高, 易于在界面处发生化学键合形成外延生长式结构, 从而促进活性组分在载体表面的分散, 使得催化剂表面的RuO2颗粒粒径越来越小[14].有趣的是, 对载体在较高焙烧温度下得到的RuO2/TiO2-750进行粒径分析后发现, 该催化剂虽表现出最高的晶格匹配度, 然而催化剂的分散度下降了, 结合图 2(d)的情况, 推测是由于TiO2在高温焙烧下出现结构塌陷以及严重烧结的现象, 影响了RuO2在载体表面的分散.
2.1.3 N2吸附-脱附分析由表 1可见, 随着焙烧温度的升高, RuO2/TiO2-C催化剂的比表面积不断下降, 当焙烧温度为450 ℃时, RuO2/TiO2-450催化剂的比表面积为44.8 m2·g-1.当焙烧温度提高到750 ℃时, RuO2/TiO2-750催化剂的比表面积降低到16.7 m2·g-1, 这是由于在高温焙烧下, 偏钛酸形成的TiO2易发生团聚导致TiO2晶粒变大, 与HR-TEM所观察到的结果相一致.
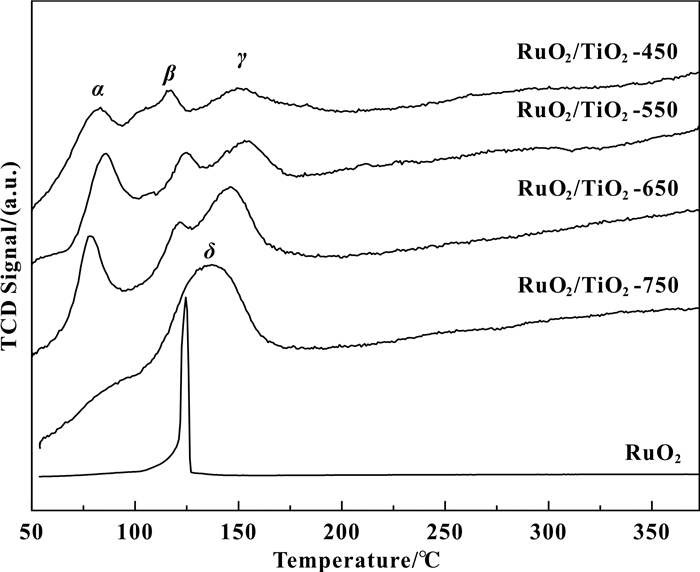
2.1.4 TPR分析图 3为RuO2/TiO2-C、RuO2的H2-TPR图.可以发现RuO2/TiO2-450、RuO2/TiO2-550、RuO2/TiO2-650催化剂出现了3个RuO2的还原峰, 这可能与RuO2在载体表面形成的颗粒大小不一有关.可以猜测其中最低温的α还原峰应该归属于载体表面微晶态小颗粒尺寸Ru物种的还原, β还原峰温度与晶相RuO2的还原温度一致, 其对应的是大颗粒尺寸RuO2的还原, 还原温度最高的γ峰还原温度高于RuO2的还原温度, 这是由于TiO2与载体之间存在相互作用, 在两者的界面处形成Ru—O—Ti键[15], γ还原峰应该是归属于载体TiO2-rutile表面的外延薄层RuO2的还原[16-17].其中RuO2/TiO2-650的低温还原耗氢峰表现出最低的氧化还原温度以及最大的低温耗氢量, 这主要是由于随着焙烧温度的升高, 载体TiO2与RuO2的晶胞参数匹配度越来越高, 所以RuO2在载体表面更易形成外延生长的结构, 从而促进了活性组份的分散度, 提高了其低温氧化还原性能.
|
图 3 RuO2、RuO2/TiO2-C催化剂的H2-TPR图 Figure 3 H2-TPR profile of RuO2、RuO2/TiO2-C catalysts |
与RuO2/TiO2-450、RuO2/TiO2-550、RuO2/TiO2-650的H2-TPR图不同, RuO2/TiO2-750在测试温区内只出现一个还原峰, 且高于RuO2的还原温度, 是由于当RuO2与TiO2之间的晶格高度匹配时, RuO2与载体之间过强的相互作用, 反而阻碍了载体表面RuO2的还原[17].
2.2 载体焙烧温度对RuO2/TiO2催化性能的影响RuO2/TiO2-C催化剂在330 ℃下的活性测试结果如图 4所示, 所有催化剂的活性用氯化氢的转化率表示, 其中RuO2/TiO2-650催化剂表现出最优的反应活性, 反应温度在330 ℃时, 其HCl转化率可达70.3%, 反应速率为3.21 molCl2·molcat-1·h-1, 表明采用合适焙烧温度的TiO2可以提高单位RuO2的利用率.

|
图 4 RuO2平均粒径和催化活性关系图 Figure 4 A linear relationship catalytic activity and average particle size of RuO2 over all catalysts |
| 表 2 RuO2/TiO2催化剂在330 ℃下的催化活性以及反应速率 Table 2 Catalytic activity and reaction rate of the RuO2/TiO2 catalysts at 330 ℃ |
对活性测试的结果进行分析发现, RuO2/TiO2-450、RuO2/TiO2-550和RuO2/TiO2-650催化剂的反应活性随着载体焙烧温度的升高逐步提高, 结合RuO2/TiO2催化剂的表征结果, 这与RuO2与TiO2之间的晶面匹配度相关, 高的晶格匹配度促进了RuO2在其载体表面的分散.纳米尺寸较小的RuO2颗粒在相同晶型的载体TiO2表面更容易发生表面重构, 更易于暴露RuO2的(110) 晶面, 使得催化剂表面存在更多的配位不饱和的氧原子(Obr)和Ru原子(Rucus)[15], 从而增加催化反应活性点位, 提高催化反应活性.
当载体焙烧温度达到750 ℃时, RuO2/TiO2-750催化剂的活性开始下降, 结合之前表征测试的结果, 是由于载体在高温度焙烧后, 严重的团聚现象影响了活性组分RuO2在载体表面的分散.结合H2-TPR测试的表征结果, 更进一步分析是由于RuO2与TiO2之间过强的相互作用, 不利于氯化氢和氧气在催化剂表面的活化, 从而影响氯化氢氧化反应的进行.
对RuO2的粒子尺寸与催化活性关系的进行研究, 发现RuO2的粒子尺寸与HCl氧化催化活性之间存在很好的线性关系, 平均粒径越小的催化剂, 其单位RuO2催化活性越高, 可见, 对于RuO2基催化剂减小其RuO2的粒径, 对于提高其HCl氧化催化活性有重要意义.
2.3 RuO2/TiO2催化剂动力学测试图 5为RuO2/TiO2催化剂对O2和HCl的反应级数测定, 具体的计算方法在之前的工作中有详细的介绍[18].与CuO基以及CeO2基催化剂的反应级数测定的结果不同[4-5, 19], 本研究动力学实验结果发现, 氧气的反应级数大大高于氯化氢的反应级数, 且增大氯化氢的分压对反应速率的提升作用微弱, 表明HCl的吸附分离, Cl2脱附以及表面氯的结合或羟基的结合并不是反应决速步骤.而增大反应物氧气的分压, 可以加快氧气的解离吸附, 从而促进反应的进行, 对反应过程进行分析总结, 初步推断O2在该催化剂上的解离吸附是该反应的决速步骤.

|
图 5 RuO2/TiO2催化剂反应级数测定 Figure 5 Reaction orders for RuO2/TiO2 catalysts |
以不同焙烧温度得到的金红石型载体TiO2作为载体, 采用湿法浸渍法制备RuO2/TiO2-C(450、550、650以及750 ℃)催化剂, 并对其进行了表征分析以及氯化氢氧化性能考察.研究发现, 载体焙烧温度对HCl氧化活性有显著影响.将RuO2负载于在相对较低温度(≤650 ℃)焙烧下得到的载体, 发现由于TiO2与RuO2之间的晶面匹配度随着焙烧温度的升高而逐渐变高, 促进了RuO2在TiO2表面的分散, 其中RuO2/TiO2-650催化剂表现出了最优的催化性能.而继续升高载体的焙烧温度下, 发现RuO2/TiO2-750催化剂的反应活性大大下降, 结合表征测试的结果推测, 是由于载体严重的烧结团聚现象所导致RuO2粒径增大以及载体与活性组分之间过强的相互作用, 阻碍了氯化氢氧化反应的进行.此外, 还发现对于RuO2基催化剂, 减小其RuO2的粒径, 对于提高其HCl氧化催化活性有重要意义.反应动力学的结果发现, 对于RuO2/TiO2催化剂, HCl氧化反应主要受O2分压的影响, 这表明O2从催化剂表面的解离吸附为决速步骤.
| [1] | Liu Hao-yue(刘皓月), Fei Zhao-yang(费兆阳), Dai Yong(戴勇), et al. Structure of ceria-based mixed oxides and its influence on HCl catalytic oxidation performance(高比表面CexTi1-xO2催化剂的结构表征及其HCl催化氧化性能)[J]. J Mol Catal (China)(分子催化), 2014, 28(4): 329–335. |
| [2] | Mortensen M, Minet R G, Tsotsis T T, et al. A two-stage cyclic fluidized bed process for converting hydrogen chloride to chlorine[J]. Chem Eng Sci, 1996, 51(10): 2031–2039. DOI:10.1016/0009-2509(96)00060-7 |
| [3] | Zou Chong(邹冲), Dai Yong(戴勇), Fei Zhao-yang(费兆阳), et al. Synthesis of efficient CuO-CeO2 catalysts in limited nanospace for HCl oxidation(限域纳米空间制备高效HCl氧化CuO-CeO2催化剂)[J]. J Mol Catal (China)(分子催化), 2015, 29(3): 238–245. |
| [4] |
a. Dai Yong (戴勇), Ye Hong-bin (叶宏斌), Fei Zhao-yang (费兆阳), et al. Preparing natural clay-based catalysts for HCl catalytic oxidation to recycle chlorine (天然粘土基催化剂的制备及HCl氧化制氯性能) [J]. J Mol Catal (China) (分子催化), 2014, 28 (1): 54-59. b. Zou Chong (邹冲), Dai Yong (戴勇), Fei Zhao-yang (费兆阳), et al. Synthesis of efficient CuO-CeO2 catalysts in limited nanospace for HCl oxidation (限域纳米空间制备高效HCl氧化CuO-CeO2催化剂) [J]. J Mol Catal (China) (分子催化), 2015, 29 (3): 238-245. |
| [5] |
a. Chen X, Xu X, Fei Z, et al. CeO2 nanodots embedded in a porous silica matrix as an active yet durable catalyst for HCl oxidation[J]. Catal Sci Technol, 2016, 6 (13): 5116-5123. b. Zhao San-ping (赵三平), Xi Hai-ling (习海玲), Zuo Yan-jun (左言军), et al. Oxidation kinetics and products of methyl phenyl sulfide, a sulfur mustard simulant by sodium molybdate catalyzed hydrogen peroxide solution (Na2MoO4催化H2O2氧化芥子气模拟剂苯甲硫醚的动力学与产物) [J]. J Mol Catal (China) (分子催化), 2015, 29 (1): 45-51. |
| [6] | Wolf A, Mleczko L, Schlüter O F, et al. Processes and apparatus for the production of chlorine by gas phase oxiidation: US[P]. 20070274897A1, 2007-11-29. |
| [7] | Walsdorff C, Fiene M, Adami C, et al. Fixed-bed met-hod for production of chlorine by catalytic gas-phase oxidation of hydrogen chloride: EP[P]. 1542923, 2005-06-22. |
| [8] | Pérezramírez J, Mondelli C, Schmidt T, et al. Sustainable chlorine recycling via catalysed HCl oxidation: from fundamentals to implementation[J]. Energy Environ Sci, 2011, 4(12): 4786–4799. DOI:10.1039/c1ee02190g |
| [9] | Seki K. Development of RuO2/rutile-TiO2 catalyst for industrial HCl oxidation process[J]. Catal Surv Asia, 2010, 14(14): 168–175. |
| [10] | Fei Z, Liu H, Dai Y, et al. Efficient catalytic oxidation of HCl to recycle Cl2 over the CuO-CeO2 composite oxide supported on Y type zeolite[J]. Chem Eng J, 2014, 257(6): 273–280. |
| [11] | Rizzi G A, Magrin A, Granozzi G. Preparation of epitaxial ultrathin RuO2-TiO2 (110) films by decomposition of Ru3 (CO)12[J]. Surf Sci, 1999, 443(3): 277–286. DOI:10.1016/S0039-6028(99)01026-2 |
| [12] | Miao G X, Gupta A, Gang X, et al. Epitaxial growth of ruthenium dioxide films by chemical vapor deposition and its comparison with similarly grown chromium dioxide films[J]. Thin Solid Films, 2005, 478(1/2): 159–163. |
| [13] | López N, Gómez-Segura J, Marín R P, et al. Mechanism of HCl oxidation (Deacon process) over RuO2[J]. J Catal, 2008, 255(1): 29–39. DOI:10.1016/j.jcat.2008.01.020 |
| [14] | Mitsui T, Tsutsui K, Matsui T, et al. Support effect on complete oxidation of volatile organic compounds over Ru catalysts[J]. Appl Catal, B, 2008, 81(1/2): 56–63. |
| [15] | Over H, Kim Y D, Seitsonen A P, et al. Atomic-scale structure and catalytic reactivity of the RuO2 (110) surface[J]. Science, 2000, 287(5457): 1474–1476. DOI:10.1126/science.287.5457.1474 |
| [16] | Madhavaram H, Idriss H, Wendt S, et al. Oxidation reactions over RuO2: A comparative study of the reactivity of the (110) single crystal and polycrystalline surfaces[J]. J Catal, 2001, 202(2001): 296–307. |
| [17] | Balint I, Miyazaki A, Aika K I. Chemical and morphological evolution of supported Ru nanoparticles during oxidative conversion of methane[J]. React Kinet Catal Lett, 2003, 80(1): 81–87. DOI:10.1023/A:1026080125183 |
| [18] | Fei Z, Xie X, Dai Y, et al. HCl oxidation for sustai-nable Cl2 recycle over the CexZr1-xO2 catalysts: Effects of Ce/Zr ratio on activity and stability[J]. Ind Eng Chem Res, 2014, 53(50): 19438–19445. DOI:10.1021/ie503297k |
| [19] | Xie Xing-xing(谢兴星), Fei Zhao-yang(费兆阳), Dai Yong(戴勇), et al. Structure of ceria-based mixed oxides and its influence on HCl catalytic oxidation performance(铈基复合氧化物的结构及其对HCl催化氧化性能的影响)[J]. J Mol Catal (China)(分子催化), 2014, 28(6): 507–514. |
 2017, Vol. 31
2017, Vol. 31


