随着人类社会与经济的快速发展, 人类面临的资源、能源与环境问题越来越严重.尤其是不可再生的化石资源逐渐减少和利用过程中带来的环境问题, 迫使人们开始开发和利用可再生资源[1].由于生物质具有可再生性, 源于生物质的化学品生产被认为是替代或补充当今石油化工产品的有效手段之一.其中, 生物质化学品制备的一条重要路线是, 首先将各种生物质原料通过发酵或催化水解等手段得到糖类(包括葡萄糖、果糖等)物质; 然后将糖类物质进一步转化为生物质平台化合物(Bioplatform molecules), 例如:乙酰丙酸、琥珀酸、乳酸等羧酸化合物; 最后以这些生物质平台化合物作为原料通过生物或化学的方法制备重要的化学品[1-2].
2004年美国能源部发表了题名为“最有价值的生物质基化学品”(Top value added chemicals from biomas)的报告[3], 并依据目前生物质转化利用的技术发展趋势, 筛选出目前可能与化石资源竞争的12种生物质平台化合物(见表 1), 其中有8种是含羧酸官能团[3], 因此如何利用有机羧酸开发下游产品已经成为研究热点.在化学品生产的过程中, 传统的石油化工路线需要通过各种催化反应向反应物分子里加入所需的官能团, 而从生物质中炼制出的生物质平台化合物及衍生物含有多种官能团, 如-OH、-C=O和-COOH等, 在生产化学品过程中可以减少许多中间反应步骤, 只要能实现选择性地催化反应就可以生产所需的产品.各类型的催化反应包括加氢、氢解、氧化、重整、水解和脱水等[2, 4].实现这些反应的催化剂有金属、金属氧化物、酸和碱等催化剂[4].此外, 由于这些生物质平台化合物具有很强的亲水性、易溶于水, 近年来有关水相体系催化加氢/氢解的反应引起了广泛关注[5].如乳酸[6-9]、乙酰丙酸[10-11]的水相加氢制备二元醇;琥珀酸水相加氢制备1, 4-丁二醇[12-17].然而, 不管是哪种反应体系, 要实现羧酸加氢的关键在于认识加氢反应机理与设计合适的催化剂.
| 表 1 生物质平台化学品 Table 1 Platform chemicals from biomass |
我们从羧酸分子加氢反应机理与相应的催化剂两方面进行了总结概述, 认识第Ⅷ族金属, 尤其贵金属作为活性金属的羧酸加氢反应机理, 以及催化剂对羧酸加氢反应途径的影响.通过介绍负载金属催化剂在水相体系中对羧酸官能团的加氢性能, 为生物质平台化合物及衍生物转化为化学品或燃料的反应途径提供一些参考信息.
1 羧酸加氢反应机理 1.1 羧酸加氢过程中的化学反应如图 1所示, 羧酸加氢过程中反应分子在金属或金属氧化物上发生的化学反应有多种.羧酸加氢可生成相应的醛和醇, 生成的醇可经脱水加氢反应生成相应的烃.一些小分子羧酸, 如乙酸, 在加氢过程中生成的乙醇可以和乙酸发生酯化反应生成乙酸乙酯.此外, 一些具有两个α-H的羧酸容易在金属氧化物上发生酮基化反应, 如两个乙酸分子脱去一个水和CO2分子生成丙酮, 丙酮在金属催化剂上可加氢生成相应的醇, 生成的醇可以继续经脱水加氢反应生成比反应物碳链还长的烃.同时, 在一些催化剂上, 羧酸分子在较高温度下容易发生脱羧反应, 生成比反应物少一个碳的烃和CO2;也可以发生加氢脱羰反应, 生成比反应物少一个碳的烃、及CO和水分子.在某些金属催化剂上, 如金属Ru和Ni, 脱羧和脱羰产生的CO和CO2易甲烷化生成甲烷.
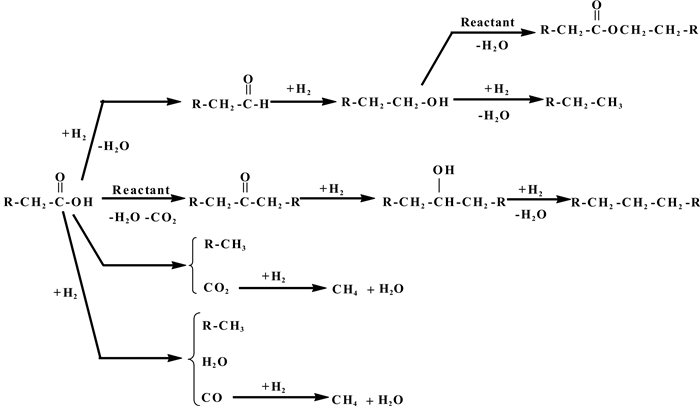
|
图 1 金属和金属氧化物上羧酸分子可发生的反应 Figure 1 Carboxylic acids reaction and decomposition pathways over metal and metal oxides |
羧酸在加氢过程中, 通常认为羧酸分子首先吸附在金属表面上解离成羧酸盐或酰基中间物种, 然后吸附在催化剂表面的中间物种继续加氢生成乙醛或乙醇. Pallassana和Neurock利用DFT量化计算研究了乙酸在金属Pd上加氢生成乙醇的反应机理, 如图 2所示[18].首先乙酸分子吸附在Pd表面上, 一方面通过O—H键活化形成吸附的乙酸盐, 另一方面通过C—O键活化形成乙酰基, 然后乙酰基加氢生成吸附的乙醛, 乙醛可以脱附生成产物, 而未脱附的乙醛可以进一步加氢生成吸附的乙氧基, 乙氧基继续加氢转变为吸附的乙醇分子, 最后脱附生成乙醇产物.整个反应过程中, 乙酸吸附解离生成乙酰基及乙酰基加氢生成乙醛的两个步骤可能是决速步. Olcay等[5]结合动力学反应结果与DFT量化计算, 研究了活性炭负载过渡金属催化剂上乙酸水相加氢反应, 分析了金属Ru比其它金属(Rh、Pt、Pd、Ir、Ni、Cu)具有良好羧酸加氢活性的原因, 认为各金属表面上乙酸或乙酸盐解离生成乙酰基(CH3O)的活性直接决定了乙酸加氢反应活性.在金属Ru催化剂上乙酸在催化剂表面吸附解离形成乙酰基及其加氢生成乙醛的过程是整个加氢反应过程的速控步骤, 乙酰基加氢生成乙醛, 最后乙醛进一步快速加氢生成乙醇.
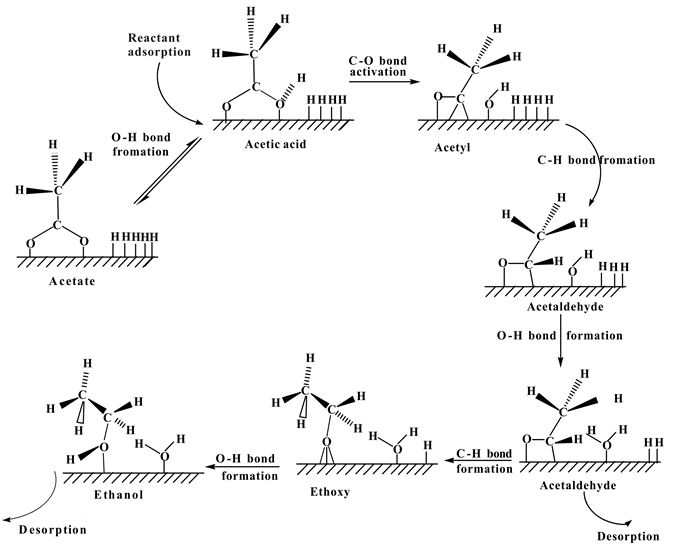
|
图 2 基于DFT计算的表面反应能提出的乙酸在Pd(111) 上氢解生成乙醇的基元反应机理[18] Figure 2 Proposed elementary mechanism for the hydrogenolysis of acetic acid to ethanol over Pd(111), based on DFT-calculated overall surface reaction energies |
Rachmady等[19]利用漫反射傅里叶变换红外光谱法(DRIFTS)结合TPD、TPSR表面反应技术, 研究了Pt/TiO2催化剂上乙酸吸附的中间物以及加氢反应机理.当乙酸吸附在催化剂时, 有乙酸分子、乙酰基、二齿吸附的乙酸盐物种吸附在TiO2表面上, 同时有乙酸脱羰反应产生的CO吸附在金属Pt上.证实了乙酸加氢生成乙醇的过程是通过金属Pt表面上活化的氢与吸附在TiO2表面上的乙酰基反应生成乙醛, 然后乙醛进一步加氢生成乙醇.此外, 他们采用穆斯堡尔光谱、H2-O2-H2-O2循环滴定和DRIFTS光谱法研究了Pt-Fe双金属上乙酸加氢还原反应[20], 认为活性氢与FeO表面吸附的乙酰基的反应是整个反应过程的决速步骤, 其动力学过程可以用Langmuir-Hinshelwood吸附模型的反应速率来表示, 认为氢气是在Pt上解离活化, 而乙酸分子吸附在FeO表面活化产生乙酰基.
羧酸分子在金属催化剂上的加氢过程中除了保留碳链骨架之外, 还通常发生C—C键断裂而破坏碳链骨架.相比于其它金属, 羧酸金属Ru上比较容易活化, 除了发生加氢反应外, 还比较容易发生C—C键断裂反应. Chen等[21-24]利用DRIFTS光谱技术及TPD、TPSR表面反应技术研究了羧酸在不同载体负载的Ru催化剂上吸附形成的中间物及其表面反应, 分析了羧酸C—C键断裂、C=O加氢和C—O键断裂的反应机理.如图 3所示[21], 酰基不但是羧酸发生C=O加氢反应的关键中间物, 也是发生C—C键断裂反应的关键中间物, 认为羧酸分子首先在Ru催化剂表面吸附解离直接生成或者通过羧酸盐物种间接生成酰基中间物;形成的酰基一方面通过醛中间产物加氢生成醇, 醇可继续经脱水-加氢反应生成相应的烷烃;另一方面酰基通过脱羰反应发生C—C键断裂生成吸附的CO和烃基, 最后进一步加氢生成甲烷和少一个碳的烷烃.对于负载Ru催化剂, 载体的结构和表面性质对酰基发生加氢还是脱羰反应影响明显, 一般酸性较强的载体(如γ-Al2O3)导致羧酸加氢生成醇的选择性较高, 而酸性较弱的载体(如活性炭、ZrO2)导致羧酸加氢生成烷烃的选择性较高[21, 24].
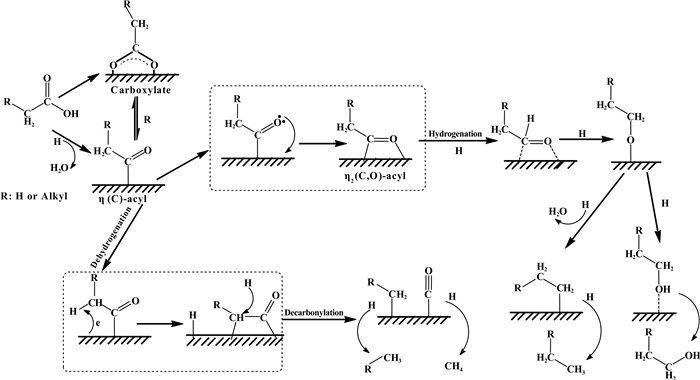
|
图 3 负载Ru催化剂上羧酸加氢脱氧反应的C=O加氢和C—C键断裂的表面反应机理模型[21] Figure 3 The surface reaction model of C=O hydrogenation and C—C bond cleavage for hydrodeoxygenation of carboxylic acids over the supported Ru catalysts |
此外, 对于小分子有机含氧化合物(醇、醛和羧酸)在过渡金属表面的分解反应机理, 通常认为是通过醛、醇反应分子在金属表面吸附形成的酰基中间物进行的, 最后酰基脱羰产生CO和烃基碎片[25-27]; 并认为乙酰基是乙酸、乙醛和乙醇在金属表面发生分解反应的关键中间物[25], 这些含氧化合物在金属表面分解产生CO之前, 都要经过乙酰基表面中间物的形成[25-26, 28].此外, 有关乙酰基解离生成CO过程的研究表明[25-26, 28], 乙酰基或乙酸盐中间物通过β C—H键(甲基的C—H键)的活化形成乙烯酮中间物(CH2CO), 乙烯酮中间物可通过C—C键断裂生成CO/CO2和金属表面吸附的甲基碎片, 并认为乙酰基中间物转化为乙烯酮中间物的过程是分解反应的速控步骤. Henderson等[29]进一步解释了乙酰基的C—C键断裂过程, 认为乙烯酮中间物在Ru单晶上以η2(C, C)吸附态的形式发生C—C键断裂, 最后解离生成CO和亚甲基.
Alcala等[30]研究了SiO2负载的Pt和Pt-Sn催化剂上乙酸加氢动力学, 发现在金属Pt上, 乙酸主要发生如图 4所示的分解反应, 认为乙酸解离生成的乙酰基容易在金属Pt上分解成CH4和CO; 但在Pt-Sn催化剂上, 这种分解反应会得到一定抑制, 乙酰基加氢生成乙醛或乙醇的反应得到促进.穆斯堡尔光谱和DFT计算结果表明Sn的加入与Pt形成新的Pt-Sn合金活性位能抑制C—C键断裂, 而对乙酸C—O(CH3CO—OH)键断裂形成乙酰基的影响不是很大.

|
图 4 Pt/SiO2和Pt-Sn/SiO2催化剂上乙酸转化的反应路径[30] Figure 4 The reaction pathway of acetic acid over the Pt/SiO2 and Pt-Sn/SiO2 |
此外, 酸加氢生成醇的过程中有中间产物醛产生, 但是金属催化剂上醛加氢生成醇的活性非常高, 导致醛的选择性低, 而一些金属氧化物催化剂上醛加氢生成醇的活性低, 可以作为酸加氢选择性地生成醛的催化剂, 如Fe2O3、CuO和SnO2等. Pestman等[31-32]研究了氧化物催化剂上乙酸加氢选择性生成乙醛的机理, 认为是Mars-Van Krevelen机理模型, 在这个机理中金属氧化物表面发生的氧化-还原过程和表面氧空位缺陷的产生起着重要作用.对于可部分还原的金属氧化物, 如Fe2O3, 催化剂经还原后产生金属Fe活性位和表面氧空位.如图 5所示, 乙酸分子的羟基氧与表面氧空位结合在一起, 然后与从金属Fe上溢流来的氢反应生成乙醛, 最后氧化物表面的晶格氧又与氢反应生成水, 重新产生氧空位.他们还指出, 具有中等强度的金属-氧键(M—O)的氧化物具有很好的选择性, 如Fe、Ga、Sn和V的氧化物[32].这是因为, 如果金属-氧键太强, 就难以产生表面氧空位; 如果金属-氧键太弱, 乙酸分子的羟基氧很难与氧空位结合.对于这样的催化体系, 必须要满足两个条件:一是要有金属活性位用来活化氢气, 二是要有金属氧化物相经过还原后能产生表面氧空位.他们还指出, 如果金属氧化物催化剂中的金属相活化氢气的能力不强, 可以加入另外的金属, 如Pt; 金属Pt与氧化物结合的催化剂的活性和醛的选择性, 要比单金属Pt催化剂和单独的氧化物催化剂高[32].

|
图 5 乙酸选择性加氢生成醛的反应机理 Figure 5 Proposed reaction mechanism of the selective hydrogenation of acetic acid to acetaldehyde |
羧酸加氢生成醇和酯的催化剂多是第Ⅷ族金属负载在第Ⅲ或Ⅳ副族金属的氧化物上[33-35].在不同的催化剂上, 羧酸加氢后得到的产物及选择性差别非常大.例如, 乙酸在Ru/TiO2催化剂上, 1.1 MPa氢气压力和227 ℃左右下, 生成乙酸乙酯的选择性高达98%, 乙醇只有2%[33]; 而Pd-Re/C催化剂上获得的产物选择性情况完全相反, 产生93%的乙醇[33].可以说羧酸加氢生成的产物及选择性主要由催化剂的活性组分和载体决定.
Rachmady等[36]研究了TiO2、SiO2、η-Al203和Fe2O3负载Pt催化剂上乙酸在固定床中气相加氢反应动力学情况, 反应条件为150~300 ℃、13.3~93.3 kPa氢气分压和0.93~6.67 kPa乙酸分压.反应结果表明加氢产物的选择性强烈依赖于氧化物载体, 在低转化率下( < 10%), Pt/SiO2催化剂上产生50%的CO和50%的CH4; Pt/Al2O3催化剂上产生8%的乙醇、4%的乙酸乙酯、10%的乙烷、40%的CH4, 33%的CO和5%的CO2; Pt/TiO2催化剂上生成50%的乙醇、30%的乙酸乙酯和20%的乙烷; 而Pt/Fe2O3催化剂上有80%的乙醛和20%的乙醇生成.其中, Pt/TiO2催化剂的催化活性最高, 其活性和转化频率(TOF)要比其它催化剂高两个数量级.
Cressely等[37]研究了惰性SiO2载体负载金属Cu、Fe和Co催化剂上乙酸加氢反应, 结果表明Cu/SiO2催化剂上生成乙醇、乙醛和乙酸乙酯的反应活性要高, Fe/SiO2催化剂上主要生成丙酮, 而Co/SiO2催化剂上主要产生分解产物CH4、CO2和表面积碳.他们认为乙酸加氢选择性地生成乙醇和乙醛, 主要是通过吸附在催化剂表面的乙酸盐中间物, 导致金属Cu、Fe和Co负载催化剂上的产物及选择性不同的原因, 可能跟这些催化剂表面是否存在吸附的乙酸盐中间物及其稳定性有关系.此外, Pestman等[32]研究发现可还原的金属氧化物, 如Fe2O3和SnO2, 对乙酸加氢生成乙醛具有较高的选择性.他们认为利于生成醛的催化剂需要在反应条件下存有金属相和氧化态相, 反应发生过程中氢气在金属表面上解离活化, 然后与吸附在氧化物表面的中间物反应生成产物.
近年来, 生物质衍生物催化加氢制备化学品和燃料的研究逐渐受到关注, 发现相对于其它金属催化剂, 金属Ru催化剂对羧酸水溶液的加氢反应具有较高的活性, 是很多生物质衍生物有机羧酸水相加氢反应的活性组分[5]. Chen等[21-24]研究了ZrO2、TiO2、SiO2、γ-Al2O3和活性炭负载的Ru催化剂上有机羧酸水相加氢反应.详细研究了Ru的分散度、Ru的电子态、催化剂的还原性能、催化剂表面酸、碱性和金属-载体相互作用对羧酸分子C=O加氢、C—C键断裂性能的影响.认为金属-载体相互作用较强和表面酸性较强的催化剂有利于形成金属-L酸双功能活性位, 从而提高羧酸官能团的C=O加氢活性; 相反, 金属-载体相互作用较弱和表面酸性较弱的催化剂有利于促进羧酸分子发生C—C键断裂反应生成小分子烷烃产物.因此, 对于Ru基催化剂上羧酸加氢反应, 研究的核心主要是如何调变或控制这两种竞争反应的活性:羧酸官能团的C=O加氢反应与C—C键断裂反应. Zhang等[6-8]研究了Ru/AC催化剂在乳酸水溶液中, 100~170 ℃和7~15 MPa氢气压力下进行加氢制备丙二醇的反应, 发现在高温条件下乳酸发生C—C键断裂反应产生甲烷的现象比较严重, 导致丙二醇的选择性显著降低. Chen等[38]研究了Ru/AC催化剂上乳酸和丙酸, 以及酸混合物和酸醇混合物的水相加氢反应, 在130 ℃和6.9 MPa压力下, 丙二醇的选择性可达80%~99%、丙醇的选择性为30%~60%, 高温下C—C键断裂副产物甲烷、乙烷和丙烷的量较多.虽然金属Ru活性位对羧酸分子的C—C键断裂活性高, 但通过引入助剂可以明显调控Ru活性位的C—C键断裂活性.有关Ru基催化剂助剂的研究经常出现在琥珀酸和马来酸水相加氢制γ-丁内酯、1, 4-丁二醇和四氢呋喃的研究领域[12-16].如, Schwartz等[12-13]研究了活性炭负载Ru催化剂上琥珀酸水相加氢制γ-丁内酯和四氢呋喃的反应, 通过加入Re助剂, 在250 ℃和8.3 MPa下, 四氢呋喃的产率可达82%. Tooley[14]和Bockrath[15]等研究了ZrO2和活性炭负载Ru催化剂上马来酸水相加氢制1, 4-丁二醇的反应, 通过加入Re或Sn助剂, 在较温和的条件下可以获得高达94%的产率. Minh等[16]考察了负载型Ru/AC和Ru-Re/AC催化剂上琥珀酸水相加氢制备1, 4-丁二醇的反应.在180 ℃, 15 MPa条件下, Ru/C催化剂具有较高的加氢活性, 主要产物为γ-丁内酯, 而1, 4-丁二醇和四氢呋喃选择性较低.然而, 由于Ru催化剂裂解能力较强, 导致液相产物中γ-丁内酯, 1, 4-丁二醇和四氢呋喃的总收率较低.当使用Ru-Re/AC催化剂时, 液相产物中1, 4-丁二醇的收率显著提高, 气相中小分子烷烃产率明显降低.对于脂肪酸及其酯的加氢反应, 由于单金属Ru催化剂的氢解能力较强导致较多的副产物, 为了在反应中能提高醇产物的选择性, 除了Re助剂外, 有关Sn助剂的研究也比多[39-47]. Narasimhan等[42]在较温和的条件下研究了Ru-Sn-B/Al2O3催化剂上的油酸甲酯加氢生成醇的反应; 此外, Cheah等[40]研究了Ru-Sn/Al2O3催化剂上的二元羧酸和饱和脂肪酸的加氢反应, 都认为Sn助剂的加入有利于提高醇和二元醇的选择性. Zhu等[41]等研究了Ru-Sn/Al2O3催化剂上1, 4环己二酸加氢生成1, 4环己二醇的反应, 发现Sn助剂的加入能明显提高二元醇产物的选择性.同时采用XPS和TPR等表征分析了Sn助剂的作用, 认为Sn在催化剂表面以Sn(Ⅱ)物种存在, 能够促进反应分子中羰基(—C=O)的极化, 从而提高了—C=O加氢选择性.此外, 除了Re、Sn助剂, Mo助剂对金属Ru的催化性能也具有显著的作用. Chen等[22]研究了Ru-Mo/ZrO2催化剂上羧酸加氢反应, 发现Mo助剂的加入能明显提高醇产物的选择性, 显著降低了小分子烷烃的选择性.催化剂表征结果显示, 金属Ru和MoOx的相互作用可能形成了Ru-MoOx活性位, 导致丙酸吸附在Ru-Mo/ZrO2催化剂表面形成的丙酰基物种呈现多样化, 具有更好的热稳定性, 有效地抑制了丙酰基的脱羰或分解反应, 从而促进了丙酰基的加氢.
3 总结与展望随着人们对可再生资源生物质转化利用的重视, 以生物质为源头, 经生物质平台化合物及衍生物, 采用催化转化的方式制备化学品或燃料越来越受到关注.考虑到含有多种含氧官能团的化合物具有很好的亲水性, 很多催化转化反应是在水相体系中进行或在水相和有机相的两相体系中进行, 因此羧酸直接液相加氢有利于将不稳定的生物质平台化合物及衍生物选择性地转化为化学品或燃料.
生物质羧酸化合物加氢转化的复杂性主要来自于其结构中稳定的羧基.如何控制羧酸分子选择性进行加氢而不发生C—C键断裂等副反应成为研究者面临的巨大挑战之一.绝大多数的羧酸加氢催化剂都是由Pt、Pd、Rh、Ru、Ir等贵金属及Fe、Co、Ni、Cu等普通金属和具有特定结构的酸性载体组成, 常以Ⅵ和Ⅶ副族金属氧化物对活性金属进行改性修饰来提高反应选择性.因此, 深入了解催化剂上活性位的特点和羧酸加氢反应机理尤为重要.从而根据羧酸化合物种类的不同, 有目的性地选择合适的催化剂和反应条件.
另外对于水相体系的反应, 羧酸表现出的酸性对活性金属具有一定的毒化作用.大量研究表明, Ru催化剂在生物质平台化合物及衍生物的水相加氢/氢解反应中具有良好的耐酸性和催化活性. Ru金属涉及的羧酸加氢/氢解反应包括羧基和羰基的C=O加氢、醇的C—O键氢解及反应分子的C—C键断裂.如果要选择性的生成想要的化学品或燃料, 则需要选择性控制C=O加氢、C—O和C—C键断裂反应速率.虽然Ru催化剂具有很好的催化活性, 但是C—C键断裂反应比较严重, 尤其是在较高温度下, 通过C—C键断裂生成的分解产物选择性高, 如甲烷、甲醇、乙烷等分解产物.因此, 这就需要充分认识Ru催化剂对生物质平台分子及衍生物中含氧官团的催化性能, 主要是C=O加氢、C—O和C—C键断裂的催化性能.最后通过调变和改善Ru催化剂的催化性能来选择性控制C=O加氢、C—O和C—C断裂反应, 以实现Ru催化剂在具体反应中的高选择性.
| [1] | Huber G W, Iborra S, Corma A. Synthesis of transportation fuels from biomass: Chemistry, catalysts, and engineering[J]. Chem Rev, 2006, 106(9): 4044–4098. DOI:10.1021/cr068360d |
| [2] | Chheda J N, Huber G W, Dumesic J A. Liquid-phase catalytic processing of biomass-derived oxygenated hydrocarbons to fuels and chemicals[J]. Angew Chem Int Edit, 2007, 46(38): 7164–7183. DOI:10.1002/(ISSN)1521-3773 |
| [3] | Werpy T, Petersen G. Top Value Added Chemicals from Biomass[M]. Pacific Northwest National Laboratory (PNNL), 2004. |
| [4] | Huber G W. Breaking the chemical and engineering barriers to lignocellulosic biofuels: Next generation hydrocarbon biorefineries, 1sted. [C]; NSF: University of Massachusetts Amherst. National Science Foundation. Che-mical, Bioengineering, Environmental, and Transport Systems Division. Washington D C, 2008. 66-88. |
| [5] | Hakan O, Li-jun X, Ye X, et al. Aqueous-phase hydrogenation of acetic acid over transition metal catalysts[J]. Chem Cat Chem, 2007, 2(11): 1420–1424. |
| [6] | Zhang Z G, Jackson J E, Miller D J. Aqueous-phase hydrogenation of lactic acid to propylene glycol[J]. Appl Catal A, 2001, 219(1/2): 89–98. |
| [7] | Zhang Z G, Jackson J E, Miller D J. Effect of biogenic fermentation impurities on lactic acid hydrogenation to propylene glycol[J]. Bioresour Technol, 2008, 99(13): 5873–5880. DOI:10.1016/j.biortech.2007.10.027 |
| [8] | Zhang Z G, Jackson J E, Miller D J. Kinetics of aqueous-phase hydrogenation of lactic acid to propylene glycol[J]. Ind Eng Chem Res, 2002, 41(4): 691–696. DOI:10.1021/ie0104767 |
| [9] | Takeda Y, Shoji T, Watanabe H, et al. Selective hydrogenation of lactic acid to 1, 2-propanediol over highly active ruthenium-molybdenum oxide catalysts[J]. Chem Sus Chem, 2015, 8(7): 1170–1178. DOI:10.1002/cssc.v8.7 |
| [10] | Li M, Li G, Li N, et al. Aqueous phase hydrogenation of levulinic acid to 1, 4-pentanediol[J]. Chem Commun, 2014, 50(12): 1414–1416. DOI:10.1039/c3cc48236g |
| [11] | Mizugaki T, Nagatsu Y, Togo K, et al. Selective hydrogenation of levulinic acid to 1, 4-pentanediol in water using a hydroxyapatite-supported Pt-Mo bimetallic catalyst[J]. Green Chem, 2015, 17(12): 5136–5139. DOI:10.1039/C5GC01878A |
| [12] | Schwartz J A. Ru, Re/carbon catalyst for hydrogenation in aqueous solution [P]. US 5478952, 1995. |
| [13] | Schwartz J A. Improved Ru, Re/carbon catalyst for hydrogenation in aqueous solution [P]. WO 027436, 1996. |
| [14] | Tooley P B. Ru, Sn/oxide catalyst and process for hydrogenation in acidic aqueous solution [P]. US 5985789, 1999. |
| [15] | Bockrath R E, Schwartz J A, Stimek R T. Method and Ru, Re, Sn/carbon catalyst for hydrogenation in aqueous solution [P]. US 6008384, 1999. |
| [16] | Minh D P, Pinel C, Fuertes P, et al. Aqueous-phase hydrogenation of biomass-based succinic acid to 1, 4-butanediol over supported bimetallic catalysts[J]. Top Catal, 2010, 53: 1270–1273. DOI:10.1007/s11244-010-9580-y |
| [17] | Delhomme C, Weuster-Botz D, Kuhn F E. Succinic acid from renewable resources as a C-4 building-block chemical-a review of the catalytic possibilities in aqueous media[J]. Green Chem, 2009, 11(1): 13–26. DOI:10.1039/B810684C |
| [18] | Pallassana V, Neurock M. Reaction paths in the hydrogenolysis of acetic acid to ethanol over Pd (111), Re (0001), and PdRe alloys[J]. J Catal, 2002, 209(2): 289–305. DOI:10.1006/jcat.2002.3585 |
| [19] | Rachmady W, Vannice M A. Acetic acid reduction by H2 over supported Pt catalysts: a DRIFTS and TPD/TPR study[J]. J Catal, 2002, 207(2): 317–330. DOI:10.1006/jcat.2002.3556 |
| [20] | Rachmady W, Vannice M A. Acetic acid reduction by H2 on bimetallic Pt-Fe catalysts[J]. J Catal, 2002, 209(1): 87–98. DOI:10.1006/jcat.2002.3623 |
| [21] | Chen L, Zhu Y, Zheng H, et al. Aqueous-phase hydrodeoxygenation of carboxylic acids to alcohols or alkanes over supported Ru catalysts[J]. J Mol Catal A, 2011, 351: 217–227. DOI:10.1016/j.molcata.2011.10.015 |
| [22] | Chen L, Zhu Y, Zheng H, et al. Aqueous-phase hydrodeoxygenation of propanoic acid over the Ru/ZrO2 and Ru-Mo/ZrO2 catalysts[J]. Appl Catal A, 2012, 411: 95–104. |
| [23] | Chen L, Liu Y, Long J, et al. The effect of Ru loading on the cleavage of C-C bond for propanoic acid aqueous-phase hydrogeantion[J]. J Mol Catal (China), 2014, 28: 29–38. |
| [24] | Chen L, Li Y, Zhang X, et al. Mechanistic insights into the effects of support on the reaction pathway for aqueous-phase hydrogenation of carboxylic acid over the supported Ru catalysts[J]. Appl Catal A, 2014, 478: 117–128. DOI:10.1016/j.apcata.2014.03.038 |
| [25] | Davis J L, Barteau M A. Spectroscopic identification of alkoxide, aldehyde, and acyl intermediates in alcohol decomposition on Pd (111)[J]. Surf Sci, 1990, 235(2/3): 235–248. |
| [26] | Shekhar R, Barteau M A, Plank R V, et al. Adsorption and reaction of aldehydes on Pd surfaces[J]. J Phys Chem B, 1997, 101(40): 7939–7951. DOI:10.1021/jp971077l |
| [27] | Mavrikakis M, Barteau M A. Oxygenate reaction pathways on transition metal surfaces[J]. J Mol Catal A, 1998, 131(1/3): 135–147. |
| [28] | Shekhar R, Barteau M A. Structure sensitivity of alcohol reactions on (110) and (111) palladium surfaces[J]. Catal Lett, 1995, 31(2): 221–237. |
| [29] | Henderson M A, Radloff P L, Greenlief C M, et al. Surface chemistry of ketene on ruthenium (001) 2. Surface processes[J]. J Phys Chem, 1988, 92(14): 4120–4127. DOI:10.1021/j100325a026 |
| [30] | Alcala R, Shabaker J W, Huber G W, et al. Experimental and DFT studies of the conversion of ethanol and acetic acid on PtSn-based catalysts[J]. J Phys Chem B, 2005, 109(6): 2074–2085. DOI:10.1021/jp049354t |
| [31] | Pestman R, Koster R M, Boellaard E, et al. Identification of the active sites in the selective hydrogenation of acetic acid to acetaldehyde on iron oxide catalysts[J]. J Catal, 1998, 174(2): 142–152. DOI:10.1006/jcat.1998.1957 |
| [32] | Pestman R, Koster R M, Pieterse J A Z, et al. Reactions of carboxylic acids on oxides: 1. selective hydrogenation of acetic acid to acetaldehyde[J]. J Catal, 1997, 168(2): 255–264. DOI:10.1006/jcat.1997.1623 |
| [33] | Pimblett G, Mclachlan K A, Price E J. Ester production by hydrogenation of carboxylic acids and anhydrides [P]. EP 0372847.A2, 1989. |
| [34] | Kitson M, Williams E S. Alcohols production by hydrogenation of carboxylic acids [P]. EP 0198682.A2, 1986. |
| [35] | Kitson M, Williams R S. The catalysed hydrogenation of carboxylic acids and their anhydrides to alcohols and/or esters [P]. EP 0285420.A2, 1986. |
| [36] | Rachmady W, Vannice M A. Acetic acid hydrogenation over supported platinum catalysts[J]. J Catal, 2000, 192: 322–334. DOI:10.1006/jcat.2000.2863 |
| [37] | Cressely J, Farkhani D, Deluzarche A, et al. Evolution des especes carboxylates dans le cadre des syntheses CO-H2. Reduction de l'acide acetique sur systeme Co, Cu, Fe[J]. Mater Chem Phys, 1984, 11(5): 413–431. DOI:10.1016/0254-0584(84)90065-8 |
| [38] | Chen Y Q, Miller D J, Jackson J E. Kinetics of aqueous-phase hydrogenation of organic acids and their mixtures over carbon supported ruthenium catalyst[J]. Ind Eng Chem Res, 2007, 46(10): 3334–3340. DOI:10.1021/ie0614632 |
| [39] | Miyake T, Makino T, Taniguchi S, et al. Alcohol synthesis by hydrogenation of fatty acid methyl esters on supported Ru-Sn and Rh-Sn catalysts[J]. Appl Catal A, 2009, 364(1/2): 108–112. |
| [40] | Toba M, Tanaka S, Niwa S, et al. Synthesis of alcohols and diols by hydrogenation of carboxylic acids and esters over Ru-Sn-Al2O3 catalysts[J]. Appl Catal A, 1999, 189(2): 243–250. DOI:10.1016/S0926-860X(99)00281-1 |
| [41] | Zhu Z, Lu Z, Li B, et al. Characterization of bimetallic Ru-Sn supported catalysts and hydrogenation of 1, 4-cyclohexanedicarboxylic acid[J]. Appl Catal A, 2006, 302(2): 208–214. DOI:10.1016/j.apcata.2006.01.005 |
| [42] | Deshpande V M, Ramnarayan K, Narasimhan C S. Studies on ruthenium-tin boride catalysts Ⅱ. Hydrogenation of fatty acid esters to fatty alcohols[J]. J Catal, 1990, 121(1): 174–182. DOI:10.1016/0021-9517(90)90227-B |
| [43] | Pouilloux Y, Piccirilli A, Barrault J. Selective hydroge-nation into oleyl alcohol of methyl oleate in the presence of Ru---Sn/Al2O3 catalysts[J]. J Mol Catal A, 1996, 108(3): 161–166. DOI:10.1016/1381-1169(96)00010-6 |
| [44] | Pouilloux Y, Guimon C, Barrault J. Ester production by hydrogenation of carboxylic acids and anhydrides[J]. J Catal, 1998, 176: 215–224. DOI:10.1006/jcat.1998.2044 |
| [45] | Echeverri D A, Marín J M, Restrepo G M, et al. Cha-racterization and carbonylic hydrogenation of methyl oleate over Ru-Sn/Al2O3: Effects of metal precursor and chlorine removal[J]. Appl Catal A, 2009, 366: 342–347. DOI:10.1016/j.apcata.2009.07.029 |
| [46] | Corradini S A, Lenzi G G, Lenzi M K, et al. Characte-rization and hydrogenation of methyl oleate over Ru/TiO2, Ru-Sn/TiO2 catalysts[J]. J Non-Cryst Solids, 2008, 354(42/44): 4865–4870. |
| [47] | Luo G, Yan S, Qiao M, et al. RuB/Sn-SBA-15 catalysts: Preparation, characterization, and catalytic performance in ethyl lactate hydrogenation[J]. Appl Catal A, 2007, 332(1): 79–88. DOI:10.1016/j.apcata.2007.08.007 |
 2017, Vol. 31
2017, Vol. 31



