2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
近些年来, 随着人口不断增长和经济快速发展带来的环境污染问题日益严重,尤其是水体的污染越来越受到国家和社会的关注.来自于一些工厂如制药厂、造纸厂、印染厂以及石油化工厂等的废水中往往含有一些有毒、有害、难降解的有机物[1-3],它们不仅对环境造成一定的破坏同时对人类健康也会产生很大的危害.因此,发展稳定高效的有机废水处理技术就显得日趋紧迫和十分重要.
目前有机废水的主要处理技术包括物理技术[4]、生物技术[5]以及化学技术[6].物理技术虽然操作简单,但不宜处理成分复杂的有机物,生物技术虽然方法快捷且无需额外提供能量但是停留时间长不适于处理毒性较大的废水,而化学技术尤其是催化湿式氧化技术(Catalytic wet air oxidation简称CWAO)是在50年代中期出现的一种处理高浓度、难降解的有机废水的先进环保技术,它是以空气或者氧气作为氧化剂,在催化剂的作用下将大分子的有机物降解为二氧化碳、水和可生物降解的小分子物质,从而避免了二次污染[7].选用合适的催化剂不仅能够降低反应的温度而且还能改变反应的路径,提高目标有机物的降解效率,缩短反应时间,进而降低投资和运行的成本.因此,利用催化湿式氧化技术处理有机废水受到了研究者的青睐.
通过催化湿式氧化技术降解的有机物主要包括一些含苯类的有机物[8-9]、含氮的有机物[10-11]以及一些有机酸等[12-14].低分子量的有机酸尤其是丁酸和醋酸往往是一些大分子有机物降解过程中生成的难降解的小分子物质[15],目前对于这些小分子酸的研究主要针对的是单一的有机酸或者是低浓度的酸[16-17],所用的催化剂往往是贵金属Ru和Pt的催化剂[18-21],同时还有一些复合氧化物如Co-Bi、Ce-Zr以及Ti-Ce等的催化剂[22-24].而利用CeO2纳米球以及Ce-Mn复合氧化物纳米球催化湿式氧化降解高浓度低分子量酸以及混合酸的研究未见报道.为此,我们针对高浓度的醋酸、丁酸以及二者混合酸的湿式氧化降解,制备出了CeO2以及CexMn1-xO2的复合氧化物,发现Ce0.2Mn0.8O2复合氧化物具有优异的催化活性,并结合多种表征手段,对催化剂构效关系和反应机理进行了研究.
1 实验部分 1.1 试剂及催化剂的制备乙二醇、无水乙醇、乙酸(分析纯,天津化学试剂有限公司)、聚乙烯吡咯烷酮(PVP,分析纯,天津市科密欧化学试剂有限公司)、硝酸铈(分析纯,成都市科龙化工试剂厂)、硝酸锰(分析纯,国药集团化学试剂有限公司)、正丁酸(化学纯,天津市化学试剂一厂)、蒸馏水(实验室自制).
CexMn1-xO2复合氧化物纳米球的制备: 250 mL烧杯中加入60 mL乙二醇和60 mL蒸馏水,并在磁力搅拌的条件下使其形成均一溶液,2.67 g PVP(作表面活性剂)加入其中直至完全溶解形成透明的溶液,而后加入一定原子比的Ce(NO3)3·6H2O和50% Mn(NO3)2,溶解完全后将该溶液转移至200 mL具有聚四氟乙烯内衬的不锈钢高压反应釜内,密封后将反应釜置于烘箱内180 ℃水热反应18 h,待自然冷却至室温后,对反应液进行过滤,然后用无水乙醇和蒸馏水对沉淀物进行数次洗涤,洗涤后的沉淀物置于烘箱内110 ℃干燥12 h,最后在马弗炉内500 ℃焙烧4 h,并标记为CexMn1-xO2(x代表Ce原子百分含量).
1.2 催化剂催化性能的评价将0.2 g催化剂和10 mL有机酸的模拟废水加入到100 mL具有聚四氟乙烯内衬的高压密闭的不锈钢反应釜中,密封后将反应釜置于带磁力搅拌的电加热装置内,待釜内温度升至设定温度后充入0.9 MPa的O2,反应一定时间后,将反应釜迅速冷却至室温,取出反应液,并通过过滤步骤分离出催化剂.最后通过5B-3B型COD速测仪对反应后的样品进行COD测试.
1.3 催化剂的表征采用荷兰PANalytical公司的X′Pert PRO型X射线衍射仪(XRD)对催化剂进行了的晶形结构的测试,并采用Cu靶射线管,且2θ角范围为10°~90°; 催化剂的形貌通过JSM-6701F型场发射扫描电镜(日本电子)进行检测分析; 催化剂的表面元素组成及价态在ESCALAB 250Xi型光电子能谱仪(Thermo Fisher Scientific)上进行测定; 催化剂的比表面积、孔径大小及其分布通过ASAP 2020 M型(美国micromeritics)快速比表面积/孔隙分析仪获得.
采用PCA-1200(彼奥德)型化学吸附分析仪对催化剂进行氢气程序升温还原(H2-TPR)分析.将150 mg催化剂置于U型石英反应管内,在纯氩气中从室温以10 K/min的速率升至300 ℃,并恒温保持30 min,脱除杂质,然后在Ar下降至室温.在5% H2/95% Ar中从室温程序升温至700 ℃进行H2-TPR实验,由热导检测器(TCD)采集信号.
2 结果和讨论 2.1 催化剂的表征图 1为制备的CeO2和CexMn1-xO2复合氧化物的SEM图谱.从图中的结果可以看出所制备的CeO2和CexMn1-xO2复合氧化物均呈现出有许多纳米颗粒聚集而成的球形形貌,当少量Mn加入时,复合氧化物球形形貌保留完好,且球的平均直径由300 nm减小到150 nm,而当加入大量Mn(Mn/Ce比≥7/3)时,复合氧化物的球形形貌变得不太规整,同时出现了球破损的现象,在SEM图中可以发现破碎的颗粒.

|
图 1 CeO2和CexMn1-xO2复合氧化物的SEM图谱 Figure 1 The SEM images of (a) CeO2; (b) Ce0.9Mn0.1O2; (c) Ce0.7Mn0.3O2; (d) Ce0.3Mn0.7O2; (e) Ce0.2Mn0.8O2; (f) Ce0.1Mn0.9O2 |
图 2为CeO2和CexMn1-xO2复合氧化物纳米球的XRD图谱.从图 2A结果可知,CeO2纳米球的特征衍射峰出现在衍射角2θ=28.6°,33.1°,47.4°,56.5°,58.8°和69.4°处,符合立方萤石结构CeO2(JCPDS 34-0394)的特征衍射峰.随着Mn/Ce比从1/9增大到8/2,CexMn1-xO2(0.2≤x≤0.8)复合氧化物仍然呈现出CeO2立方萤石结构的特征衍射峰,未发现其它衍射峰.同时,CexMn1-xO2复合氧化物纳米球的衍射峰随之变宽且衍射角向高角度偏移(图 2B所示).其可能的原因是Mnn+离子半径(Mn4+=0.053 nm,Mn3+=0.066 nm,Mn2+=0.083 nm)小于Ce4+半径(0.097 nm),Mnn+进入了CeO2的晶体结构中形成了Ce-Mn-O复合氧化物的固溶体[25-26].但是,当Ce/Mn原子比为1/9时,除了CeO2的立方萤石结构的特征衍射峰外,还出现了Mn2O3(JCDS 33-0900)的特征衍射峰.表明了在Ce0.1Mn0.9O2复合氧化物中Ce和Mn未形成固溶体,而是以各自的氧化物形式存在的.

|
图 2 CeO2纳米球和CexMn1-xO2复合氧化物纳米球的XRD图谱 Figure 2 The XRD patterns of (a) CeO2 nanosphere; (b) Ce0.9Mn0.1O2; (c) Ce0.7Mn0.3O2; (d) Ce0.3Mn0.7O2; (e) Ce0.2Mn0.8O2; (f) Ce0.1Mn0.9O2 |
以CeO2纳米球和Ce0.2Mn0.8O2复合氧化物纳米球为例,对单一氧化物和复合氧化物的Ce 3d、Mn 2p和O 1s进行了XPS分析.从图 3A的Ce 3d XPS谱图中可以得知,两种物质的Ce 3d被分成10个小峰,表明了在两种物质中Ce是以Ce3+和Ce4+的共同形式存在,而Ce3+与氧空穴的形成又有着紧密的联系[27-28].与此同时通过两种催化剂的O 1s的XPS(图 3C)分析可知,CeO2纳米空心球和Ce0.2Mn0.8O2复合氧化物纳米球中有3种形式的氧物种存在,分别为晶格氧(Olatt)、表面氧(Osur)以及化学吸附氧(Oads),它们分别位于结合能529.0~530.0 eV、530.0~531.8 eV以及531.9~532.9 eV处[29-30].而且Ce0.2Mn0.8O2复合氧化物中O 1s向高结合能处偏移,表明了随着Mn的加入,氧物种的配位环境发生了变化.表面氧物种主要包括晶格缺陷导致的氧空穴、低配位的表面氧离子以及具有弱配位键的氧物种,它们曾被报道出是最具有活性的氧物种且在氧化反应中起着决定性的作用[31],且表面氧的含量越高催化剂的催化活性越大. 图 3B描述的是Ce0.2Mn0.8O2复合氧化物纳米球的Mn 2p XPS图谱,从图谱中可以看出有3种形式的Mn存在,分别出现结合能为640.4、641.5和643.3 eV处,代表着Mn的+2、+3和+4的价态[32].而其他Ce/Mn原子比的复合氧化物中3种元素的XPS结果与Ce0.2Mn0.8O2复合氧化物相一致.同时各物种所占的百分含量通过对代表着对应物种的峰面积计算得到,其结果如表 1所示.在所制备的复合氧化物中随着Mn/Ce比从1/9增大到8/2,表面氧的百分含量从14.8%增大到24.5%,Ce3+的百分含量从15.1%增大到24.9%,Mn4+的百分含量也从13.1%增大到24.9%. Ce0.2Mn0.8O2复合氧化物含有最高百分含量的表面氧物种和Mn4+.
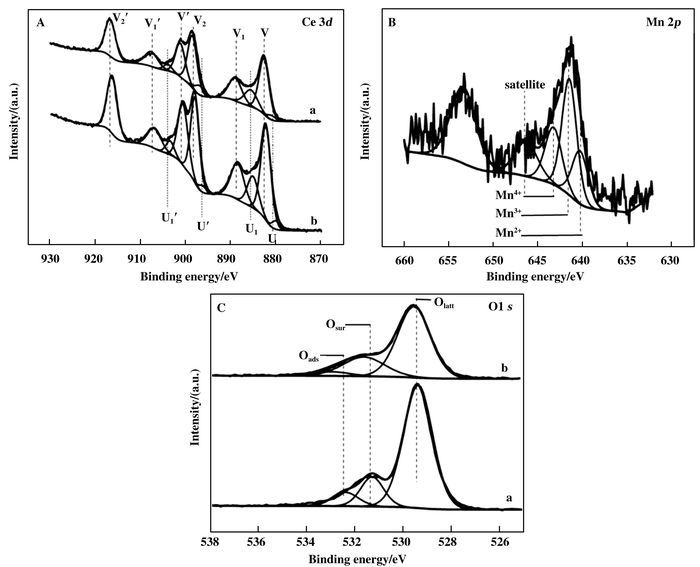
|
图 3 (a) CeO2纳米球和(b) Ce0.2Mn0.8O2复合氧化物纳米球的XPS图谱 Figure 3 XPS spectra of (a) CeO2 nanosphere and (b) Ce0.2Mn0.8O2 mixed oxide nanosphere: (A) Ce 3d; (B) Mn 2p; (C) O 1s |
| 表 1 CeO2和CexMn1-xO2复合氧化物的XPS数据 Table 1 XPS results of CeO2 and CexMn1-xO2 samples |
CeO2和CexMn1-xO2复合氧化物的H2-TPR图谱如图 4所示.通过CeO2的H2-TPR的图谱(图 4a)可以看出,CeO2纳米球在320~600 ℃温度范围内出现较强的信号峰,该峰归属于表面氧的还原以及Ce4+向低价态的Ce3+的还原[30].而CexMn1-xO2复合氧化物的H2-TPR的图谱共有两个信号峰:在200~300 ℃范围内低温峰可归属于MnO2/Mn2O3还原成Mn3O4产生的耗氢峰; 在350~500 ℃温度范围内的高温峰则可归因于Mn3O4进一步还原生成MnO以及CeO2表面氧物种还原产生的耗氢峰[33].值得注意的是,随着Mn/Ce的原子比从1/9增大到3/7,低温还原峰峰面积增加,同时高温还原峰逐渐向低温处偏移,这可能是由于Mnn+进入CeO2晶格中并部分取代了Ce4+离子,形成了复合氧化物固溶体.而且随着复合氧化物中Mn含量的升高,进入到CeO2晶格中的Mnn+离子数目增加,Ce与Mn物种间的相互促进作用增强,从而降低了还原温度[34].如图 4e所示,Ce0.2Mn0.8O2除了在260和380 ℃处的还原峰外,在296 ℃还出现一个小的还原峰,进一步表明了复合氧化物中Ce4+和Mnn+之间协同作用的存在.

|
图 4 CeO2和CexMn1-xO2复合氧化物的H2-TPR谱图 Figure 4 The H2-TPR profiles of (a) CeO2; (b) Ce0.9Mn0.1O2; (c) Ce0.7Mn0.3O2; (d) Ce0.3Mn0.7O2; (f) Ce0.2Mn0.8O2 |
CeO2和CexMn1-xO2复合氧化物的比表面积以及孔的尺寸分布及其大小通过N2吸附-脱附的方法测定.从图 5的N2吸附曲线的结果可以看出,CeO2和CexMn1-xO2复合氧化物均展现出Ⅳ-型等温线和H4-型滞回环,按照国际纯粹化学与应用化学联合会(IUPAC)的规定,所制备的复合氧化物属于介孔材料,且存在锥形结构的狭缝孔.如表 2所示,CeO2的比表面积为81.5 m2/g,随着Mn的加入,CexMn1-xO2复合氧化物的比表面积呈现出增大的趋势,当Mn/Ce比从1/9增大到8/2时,复合氧化物的比表面积从88.4 m2/g增大至110.6 m2/g.
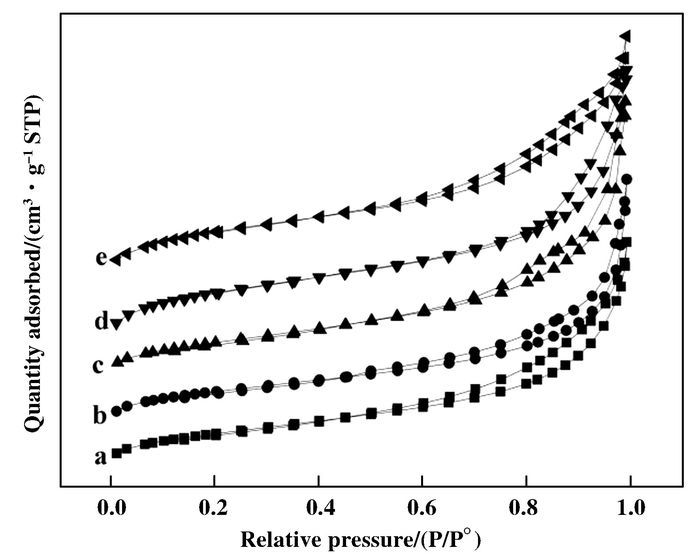
|
图 5 CeO2和CexMn1-xO2复合氧化物的N2吸附脱附等温曲线 Figure 5 N2 adsorption-desorption isotherm of (a) CeO2; (b) Ce0.9Mn0.1O2; (c) Ce0.7Mn0.3O2; (d) Ce0.3Mn0.7O2; (e) Ce0.2Mn0.8O2 |
| 表 2 CexMn1-x复合氧化物的结构性质 Table 2 The textural properties of CexMn1-x mixed oxides |
为了探究CexMn1-xO2复合氧化物的催化活性,在185 ℃、0.9 MPa O2的条件下对初始COD为5 500 mg/L的丁酸进行催化湿式氧化降解,COD去除率与催化剂之间的关系如图 6所示.在CeO2催化剂下,反应进行2 h后,丁酸COD的去除率达到61.2%.而用CexMn1-xO2复合氧化物作催化剂时,丁酸COD的去除率有所提高.当CexMn1-xO2复合氧化物中Mn/Ce比从1/9增大到8/2时,丁酸COD的去除率也从75.0%增大到99.5%.从反应的结果明显的可以看出,Ce0.2Mn0.8O2复合氧化物对于丁酸的催化湿式氧化降解表现出最高的催化降解活性.这与前面的表征结果相一致,具有最高活性的Ce0.2Mn0.8O2复合氧化物的固溶体中Ce与Mn物种之间存在着最强的相互作用,具有最高含量的活性反应氧物种.为进一步考察Ce0.2Mn0.8O2复合氧化物对有机酸的降解活性,以更高浓度的丁酸(初始COD: 9 832 mg/L)、醋酸(初始COD: 9 886 mg/L)以及丁酸和醋酸的混合溶液(初始COD: 10 385 mg/L,丁酸和醋酸的COD比为1:1)作为反应底物进行后续实验.

|
图 6 CeO2和CexMn1-xO2催化湿式氧化降解丁酸的活性 Figure 6 The activities of CeO2 and CexMn1-x O2 mixed oxides for CWAO of butyric acid |
Ce0.2Mn0.8O2复合氧化物在不同温度下催化湿式氧化降解3种高浓度有机酸COD的去除率与时间的关系图如图 7所示.对于醋酸而言(图 7a),当反应温度从175增大到195 ℃,且反应进行2 h后,COD的去除率从63.3%大幅提高至99.7%.同样地,如图 7b所示,随着反应温度从160增大到185 ℃,丁酸COD的去除率也从63.7%增大到99.5%.从以上的实验结果可以看出Ce0.2Mn0.8O2复合氧化物对单一高浓度的低分子量有机酸的降解呈现出优异的催化活性. Ce0.2Mn0.8O2复合氧化物对混合有机酸降解的催化活性如图 7c所示.随着反应温度从175升至195 ℃,混合酸COD的去除率从65.8%增大到99.4%,表明了该催化剂对混合酸的降解也表现出高的催化活性.以上实验结果表明反应温度提高可明显促进催化剂的催化降解过程.
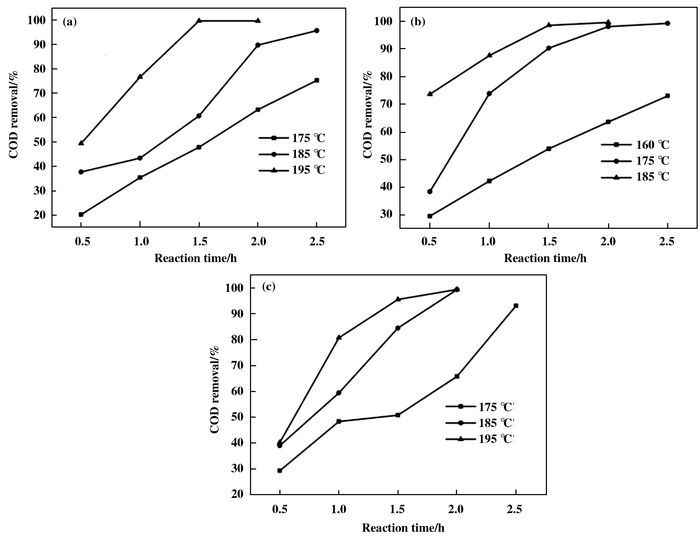
|
图 7 高浓度有机酸COD的去除率与温度的关系 Figure 7 Effects of temperature on COD removal by the Ce0.2Mn0.8O2 mixed oxide catalyst (a) acetic acid; (b) butyric acid; (c) the mixture of acetic acid and butyric acid |
在上述实验的基础上,我们对Ce0.2Mn0.8O2复合氧化物催化湿式氧化降解有机酸提出了简单的动力学方面的研究.由于有机酸的降解是一个复杂的过程,所以我们以有机酸的COD浓度代替有机物浓度,反应表示如下:
| $\begin{array}{l} \;\;{\rm{Organic}}\;{\rm{compounds}}({\rm{CO}}{{\rm{D}}_0}) + {\rm{catalysts}} + {{\rm{O}}_2} \to {\rm{Pro}} - \\ {\rm{ducts}}\left( {{\rm{COD}}} \right) + {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}} \end{array}$ | (1) |
由于反应体系中O2和水都是过量的,相对于水和氧气为零级反应.假定以COD为变量的有机物降解经历的是准一级反应,其速率方程[35]可以表示为:
| $ - {\rm{d}}\left[ {{\rm{COD}}} \right]/{\rm{dt}} = {{\rm{k}}_1}{\rm{dt}}$ | (2) |
| ${\rm{ln([CO}}{{\rm{D}}_{\rm{0}}}\left] {\rm{/}} \right[{\rm{COD]) = }}{{\rm{k}}_{\rm{1}}}{\rm{t}}$ | (3) |
Ce0.2Mn0.8O2复合氧化物CWAO降解醋酸、丁酸以及两种酸的混合酸的动力学曲线如图 8所示.在185 ℃温度下醋酸、丁酸以及混合酸的速率常数分别为0.023 6 min-1、0.047 3 min-1和0.049 4 min-1.对应的线性相关系数(R2)分别为0.93、0.95和0.75,表明了单一酸的降解符合一级反应动力学模型,混合酸的降解则不能很好的遵循一级反应.为了进一步的探究反应的活化能,假定混合酸的降解也遵循的是准一级反应动力学模型.反应速率常数和温度之间遵循阿伦尼乌斯方程:

|
图 8 催化湿式氧化降解有机酸的动力学研究 Figure 8 The kinetic studies of CWAO of organic aicds (a) acetic acid; (b) butyric acid; (c) the mixture of acetic acid and butyric acid |
| ${\rm{lnk = ln}} - {\rm{A}}\left( {{\rm{Ea/RT}}} \right)$ | (4) |
其中A为指前因子,与速率常数k有相同的单位: Ea为反应的活化能(kJ/mol); R为气体常数=8.314 J·mol-1·K-1.醋酸、丁酸和二者混合酸降解的速率常数与温度的关系如图 9所示.经过计算可以得出,CWAO降解醋酸、丁酸以及二者混合酸的活化能分别为158.2 kJ/mol、118.5 kJ/mol和184.4 kJ/mol.表观活化能的大小决定了反应的难易程度,活化能越小说明反应所需要的能量越低,反应体系中分子越容易越过能垒发生催化氧化反应.从活化能的关系可以看出,在Ce0.2Mn0.8O2复合氧化物催化剂下,3种酸降解由易到难顺序为:丁酸>醋酸>两者混合酸.
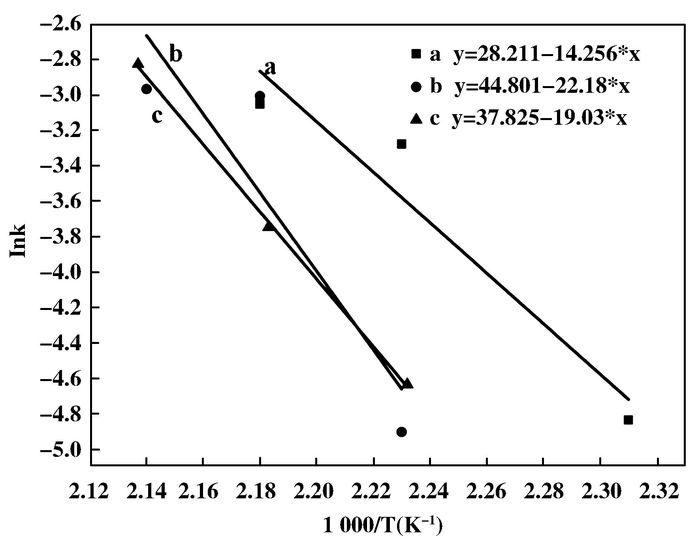
|
图 9 Ce0.2Mn0.8O2复合氧化物降解醋酸、丁酸以及二者混合酸的反应动力学计算结果 Figure 9 Arrhenius plot of COD removal of (a) acetic acid; (b) the mixture of acetic acid and butyric acid; (c) butyric acid catalyzed by Ce0.2Mn0.8O2 mixed oxide |
催化剂的稳定性是评价催化剂的一个重要标准,催化剂的稳定性越高,其使用价值就越高.
因此,对具有最高活性Ce0.2Mn0.8O2催化剂进行了循环稳定性评价.循环反应实验在185 ℃、0.9 MPa的O2分压下对COD含量为9 832 mg/L的丁酸进行催化湿式氧化降解,反应时间为2 h.且每次反应之后,对催化剂进行分离、洗涤和干燥处理,直接用于下一次的反应中. COD的去除率随催化剂的使用次数的变化如图 10所示.当催化剂重复使用3次之后,丁酸COD的去除率高达99.3%,几乎没有太大的变化,催化剂重复使用6次之后,COD的去除率稍有下降,但仍可高达96.9%,并没有明显的催化剂失活现象出现.表明了Ce0.2Mn0.8O2复合氧化物催化剂具有高的稳定性.
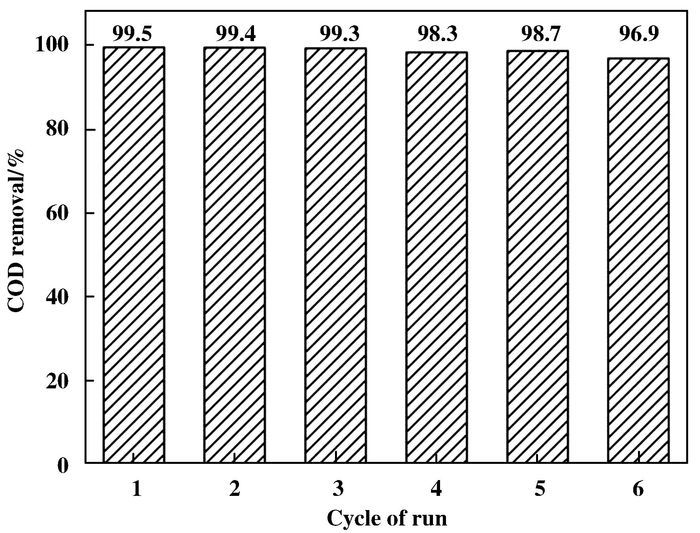
|
图 10 Ce0.2Mn0.8O2复合氧化物的重复使用 Figure 10 Cycle experiments on the COD removal in the presence of Ce0.2Mn0.8O2 mixed oxide |
通过PVP辅助的水热法制备的一系列不同Ce/Mn原子比的复合氧化物中,Ce0.2Mn0.8O2复合氧化物具有比较好的球形形貌,大的比表面积以及高含量的表面氧物种.其对高浓度的醋酸(COD: 9 886 mg/L)、丁酸(COD: 9 832 mg/L)以及两种酸的混合物(COD: 10 385 mg/L)呈现出优异的催化活性,在185 ℃、0.9 MPa O2条件下反应2 h,醋酸、丁酸以及两者混合酸的COD的去除率分别高达89.8%、99.5%和99.4%.同时对该催化剂催化湿式氧化降解3种酸进行了反应动力学研究,得到了不同温度下3种酸降解的速率常数及反应所需的活化能,混合酸降解的活化能要高于单一酸.最后,对该催化剂的稳定性进行了研究,当催化剂重复使用6次之后,仍然具有很高的催化活性,丁酸COD的去除率可以高达96.9%.
| [1] | Pintarl A, Besson M, Gallezot P. Catalytic wet air oxidation of Kraft bleach plant effluents in a trickle-bed reactor over a Ru/TiO2 catalyst[J]. Appl Catal B:Enviorn, 2001, 31(4): 275–290. DOI:10.1016/S0926-3373(00)00288-5 |
| [2] | Wang G W, Wang D, Xu X C, et al. Wet air oxidation of pretreatment of pharmaceutical wastewater by Cu2+ and[PxWmOy]q- co-catalyst system[J]. J Hazard Mater, 2012, 217/218(4): 366–373. |
| [3] | Rodríguez A, Ovejero G, Romero M D, et al. Catalytic wet air oxidation of textile industrial wastewater using metal supported on carbon nanofibers[J]. J Supercrit Fluid, 2008, 46(2): 163–172. DOI:10.1016/j.supflu.2008.04.007 |
| [4] |
a. Cassano A, Conidi C, Giorno L, et al. Fractionation of olive mill wastewaters by membrane separation techniques [J]. J Hazard Mater, 2013, 248/249(1): 185-193. b. Tang Chang-cun(唐长存), Li Yong-gang(李永刚), Huang Ying-ping(黄应平), et al. Effect of NaF soaking on photocatalytic degradation of organic dye RhB over BiOBr samples NaF (浸泡处理对BiOBr光催化降解有机染料罗丹明B的影响) [J]. J Mol Catal(China)(分子催化), 2017, 31(2): 169-180. c. Lu Guang(陆 光),Zhang Shuang(张 爽),Lun Zi-shuai(伦子帅), et al. Effect of solvents on structural performance and photocatalytic degradation of RhB over BiOBr samples(溶剂对 BiOBr结构和光催化降解 RhB的影响) [J]. J Mol Catal(China)(分子催化), 2016, 30(4): 383-390. |
| [5] | Song Jin-fu(宋敬伏), Yu Chao-ying(于超英), Zhao Pei-qing(赵培庆), et al. Research progress of catalytic wet air oxidation(湿式催化氧化技术研究进展)[J]. J Mol Catal(China)(分子催化), 2010, 24(5): 474–482. |
| [6] | Bhargava S K, Tardio J, Prasad J, et al. Wet oxidation and catalytic wet oxidation[J]. Ind Eng Chem Res, 2006, 45(4): 1221–1258. DOI:10.1021/ie051059n |
| [7] | Liu Jie(刘杰), Yu Chao-ying(于超英), Zhao Pei-qing(赵培庆), et al. Degradation of β-Naphthol by catalytic wet air oxidation(催化湿式氧化法降解水中的β-萘酚)[J]. Environ Sci(环境科学), 2012, 33(11): 3826–3832. |
| [8] | Li N, Descorme C, Besson M. Catalytic wet air oxidation of 2-chlorophenol over Ru loaded CexZr1-xO2 solid solutions[J]. Appl Catal B:Environ, 2007, 76(1/2): 92–100. |
| [9] | Gao P, Li N, Wang A Q, et al. Perovskite LaMnO3 hollow nanospheres:the synthesis and the application in ca-talytic wet air oxidation of phenol[J]. Mater Lett, 2013, 92(1): 173–176. |
| [10] | Garcia J, Gomes H T, Serp Ph, et al. Carbon nanotube supported ruthenium catalysts for the treatment of high strength wastewater with aniline using wet air oxidation[J]. Carbon, 2006, 44(12): 2384–2391. DOI:10.1016/j.carbon.2006.05.035 |
| [11] | Barbier Jr J, Oliviero L, Renard B, et al. Catalytic wet air oxidation of ammonia over M/CeO2 catalysts in the treatment of nitrogen-containing pollutants[J]. Catal Today, 2002, 75(1): 29–34. |
| [12] | Manole C C, Julcour L C, Wilhelm A M, et al. Catalytic oxidation of 4-hydroxybenzoic acid on activated carbon in batch autoclave and fixed-bed reactors[J]. Ind Eng Chem Res, 2007, 46(25): 8388–8396. DOI:10.1021/ie0700314 |
| [13] | Renarda B, Barbier Jr J, Dupreza D, et al. Catalytic wet air oxidation of stearic acid on cerium oxide supported noble metal catalysts[J]. Appl Catal B:Environ, 2005, 55(1): 1–10. DOI:10.1016/j.apcatb.2004.06.017 |
| [14] | Besson M, Kallel A, Gallezot P, et al. Gold catalysts supported on titanium oxide for catalytic wet air oxidation of succinic acid[J]. Catal Commun, 2003, 4(9): 471–476. DOI:10.1016/S1566-7367(03)00115-8 |
| [15] | Gomes H T, Figueiredo J L, Faria J L, et al. Carbon-supported iridium catalysts in the catalytic wet air oxidation of carboxylic acids:kinetics and mechanistic interpretation[J]. J Mol Catal A:Chem, 2002, 182/183(1): 47–60. |
| [16] | Dükancı M, Gündüz G. Catalytic wet air oxidation of butyric acid and maleic acid solutions over noble metal catalysts prepared on TiO2[J]. Catal Commun, 2009, 10(6): 913–919. DOI:10.1016/j.catcom.2008.12.022 |
| [17] | Mikulová J, Barbier Jr J, Rossignol S, et al. Wet air oxidation of acetic acid over platinum catalysts supported on cerium-based materials:Influence of metal and oxide crystallite size[J]. J Catal, 2007, 251(1): 172–181. DOI:10.1016/j.jcat.2007.07.008 |
| [18] | Gomes H T, Figueiredo J L, Faria J L. Catalytic wet air oxidation of low molecular weight carboxylic acids using a carbon supported platinum catalyst[J]. Appl Catal B:Environ, 2000, 27(4): L217–L223. DOI:10.1016/S0926-3373(00)00162-4 |
| [19] | Gaálová J, Barbier Jr J, Rossignol S. Ruthenium versus platinum on cerium materials in wet air oxidation of acetic acid[J]. J Hazard Mater, 2010, 181(1/3): 633–639. |
| [20] | Wang J B, Zhu W P, He X W, et al. Catalytic wet air oxidation of acetic acid over different ruthenium catalysts[J]. Catal Commun, 2008, 9(13): 2163–2167. DOI:10.1016/j.catcom.2008.04.019 |
| [21] | Wang Wei(王伟), Wang Jian-bin(王建兵), Zhu Wan-peng(祝万鹏), et al. Catalytic wet air oxidation of acetic acid and phenol with Ru/ZrO2-CeO2 catalysts(Ru/ZrO2-CeO2催化剂催化湿式氧化乙酸和苯酚的研究)[J]. J Mol Catal (China)(分子催化), 2007, 21(5): 401–405. |
| [22] | Imamura S, Hlrano A, Kawabata N. Wet oxidation of acetic acid catalyzed by Co-Bi complex oxides[J]. Ind Enp Chem Prd Res Dev, 1982, 21(4): 570–575. DOI:10.1021/i300008a011 |
| [23] | Jiang Zhan-peng(蒋展鹏), Fu Hong-xiang(付宏祥), Tan Ya-jun(谭亚军). The catalytic wet air oxidation reaction of acetic acid with Ti-Ce series catalyst(Ti-Ce系列催化剂上乙酸的催化湿式氧化反应)[J]. Environ Sci(环境科学), 2002, 23(1): 54–57. |
| [24] | Leitenburg C, Goi D, Primavera A, et al. Wet oxidation of acetic acid catalyzed by doped ceria[J]. Appl Catal B:Environ, 1996, 11(1): L29–L35. DOI:10.1016/S0926-3373(96)00080-X |
| [25] | Murugan B, Ramaswamy A V. Nature of manganese species in Ce1-xMnxO2-δ solid solutions synthesized by the solution combustion route[J]. Chem Mater, 2005, 17(15): 3983–3993. DOI:10.1021/cm050401j |
| [26] | Mousavi S M, Niaei A, Gómez M J I, et al. Characte-rization and activity of alkaline earth metals loaded CeO2-MOx (M=Mn, Fe) mixed oxides in catalytic reduction of NO[J]. Mater Chem Phys, 2014, 143(3): 921–928. DOI:10.1016/j.matchemphys.2013.09.017 |
| [27] | Chen Y T, Zheng H J, Guo Z, et al. Pd catalysts supported on MnCeOx mixed oxides and their catalytic application in solvent-free aerobic oxidation of benzyl alcohol:Support composition and structure sensitivity[J]. J Catal, 2011, 283(1): 34–44. DOI:10.1016/j.jcat.2011.06.021 |
| [28] | Ma Z W, Zhao S L, Pei X P, et al. New insights into the support morphology dependent ammonia synthesis activity of Ru/CeO2 catalysts[J]. Catal Sci Technol, 2017, 7(1): 191–199. DOI:10.1039/C6CY02089E |
| [29] | Yu D Q, Liu Y, Wu Z B. Low-temperature catalytic oxidation of toluene over mesoporous MnOx-CeO2/TiO2 prepared by sol-gel method[J]. Catal Commun, 2010, 11(8): 788–791. DOI:10.1016/j.catcom.2010.02.016 |
| [30] | Liao Y N, Fu M L, Chen L M, et al. Catalytic oxidation of toluene over nanorod-structured Mn-Cemixed oxides[J]. Catal Today, 2013, 216(6): 220–228. |
| [31] | Tang W X, Wu X F, Liu G, et al. Preparation of hierarchical layer-stacking Mn-Ce composite oxide for catalytic total oxidation of VOCs[J]. J Rare Earths, 2015, 33(1): 62–69. DOI:10.1016/S1002-0721(14)60384-7 |
| [32] | Yu X H, Li J M, Wei Y C, et al. Three-dimensionally ordered macroporous MnxCe1-xOδ and Pt/Mn0.5Ce0.5Oδ catalysts:Synthesis and catalytic performance for soot oxidation[J]. Ind Eng Chem Res, 2014, 53(23): 9653–9664. DOI:10.1021/ie500666m |
| [33] | Tang X F, Li Y G, Huang X M, et al. MnOx-CeO2 mixed oxide catalysts for complete oxidation of formaldehyde:Effect of preparation method and calcination temperature[J]. Appl Catal B:Environ, 2006, 62(3/4): 265–273. |
| [34] | Yu C Y, Zhao P Q, Chen G X, et al. Al2O3 supported Ru catalysts prepared by thermolysis of Ru3(CO)12 for catalytic wet air oxidation[J]. Appl Surf Sci, 2011, 257(17): 7727–7731. DOI:10.1016/j.apsusc.2011.04.017 |
| [35] | Wang Y M, Yu C Y, Meng X, et al. The ethanol mediated-CeO2-supported low loading ruthenium catalysts for the catalytic wet air oxidation of butyric acid[J]. RSC Adv, 2017, 7(63): 39796–39802. DOI:10.1039/C7RA06028A |
 2017, Vol. 31
2017, Vol. 31


