2. 中国科学院兰州化学物理研究所 羰基合成和选择氧化国家重点实验室, 甘肃 兰州 730000;
3. 黑龙江八一农垦大学 食品学院, 黑龙江 大庆 163319
2. State Key Laboratory for Oxo Synthesis & Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000;
3. China College of Food Science and Engineering, Heilongjiang Bayi Agricultural University, Daqing 163319, China
微波是频率在300 ~ 300 000 MHz范围内的一种电磁波, 其对应的波长范围为1 ~ 0.001 m, 在电磁波谱中的位置如图 1所示, 处于无线电波与红外线之间[1-2].
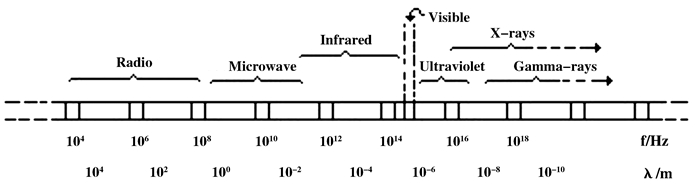
|
图 1 电磁波谱 Figure 1 Electromagnetic spectrum |
1969年, 美国科学家Vanderhoff[3]发现通过家用微波炉加热会使丙烯酸、丙烯酸酯与α-甲基丙烯酸的聚合反应速度比常规加热更快. 1986年, Gedye等[4]发现在微波中进行的反应比常规加热回流要快240倍, 这开启了微波化学作用的研究之门.此后, 微波辐射作为一种加热能源和传输介质, 成为了一种新型的“绿色”工具与方法, 被广泛地应用于从生产到科研的各个领域.
1 微波辐射对酶促反应的影响科学研究中, 常用的微波频率为2.45 GHz.在酶催化有机化学反应中, 微波辐射最开始是作为取代常规加热方式(如水浴、油浴等)的一种新方法.随着研究的深入, 很多科学家的研究结果证明了微波辐射下的酶催化反应和常规加热下的酶催化反应具有很多不同.
1.1 微波辐射对酶促反应的影响经过十多年的研究, 微波辐射技术显示出能够提高酶活性中心与底物的诱导作用, 增强酶的催化活性, 有效提高酶促反应速度与转化率或产率.
1.1.1 酶解反应2014年, Horikoshi等[5]分别在频率5.8与2.4 GHz的微波下酶法水解蛋白肽, 水解肽键如图 2箭头所示.功率在1~2.1 W下的两种不同频率的微波都显示出比在常规加热条件下更快的反应速度, 高频微波快2.3倍, 低频微波快1.5倍.
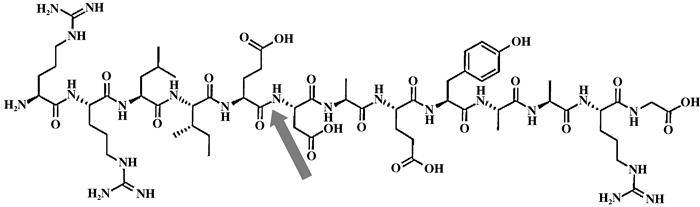
|
图 2 肽段结构 Figure 2 Structure of the peptide |
Gong等[6]利用雪腐镰刀菌产橙皮苷酶催化水解芦丁生产异槲皮苷, 在微博辐射(30 ℃, 微波密度88.9 W/L)下, 酶催化速度提高6.34倍.
Lin等[7]研究在不同溶剂体系中对胰蛋白进行酶解反应, 发现其在微波辐射加热的条件下(2.5 GHz, 最大输出功率300 W), 靠控制反应终止温度的方式调节微波辐照时间.结果表明, 在微波辐射下, 酶解胰蛋白10 min的消化率相当于常规加热方式下酶解6 h.
1.1.2 酯化反应蔡汉成等[8]将微波辐射与酶催化结合运用在催化反应中的方法称为“微波辐射-酶耦合催化”(MIECC), 他的研究发现MIECC在提高酯化反应速度方面表现出明显的耦合效应.通过研究戊醇与辛酸在脂肪酶催化下, 分别通过微波加热(MI)、常规加热(CH)和先微波后常规加热(pre-MI+CH)的方式来进行酯化反应, 如下所示:
| $ {{\rm{C}}_5}{{\rm{H}}_{11}}{\rm{OH + }}{{\rm{C}}_7}{{\rm{H}}_{15}}{\rm{COOH}}\mathop \to \limits^{{\rm{Lipase}}} {{\rm{C}}_7}{{\rm{H}}_{15}}{\rm{COO}}{{\rm{C}}_5}{{\rm{H}}_{11}} + {{\rm{H}}_2}{\rm{O}} $ |
结果表明, 功率为200W的微波加热比常规加热的反应初速度提高2.5~4.5倍.
Ziaullah等[9]利用脂肪酶催化葡萄糖苷与脂肪酸的酯化反应, 在45~60 ℃的范围内, 相近产率下, 微波法(有溶剂时120~160 s, 无溶剂时75~105 s)比常规加热法(18~24 h)更加节能.
Shinde等[10]研究发现, 微波辐射(30~40 W)下的4-氯-2-甲基苯氧基乙酸的酯化反应初速度提高2倍, 6 h内转化率达到了83%.
2015年, Shinde等[11]又研究了微波辅助固定化酶生物催化转化手性药物拆分, 反应如图 3所示, 结果表明, 在微波协同作用下, 50 ℃时反应速度比常规加热增加1.5倍.
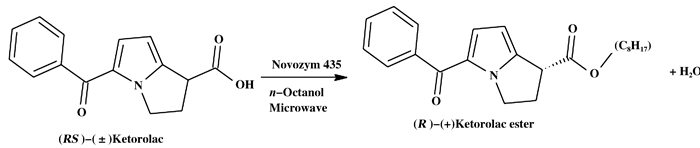
|
图 3 微波辐射脂肪酶催化酮咯酸手性拆分 Figure 3 Enzymatic resolution of RS-(±)-ketorolac under microwave irradiation |
Yadav等[12]利用微波辐射(60 ℃)脂肪酶N435转酯4, 8-二甲基-7-烯-1醇时, 反应速度比常规加热提高了2.3倍.
Yadav等[13]还研究了脂肪酶N435催化乙酰乙酸甲酯与各种醇的转酯化反应, 反应如下所示:
| $ {\rm{C}}{{\rm{H}}_3}{\rm{COC}}{{\rm{H}}_2}{\rm{COOC}}{{\rm{H}}_3} + {\rm{ROH}}\mathop \to \limits^{{\rm{Lipase}}} {\rm{C}}{{\rm{H}}_3}{\rm{COC}}{{\rm{H}}_2}{\rm{COOR + C}}{{\rm{H}}_3}{\rm{OH}} $ |
微波辐射与常规加热下的转化率见表 1, 表明微波辐射下的转化率均高于常规加热, 且研究表明微波辐射和酶催化之间存在协同作用, 反应机理遵循乒乓机制.之后在2012年, Yadav等[14]在酶催化3-苯基丙酸乙酯与正丁醇的转酯反应中, 又再一次证明了这一结论.
| 表 1 酶N435催化乙酰乙酸甲酯与不同醇的转酯反应 Table 1 Transesterification of methyl acetoacetate with different alcohols with Novozym 435 |
Yu等[15]在用葡萄糖异构酶催化葡萄糖成为果糖的研究中, 两者产率都在44%左右时, 70 ℃下, 微波辐射加热比常规加热快1.5倍.
1.2 微波辐射对选择性与专一性的影响微波辐射作用于极性分子后, 使反应更易向生成某种产物的方向进行.同时, 酶的催化活性基团分子与底物分子瞬间发生诱导契合作用激活反应底物.
孙诗雨等[16]研究发现微波辐射(200 W, 65 ℃)削弱脂肪酶的位置选择性, 但并未根本改变脂肪酶的1, 3-专一性.
Pilissão等[17]对比了低温微波(35 ℃)下和常规加热方式对几种不同的游离或固定脂肪酶催化仲丁胺分解的影响, 发现微波加热下比常规加热下, 转化率高3倍, 如果微波辐射时间稍微延长, 则转化率下降但酶的选择性提高.
1.3 微波辐射对酶结构和活性的影响蔡汉成等[18]通过MIECC催化戊醇同分异构体与n-辛酸的酯化反应, 研究结果发现经微波预辐射(200 W, 4 min)的酶产生某种记忆效应, 酶能持久性地被改变催化活性, 反应速度加快, 产率略有下降.但随着辐射延长, 酶的催化活性下降, 反应速度及产率也会较大幅度地降低.
夏咏梅等[19]研究了相同温度下的分别经过微波辐射处理和常规加热处理过的酶液的荧光强度变化, 发现酶的蛋白结构经微波辐射后更加暴露, 从而引起了酶活的增加.
Chen等[20]利用微波辐射(1.26 mW/mm2, 8 s)植物种子中的淀粉酶、蛋白酶和转氨酶, 发现在适量的微波辐射下, 酶活更高, 微波辐射对极性较强的底物更有优势.
Soysal等[21]发现当采用不同的微波辐射功率(70~700 W, 0~180 min, 75 ℃)处理胡萝卜过氧化物酶催化的化学反应时, 酶的失活程度不同.
Saifuddin等[22]利用假丝酵母脂肪酶催化酯交换反应, 酶被微波辐射(100 W, 10 s)后, 酶活增加, 酶催化的酯交换率和反应速度分别比提高3.8倍和1.6倍.
从上述总结的微波对酶反应的影响来看, 这些影响尚无明确规律可循, 这与微波功率、微波辐射时间、酶的种类及酶所处的环境、反应体系等因素有关, 有待进一步深入研究.但是, 总的来说, 不拘于反应类型、溶质有无、微波功率大小(除个别说明外, 微波频率基本都是2.45 GHz), 微波都显示出了区别于常规加热的特点, 但是微波的这种作用我们可以统称为微波效应, 对其作用机理我们下面来进行阐述.
2 微波效应及其机理研究者们在探讨微波辐射对化学反应的作用时, 一般将其划分为“热效应”与“非热效应”两种.
2.1 微波“热效应”热效应主要是利用微波电场对介质分子进行极化, 交变电场发生快速反复的方向改变时, 迫使分子偶极快速重新排列使得分子间产生摩擦碰撞, 电能转化为热能.因此, 微波辐射可以直接作用于反应物质的分子, 这不同于常规加热时热的传导与对流作用.微波辐射在协同酶进行催化时直接作用于酶的官能团, 使得反应体系可以迅速达到酶的最适反应温度.因此, 微波热效应具有快速、全面的特性[1-2].另外, 微波具有选择性加热物质的特性, 这与物质的介电常数(ε)相关, 介电常数是表征介质在外电场作用下极化程度的物理量.介电常数越大, 对微波的吸收能力越强.如水等极性物质, 对微波有强吸收作用, 能被快速加热[23-24].
2.2 微波“非热效应”非热效应主要是由微波辐射的电磁效应引发的除热效应以外的其他效应, 这些效应是在用别的手段提供均匀加热时不会出现的, 如提高反应速率、改变分子的立体选择性、减少副反应等.这些不能用热效应来解释的现象统称“微波的非热效应”[25-26].目前, 微波非热效应的作用机理尚不明确, 但推测主要是微波电磁场对分子的极化作用, 会使分子原有的电子排列状态发生改变; 另外, 微波产生的能量导致分子振动和旋转可能引起化学键的断裂, 或因微波选择性加热的特性使物质的活性增加[27-28].
研究者们对于微波非热效应的存在与否一直存有争议, 至今为止所有围绕这一研究的实验结果并没有明确统一的结论. “非热效应”的支持者认为微波对极性物质的选择性加热, 能够降低指前因子和活化能; 电磁场中的电场部分能够稳定反应过渡态, 降低活化能, 从而提高反应速度. “非热效应”的反对者则认为微波加速反应, 仅仅是因为它迅速提高了反应温度.在高温高压下, 反应速度也会有较大幅度的提高, 即只有“热效应”存在.双方通过理论计算、对比实验证明各自观点.
2.3 微波与酶的协同效应前面我们总结的微波对酶催化反应的影响与常规加热的区别都是由于微波这两种效应的影响, 总体来说在酶进行催化反应的过程中, 温度是影响酶催化的重要因子, 微波辅助酶进行有机化学反应的研究报道前面我们进行了阐述, 显示出了微波辅助下反应时间对比常规加热方式能够大幅度的得到减少.除了反应速度的加快, 微波辐射还可以改变某些酶的催化活性和立体选择性.
微波量子的能量一般来说不足以破坏分子间的作用力, 但通过能量累积可能会对生物大分子的高级结构中的氢键、范德华力产生较大影响, 同时在高电场强度、高频率的微波场中将被极化, 并随着微波场极性的迅速交替变化而引起蛋白质分子基团的性质变化.前述的许多微波对酶催化的影响中, 微波都是间歇式对反应体系进行加热以防止反应体系过热导致酶的失活, 这就给判断微波效应是否存在与酶的协同作用带来了问题, 所以是不是单纯由微波热效应导致的结果还需要精确严谨的科学实验来予以佐证, 在研究微波与酶共同作用时, 酶由于其本身的生物特点造成了研究上一定的技术壁垒, 所以需要研究者们思考更科学合理的研究方法.
3 微波效应的研究方法证明微波非热效应存在的思路大体上有两类:一是在微波条件下与常规加热条件下有相同的热效应时, 如果结果仍然产生了较大的差异, 那可以证明非热效应的存在.二是让微波产生的热效应忽略不计, 从而研究它与常规加热方法带来的差异.目前, 有以下几种方法可以用来研究微波的“非热效应”.
3.1 同步升温比较法从20世纪90年代初开始, 研究者们利用由微波加热与常规加热所进行的相同温度条件下的有机化学反应具有明显不同的反应速度这一点来证明“非热效应”的存在[3-22].但是, 相同的起点温度和终点温度并不能确保相同的升温速度和反应体系中同等的温度梯度.因此, 这些研究并不能排除“热效应”从而证明“非热效应”的存在.只有通过比较微波加热与常规加热两种方式在相同的时间内以相同的升温速度加热到相同的温度后, 如果得到不同的结果, 才可认为存在“非热效应”.因此, Chatti等[29]与Loupy等[30]分别按照同步升温法进行化学合成反应后, 都观察到微波辐射法比常规加热法在产率上得到了明显的提高, 而且反应选择性也发生了改变.但这是化学催化合成中的研究案例, 酶催化合成中还未见到有人利用此法来研究微波非热效应.
3.2 低功率微波辐射法低功率微波产生的热效应非常微小, 可以忽略不计.因此用不产生热效应的低功率微波来进行研究也是学者们探讨微波“非热效应”的一种方法.张志斌等[31]对反应体系施以连续的低频率(1 GHz)、低功率密度(50 mW/cm2)微波辐照, 进行了几种不同的化学合成反应.与常规方法相比, 低功率微波可使反应速度提高5~10倍, 产率也相应提高, 他们认为这可能与分子间氢键及分子缔合作用有关, 微波对这几类反应存在“非热效应”. 2009年, Lukasiewicz等[32]利用低功率密度微波(70 mw/g以下), 研究了γ-淀粉酶对马铃薯淀粉的酶水解, 在低底物浓度的情况下观察到初始反应速率比水浴加热下增加2.5倍. 2012年, Lukasiewicz等[33]又研究了低能量微波下的酶催化淀粉酯化, 筛选了有机溶剂和酰基供体, 对比常规加热法, 低能量微波辐射的反应速度提供了2.5倍, 且对比了两种微波(80 mw/g与160 mw/g), 结果低密度微波的淀粉酯取代度更高.
但是, 用低功率密度微波法进行酶催化的也有认为微波效应不存在的. 2016, Chen等[34]利用南极假丝酵母脂肪酶(CRL)、洋葱伯克霍尔德菌脂肪酶(BCL)与猪胰脂肪酶(PPL)水解三油酸甘油酯, 结果显示反应速度和产率均未受微波影响. Mazinani等[35]用α-淀粉酶和碱性磷酸酯酶在低功率(10 W)微波下分别进行水解反应, 结果显示酶的活性均未受到微波辐射的影响.
3.3 微波辐射同步制冷法目前很多的研究是通过在保证其它条件相同的情况下, 对比常规加热和微波加热所得到的试验结果是否一致来验证微波的“非热效应”.然而, 利用微波加热时经常会碰到一个问题, 即当微波辐射一定的时间之后, 需要降低功率或暂停微波辐射才能确保反应温度的一致.因此, 微波辐射的实际时间较短, 那么通过微波与常规加热时间不同所得到的试验结果去解释微波效应是不合理的.也有研究者认为“非热效应”是微波自身引发的, 在更多的微波辐射下才更可能体现出此效应[36].因此, 微波辐射同步冷却法应运而生, 令反应体系在接受微波辐射的同时, 在反应容器外部通入冷却介质进行制冷.这一方法能连续带走热量防止过热, 延长微波辐射时间, 保证与常规加热方式相同的反应温度.
目前这一技术在有机合成中有了一些研究, 证明微波同步制冷技术能使某些有机反应速度加快, 产率提高, 选择性变好[37-38].黄伟[39]研究n-辛酸与n-戊醇作反应底物、n-辛烷为溶剂的非水相酶催化酯化反应, 以煤油为冷却介质, 发现微波辐射(200 W, 55 ℃)增大了酶与底物醇的亲和力, 对酶与底物酸的复合物却无明显影响, 从而表现出了一定的底物特异性.但是, Leadbeater等[40]通过研究以甲苯为溶质, 脂肪酶催化的转酯化反应中, 利用微波辐射(25 W, 50或70 ℃, 2.5 h)用低温空气冷却维持反应体系温度恒定.结果显示, 从转化率上来看微波辐射未对反应产生明显影响.
3.4 分离微波热效应法将反应物置于含有一种超级吸波材料制作的容器内, 让反应容器强烈地吸收微波迅速升温, 然后通过热传导将反应容器的热量传递给反应体系, 这使得它和常规加热机制相同, 是研究微波“非热效应”的新途径.有研究表明碳化硅是一种超强的吸波材质[41]. Obermayer等[42]用碳化硅作为反应容器的材质, 使用CEM Discover微波反应器, 红外测温外部的同时光纤温度计测温内部, 研究碳化硅容器和玻璃反应容器中各种溶剂的升温曲线, 见图 4.结果表明, 在相同的微波辐射功率下, 玻璃反应容器中, 各溶剂的升温曲线差别较大, 溶剂极性大升温快; 碳化硅反应容器中, 升温速率与极性无关.这证明碳化硅反应容器中的各种极性的溶剂对微波能量的吸收全部相同, 消除微波辐射对极性反应物的选择性加热.利用这种吸波材料制作的容器来吸收微波产生的热效应, 对比常规加热下的相同条件的反应, 可以研究微波的“非热效应”.

|
图 4 不同溶剂的升温曲线 Figure 4 The temperature rising curve of different solvents a) heating in a Pyrex vessel without SiC element; b) heating in a Pyrex vessel with SiC element |
此外, Okada等[43]还研究用纳米颗粒作为微波吸收粒子作为热源使酶失活.这提示研究者我们也可以用这种思路来分离微波热效应去研究非热效应对酶反应的影响.
4 结论微波辐射作为一种新型的绿色安全的加热能源已经被广泛的应用于酶催化领域, 且在生物化学、医药和食品工业等生产和科研领域发挥了巨大作用.微波协同酶催化不仅可以加快化学反应速率, 提高化学反应平衡转化率, 而且还能改变酶催化反应的选择性和专一性.
但是微波对酶催化的协同作用究竟有没有微波非热效应的影响还需要更多的实验数据来验证, 在我们所阐述的研究微波效应的方法中, 酶催化这一领域现在还是以低功率密度微波法为主.由于酶催化反应中温度的重要影响, 随着设备改装的发展, 微波辐射同步制冷技术在酶催化这一领域将会有更大的发展前景, 如果能够将微波的选择性加热去除, 再结合同步制冷技术, 配以温度的精确感知和测量, 那么反应结果会更为科学严谨, 也是将来研究微波效应的主要技术发展方向.
| [1] | Jin Qin-Han(金钦汉), Dai Shu-Shan(戴树珊), Huang Ka-Ma(黄卡玛). Mirowave Chemistry(微波化学)[M]. Beijing: Science Press(北京: 科学出版社), 1999. |
| [2] | 卡帕, 斯塔德勒著, 等. 麻远等译. 微波在有机和医药化学中的应用[M]. 北京: 化学工业出版社, 2007. Kapper C O, Stadler A, Ma Yuan, et al transl. Application of Microwave in Organic and Pharmaceutical Chemistry[M]. Beijing:Chemical Industry Press, 2007. |
| [3] | Vanderhoff J W. Method for carrying out chemical reactions using microwave energy. US[P], 3432413, 1969. |
| [4] | Gedye R, Smith F, Westaway K, et al. The use of microwave ovens for rapid organic synthesis[J]. Tetra Lett, 1986, 27(3): 279–282. DOI:10.1016/S0040-4039(00)83996-9 |
| [5] | Horikoshi S, Nakamura T, Kawaguchi M, et al. Enzymatic proteolysis of peptide bonds by a metallo-endoproteinase under precise temperature control with 5.8-GHz microwave radiation[J]. J Mol Catal B:Enzy, 2015, 2015(116): 52–59. |
| [6] | Gong A, Zhu D, Mei Y Y, et al. Enhanced biocatalysis mechanism under microwave irradiation in isoquercitrin production revealed by circular dichroism and surface plasm on resonance spectroscopy[J]. Biores Technol, 2016, 2016(205): 48–57. |
| [7] | Lin S S, Wu C H, Sun M C, et al. Microwave-assisted enzyme-catalyzed reaction in various solvent systems[J]. J Ameri Soc Mass Spect, 2005, 2005(16): 581–588. |
| [8] | Cai Han-cheng(蔡汉成), Fang Yun(方云), Xia Yong-mei(夏咏梅), et al. A novel catalytic technique:Microwave irradiation-enzyme coupling catalysis(一种新的催化方法:微波辐射酶耦合催化有机合成)[J]. Chin J Org Chem(有机化学), 2003, 23(3): 298–304. |
| [9] | Ziaullah , Rupasinghe H P V. An efficient microwave-assisted enzyme-catalyzed regioselective synthesis of long chain acylated derivatives of flavonoid glycosides[J]. Tetra Lett, 2013, 2013(54): 1933–1937. |
| [10] | Shinde S D, Yadav G D. Process intensification of immobilized lipase catalysis by icrowave irradiation in the synthesis of 4-chloro-2-methylphenoxyacetic acid (MCPA) esters[J]. Biochem Engineer J, 2014, 2014(90): 96–102. |
| [11] | Shinde S D, Yadav G D. Insight into microwave assisted immobilized Candida antarctica lipase B catalyzed kinetic resolution of RS-(±)-ketorolac[J]. Proc Biochem, 2015, 2015(50): 230–236. |
| [12] | Yadav G D, Shinde S D. Synergism of microwave irradiation and immobilized lipase catalysis in synthesis of 4, 8-dimethylnon-7-en-1yl(2E) -3-phenylpro-2-enolate[J]. Inter Rev Chem Engineer, 2012, 6(4): 589–596. |
| [13] | Yadav G D, Lathi P S. Synergism between microwave and enzyme catalysis in intensification of reactions and selectivities:Transesterification of methyl acetoacetate with alcohols[J]. J Mol Catal Chem, 2004, 2004(223): 51–56. |
| [14] | Yadav G D, Pawar S V. Synergism between microwave irradiation and enzyme catalysis in transesterification of ethyl-3-phenylpropanoate with n-butanol[J]. Biores Technol, 2012, 2012(109): 1–6. |
| [15] | Yu D H, Wu H, Zhang A J. Microwave irradiation-assisted isomerization of glucose to fructose by immobilized glucose isomerase[J]. Proc Biochem, 2011, 46(2): 599–603. DOI:10.1016/j.procbio.2010.09.026 |
| [16] | Sun Shi-yu(孙诗雨), Fang Yun(方云), Min Rui(闵瑞), et al. Effect of microwave irradiationon 1, 3-specificity of novozyme 435 in glyceride synthesis(微波辐射对酶促合成甘油酯位置选择性的影响)[J]. Chin J Appl Chem(应用化学), 2007, 24(7): 778–781. |
| [17] | Pilissão C, Carvalho P de O, Nascimento M da G. The influence of conventional heating and microwave irradiation on the resolution of (rs)-sec-butylamine catalyzed by free or immobilized lipase[J]. J Braz Chem Soc, 2012, 23(9): 1688–1697. DOI:10.1590/S0103-50532012005000033 |
| [18] | Cai Han-cheng(蔡汉成), Gao Hui(高惠), Fang Yin-jun(方银军), et al. Esterification between amyl alcohol isomers and n-caprylic acid under microwave irradiation-enzyme coupling catalysis (MIECC)(微波辐射-酶耦合催化(MIECC)戊醇同分异构体与n-辛酸的酯化反应)[J]. Acta Chim Sin(化学学报), 2004, 62(9): 923–928. |
| [19] | Xia Yong-mei(夏咏梅), Sun Shi-yu(孙诗雨), Fang Yun(方云), et al. Microwave irradiation-enzyme coupling catalysis(微波辐射-酶耦合催化(MIECC)反应)[J]. Prog Chem(化学进展), 2007, 19(2/3): 250–255. |
| [20] | Chen Y P, Liu Y J, Wang X L, et al. Effect of microwave and He-Ne laser on enzyme activity and biophoton emission of Isatis indigotica fort[J]. J Integ Plant Biol, 2005, 47(7): 849–855. DOI:10.1111/jipb.2005.47.issue-7 |
| [21] | Soysal Ç, Söylemez Z. Kinetics and inactivation of carrot peroxidase by heat treatment[J]. J Food Engineer, 2005, 68(3): 349–356. DOI:10.1016/j.jfoodeng.2004.06.009 |
| [22] | Saifuddin N, Raziah A Z. Enhancement of lipase enzyme activity in non-aqueous media through a rapid three phase partitioning and microwave irradiation[J]. E-J Chem, 2008, 5(4): 864–871. DOI:10.1155/2008/920408 |
| [23] | Kappe C O. Microwave dielectric heating in synthetic organic chemistry[J]. Chem Soc Rev, 2008, 2008(37): 1127–1139. |
| [24] | Luo Yu-shang(罗羽裳), Zhou Ji-cheng(周继承), You Zhi-min(游志敏), et al. Advances in microwave on chemical reactions(微波作用于化学反应的研究进展)[J]. Hans J Chem Engineer Technol(化学工程与技术), 2014, 2014(4): 45–62. |
| [25] | Huang Ka-ma(黄卡玛), Li Ying(李颖), Liu Ning(刘宁), et al. Current development of researeh on biologiea leffeets of low-intensity EMF(W)(近年来弱电磁场(波)生物效应机理研究的进展)[J]. Chin J Med Phys(中国医学物理学杂志), 2000, 17(1): 36–40. |
| [26] | Young D D, Nichols J, Kelly R M, et al. Microwave Activation of Enzymatic Catalysis[J]. J Ameri Chem Soc, 2008, 130(31): 10048–10049. DOI:10.1021/ja802404g |
| [27] | Shazman A, Mizrahi S, Cogan U. Examining for possible non-thermal effects during heating in a microwave oven[J]. Food Chem, 2007, 103(2): 444–453. DOI:10.1016/j.foodchem.2006.08.024 |
| [28] | Jiao J, Fu Y J, Zu Y G, et al. Enzyme-assisted microwave hydro-distillation essential oil from Fructus forsythia, chemical constituents, and its antimicrobial and antioxidant activities[J]. Food Chem, 2012, 2012(134): 235–243. |
| [29] | Chatti S, Bortolussi M, Bogdal D, et al. Synthesis and properties of new poly(ether-ester)s containing aliphatic diol based on isosorbide. Effects of the microwave-assisted polycondensation[J]. Eur Poly J, 2006, 42(2): 410–424. DOI:10.1016/j.eurpolymj.2005.08.009 |
| [30] | Loupy A, Maurel F, Sabatié-Gogová A. Improvements in Diels-Alder cycloadditions with some acetylenic compounds under solvent-free microwave-assisted conditions:experimental results and theoretical approaches[J]. Tetrahedron, 2004, 204(60): 1683–1691. |
| [31] | Zhang Zhi-bin(张志斌), Zhou Lan-xiang(周兰香), Li You-rong(李幼荣), et al. The synthesis of diphenyl thiourea under irradiation of different frequency microwave(不同频率微波辐照合成二苯硫脲)[J]. J YangZhou Univer(Nat Sci Ed)(扬州大学学报(自然科学版)), 2000, 3(4): 14–16. |
| [32] | Lukasiewicz M, Marciniak M, Osowiec A. Microwave-assisted enzymatic hydrolysis of starch[C]. 13rd International Electronic Conference on Synthetic Organic Chemistry (ECSOC-13), 2009, 2009(11):1-30. http://www.usc.es/congresos/ecsoc/13/hall_e_MAS/e11/Ecsoc_lukasiewicz.html |
| [33] | Lukasiewicz M, Kowalski S. Low power microwave-assisted enzymatic esterification of starch[J]. Starch/Stärke, 2012, 2012(64): 188–197. |
| [34] | Chen C C, Reddy P M, Devi C S, et al. Study of microwave effects on the lipase-catalyzed hydrolysis[J]. Enzyme Micro Technol, 2016, 2016(82): 164–172. |
| [35] | Mazinani S A, Yan H. Impact of microwave irradiation on enzymatic activity at constant bulk temperature is enzyme-dependent[J]. Tetra Lett, 2016, 2016(57): 1589–1591. |
| [36] | Larhed M, Moberg C, Hallberg A. Microwave-accele-rated homogeneous catalysis in organic chemistry[J]. Acco Chem Res, 2002, 35(9): 717–727. DOI:10.1021/ar010074v |
| [37] | Cai Gao(蔡高), Mu Xiao-Jing(穆小静), Xia Zhi-ning(夏之宁). Application of microwave irradiation with simultaneous cooling in organic synthesis(同步冷却技术在微波辅助有机合成中的应用)[J]. Chem Reag(化学试剂), 2010, 32(2): 129–133. |
| [38] | Hayes B L. Recent advances in microwave-assisted synthesis[J]. Aldrichim Acta, 2004, 37(2): 66–77. |
| [39] | 黄伟. 江南大学硕士论文[D]. 2005. Huang Wei. Masteral dissertion of JiangNan university[D]. 2005. |
| [40] | Leadbeater N E, Stencel L M, Wood E C. Probing the effects of microwave irradiation on enzyme-catalysed organic transformations:the case of lipase-catalysed transesterification reactions[J]. Org & Biomo Chem, 2007, 2007(5): 1052–1055. |
| [41] | Kremsner J M, Kappe C O. Silicon carbide passive hea-ting elements in microwave-assisted organic synthesis[J]. J Org Chem, 2006, 71(12): 4651. DOI:10.1021/jo060692v |
| [42] | Obermayer D, Gutmann B, Kappe C O. Microwave chemistry in silicon carbide reaction vials:Separating thermal from nonthermal effects[J]. Angew Chemie, 2009, 2009(48): 8321–8324. |
| [43] | Okada H, Tanaka K, Chujo Y. Microwave-driven enzyme deactivation using imidazolium salt-presenting silica nanoparticles[J]. Bioorg & Med Chem Lett, 2014, 2014(24): 4622–4625. |
 2017, Vol. 31
2017, Vol. 31


