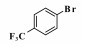
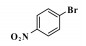
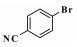
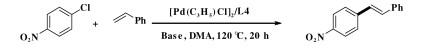钯催化的Heck偶联反应是形成碳-碳键的有效方法之一, 在有机合成中具有非常重要的地位[1-2].该反应自上世纪七十年代由Heck和Mizoroki分别独立发现以来, 已逐渐成为大家研究的热点, 并被广泛的应用于肉桂酸酯类衍生物、二苯乙烯衍生物和某些医药中间体的合成中[3-5], 同时也为新化合物的合成与探究提供了重要的合成手段.
在钯催化的Heck反应中通常认为零价钯是反应的活性物种, 然而零价钯在反应过程中很容易团聚致使其活性显著降低, 为了解决该问题, Heck尝试在反应体系中加入三苯基膦(PPh3), 确实显著提高了反应的催化效果[2].由于单膦配体不能与零价钯活性物种形成螯合作用, 需要大幅增加钯催化剂的用量才能保持较好的催化效果.钯催化剂昂贵的价格一定程度上也限制了单膦配体在Heck反应中的应用, 因此, 科研工作者们合成了一系列具有螯合效应的双齿膦配体并将其用于该反应中.该配体很大程度上延长了催化剂寿命, 大幅减少了催化剂的用量, 提高了反应的TON值[6-7], 但双膦体系相对较低的催化活性使其显得仍然不够完美.近年来, 多齿膦配体由于有多个配位点可以较长时间稳定催化剂, 延长催化剂寿命, 而逐渐得到更多关注. 2003年, Hierso等[8-9]将二茂铁为骨架的四膦配体Fc(P)4tBu的钯配合物用于苯乙烯与对溴苯甲醚的Heck反应中, 该催化体系表现出了很高的催化活性, TON值高达65 000.在Heck反应中表现最优异的四齿膦配体当属Santelli报道的Tedicyp, 他详细研究了该配体的钯催化体系在各类反应中的活性, 对于溴苯和丙烯酸丁酯的反应, 获得了迄今为止最高的TON值(2.1×108)[10].

|
图 1 四齿膦配体 Figure 1 Tetrapodal phosphine ligands |
然而, 四齿膦配体Fc(P)4tBu和Tedicyp的合成方法非常复杂, 这在很大程度上限制了这些配体在有机合成中的应用.因此, 简单高效的四齿膦配体的设计和合成显得尤为重要.基于此, 我们课题组利用廉价的PPh3作原料合成得到稳定的季鏻盐, 然后与二胺发生缩合反应, 得到了一系列含氮的四齿膦配体, 同时考察了这些四齿膦配体在各类偶联反应中的活性(Scheme 1).乙二胺的四齿膦配体L1与钯的配合物最先被用于各类传统的偶联反应如Heck[11-12], Suzuki[13], Sonogashira[14]反应中, 该催化体系对这些反应都表现出了很好的催化活性, 这也体现了该类配体良好的兼容性.然而, 该催化剂的寿命与Tedicyp体系相比差很多, 反应的TON值与之相差甚远, 这可能是由于配体L1的基本骨架为乙二胺, 配体的柔变性较好不利于四个磷原子与中心金属钯配位.因此, 尝试将乙二胺骨架换成更加刚性的间苯二胺和2, 6-二胺基吡啶, 成功合成了四齿膦配体L2和L3并将其用于Suzuki[15-16]和Sonogashira[17-18]反应中, 正如预期催化剂的寿命大幅延长, 反应的TON值最高可达3.35×106 (Suzuki)[16]和8.6×105 (Sonogashira)[17].基于前期的研究, 我们设计用骨架刚性介于乙二胺和间苯二胺之间的(1, 1′-联萘)-2, 2′-二胺作前体, 成功合成了相应的四齿膦配体L4, 并将其与钯的催化体系用于Heck偶联反应中, 以期通过配体骨架刚性的调变提高反应的催化活性(Scheme 1).
|
图式 1 新型四齿膦配体的合成及其在偶联反应中的应用 Scheme1 Synthesis and application of tetrapodal phosphine ligands |
所有对空气和水敏感的操作均使用标准的Schlenk瓶, 在氮气保护下进行. 1H NMR在Bruker Avance Ⅱ-400核磁共振仪上测定, 以氘代氯仿作溶剂, TMS为内标; 反应收率在GC-6890 (ALLTECHTM, SE-30TM, 30 mm × 0.32 mm × 0.25 μm)气相色谱仪上测得. N, N-二甲基甲酰胺, N, N-二甲基乙酰胺, 1, 4-二氧六环, 三乙胺, 甲苯等试剂使用前按照文献方法处理.其它试剂均为分析纯或化学纯, 未经纯化直接使用.
1.2 四齿膦配体L4的合成称取季鏻盐[Ph2P(CH2OH)2]+Cl- (1.4 g, 5 mmol)加入到100 mL三颈圆底烧瓶中, 并将(1, 1′-联萘)-2, 2′-二胺(284 mg, 1 mmol)加入到50 mL恒压滴液漏斗中, 用氮气置换5次后, 加入15 mL无水无氧甲苯和10 mL乙醇到三颈烧瓶中, 并将8 mL三乙胺和5 mL乙醇加到恒压滴液漏斗中使联萘二胺完全溶解, 然后将其缓慢滴加至烧瓶中, 滴加完毕后回流40 h.反应结束后降至室温, 反应液用水(2 × 20 mL)洗涤, 有机相用无水MgSO4干燥后过滤, 并减压除去溶剂得到油状物.油状物用二氯甲烷和乙醇重结晶得到690 mg白色固体产物N, N, N′, N′-四(二苯基膦甲基)-(1, 1′-联萘)-2, 2′-二胺L4, 产率为64%.
1.3 L4/钯催化的Heck偶联反应将碱(1 mmol)、TBAB (0.5 mmol)、[Pd-(C3H5)Cl]2和配体L4加入到一个带有搅拌子的干燥Schlenk反应管中, 用氮气置换5次后, 加入溴代芳烃(0.5 mmol)和苯乙烯(1 mmol), 然后加入1.5 mL新鲜蒸馏的DMF和1.5 mL DMA, 升高温度到120 ℃反应相应时间.反应结束后, 冷至室温, 加入5 mL水淬灭反应, 然后用乙酸乙酯萃取(3 × 5 mL), 有机层用无水硫酸钠干燥, 过滤并减压除去溶剂.所得粗产物经柱层析分离后得到Heck偶联产物.
2 结果与讨论 2.1 反应条件的筛选基于文献调研[19-20]和前期对钯/四膦配体催化的Heck反应的研究[11-12], 首先选择4-硝基氯苯与苯乙烯的偶联作为模板反应, 选用Heck反应中效果较好的[Pd(C3H5)Cl]2作钯源, 催化剂与底物的比(S/C)为1000, DMA作溶剂, 考察了反应所用碱对收率的影响(表 1).当用碱性较弱的NaOAc作碱时, 并没有检测到相应的偶联产物(表 1, entry 1).当用碱性较强的NaHCO3时, 反应检测到了目标产物, 但产率仅为5% (表 1, entry 2).基于此, 继续增加碱的强度, 当用Na2CO3作碱时, 反应得到了中等左右的收率(49%, 表 1, entry 3).然而, 当碱性继续增强时, 反应的收率却显著降低, NaOH和KOH作碱时, 几乎检测不到相应的产物(表 1, entries 4-8).此外, 有机碱如Et3N, DIPEA等也被用到该反应中, 反应收率非常低(表 1, entries 9-11).综合以上实验结果, 我们选择Na2CO3作碱, 继续进行后续的反应条件优化.
| 表 1 碱对4-硝基氯苯与苯乙烯反应的影响a Table 1 Effect of bases on Heck reaction of 4-nitrochlorobenzene with styrene |
为了进一步提高反应产率, 对反应溶剂进行了考察, 实验结果见表 2.当用沸点较低的醇, 1, 4-二氧六环, 甲苯作溶剂时, 即使延长反应时间至30 h, 反应也无法进行(表 2, entries 1-4);而用高沸点的DMA作溶剂升高温度至120 ℃时, 反应能达到49%的收率(表 2, entry 5).更重要的是, 在反应体系中加入添加剂四丁基溴化胺(TBAB)时, 无论是用甲苯, 1, 4-二氧六环还是DMA, 反应产率都有显著提高(表 2, entries 3-8).进一步筛选溶剂后, 当混合溶剂DMF和DMA的比例为1:1时, 反应达到最高收率92%(表 2, entries 9-12).由于添加剂很好地促进了该反应, 添加剂TBAB的用量可能对反应有重要影响, 当TBAB的用量为0.5 mmol时, 反应6 h产率就能达到77%, 继续增加TBAB的用量反应的产率反而有所下降(表 2, entries 13-16).基于此, 确定了钯/L4催化的Heck反应的最佳反应条件为:使用[Pd(C3H5)Cl]2和配体L4作催化剂, 1 equiv.的TBAB作添加剂, 2 equiv.的碱, 在DMF和DMA混合溶剂中反应温度为120 ℃.
| 表 2 溶剂和添加剂的影响a Table 2 Effect of solvents and additives on the Heck reaction |
在上述最佳反应条件下, 对钯/四膦配体催化剂催化的Heck反应的底物适用性进行了研究, 实验结果见表 3.首先对溴代芳烃苯环上的取代基进行了考察.当苯环上含有吸电子基团如-CF3, -NO2, -CN, -COMe时, 催化剂的用量为0.05%(摩尔百分比)时, 反应能在很短的时间内达到非常高的转化率(86%~100%, 表 3, entries 2-6).而当苯环上含供电子基团时, 反应活性有所降低, 但延长时间至6 h后, 反应同样能达到80%以上的收率(88%, 84%, 表 3, entries7-8).更重要的是, 当进一步减少催化剂的用量至0.005%(摩尔百分比)时, 延长反应时间至24 h, 反应转化率都能达到80%以上, 这也再次体现了四齿膦配体的优势, 大幅延长了催化剂的寿命, 使其能在极少的催化剂用量下仍然保持很高的催化活性.
| 表 3 对位取代卤代芳烃与苯乙烯的Heck反应a Table 3 Heck reactions of styrene withpara-substituted aryl halides |
继而, 进一步考察了溴代芳烃底物空间位阻对反应催化活性的影响.当苯环间位上为吸电子基团时, 反应依然能在较短时间内达到90%以上的转化率, 但反应的选择性相对较差(表 4, entries 1-2);当邻位为吸电子基团时, 延长反应时间也能达到理想的收率(表 4, entry 3).而当苯环上含供电子基团-OMe时, 由于间位取代基共轭效应较弱, 使得其反应活性高于对位取代的底物(表 3, entry 8 vs 表 4, entry 4).尤其值得一提的是, 该催化体系对于杂环底物3-溴吡啶和3-溴喹啉也表现出了很高的催化活性, 反应能以68%和84%的分离收率得到相应的偶联产物(表 4, entries 6-7), 这也再次证明该催化体系对官能团有很好的容忍性.
| 表 4 邻位或间位取代卤代芳烃与苯乙烯的Heck反应a Table 4 Heck reactions of styrene with ortho- or meta- aryl halides |
研究了[Pd(C3H5)Cl]2/N, N, N′, N′-四(二苯基膦甲基)-(1, 1′-联萘)-2, 2′-二胺组成的催化体系对卤代芳烃与苯乙烯的Heck反应.该催化体系对含各种取代基的溴代芳烃都表现出了良好的催化活性, 更重要的是, 对活性更低的杂环溴代芳烃也能以较好的收率得到相应的偶联产物.该催化体系对Heck反应表现出了优秀的普适性.
| [1] |
a. Mizoroki T, Mori K, Ozaki A. Arylation of olefin with aryl iodide catalyzed by palladium[J]. Bull Chem Soc Jpn, 1971, 44 (2): 581. b. Chen Xiang-ning(陈向宁), Gao Bao(高宝), Xie Pan(解攀), et al. Palladium-catalyzed oxidative carbonylation of arylazosvia N=N double bondCleavage(钯催化芳基偶氮的氧化羰基化反应)[J]. J Mol Catal(China)(分子催化), 2016, 30 (3): 207-213. |
| [2] | Heck R F, Nolley J P. Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides[J]. J Org Chem, 1972, 37(14): 2320–2322. DOI:10.1021/jo00979a024 |
| [3] | Mariampillai B, Herse C, Lautens M. Intermolecular Heck-type coupling of aryl iodides and allylic acetates[J]. Org Lett, 2005, 7(21): 4745–4747. DOI:10.1021/ol051947e |
| [4] | Polshettiwar V, Molnûr A. Silica-supported Pd catalysts for Heck coupling reactions[J]. Tetrahedron, 2007, 63(30): 6949–6976. DOI:10.1016/j.tet.2007.04.023 |
| [5] | Yin L X, Liebscher J. Carbon-carbon coupling reactions catalyzed by heterogeneous palladium catalysts[J]. Chem Rev, 2007, 107(1): 133–173. DOI:10.1021/cr0505674 |
| [6] | Beletskaya I P, Cheprakov A V. The Heck reaction as a sharpening stone of palladium catalysis[J]. Chem Rev, 2000, 100(8): 3009–3066. DOI:10.1021/cr9903048 |
| [7] | Doucet H, Santelli M. cis, cis, cis-1, 2, 3, 4-Tetrakis(diphenylphosphinomethyl)cyclopentane:tedicyp, an efficient ligand in palladium-catalysed reactions[J]. Synlett, 2006, 2006(13): 2001–2015. DOI:10.1055/s-2006-948175 |
| [8] | Fihri A, Meunier P, Hierso J C. Performances of symmetrical achiral ferrocenylphosphine ligands in palladium-catalyzed cross-coupling reactions:A review of syntheses, catalytic applications and structural properties[J]. Coord Chem Rev, 2007, 251(15): 2017–2055. |
| [9] | Hierso J C, Doucet H, Santelli M. A palladium-ferrocenyl tetraphosphine system as catalyst for Suzuki cross-coupling and Heck vinylation of aryl halides:dynamic behavior of the palladium/phosphine species[J]. Organometallics, 2003, 22(22): 4490–4499. DOI:10.1021/om0302948 |
| [10] | Laurenti D, Doucet H, Santelli M, et al. A new tetratertiary phosphine ligand and its use in Pd-catalyzed allylic substitution[J]. J Org Chem, 2001, 66(5): 1633–1637. DOI:10.1021/jo001146j |
| [11] | Yu X J, Zhou R, Li R X, et al. Heck coupling reaction catalyzed by[(C3H5)PdCl]2-N, N, N', N'-tetra(diphenylphosphinomethyl)-1, 2-ethylenediamine[J]. Catal Commun, 2010, 12(3): 222–225. DOI:10.1016/j.catcom.2010.07.007 |
| [12] | Zhou Rong(周蓉), Wang Wei(汪伟), Li Rui-xiang(李瑞祥), et al. N, N, N', N'-Tetra-[(diphenylphosphino)methyl]ethylenediamine/palladium catalyzed Heck reactio(N, N, N', N'-四[(二苯基膦)甲基]乙二胺钯配合物催化Heck反应研究)[J]. Chin J Org Chem (China)(有机化学), 2011, 31(9): 1490–1494. |
| [13] | Wang K, Yi T, Li R X, et al. Palladium-catalyzed Suzuki-Miyaura coupling with aryl and heteroaryl bromides using N, N, N', N'-tetra(diphenylphosphinomethyl)-1, 2-Ethylenediamine[J]. Appl Org Chem, 2012, 26(7): 342–346. DOI:10.1002/aoc.v26.7 |
| [14] | Yi T, Mo M, Li R X, et al. Highly efficient Pd/tetraphosphine catalytic system for copper-free Sonogashira reactions of aryl bromides with terminal alkynes[J]. Catal Lett, 2012, 142(5): 594–600. DOI:10.1007/s10562-012-0796-2 |
| [15] | Wang K, Wang W, Li R X, et al. An easily prepared tetraphosphine and its use in the palladium-catalyzed Suzuki-Miyaura coupling of aryl chlorides[J]. Catal Lett, 2013, 143(11): 1214–1219. DOI:10.1007/s10562-013-1028-0 |
| [16] | Guo F C, Zhou R, Li R X, et al. N, N, N', N'-tetra(diphenylphosphinomethyl)pyridine-2, 6-diamine/palladium catalyzed Suzuki-Miyaura coupling of aryl and heteroaryl halides[J]. Catal Commun, 2015, 66(1): 87–90. |
| [17] | Zhou R, Wang W, Li R X, et al. Pd/tetraphosphine catalytic system for Cu-free Sonogashira reaction "on water"[J]. Catal Sci Technol, 2014, 4(3): 746–751. DOI:10.1039/c3cy00831b |
| [18] | Zhou R, Wang W, Li R X, et al. One-pot synthesis of 2-substituted benzo[b]furans via Pd-tetraphosphine catalyzed coupling of 2-halophenols with alkynes[J]. Chem Commun, 2014, 50(45): 6023–6026. DOI:10.1039/C4CC00815D |
| [19] | Wu Qi(吴琦), Wu Zhi-Chuan(吴之传), Huang Ya(黄雅), et al. Synthesis of AOCF supported palladium(Ⅱ) complex and its catalytic properties for Heck reaction(偕胺肟纤维-钯(Ⅱ)配合物的制备及对Heck反应的催化性能研究)[J]. J Mol Catal (China)(分子催化), 2010, 24(3): 254–261. |
| [20] | Li Wen(刘文), Zheng Long-zhen(郑龙珍), Liu Qiang(刘强). Synthesis of Fe3O4-graphene oxide-palladium catalyst and its application in Heck reaction(Fe3O4-氧化石墨烯-钯催化剂的制备及其对Heck反应催化研究)[J]. J Mol Catal(China)(分子催化), 2011, 25(6): 549–556. |
 2018, Vol. 32
2018, Vol. 32