2. 山西大学 精细化学品工程研究中心, 山西 太原 030006
2. Engineering Research Center of Ministry of Education for Fine Chemicals, Shanxi University, Taiyuan 030006, China
肉桂醇是一种含C=C键的α, β-不饱和醇, 在食品、日化品、医药中间体、杀菌剂等的合成领域具有重要而广泛的用途[1].肉桂醇可经肉桂醛选择加氢制备, 从热力学上说, 肉桂醛中C=C—C=O共轭体系中C=C键的加氢较C=O加氢更容易, 实现C=O键的高选择加氢, 而不破环C=C键, 得到α, β-不饱和醇肉桂醇, 是一项具有挑战性的研究工作.
科研工作者以H2作为氢源, 以负载型过渡金属(Pt、Ru、Au、Co、Cu等)为催化剂, 尝试通过调变催化剂活性组分种类、晶粒尺寸、载体、助剂等手段, 抑制加氢副产物3-苯丙醛、3-苯丙醇等的生成, 提高肉桂醇的选择性, 但效果不佳[2-6].与之相比, 以醇为氢源, 以酸、碱为催化剂的转移加氢Meerwein-Ponndorf-Verley (MPV)还原过程, 显示出高的C=O加氢选择性, 且具有反应条件温和的优点, 在α, β-不饱和醛加氢制α, β-不饱和醇研究领域更具优越性.文献报道了以Al、B、Zr等的醇盐为催化剂的均相催化体系[7-8], 以及以固体酸/碱, 如Al2O3、MgO、ZrO2等, 为催化剂的多相催化体系[9-12].其中, 以固体酸/碱为催化剂的多相催化体系因其环境友好、产物与催化剂易分离等优点备受关注.众多研究表明[13-15], 强L酸中心是生成肉桂醇的活性中心, 而高的比表面则有利于提高转化率.因此, 相关研究多以稀土金属改性的Al2O3为催化剂.但Al2O3比表面积较小, 热稳定性较差, 这大大影响了催化剂的稳定性及使用寿命. SiO2-Al2O3复合氧化物具有发达的孔隙结构、高的比表面积及高的热稳定性, 且表面性质易于调控, 是一种性能优异的固体酸和载体[16-19], 但SiO2-Al2O3复合氧化物中含有一定量的B酸中心, 会使肉桂醇与异丙醇醚化生成肉桂丙基醚, 导致肉桂醇选择性下降.因此, 通过改变制备参数, 调控SiO2-Al2O3复合氧化物的性质, 如孔结构、酸类型(L或B酸)、酸强度、酸密度等, 使其成为性能优异的肉桂醛MVP转移加氢制肉桂醇反应催化剂具有潜在的研究价值.
基于此, 我们采用溶胶-凝胶法制备一系列不同Al2O3含量的SiO2-Al2O3复合氧化物, 并通过浸渍法引入适量ZrO2, 调控SiO2-Al2O3复合氧化物的结构、织构以及表面性质, 探索ZrO2/SiO2-Al2O3复合氧化物性质的改变对其催化肉桂醛MPV转移加氢反应性能的影响规律, 为高效肉桂醛MVP转移加氢制肉桂醇催化剂的研究提供参考.
1 实验部分 1.1 催化剂的制备按所需的Al/Si比, 计算并准确称取定量的九水合硝酸铝(Al(NO3)3·9H2O)与正硅酸乙酯(TEOS), 将其溶解于无水乙醇中, 配制Al与Si总摩尔浓度0.3 mol/L的混合溶液, 80 ℃搅拌条件下回流反应1.5 h, 向其中滴入浓氨水调节体系pH达到7.0, 反应一定时间后形成均匀凝胶, 静置老化12 h.经60 ℃真空干燥10 h, 750 ℃下焙烧3 h, 得到具有不同化学组成的硅铝复合氧化物.在此基础上, 以硝酸氧锆乙醇溶液为浸渍液, 采用等体积浸渍法, 浸渍后静置30 min, 40 ℃真空干燥12 h, 400 ℃下焙烧3 h得到Zr负载量1%的ZrO2/SiO2-Al2O3催化剂, 标记为Zr/Si-Al(x), 其中x表示复合氧化物中Si/Al的摩尔比.
1.2 催化剂的表征催化剂的比表面积和孔分布测定在Micromeri- tics公司ASAP 2020型物理吸附仪上进行.测试前样品经150 ℃高真空下处理12 h, 然后在-196 ℃温度下进行氮吸附.用Brunauer-Emmett-Teller理论(BET理论)方法计算催化剂的比表面积.依据Barret-Joyer -Halenda(BJH)方法计算催化剂的孔径分布曲线.
X-射线衍射(XRD)在德国Bruker D8 ADVANCE型号X射线粉末衍射仪上进行. Cu Kα射线, λ = 1.542 Å, 工作电压40 kV, 工作电流40 mA.广角XRD的扫描范围为2θ =10° ~ 80°, 扫描速率为5°/ min.小角XRD的扫描范围为2θ =0.8°~ 10°, 扫描速率为0.05°/ min.
红外光谱(FTIR)分析在德国Bruker公司的Tensor 27型红外光谱仪上进行, KBr压片, 波长范围400 ~ 4000 cm-1, 分辨率4 cm-1.
在美国Micromeritics公司Autochem Ⅱ 2920型化学吸附仪上进行NH3-TPD测定:称取0.1 g样品(0.450~0.280 mm), 氦气气氛下300 ℃脱气处理, 于100 ℃吸附饱和NH3后以10 ℃/min升温速率脱附NH3, 并TCD检测器检测脱附NH3量.
吡啶吸附的红外光谱测定在德国Bruker公司的Tensor 27型红外光谱仪上进行.将所测试样品压成直径为15 mm的自担载片(6 ~ 8 mg/cm2), 然后置于石英反应器中, 连接真空系统, 样品经150 ℃, 6.0×10-3 Pa条件下原位表面净化, 室温吸附吡啶蒸汽至平衡, 再经200 ℃减压脱附至2.0×10-3 Pa, 降至室温后后测定谱图.
1.3 催化性能评价取0.3 g肉桂醛溶于30 mL异丙醇, 连同0.1 g催化剂一起加入到100 mL的高压反应釜中, 密封釜体, 以高纯N2置换空气5次后, 充至1.2 MPa, 升温至所需温度, 开搅拌反应所需时间.采用安捷伦7890A气相色谱仪对产物进行定量分析, FID检测器, HP-INNOWax毛细管色谱柱(0.25 mm×30 m).肉桂醛(CAL)分子中同时含有苯环、C=C及C=O不饱和键, 经MPV转移加氢过程中, 除目标产物肉桂醇(COL)外, 还有氢化肉桂醛(HCAL)、氢化肉桂醇(HCOL)以及醚类化合物1-苯丙烯-2-丙基醚(CPE), 肉桂醛转化率及各产物选择性的计算方法如下:
| $ {\rm{CAL}转化率} = \left( {1 - {产物中\rm{CAL}摩尔数}/{初始反应物中\rm{CAL}摩尔数}} \right) \times 100\% $ | (1) |
| $ {\rm{HCAL}选择性} = {\rm{HCAL}摩尔数}/反应后所有产物的摩尔数 \times 100\% $ | (2) |
| $ {\rm{COL}选择性} = {\rm{COL}摩尔数}/反应后所有产物的摩尔数 \times 100\% $ | (3) |
| $ {\rm{HCOL}选择性} = {\rm{HCOL}摩尔数}/反应后所有产物的摩尔数 \times 100\% $ | (4) |
| $ {\rm{CPE}选择性} = {\rm{CPE}摩尔数}/反应后所有产物的摩尔数 \times 100\% $ | (6) |
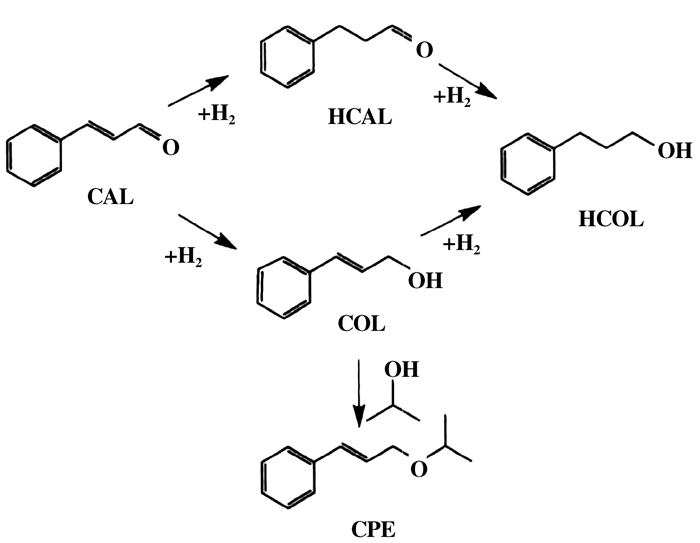
|
图示1 肉桂醛转移加氢反应 Scheme1 transfer hydrogenation of CAL |
图 1为样品的N2吸脱附等温线, 由图可见, p/po小于0.01的区域, 所有样品均具有高的吸、脱附量, 表明所有样品中均含有较多的微孔结构.除此以外, 具有低Al含量的Zr/Si-Al(50)在p/po0.8~1的区域内出现明显的脱附滞后, 属Ⅳ型等温线, 表现为典型的介孔结构特征, 该滞后环在p/po接近1时, 持续上升, 并未出现平台, 表明样品中存在的介孔尺寸较大, 并可能存在大于50 nm的大孔结构[20].增加Al含量, Zr/Si-Al(10)呈现出Ⅳ型等温线特征, 但与Zr/Si-Al(50)相比, 等温线的吸、脱附量明显增大, 且出现滞后环的p/po范围宽化至0.4~1, 表明样品中出现了大量孔径较小的介孔结构, 推测是由于Al的引入阻止了SiO2粒子的团聚, 使颗粒尺寸变小, 较小的颗粒堆积形成了介孔结构.进一步增加Al含量, Zr/Si-Al(2)在p/po为0.4~1范围内的吸、脱附量明显下降, 至高Al含量的Zr/Si-Al(1)时, 介孔结构几乎消失, 仅呈现出具有微孔结构特征的Ⅰ型等温线, 推测在高的Al含量里, Al自身发生聚集, 堵塞了介孔结构.

|
图 1 ZrO2/SiO2-Al2O3催化剂的N2吸附-脱附等温线 Figure 1 N2 adsorption-desorption isotherms of ZrO2/SiO2-Al2O3 catalysts |
样品孔结构的变化, 不仅改变了吸脱附等温线的类型, 也使得其比表面积、孔容发生较大变化, 依据吸脱附等温线数据计算得到了各样品的织构参数, 列于表 1.可以看出, 随着Al含量的增加(即Si/Al比的减小), 样品的比表面积呈现先增加后减小的趋势, 而孔体积和平均孔径则持续减小, Zr/Si-Al(50)具有最低的比表面积258 m2·g-1, 和最大的孔容与平均孔径, 分别为0.94 cm3·g-1与12.5 nm. Zr/Si-Al(10)比表面积大幅增加至562 m2·g-1, 孔容与平均孔径则减至0.86 cm3·g-1与5.2 nm, 由于较小的孔道结构可以提供更多的比表面积, 此时比表面积的增加归因于大孔结构向较小介孔结构的转变.进一步增加Al含量, 比表面、孔容、孔径均下降, 在Zr/Si-Al(1)中, 分别达到361 m2·g-1、0.19 cm3·g-1与2.3 nm, 归因于前述的Al物种自身聚集引起的孔道堵塞.
| 表 1 ZrO2/SiO2-Al2O3催化剂的织构参数及酸性质 Table 1 Texture parameters and acid properties of ZrO2/SiO2-Al2O3 catalysts |
图 2为不同Si/Al比的ZrO2/SiO2-Al2O3的XRD图.可以看出, 所有样品在2θ ≈ 15°~30°的范围内出现一个极为宽化的衍射峰, 归属为无定形SiO2的特征衍射峰.随着Al含量的升高(即Si/Al比降低), SiO2的特征衍射峰强度降低, 且其衍射峰位置向高2θ角方向迁移, 表明Al进入SiO2的网络结构, 由于Al与Si原子半径以及价态的不同, 使SiO2原有的结构发生微小的变化.当Si/Al高于2时, 仅观察到SiO2的特征衍射峰, Si/Al比降至1时, 在2θ = 12°左右出现了勃母石(020)的特征衍射峰[21], 这一结果表明, 低Al含量里, Al与Si间具有原子水平的复合, 而Al含量增加至一定程度, Al物种自身聚集.这也进一步验证了前述关于高Al含量时Al物种聚集引起的孔道结构堵塞.在所有样品中均没有观察到任何形式ZrO2的特征衍射峰, 表明ZrO2以极高的分散度存在于SiO2-Al2O3表面, 其晶粒尺寸小于XRD的检测限.

|
图 2 ZrO2/SiO2-Al2O3催化剂的XRD图谱 Figure 2 XRD patterns of ZrO2/SiO2-Al2O3 catalysts |
图 3为不同Si/Al比的ZrO2/SiO2-Al2O3的FTIR谱.由图可知, 低Al2O3含量的Zr/Si-Al(50)表现出与纯SiO2相似特征的谱图, 均在1100、810以及470 cm-1处分别出现二维Si—O—Si反对称伸缩振动吸收峰、Si—O键对称伸缩振动吸收峰以及Si—O键弯曲振动吸收峰[21-22].随着Al含量的增加, 各样品位于1100 cm-1处的Si—O—Si振动吸收峰发生明显变化, 该峰不仅发生明显的宽化, 峰位置也逐渐向低波数移动, Si/Al比为1时, 该峰红移至1060 cm-1处.这一表征结果表明, 在制备的SiO2-Al2O3中, Al2O3进入SiO2网络结构时会破坏Si—O—Si键, 并形成Si—O—Al键[21, 23-25], 这与XRD中低Al2O3含量样品无Al2O3衍射峰结果相一致.所有样品的红外谱图均在600 cm-1观察到归属为ZrO2中Zr—O键的弱吸收峰, 表明通过浸渍法引入的Zr主要以ZrO2微小团簇的形式存在于SiO2-Al2O3表面.
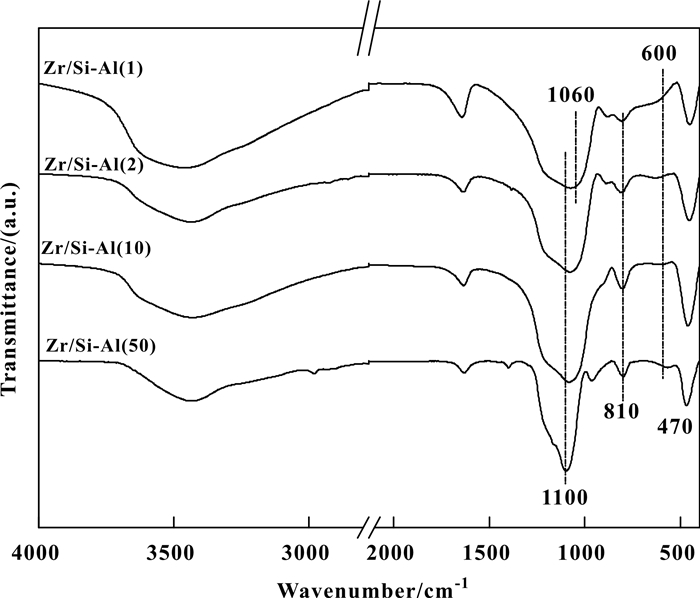
|
图 3 ZrO2/SiO2-Al2O3催化剂的FTIR谱图 Figure 3 FTIR spectra of ZrO2/SiO2-Al2O3 catalysts |
图 4为不同Si/Al比的ZrO2/SiO2-Al2O3的NH3-TPD图.由图可以看出, 在100~450 ℃脱附温度区间内, 均观察到明显的NH3脱附峰, 且随样品中Al2O3含量的增加, 脱附峰面积逐渐增加, 说明催化剂中存在弱酸与中强酸中心, 酸量随Al2O3引入量增加逐渐增加[26]. 图 5催化剂的Py-IR表征结果进一步显示, 各催化剂中均观察到1458 cm-1处归属为L酸中心, 1546 cm-1处归属为B酸中心以及1490 cm-1处L与B酸中心共同作用的特征吸收峰.由L酸与B酸中心红外吸附峰的相对强度可以发现, 所有催化剂均以L酸为主, 并含有少量的B酸中心.随Al含量的增加, L酸与B酸数量均有所增加, 这与NH3-TPD结果一致.
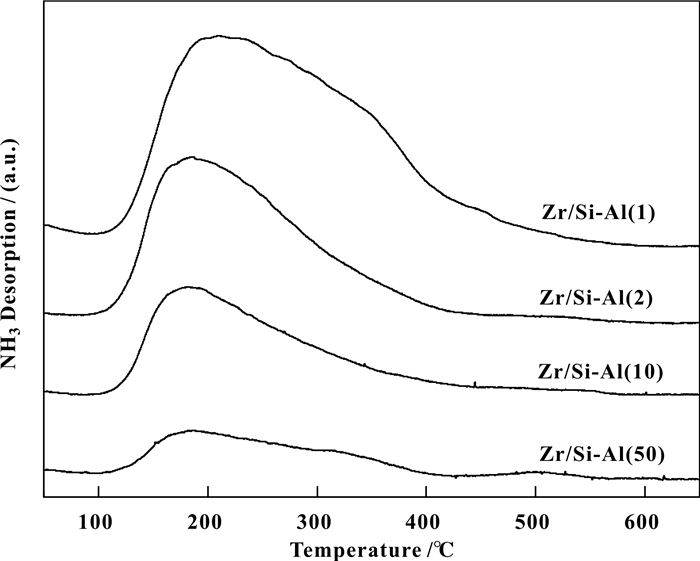
|
图 4 ZrO2/SiO2-Al2O3催化剂的NH3-TPD图 Figure 4 NH3-TPD profiles of ZrO2/SiO2-Al2O3 catalysts |

|
图 5 ZrO2/SiO2-Al2O3催化剂的Py-IR图 Figure 5 Py-IR spectra of ZrO2/SiO2-Al2O3 catalysts |
根据样品NH3脱附峰面积及Py-IR数据计算得到了各样品总酸量及B酸与L酸的比值, 结果列于表 1.由表中数据可以看出, 随着Al2O3含量的增加, 样品的总酸量呈现逐渐增加的趋势. ZrO2/SiO2-Al2O3的酸性一部分来自于SiO2-Al2O3复合物本身, 另一部分来自于负载的ZrO2.在Zr含量固定的前提下, 随Al2O3含量增加, 酸量增加主要由SiO2-Al2O3复合物酸量变化引起.在富硅体系中, 硅铝氧化物的酸性来源于Al3+对硅氧四面体结构中Si4+的同晶取代:由于电荷不平衡, 致使Al3+负电荷过剩, 需要带有正电荷的H+平衡该负电荷, 形成了B酸中心; 配位不饱和的Al3+则形成新的L酸中心[27].结合前述的FTIR表征, SiO2-Al2O3复合物中形成了均匀的Si—O—Al键, 随Al2O3含量的增加, Si—O—Al键数量增多, 酸量增加.也就是对于复合均匀的SiO2-Al2O3复合物来说, 在形成L酸的同时也不可避免地会形成B酸中心.文献中报道的B/L比值通常在0.2以上, 虽然通过提高焙烧温度与Al2O3含量可以使这一比例有所下降, 但仍很难达到我们实验中B/L低于0.03的比值[15].这可能归因于浸渍法引入的Zr4+取代了提供B酸中心的H+, 使暴露在表面的B酸中心大幅下降, 且ZrO2中酸性中心来源于Zr4+, 表现为L酸, 从而使得ZrO2/SiO2-Al2O3主要以L酸中心为主, 而B酸中心极少.
2.5 催化反应性能图 6列出了ZrO2/SiO2-Al2O3催化剂上CAL催化转移加氢反应中CAL转化率与各产物选择性数据, 可以看出, CAL转移加氢产物包括HCAL、COL、HCOL、CPE, 其中目标产物COL为主产物, 选择性在77%以上, 其次为副产物CPE, 在16%以下, 其余副产物HCAL、HCOL均在5%以下.这一结果说明, ZrO2/SiO2-Al2O3催化剂在CAL转移加氢过程中不仅具有高的活性, 而且可在保留C=C键的情况下实现C=O键的高选择性加氢, 获得α, β-不饱和醇.对比各催化剂发现, 随Al2O3含量的增加, CAL转化率呈现先增加后减小的趋势, 由Zr/Si-Al(50)的18%左右, 大幅增加至Zr/Si-Al(2)的约83%, 后又降至Zr/Si-Al(1)的71%左右.与之相对应的, COL选择性呈现先轻微减少后有所升高的趋势, 而CPE选择性则呈现先稍有增加后降低的趋势.低Al2O3含量的Zr/Si-Al(50)表现为最高COL选择性85%, 以及最低的CPE选择性10%. Zr/Si-Al(2)则表现为最低的COL选择性77%, 及最高的CPE选择性16%. HCAL与HCOL的选择性随Al2O3含量的增加, 变化不明显, 均维持在1%~5%的范围内.
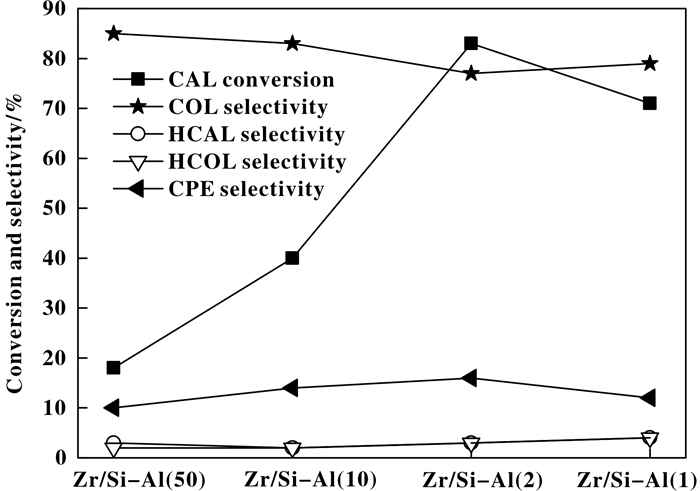
|
图 6 ZrO2/SiO2-Al2O3催化剂上CAL催化转移加氢性能 Figure 6 Catalytic performance of transfer hydrogenation of CAL over ZrO2/SiO2-Al2O3 catalysts Reaction condition: 0.3 g CAL, 30 mL isopropyl alcohol C3H8O, 0.1 g catalyst, 130 ℃, 8 h |
结合文献报道[13-15], 肉桂醛的转移加氢反应直接在催化剂表面的L酸中心上发生H的转移, 不需要经过H2活化为H原子的过程, 如图示2所示.

|
图示2 肉桂醛转移加氢机理 Scheme2 Mechanism of transfer hydrogenation of CAL |
L酸中心通过对肉桂醛和异丙醇分子中氧的吸附, 形成六元环结构, 异丙醇中的氢以离子形态直接转移到肉桂醛中形成肉桂醇, 异丙醇脱氢生成酮.由于不存在活化的H原子, C=C的加氢便得到了抑制, 故产物中HCAL及HCOL含量极低.从该催化反应机理还可看出, 催化剂活性与L酸中心的数量直接相关.据此便可解释, 随Al2O3含量的增加, 催化剂的酸量增加, CAL转化率也随之增加的现象.但当Al2O3含量增加到较大值时, Zr/Si-Al(1)虽然具有最多的酸中心数量, 但其CAL转化率有所下降, 这表明除了催化剂酸量以外, 还存在其他影响催化剂活性的因素.结合物理吸附表征结果, 随Al2O3含量的增加, 催化剂孔径逐渐减小, 尤其是Zr/Si-Al(1), 其平均孔径仅为2.3 nm, 主要以微孔结构存在.据此推测孔径的减小增加了分子的扩散阻力, 致使部分酸性中心利用率降低, 同时微孔内出现的低聚物会堵塞孔道、覆盖酸性中心, 最终导致Zr/Si-Al(1)酸量虽然增加, 但CAL转化率反而降低.
研究表明, COL与CPE的选择性与催化剂表面酸类型相关, L酸是生成COL的活性中心, B酸中心则会使COL进一步与异丙醇发生醚化反应生成CPE[15].在制备的SiO2-Al2O3复合物中通过浸渍法引入Zr4+, 使得SiO2-Al2O3复合物表面的B酸中心显著减少, 从而抑制了醚化副反应, 获得了高的COL选择性.随催化剂中Al2O3含量的增加, COL选择性下降, CPE选择性升高.结合NH3-TPD和Py-IR表征结果推测, 这种现象的发生一方面是由于在Zr4+含量不变的前提下, Al2O3含量的增加不仅使催化剂的L酸中心数量增加, 同时B酸量也有所增加, 即醚化反应活性中心数量增加; 另一方面随Al2O3含量增加, CAL转化率升高, 使得反应体系中COL的绝对浓度增加, 在B酸中心的催化作用下有更多的COL转化生成CPE, 最终在Al2O3含量较高的Zr/Si-Al(2)中COL选择性达到最小值, 而CPE选择性达到最大值. Al2O3含量进一步增加, Zr/Si-Al(1)的COL选择性又有所升高, CPE选择性下降, 这同样归因于该催化剂孔道结构的影响:如前所述, Zr/Si-Al(1)中孔径较小的微孔结构抑制了大分子尺寸CPE的产生, 故CPE选择性下降.
对催化性能最优的Zr/Si-Al(2), 研究了催化剂用量、反应时间、反应温度对催化性能的影响, 并对催化剂进行了循环使用稳定性考察, 结果示于图 7.可以看出, 随着催化剂用量的增加, CAL转化率逐渐升高, COL及CPE均有微弱的增加, HCAL及HCOL稍有减小, 在0.25 g催化剂用量时, CAL转化率达到95%左右, COL及CPE选择性分别达到80%与18%, 而HCAL及HCOL选择性降至1%以下. 图 7(b)显示, 随反应时间的延长, CAL转化率逐渐升高, 但目标产物COL选择性持续下降, 副产物CPE、HCAL及HCOL均有不同程度增加, 说明在延长反应时间时, 未转化的CAL及生成的COL均会进一步转化, 生成相应的副产物. 图 7(c)反应温度对催化性能的影响更加显著, 高温时虽然有利于CAL的转化, 但同样导致目标产物选择性的下降及副产物的升高, 在180 ℃的反应条件下, CAL转化率接近100%, 但目标产物选择性仅为不足60%.综合分析上述条件, 在0.3 g CAL, 30 mL异丙醇, 0.25 g催化剂, 反应温度100 ℃, 反应时间12 h条件下, 进行了循环使用稳定性考察, 从图 7(d)可以看出, 在8次循环使用过程中催化剂的CAL转化率缓慢下降, 由96%下降至90%, 随着循环次数继续增加至12次时, 快速下降至73%左右, 表明催化剂快速失活.在整个循环过程中, 目标产物COL选择性稍有增加, 由89%增加至92%左右, 其余副产物选择性均呈现轻微的下降, 推测在循环过程中酸性中心表面具有部分低聚物聚集, 造成活性位点的减少, 催化剂总活性下降.
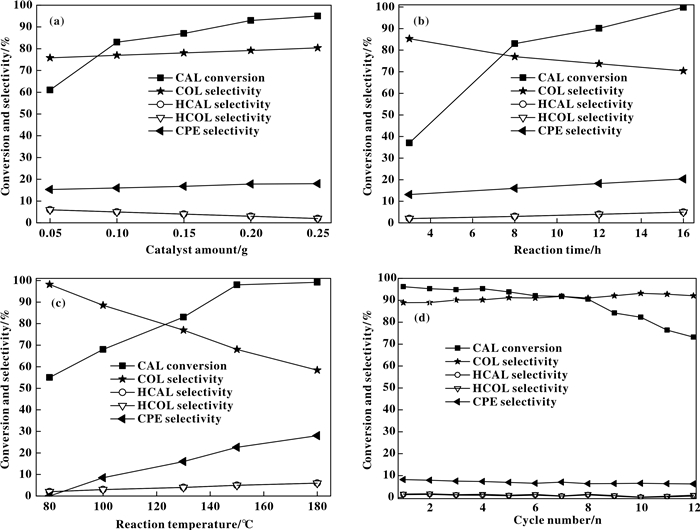
|
图 7 催化剂用量(a)、反应时间(b)、反应温度(c)、循环次数(d)对Zr/Si-Al(2)催化剂CAL转移加氢性能的影响 Figure 7 Effects of catalyst amount (a), reaction time (b), reaction temperature (c) and cycle number (d) on CAL transfer hydrogenation performance of Zr/Si-Al (2) catalyst Reaction conditions: 0.3 g CAL, 30 mL isopropanol alcohol, 0.1 g catalyst, 130 ℃, 8 h. On the basis of reaction conditions, one of the variables was changed each time to investigate the effect of catalyst dosage, reaction time and reaction temperature on the catalytic performance. The reaction conditions of cycle number experiment: 0.3 g CAL, 30 mL isopropyl alcohol, 0.25 g catalyst, 100 ℃, 12 h. |
采用溶胶-凝胶法制备一系列SiO2-Al2O3复合氧化物, 并通过浸渍法引入ZrO2.表征结果显示, 在所制备的催化剂中, SiO2与Al2O3复合均匀, 形成了Si—O—Al键; 引入的Zr4+以高度分散的状态存在, 在部分取代SiO2-Al2O3表面B酸中心的同时, 与配位不饱和的Al3+提供了L酸中心, 故ZrO2/SiO2-Al2O3催化剂主要以L酸为主, 同时含有少量B酸中心. Al2O3含量的提高一方面可以使表面L酸活性中心数量持续增加, 另一方面催化剂的孔道结构也会被过量聚集的Al2O3堵塞, 导致孔径明显下降而降低催化活性.在这两种因素的共同作用下, CAL转化率呈现先增加后减少的趋势, 而目标产物COL的选择性则在轻微下降后有所上升.催化剂中少量B酸中心的存在促使COL与异丙醇进一步发生醚化反应, 生成了少量CPE副产物.
| [1] | Wu Wen-tao(武文涛), Jia Yin-ping(贾颖萍), Yi Jing-mei(尹静梅), et al. Research progress on selective hydrogenation of cinnamaldehyde to cinnamyl alcohol(肉桂醛选择性加氢合成肉桂醇的研究进展)[J]. Chem Interm (in Chinese)(化工中间体), 2009, 5(4): 1–5. DOI:10.3969/j.issn.1672-8114.2009.04.001 |
| [2] | Zhang Y, Chen C, Gong W, et al. One-pot redox synthesis of Pt/Fe3O4 catalyst for efficiently chemoselective hydrogenation of cinnamaldehyde[J]. RSC Adv, 2017, 7(34): 21107–21113. DOI:10.1039/C7RA02898A |
| [3] | Niu Li-bo(牛立博), Liu Chen(刘辰), Ma Yuan-yuan(马苑媛), et al. Preparation of core-shell nickel-based nanocatalysts and their properties in hydrogenation of cinnamaldehyde(核壳结构镍基纳米催化剂的制备及其在肉桂醛加氢反应中的性能)[J]. J Chem Indus(化工学报), 2017, 68(11): 4161–4168. |
| [4] | Cao Gen-ting(曹根庭), Xue Ji-long(薛继龙), Xiao Xue-chun(肖雪春), et al. Mechanism analysis of surface hydrogenation of cinnamaldehyde on M13(M=Au, Pt) clusters(肉桂醛在M13(M=Au, Pt)团簇表面加氢反应机理分析)[J]. J Chem Indus(化工学报), 2016, 67(4): 1333–1339. |
| [5] | Ma H, Yu T, Pan X, et al. Confinement effect of carbon nanotubes on the product distribution of selective hydrogenation of cinnamaldehyde[J]. J Catal, 2017, 38(8): 1315–1321. |
| [6] | Xu Li-yong(许莉勇), Zhang Xin-bo(张新波), Zhang Bin(张斌), et al. Research progress on heterogeneously catalyzed selective hydrogenation of cinnamaldehyde to cinnamyl alcohol(肉桂醛多相催化选择性加氢制肉桂醇的研究进展)[J]. Chin J Mod Appl Pharm(中国现代应用药学), 2010, 27(7): 599–603. |
| [7] | Evans D A, Nelson S G, Gagne M R, et al. A chiral samarium-based catalyst for the asymmetric Meerwein-Ponndorf-Verley reduction[J]. J Am Chem Soc, 1993, 115(21): 9800–9801. DOI:10.1021/ja00074a057 |
| [8] | Campbell E J, Zhou H Y, Nguyen S T. Catalytic meerwein-pondorf-verley reduction by simple aluminum complexes[J]. Org Lett, 2001, 3(15): 2391–2393. DOI:10.1021/ol0162116 |
| [9] |
a. Nandi P, Solovyov A, Okrut A, et al. AlⅢ-Calix [4] arene catalysts for asymmetric meerwein-ponndorf-verley reduction[J]. ACS Catal, 2014, 4(8): 2492-2495. b. Lu Peng(吕鹏), Xu Ding(徐钉), Shen Dong-ming(申东明), et al. Preparation of Cu-based catalyst by solid-phase grinding method with citric acid assisting and performance research in methanol synthesis reaction from CO2 hydrogenation(柠檬酸辅助固相研磨法制备铜基催化剂及在CO2加氢合成甲醇反应中的性能研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(2): 141-151. c. Chen Lun-gang(陈伦刚), Zhang Xing-hua(张兴华), Liu Qi-ying(刘琪英), et al. Research progress on reaction mechanism and catalysts for hydrogenation of carboxylic acids(羧酸加氢反应机理及催化剂的研究进展)[J]. J Mol Catal(China)(分子催化), 2017, 31(3): 267-276. |
| [10] |
a. Wang F, Ta N, Shen W. MgO nanosheets, nanodisks, and nanofibers for the meerwein-ponndorf-verley reduction[J]. Appl Catal A: General, 2014, 475(475): 76-81. b. Xue Dong(薛冬), Lu Zhen-hui(吕振辉). Effect of addition method of critric acid on hydrogenation perfor-mance of avtivity of Mo-Ni-P/Al2O3 catalyst(柠檬酸添加方式对Mo-Ni-P/Al2O3催化剂加氢活性的影响)[J]. J Mol Catal(China)(分子催化), 2017, 31(4): 382-389. c. Li Gui-xian(李贵贤), Zeng Xiao-liang(曾晓亮), Yun Hong-fei(贠宏飞), et al. Preparation of Cu-HMS catalysts by hydrothermal method and study on catalytic hydrogenation performance of dimethyl oxalate(水热法制备Cu-HMS催化剂及其催化草酸二甲酯加氢性能的研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(1): 1-7. |
| [11] |
a. Boukha Z, Fitian L, Haro M L. Influence of the calcintion temperature on the nano-structural properties, surface basicity, and catalytic behavior of alumina-supported lanthana samples[J]. J Catal, 2010, 272(1): 121-130. b. Shen Mei-yu(沈美玉), Wang Xiao-yue(王晓月), Sun De(孙德), et al. Selective hydrogenation of ethyl lactate to 1, 2-propanediol over the La-doped Co-B amorphous catalyst(La修饰的Co-B非晶态催化剂用于乳酸乙酯选择性加氢制1, 2-丙二醇)[J]. J Mol Catal(China)(分子催化), 2016, 30(1): 1-9. c. Sun Pei-yong(孙培永), Luo Xue-qing(罗学清), Zhang Sheng-hong(张胜红), et al. Deactivation and regeneration of Cu/B/Ca/Al2O3 catalysts for the hydroge-nation of sec-butyl acetate(醋酸仲丁酯加氢反应中Cu/B/Ca/Al2O3催化剂的失活及再生)[J]. J Mol Catal(China)(分子催化), 2016, 30(3): 226-233. |
| [12] | Komanoya T, Nakajima K, KitanoMa , et al. Synergistic catalysis by lewis acid and base sites on ZrO2 for meerwein-ponndorf-verley reduction[J]. J Phys Chem C, 2015, 119: 26540–26546. DOI:10.1021/acs.jpcc.5b08355 |
| [13] | Chen Xi-hui(陈希慧), Wu Ke-song(吴克松), Li Jin-zhou(李锦周). The role of several transition metal oxides in the reduction of cinnamaldehyde MPV(几种过渡金属氧化物在肉桂醛MPV还原中的作用)[J]. J Guangxi Unive:Nat Sci Edit(广西大学学报:自然科学版), 2009, 34(4): 498–500. |
| [14] | Cai W, Yang J, Sun H, et al. Surface titanium oxide loaded on a special alumina as high-performance catalyst for reduction of cinnamaldehyde by isopropanol[J]. J Catal (China), 2017, 38(8): 1330–1337. DOI:10.1016/S1872-2067(17)62873-0 |
| [15] | Gao Z, Hong Y, Hu Z, et al. Transfer hydrogenation of cinnamaldehyde with 2-propanol on Al2O3 and SiO2-Al2O3 catalysts:role of Lewis and Brønsted acidic sites[J]. Catal Sci Tech, 2017, 7(19): 4511–4519. DOI:10.1039/C7CY01569K |
| [16] | Perego C, Angelis A, Carati A, et al. Amorphous aluminosilicate catalysts for hydroxyalkylation of aniline and phenol[J]. Appl Catal A:General, 2006, 307(1): 128–136. DOI:10.1016/j.apcata.2006.03.013 |
| [17] | Trombetta M, Busca G, Rossini S, et al. FT-IR studies on light olefin skeletal isomerization catalysis[J]. J Catal, 1998, 179(2): 581–596. DOI:10.1006/jcat.1998.2251 |
| [18] | Kim Y T, Jung K D, Park E D. Gas-phase dehydration of glycerol over silica-alumina catalysts[J]. Appl Catal B:Environ, 2011, 107(1): 177–187. |
| [19] | Youssef A M, Ahmed A I, Samra S E. Surface and aci-dic properties of some mixed oxide catalysts in relation to their catalytic activities[J]. Mater Lett, 1990, 10: 175–180. DOI:10.1016/0167-577X(90)90084-Y |
| [20] | Pore size distribution and porosimetry of solid materials by mercury porosimetry and gasadsorption-Part 2: Analysis of mesopores and macropores by gas adsorption[S]. ISO 15901-2, 2006. 12-15. |
| [21] | Hernandez C, Pierre A C. Evolution of the texture and structure of SiO2-Al2O3 xerogels and aerogels as a function of the Si to Al molar ratio[J]. J Sol-Gel Sci and Tech, 2001, 20(3): 227–243. DOI:10.1023/A:1008714617174 |
| [22] | Nampi P P, Moothetty P, Berry F J, et al. Aluminosilicates with varying alumina-silica ratios:synthesis via a hybrid sol-gel route and structural characterisation[J]. Dalton T, 2010, 39(21): 5101–5107. DOI:10.1039/c001219j |
| [23] | Pierre A C, Hernandez C. Influence of the Sol-Gel acidic synthesis conditions on the porous texture and acidity of SiO2-Al2O3 catalysts with a low Al proportion[J]. Langmuir, 2000, 16: 530–536. DOI:10.1021/la990839w |
| [24] | Miller J B, Rankin S E, Ko E I. Strategies in controlling the homogeneity of zirconia-silica aerogels:effect of pre-paration on textural and catalytic properties[J]. J Catal, 1994, 148(2): 673–682. DOI:10.1006/jcat.1994.1254 |
| [25] | Zhan Z Q, Zeng H C. The self-catalytic role of zirconium n-propoxide in sol-gel syntheses of ZrO2-SiO2 mixed oxides[J]. J Mater Chem, 1999, 9(10): 2647–2652. DOI:10.1039/a901422e |
| [26] | Yang Xi-yao(杨锡尧). Research methods of solid catalysts Chapter 13 temperature-programming analysis techniques (below)(固体催化剂的研究方法第十三章程序升温分析技术(下))[J]. Petrochemical(石油化工), 2002, 31(1): 63–73. |
| [27] | Deng Jing-fa(邓景发). Introduction to the principle of catalysis(催化作用原理导论)[M]. Shenyang: Jilin Science and Technology Press(沈阳: 吉林科学技术出版社), 1984: 336-338. |
 2018, Vol. 32
2018, Vol. 32


