2. 华南农业大学 材料与能源学院, 广东 广州 510642
2. College of Materials and Energy, South China Agricultural University, Guangzhou 510642, China
1-丁烯、1-己烯、1-辛烯甚至更高级的α-烯烃是制备高性能聚烯烃不可缺少的原料.乙烯高选择性齐聚为生产单一特定碳数的线性α-烯烃(LAO)提供了重要途径[1].寻找更优的反应催化体系[2], 不断提高1-已烯/1-辛烯选择性是目前的研究热点.
近年来, 改变配体骨架[1]、加入给电子体[3]等调变乙烯齐聚反应或采用多相催化乙烯齐聚反应[4-5]的研究逐渐增多.在Ziegler-Natta丙烯聚合反应中, 主要是通过给电子体的电子效应和空间效应共同作用调变反应的活性和立构规整性[6].而在乙烯高选择性齐聚体系中, 对给电子体的研究也不断完善. Manyik等[7]发现乙二醇二甲醚(DME)使Cr(Ⅲ) 2-EH/三异丁基铝由乙烯聚合催化转变为三聚体系, 这种新型的反应路径激发了其工业应用研究的热潮.我们认为该体系中DME的电子效应利于铬金属环的扩张, 但位阻效应使铬金属环扩张步骤能垒高于其1-己烯生成步骤导致转变发生[8].而Monoi等[9]添加DME至二氧化硅负载的Cr[N(SiMe3)2]3/异丁基铝氧烷铬系催化体系, 1-己烯的选择性从74.2%增加到86.4%, 但是反应活性和癸烯的选择性下降.我们前期对Chevron-Phillips已工业化乙烯三聚体系Cr(2-EH)3/2, 5-二甲基吡咯/助催化剂/卤化物的研究表明, 加入溴化物会因较大的位阻和与铬活性中心较强的配位能力导致活性下降; 而加入饱和烷烃上氯取代基数目的增加可以提高反应的活性和选择性[10].
但目前针对乙烯高选择性四聚体系给电子体的研究较少.姜涛等[11]发现在Cr(Ⅲ)/PNP四聚体系中加入卤化物可以提高1-辛烯的选择性, 并认为是卤化物和铬活性中心弱配位的空间效应导致, 而活性显著下降则是因为卤化物和铬中心配位影响了乙烯的插入.近期, 我们对Cr/PNP体系乙烯高选择性四聚体系加入给电子体的初步研究表明, 含有N、O、P、S的几种给电子体会导致铬活性中心位阻的增加、活性降低.而加入三苯基膦可以使反应总选择性上升[12-13].可以看出, 乙烯高选择齐聚反应中, 给电子体的影响还需深入系统的研究.
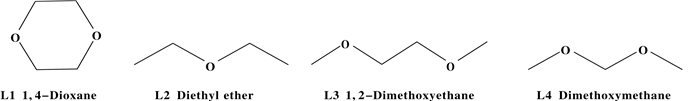
我们选取了如图 1所示的4种醚类给电子体.采用理论和实验相结合的方法对Cr/PNP/甲基铝氧烷(MAO)/醚类化合物乙烯齐聚体系进行了系统的研究, 考察了给电子体的位阻效应和电子效应对乙烯齐聚体系的影响.另外考虑到MAO中含有微量甲苯, 采用溶剂模型密度(SMD)连续溶剂化模型[14]和真实溶剂似导体屏蔽(COSMO-RS)模型[15]研究甲苯和甲基环己烷的溶剂效应.
|
图 1 醚类化合物结构 Fig.1 Structures of ether compounds |
乙烯(聚合级, 纯度99.95%), 高纯氮气(纯度99.999%), 上海伟创标准气体有限公司; 甲基环己烷(分析纯), 阿拉丁试剂有限公司, 经金属钠回流处理; 10%(重量百分比)甲基铝氧烷(MAO)甲苯溶液、7%(重量百分比)改性甲基铝氧烷(MMAO)庚烷溶液购自阿克苏诺贝尔; Ph2PN(tBu)PPh2配体按照文献[16]合成(结构见图 2); 乙酰丙酮铬(Cr(acac)3, 纯度97 %)购自百灵威科技有限公司; 乙二醇二甲醚、甲缩醛、二噁烷、乙醚购自TCI, 并在氮气氛围下经钠回流处理.

|
图 2 Ph2PN(tBu)PPh2的结构 Fig.2 Structure of Ph2PN(tBu)PPh2 |
在300 mL反应釜进行乙烯齐聚反应[16-17], 抽真空升温到100 ℃, 用高纯氮气和乙烯置换3次, 依次加入甲基环己烷溶剂、助催化剂、Cr(acac)3、配体和醚类化合物.待体系稳定至反应温度, 快速通入乙烯使釜内压力升至反应压力, 反应30 min后, 用液氮和乙醇的混合液降温, 然后快速放掉体系内的气体.加入1 mL内标物壬烷并搅拌均匀, 气相色谱仪分析液相产物.向剩余的液体与蜡状物中加入10%(重量百分比)的盐酸/乙醇搅拌, 称量固体产物聚乙烯(PE)的质量.每组均进行重复实验, 实验误差在±1%以内.
1.3 产物分析乙烯齐聚产物分析用上海锐敏GC2060气相色谱(温度: 35~250 ℃, 起始温度和终止温度下各保持10 min; 升温速率: 10 ℃·min-1; 进样器和检测器温度: 250 ℃; 载气:氮气, 流量30 mL·min-1; 检测器: FID; 进样量: 1.0 μL).配体的表征用安捷伦的J&W HP-5msUI柱.核磁共振波谱仪为安捷伦400-NMR; 质谱为安捷伦6224TOFLC/MS. 1H NMR (400 MHz, CDCl3, δ): 1.42 (s, 9H), 7.23-7.52 (m, 20 H); 31P NMR (162 MHz, CDCl3, δ): 57.9 (br, s); HRMS (ESI) m/z: 422.1843(C28H30NP2+).
1.4 计算方法所有的DFT计算采用高斯09程序[18].对于催化反应中不同基态的中间态, 即自旋交叉点(MECPs)利用Harvey [19]的方法计算.选择B3LYP密度泛函和def2-SVP基组来优化所有结构[20-21].溶剂化能是用高斯的SMD模型[14]和COSMOtherm程序的COSMO-RS模型[15]在模拟溶剂条件下计算气相下优化结构的溶剂能.所有的自由能在实验条件t=318.15 K和p=3.0 MPa下进行校正.所有结构吉布斯自由能极小值无虚频或者所有过渡态只具有一个虚频, 显示出与预期反应路径一致的振动模式(通过本征反应坐标计算验证).电荷分析利用高斯09程序中的自然键轨道(NBO)进行分析[18].位阻效应的研究利用Sambvca 2.0软件[22-23].本征反应坐标(IRC)计算是根据过渡态与相应的反应物和产物之间的关系, 通过IRC计算来确定过渡态.模拟过程中, 探索了六重态和四重态两个可能势能面下所有可能的反应路径.
2 结果与讨论 2.1 给电子体对乙烯齐聚性能影响的实验研究给电子体化合物一般为路易斯碱, 通常是含氧、氮、磷、硅的有机化合物, 如酯类、醚类、胺类和硅烷类化合物.在本实验中, 选取了一系列醚类给电子体, 结构如图 1所示.选择了在乙烯铬系高选择三聚体系中表现良好的乙二醇二甲醚, 考虑到给电子体的电子效应和位阻效应, 因此选择给电子能力较差的乙醚, 和位阻较小的甲缩醛以及环状结构二噁烷.
从表 1的实验结果可以看出, 不同给电子体对体系产生的影响各异. L3(乙二醇二甲醚)的加入导致活性大幅下降至6.022×106 g·molCr-1·h-1, 并且产生较多的聚乙烯.加入L1(二噁烷)、L2(乙醚)和L4(甲缩醛)后, 活性稍有下降, 但整体总选择性和活性仍然保持在较高水平.而我们前期选用的丁基苯基醚和苯甲酸乙酯含氧给电子体使齐聚反应活性和选择性大幅降低, PE大幅增加[12].加入L3(乙二醇二甲醚)和L4(甲缩醛)后, C6+C8总选择性增加; 加入L1(二噁烷)和L2(乙醚)后, 体系的聚乙烯量略有降低.
| 表 1 醚类给电子体对乙烯齐聚的影响 Table 1 Effect ofether electron donors on ethylene oligomerization |
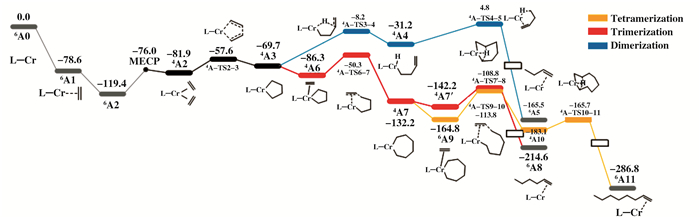
为了进一步研究加入醚类化合物对Cr/PNP乙烯齐聚体系性能的影响, 对Cr/PNP体系(模型A)和加入给电子体的体系(模型A-L)分别进行了DFT计算, 整个反应路径的吉布斯自由能能垒和转化频率(TOF)的计算结果列在表 2.整个反应路径基于Briggs的金属环状机理在气相条件计算后进行溶剂矫正. 图 3为甲基环己烷溶剂条件下模型A所有中间体在Cr低自旋态的吉布斯自由能分布, 其中低自旋多重态和高自旋多重态两个相邻表面通过最小能量交叉点连接.在计算乙烯二聚路径过程中, 4A3需要经过β-H转移才能产生1-丁烯, 而4A3首先会形成更稳定的状态4A6, 能垒降低16.6 kJ·mol-1.因此, 乙烯二聚过程需要克服过渡态4A-TS4-5和4A6之间的能垒为91.1 kJ·mol-1, 而4A3环扩张形成4A7过程的能垒为36.0 kJ·mol-1, 形成4A7更稳定, 4A3更容易向环扩张生成4A7的方向进行.在乙烯三聚反应过程中, 反应路径和二聚过程类似.第4分子乙烯吸附到4A7, 能垒降低32.6 kJ·mol-1, 所以1-己烯的形成需要克服4A-TS7′-8过渡态的能垒为56.0 kJ·mol-1.而这里也有一个竞争反应, 4A7通过β-H转移发生环扩张为铬金属九元环(51.0 kJ·mol-1), 相比之下更倾向于四聚反应路径.本体系速率决定步骤是铬金属五元环的形成过程, 能垒降低将有利于活性增加.我们可以用TOF更直观地比较活性和选择性.根据能量跨度模型[24-27], TOF值取决于整个反应路径最低的能量和速率决定步骤的能量差值.对于模型A的乙烯二聚过程, 速率决定中间体(TDI)和速率决定过渡态(TDTS)分别是6A2和4A-TS4-5, 二聚过程TOF值是2.7×10-7 s-1.三聚和四聚过程, 速率决定中间体(TDI)和速率决定过渡态(TDTS)分别是6A2和4A-TS2-3, TOF值是1.8×102 s-1, 因此Cr/PNP体系更倾向于环增大的三聚/四聚反应.
| 表 2 添加与未添加醚类化合物的Cr/PNP乙烯齐聚体系能垒(kJ·mol-1)和TOFs (s-1) Table 2 Energy barriers (kJ·mol-1) and the calculated TOFs (s-1) of ethylene oligomerization over Cr/PNP with/without ether compounds |
|
图 3 模型A在甲基环己烷溶剂下乙烯齐聚相对吉布斯自由能分布 Fig.3 Relative Gibbs free energy profiles of ethylene oligomerization of model A in methylcyclohexane |
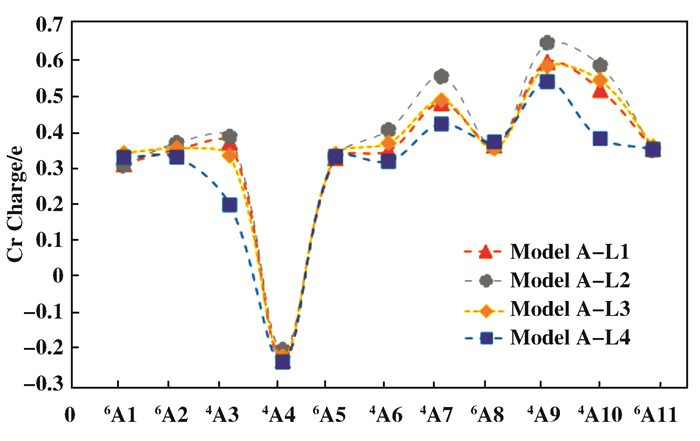
对添加醚类化合物体系铬活性中心的电荷进行分析.从图 4可以看出, 在4种给电子体中, 含有相同碳氧原子数的乙二醇二甲醚和二噁烷对铬电荷的影响相近, 相比乙二醇二甲醚和二噁烷, 甲缩醛使铬电荷降低最多, 而乙醚使铬电荷降低的最少.虽然我们前期发现降低铬中心电荷对提高反应的活性有利[12], 但电子效应对于该反应不是唯一的影响因素, 给电子体位阻效应的影响同样需要考虑.
|
图 4 模型A-L在整个乙烯齐聚反应路径的铬电荷 Fig.4 Charges on Cr of model A-L in the whole oligomerization pathway |
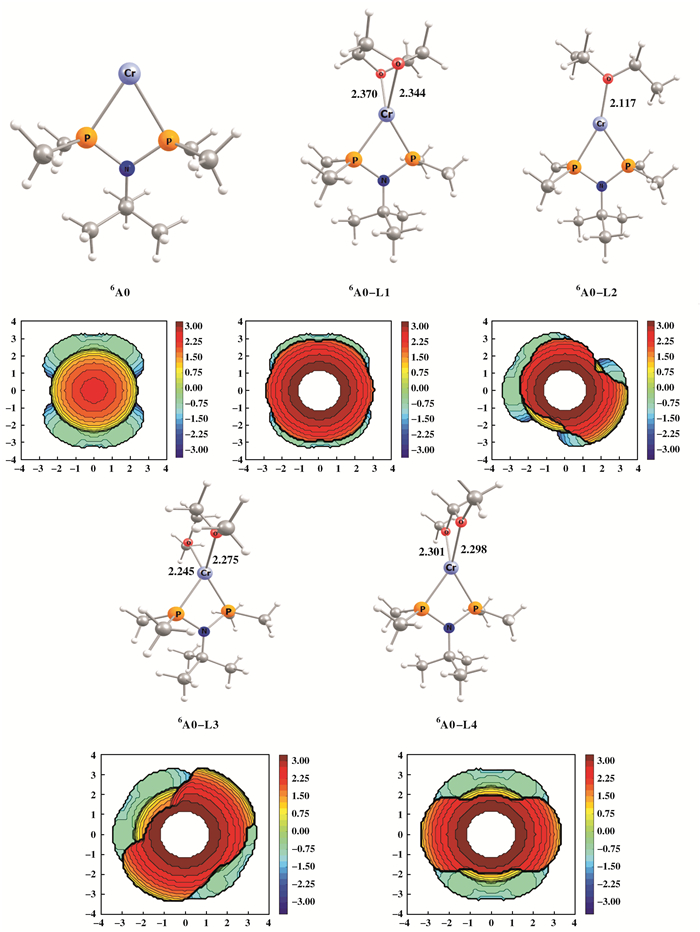
我们进一步研究了给电子体体系的位阻效应, 将含4种不同给电子的模型与模型A进行对比.位阻影响采用SambVca2程序[22-23]来分析. 图 5中的位阻图用简单的二维等值线代表相互作用面, 通过比较金属中心周围单个象限中的埋深体积百分比(%VBur)来比较位阻大小. %VBur的值是对已经DFT优化的结构进行立体位阻分析得到的.对应模型A, A-L1, A-L2, A-L3和A-L4, %VBur的值分别是53.4, 72.4, 69.2, 73.3和68.2, 即添加4种给电子体体系位阻为A-L4 < A-L2 < A-L1 < A-L3.其中, 链长最短的L4位阻最小; 含有相同碳氧原子数的链状结构L3位阻略大于环状结构L1位阻; L3乙二醇二甲醚的位阻最大, 导致活性下降更为明显, 且位阻越大使反应越倾向于乙烯三聚反应的发生, 这与表 1的实验结果一致.接下来结合反应能垒分析不同结构给电子体下电子效应和位阻效应协同作用对乙烯齐聚反应的影响.
|
图 5 模型A和模型A-L1~4的优化结构和位阻图 Fig.5 Optimized structures and steric maps of model A and model A-L1~4 (铬原子在原点, 氮、铬原子在Z轴的负方向) (Chromium atoms at origin, nitrogen and chromium atoms in the negative direction of Z axis) |
从表 2可以看出, 在未加入给电子体的体系中速率决定步骤是两分子乙烯氧化偶联形成金属五元环(6A2→4A3), 能垒61.8 kJ·mol-1.加入给电子体后, 速率决定步骤转移到了第4分子乙烯插入铬金属七元环(4X9→6X11)的步骤, 并且速率决定步骤能垒均不低于86.7 kJ·mol-1.添加乙二醇二甲醚的体系反应活性大幅降低, 可能是由于乙二醇二甲醚的位阻较大.三聚/四聚过程模型A的TOF值远远大于模型A-L, 表明4种给电子体对该体系产生一定阻碍.从结构上看, 链状结构L3位阻略大于环状结构L1, 而两者电子效应影响相同, 但A-L3相比A-L1的能垒大幅升高; 而位阻相差很小, 电子效应相差最大的L2和L4, 能垒相差很小, 说明相比电子效应, 位阻效应对反应的影响更明显.这与乙烯四聚体系中, 对PNP配体N上不同取代基的电子效应和位阻效应研究发现, 后者对反应选择性的影响起主导作用的结论一致[28]. 4种给电子体中, 甲缩醛使铬电荷降低最多且位阻最小, 速率决定步骤能垒最低同时活性最高.而与前期加入苯甲酸乙酯相比[12], 虽然苯甲酸乙酯使铬中心电荷降低地更多, %VBur值为65.3, 位阻相比也较小, 但是反应活性不高.所以给电子体对乙烯齐聚反应的影响是电子效应和位阻效应的协同作用, 最优条件仍需继续探索.
有趣的是, 在模拟过程中我们发现相比乙醚, 二元醚给电子体甲缩醛、乙二醇二甲醚和二噁烷, 在反应路径中存在氧原子单/双配位的变换, 影响铬中心配位点的变化从而影响乙烯分子插入的难易程度.以乙二醇二甲醚的反应路径为例. 6A0-L3 Cr(Ⅰ)是高度不饱和状态, 只有PNP配体和乙二醇二甲醚与铬配位, 乙二醇二甲醚为双配位形式.一个乙烯分子非常容易插入形成单乙烯配位的物质6A1-L3, 而第2分子乙烯插入会取代乙二醇二甲醚上一个氧原子的位置, 乙二醇二甲醚变为单配位, Cr-O距离从6A1-L3的2.67 Å增长到6A2-L3的4.08 Å, 另一个氧原子仍保持配位, Cr-O距离分别为2.39和2.64 Å.铬金属五元环4A3-L3形成时, 乙二醇二甲醚和铬中心变为双配位.第3分子乙烯插入4A6-L3会再次占据一个氧原子的位置呈现乙二醇二甲醚单配位, 4A3-L3到4A6-L3过程如图 6所示.当形成铬金属七元环4A7-L3, 乙二醇二甲醚为双配位. 4A7-L3经过β-H的转移, 以及乙二醇二甲醚和铬中心的单双配位变换形成了稳定的链状产物6A8-L3.这时, 乙二醇二甲醚为双配位.同样地, 在插入第4分子乙烯4A9-L3时为单配位形式, 直到生成链状产物6A11-L3变成双配位.具有类似链状结构的甲缩醛和乙二醇二甲醚的两个氧原子会和铬中心配位形成不同环状中间体, 前者的四元环较乙二醇二甲醚和铬中心形成的五元环稳定性差, 且四元环对铬周围位阻影响相比较小, 当乙烯分子插入更容易开环, 反应过程能垒更低, 从而影响1-己烯和1-辛烯的选择性.同样含有两个氧原子的环状结构二噁烷, 相比链状给电子体形成双配位需要的铬周围空间要求更严格, 只在空间较大的6A0-L1和4A3-L1状态为双配位.
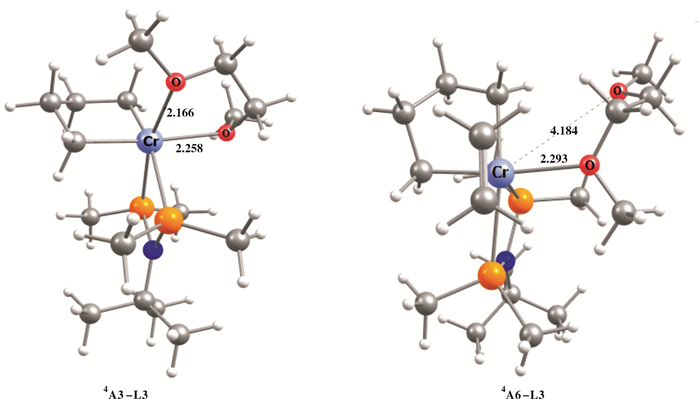
|
图 6 模型A-L3反应中间体4A3-L3和4A6-L3的优化结构 Fig.6 Optimized structures of intermediates 4A3-L3 and 4A6-L3 of model A-L3 |
我们也选择了乙烯齐聚体系中常用的助催化剂MMAO[29]进行对比实验.从表 3可以看出, 与MAO相比, 采用MMAO后体系的活性略微增加, 产生的PE略微减少.但是助催化剂的种类并没有对C6/C8的选择性产生很大的影响.
| 表 3 助催化剂对乙烯齐聚的影响 Table 3 Effect of cocatalyst on ethylene oligomerization |
通常情况下, 乙烯齐聚反应所用的溶剂是甲苯或者饱和烷烃, 如甲基环己烷[30].本实验所用的Cr(acac)3/tBu-PNP/MAO体系中, 其中MAO为10%(重量百分比)的甲苯溶液; 而根据Indu等[31]报道甲苯会对乙烯齐聚反应有毒化作用.据此, 我们采用SMD模型[14]和COSMO-RS模型[15]计算了Cr/PNP体系中甲苯和甲基环己烷的溶剂效应.从表 4的模拟结果来看, COSMO的计算结果和SMD方法得到的结果相近.甲基环己烷和甲苯两种溶剂下乙烯齐聚反应路径的能垒差小于1.5 kJ·mol-1.总的来说甲苯对本体系影响不大, 可能是由于甲苯溶剂的极性相对较低, 并且本体系中铬中心的配位环境比较拥挤, 甲苯难与铬中心产生较强的配位作用.考虑到乙烯在甲基环己烷中的溶解性更好[32], 我们倾向选择甲基环己烷作为溶剂.
| 表 4 不同溶剂的乙烯齐聚体系能垒(kJ·mol-1) Table 4 Energy barriers of ethylene oligomerization with different solvents (kJ·mol-1) |
4种醚类给电子体加入后, 乙二醇二甲醚和甲缩醛使C6+C8总选择性略微增加; 加入乙醚和二噁烷, 聚乙烯的量略微降低.加入乙醚体系铬电荷相比二元醚体系的高, 但其活性仍保持在较高水平.位阻最大的乙二醇二甲醚导致活性下降最明显, 且位阻越大使反应越倾向于乙烯三聚反应.醚类给电子体对乙烯齐聚反应的影响是电子效应和位阻效应的协同作用, 但位阻效应更加明显.
相比乙醚, 含双元醚键给电子体的单双配位变化会影响铬中心配位点的变化从而影响乙烯分子插入的难易程度. DFT计算结果表明给电子体会导致乙烯齐聚的速率决定步骤从两分子乙烯配位氧化偶联转移到第四分子乙烯插入铬金属七元环的步骤.
助催化剂MMAO与MAO并没有对本体系C6/C8的选择性产生很大的影响.计算得到甲基环己烷和甲苯两种溶剂下乙烯齐聚反应路径能垒差小于1.5 kJ·mol-1, 在本体系中可以忽略MAO中微量甲苯可能产生的毒化作用.
| [1] |
a. Liu Rui(刘睿), Xiao Shu-meng(肖树萌), Zhong Xiang-hong(钟向宏), et al. Advances in selective ethylene oligomerization based on [PNP]-ligand chromium catalysts(基于[PNP]配体的铬催化剂体系选择性催化乙烯齐聚的研究进展)[J]. Org Chem (China)(有机化学), 2015, 35(9): 1861-1888. b. Mi Pu-ke(米普科), Wang Jian-wei(王建伟), Wang Li-juan(王立娟), et al. Synthesis and characterization of copolymer of ethylene and 1-hexene by carbon bridge CpCN-CGC(碳桥限制构型催化剂催化乙烯1-己烯共聚和共聚物结构表征) [J]. J Mol Catal (China)(分子催化), 2017, 31(6): 501-512. |
| [2] | Wu Jian-min(吴建民), Sun Qi-wen(孙启文), Zhang Zong-sen(张宗森), et al. Thermodynamic study for ethylene oligomerization to α-olefin(乙烯齐聚制α-烯烃反应体系的热力学研究)[J]. J Mol Catal(China)(分子催化), 2013, 27(4): 385–391. |
| [3] | Briggs J R. The selective trimerization of ethylene to hex-1-ene[J]. J Chem Soc Chem Commun, 1989, 1989(11): 674–675. |
| [4] | Zhang Jun-tao(张君涛), Zhang Yao-jun(张耀君), Liang Sheng-rong(梁生荣). Influence of surface-modified on ethylene oligomerization performance of metal-loaded MZSM-5 catalysts(表面修饰对金属负载型MZSM-5催化剂乙烯齐聚性能的影响)[J]. J Mol Catal(China)(分子催化), 2005, 19(2): 121–124. |
| [5] | Zhang Jun-tao(张君涛), Zhang Yao-jun(张耀君), Liang Sheng-rong(梁生荣). Study on the heterogeneous ethylene oligomerization for preparation of α-olefins(Ⅰ)(多相催化乙烯齐聚制α-烯烃的研究(Ⅰ))[J]. J Mol Catal(China)(分子催化), 2004, 18(5): 357–360. |
| [6] | Wang Jian-feng(王剑峰), Wang Li(王立). Progress in catalysts for propylene polymerization(丙烯聚合催化剂的研究进展)[J]. J Mol Catal(China)(分子催化), 2004, 18(3): 234–240. |
| [7] | Manyik R M, Walker W E, Wilson T P. A soluble chromium-based catalyst for ethylene trimerization and polymerization[J]. J Catal, 1977, 47(2): 197–209. |
| [8] | Qi Y, Dong Q, Zhong L, et al. Role of 1, 2-Dimethoxyethane in the transform-ation from ethylene polymerization to trimerization using chromium tris(2-ethylhexan-oate)-based catalyst system:a DFT study[J]. Organometallics, 2010, 29(7): 1588–1602. DOI:10.1021/om900917k |
| [9] | Takashi M, Yasuaki S. Silica-supported Cr[N(SiMe3)2]3/isobutylalumoxane catalyst for selective ethylene trimerization[J]. J Mol Catal A-Chem, 2002, 187(1): 135–141. DOI:10.1016/S1381-1169(02)00183-8 |
| [10] | Tang S Y, Liu Z, Yan X W, et al. Kinetic studies on the pyrrole-Cr-based chevron-phillips ethylene trimerization catalyst system[J]. Appl Catal A-Gen, 2014, 481(5): 39–48. |
| [11] | Chen H X, Liu X Y, Wu W B, et al. Effects of halide in homogeneous Cr(Ⅲ)/PNP/MAO catalytic systems for ethylene tetramerization toward 1-octene[J]. J Mol Catal A-Chem, 2007, 270(1/2): 273–277. |
| [12] | Liu L, Liu Z, Cheng R H, et al. Unraveling the effects of H2, N substituents and secondary ligands on Cr/PNP-catalyzed ethylene selective oligomerization[J]. Organometallics, 2018, 37(21): 3893–3900. DOI:10.1021/acs.organomet.8b00578 |
| [13] | Li Bo-min(李博民), Liu Bo-ping(刘柏平), Liu Zhen(刘振). Ethylene selective tri-/tetramerisation with PNP-Cr mixed ligands(PNP-Cr复合配体用于乙烯选择性三聚/四聚的研究)[J]. East Chin Univer Sci Technol(Nat Sci Ed)(China)(华东理工大学学报(自然科学版)), 2018, 44(3): 303–307. |
| [14] | Marenich A V C C, Truhlar D G. Universal solvation model based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions[J]. J Phys Chem B, 2009, 113(18): 6378–6396. DOI:10.1021/jp810292n |
| [15] | Klamt A. COSMO:A new approach to dielectric screening in solvents with explicit expressions for the screening energy and its gradient[J]. J Chem Soc Perkin Trans, 1993, 2(5): 799–805. |
| [16] | Maumela M C, Blann K, Dixon J T, et al. Efficient synthesis of novel N-substituted bulky diphosphinoamines[J]. Synthesis, 2007, 2007(24): 3863–3867. DOI:10.1055/s-2007-990868 |
| [17] | Zhu Xiang-feng(朱祥峰), Cheng Rui-hua(程瑞华), Sun Ren(孙任), et al. Kinetics of ethylene selective oligomerization over Cr(acac)3/Ph2PN(tBu)PPh2/MAO catalyst system(Cr(acac)3/Ph2PN(tBu)PPh2/MAO催化乙烯高选择性齐聚的动力学研究)[J]. Chin Syn Res Plast(China)(合成树脂及塑料), 2018, 35(5): 5–9. |
| [18] | Frisch M J, Trucks G W, Schlegel H B, et al. Gaussian 09, Revision E.01; Gaussian, Inc.: Wallingford, CT, 2009. |
| [19] | Harvey J N A. Spin-forbidden dehydrogenation of methoxy cation:A statistical view[J]. Phys Chem Chem Phys, 1999, 1(24): 5555–5563. DOI:10.1039/a907723e |
| [20] | Becke A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J]. J Chem Phys, 1993, 98(7): 5648–5652. DOI:10.1063/1.464913 |
| [21] | Stephens P, Devlin F, Chabalowski C, et al. Ab initio calculation of vibrational absorption and circular dichroism spectra using density functional force fields[J]. J Phys Chem, 1994, 98(45): 11623–11627. DOI:10.1021/j100096a001 |
| [22] | Clavier H, Nolan S P. Percent buried volume for phosphine and N-heterocyclic carbene ligands:Steric properties in organometallic chemistry[J]. Chem Commun, 2010, 46(6): 841–861. DOI:10.1039/b922984a |
| [23] | Falivene L, Credendino R, Poater A, et al. Sambvca 2. a web tool for analyzing catalytic pockets with topographic steric maps[J]. Organometallics, 2016, 35(13): 2286–2293. DOI:10.1021/acs.organomet.6b00371 |
| [24] | Kozuch S. A refinement of everyday thinking:the energetic span model for kinetic assessment of catalytic cycles[J]. Wires Comput Mol Sci, 2012, 2(5): 795–815. DOI:10.1002/wcms.1100 |
| [25] | Kozuch S, Shaik S. Kinetic-quantum chemical model for catalytic cycles:The haber-bosch process and the effect of reagent concentration[J]. J Phys Chem A, 2008, 112(26): 6032–6041. DOI:10.1021/jp8004772 |
| [26] | Kozuch S, Shaik S. A combined kinetic-quantum mechanical model for assessment of catalytic cycles:Application to cross-coupling and Heck reactions[J]. J Am Chem Soc, 2006, 128(10): 3355–3365. DOI:10.1021/ja0559146 |
| [27] | Kozuch . How to conceptualize catalytic cycles? the energetic span model[J]. Acc Chem Res, 2011, 44(2): 101–110. DOI:10.1021/ar1000956 |
| [28] | Blann K, Bollmann A, Debod H, et al. Ethylene tetramerisation:Subtle effects exhibited by N-substituted diphosphinoamine ligands[J]. J Catal, 2007, 249(2): 244–249. DOI:10.1016/j.jcat.2007.04.009 |
| [29] | Jiang T, Liu X Y, Ning Y N, et al. Performance of various aluminoxane activators in ethylene tetramerization based on PNP/Cr(Ⅲ) catalyst system[J]. Catal Commun, 2007, 8(7): 1145–1148. DOI:10.1016/j.catcom.2006.10.032 |
| [30] | Jong Y J, Dong S P, Dong H L, et al. A chromium precursor for the phillips ethylene trimerization catalyst:(2-ethylhexanoate)2CrOH[J]. Dalton Trans, 2015, 44(24): 11004–11012. DOI:10.1039/C5DT01203A |
| [31] | Indu V, Grigory B, Nikiforov Dr, et al. Isolation of a self-activating ethylene trimerization catalyst[J]. Angew Chem Int, 2009, 48(35): 6552–6556. DOI:10.1002/anie.v48:35 |
| [32] | Kuhlmann S, Kevin B, Annette B, et al. N-substituted diphosphinoamines:Toward rational ligand design for the efficient tetramerization of ethylene[J]. J Catal, 2007, 245(2): 279–284. DOI:10.1016/j.jcat.2006.10.020 |
 2019, Vol. 33
2019, Vol. 33


