2. 江南大学 生物工程学院 粮食发酵工艺与技术国家工程实验室, 江苏 无锡 214122;
3. 山东昆达生物科技有限公司, 山东 临沂 276400
2. National Engineering Laboratory for Cereal Fermentation Technology, School of Biotechnology, Jiangnan University, Wuxi 214122, China;
3. Shandong Kunda Biotechnology Co., Ltd, Linyi 276400, China
腈水解酶(EC3.5.5.1)属于腈水解酶超家族, 是一类能将腈类化合物转化成相应羧酸的水解酶[1], 具有较保守的α-β-β-α的三明治结构, 以及E-K-C催化三联体[2].由于具有反应条件温和、环境友好、底物特异性强等优点, 腈水解酶在精细化学品、食品添加剂及医药中间体的生物催化合成中具有良好的应用价值[3].
烟酸(维生素B3)是人体所必须的13种维生素之一, 在人体中为脱氢酶的辅酶(NAD+, NADP+)提供碳骨架, 这些辅酶在多种氧化还原反应中有着重要作用.而人体自身仅能通过转化少量酪氨酸来合成烟酸, 其余需依赖饮食以及医疗补剂来补充[4].另外, 在制药工业中, 烟酸也作为一种重要的中间体被应用于维生素类药物的生产中.但目前合成烟酸的传统方法主要采用化学水解法, 存在反应条件苛刻, 收率偏低, 能耗和生产成本较高等问题[5].随着烟酸需求量的日益攀升, 腈水解酶生物催化法制备烟酸作为一种相对绿色环保的合成方式也越来越受到关注[6].
大肠杆菌高密度发酵(High Cell-Density Cultivation, HCDC)是一种利用特定的发酵策略, 提升罐内大肠杆菌的单位体积生物量, 从而高效获取重组蛋白的技术[7].除此之外, HCDC还能够减少发酵对培养体积的需求, 在恒定的固定资产成本、时间成本以及人力成本基础上实现更高的产量, 有效降低单位产品的生产成本, 显著提升产品竞争力. HCDC技术的实施, 能够提高酶的产量、降低生产成本, 更好地将腈水解酶应用于烟酸合成.
我们应用HCDC中pH-stat策略[7], 补料培养基的主要成分为葡萄糖, 利用大肠杆菌代谢葡萄糖产生乙酸的原理, 通过调控发酵过程的pH值来控制发酵过程.最后, 考虑到腈类化合物的毒性, 我们在生物转化过程中使用全细胞进行转化, 因此进一步考察了重组菌全细胞的催化特性, 并使用高密度发酵获得的菌体进行了3-氰基吡啶的批次投料转化合成烟酸, 以期为烟酸的大规模生物合成应用奠定基础.
1 实验部分 1.1 材料 1.1.1 菌株与质粒我们所使用菌株E.coli BL21(DE3)-NIT由实验室前期构建和保藏.
1.1.2 培养基LB培养基(g/L): Tryptone 10, Yeast extract 5, 氯化钠10.
种子培养基(g/L): Tryptone 20, Yeast extract 5, 氯化钠0.5, 氯化钾0.19, 氯化镁0.95, 葡萄糖3.6, 微量元素2 mL/L.
发酵培养基(g/L): Tryptone 20, Yeast extract 5, 氯化钠0.5, 氯化钾0.19, 氯化镁0.95, 葡萄糖10, 微量元素2 mL/L.
补料培养基(g/L):葡萄糖700, 硫酸镁14, 微量元素14 mL/L.
微量元素(g/L):硫酸锌0.58, 氯化铁6, 氯化钙0.2, 硫酸锰0.3, 氯化铜0.2, 乙二胺四乙酸0.5.
将上述培养基的pH值调整至7.0后在115 ℃条件下灭菌20 min, 氨苄青霉素采用0.22 μm滤膜过滤除菌.
1.1.3 试剂3-氰基吡啶、烟酸购于阿拉丁试剂有限公司, 氨苄青霉素购于上海生工生物工程有限公司, 胰蛋白胨和酵母粉购于Thermo Fisher公司, 葡萄糖标准液与生物传感分析仪缓冲剂购于山东省科学院生物研究所, 其余试剂购于国药集团化学试剂有限公司.
1.1.4 仪器7 L发酵罐系统、冷冻离心机, 艾本德中国有限公司; 电子天平、电子pH计、pH电极、DO电极, 梅特勒-托利多公司; 生物传感分析仪, 山东省科学院生物研究所; 高压蒸汽灭菌锅, 松下健康医疗器械株式会社; 生化培养箱、超净工作台, 上海博迅实业有限公司; 酶标仪, 美谷分子仪器有限公司; 高效液相色谱仪, Dionex公司; Atlantis dC18柱, WATERS公司.
1.2 实验方法 1.2.1 菌种活化将保藏在-80 ℃冰箱中的重组菌E.coli BL21(DE3)-NIT在固体种子平板上划线(固体培养基中添加氨苄抗性, 下同), 在生化培养箱中37 ℃培养12 h, 在活化平板上挑取长势较好的单克隆接种于种子培养基中, 置于旋转式摇床(下同)37 ℃、220 r/min条件下培养12 h并检测菌液酶活, 选取酶活最高的菌液制备成固体斜面保存.
1.2.2 种子制备将上述种子斜面上刮取单菌落接种至液体种子培养基中, 37 ℃、220 r/min培养8 h; 接入液体种子培养基中(2%接种量(V/V)), 37 ℃、220 r/min培养8 h.
1.2.3 pH-stat补料策略下的高密度发酵培养基中的葡萄糖在E. coli发酵时会被代谢产生乙酸, 致使pH下降; 而当葡萄糖被代谢完后, 大肠杆菌又会继续利用之前产生的乙酸作为碳源, 致使pH升高.因此, 我们通过使用pH-stat法补料, 在发酵液pH升高时反馈流加葡萄糖, 此时, 菌体代谢葡萄糖产生乙酸, 会使发酵体系的pH值下降; 而当pH低于一定限值时, 又通过流加氨水、提供氮源的同时, 中和体系中的乙酸, 提升罐内pH值, 使整个发酵过程的pH控制在一定范围内.
我们以培养基初始葡萄糖被完全耗尽作为分界点, 前期为分批发酵阶段, 后期为补料发酵阶段.发酵初始, 我们将先前制备的二级种子液按接入发酵培养基中(10%(V/V)接种量), 同时添加终浓度为100 μg/mL的氨苄青霉素, 控制发酵温度为37 ℃, 转速和通气量通过溶氧电极反馈的溶氧值来调节(考虑到实际应用, 发酵罐转速被控制在600 r/min以内), pH根据pH电极反馈的数据, 适量流加氨水来控制, 使发酵液pH不低于6.75, 整个发酵过程中定期取样, 检测发酵液中葡萄糖浓度(g/L), 菌浓(OD600)以及酶活(U/mL).在补料发酵阶段, 采用pH-stat补料策略, pH高于6.85则流加补料培养基, pH低于6.75则流加氨水.
1.2.4 催化性质考察最适温度:测定重组菌在20~60 ℃下的酶活, 其他条件保持不变, 设定50 ℃下的重组菌酶活为100%.
热稳定性:将静息细胞分别置于4、30、40、50和60 ℃中温浴, 设置初始的静息细胞酶活为100%, 定期取样检测残留酶活.以残留相对酶活的自然对数Ln(RA)对时间作图, 计算重组菌酶活的半衰期t1/2.
最适pH:在pH=4.0、4.6、5.2、5.8(柠檬酸-柠檬酸钠缓冲液)、pH=5.8、6.5、7.2、7.8(磷酸钠缓冲液(PBS))、pH=7.8、8.5、9.0(Tris-HCl缓冲液)的反应缓冲液条件下测定重组菌酶活, 设置pH 7.2条件下的酶活为100%.
pH稳定性:将静息细胞分别重悬在pH 6.5、7.2、7.8的PBS缓冲液保存在4 ℃条件下, 定期取样检测酶活, 设置初始静息细胞酶活为100%, 以残留相对酶活的自然对数Ln(RA)对时间作图, 计算重组菌酶活的半衰期.
金属离子:选取不同金属离子溶液添加至测活体系中, 在30 ℃温浴30 min, 其他条件保持不变, 金属离子终浓度设置为10 mmol/L, 在此条件下测定重组菌酶活, 选择不额外添加金属离子的反应体系酶活为100%.
有机溶剂:选取5%(V/V)和20%(V/V)终浓度的不同有机溶剂, 测定重组菌酶活, 设置不添加有机溶剂的反应体系的酶活为100%.
1.2.5 底物批次转化为了减少底物对重组菌酶活的抑制作用, 我们采用批次投料的方式来转化3-氰基吡啶.离心收集发酵菌体, 采用pH 7.2、100 mmol/L的磷酸钠缓冲液(PBS)重悬菌体并洗涤2~3次, 控制菌体生物量(Dry Cell Weight, DCW)为4.6 g/L, 生物转化实验采用100 mL生物转化体系, 以pH 7.2、100 mmol/L的磷酸钠缓冲液为反应介质, 选取200 mmol/L作为3-氰基吡啶的投料浓度, 30 ℃、220 r/min振荡反应, 通过HPLC检测转化体系中底物的残留情况, 并且在底物完全消耗完后进行下一批次的投料.
1.2.6 分析方法菌体生物量(DCW):使用紫外分光光度计测定菌体OD600(测定过程中将菌体密度稀释至OD值介于0.2~0.7, 再乘以稀释倍数获得最终结果), 再换算成细胞干重: 1 OD600=0.453 g /L.
葡萄糖浓度:使用生物传感分析仪.
生物转化反应过程:取200 μL菌液, 12 000 r/min离心1 min后弃上清, 用pH 7.2、0.1 mol/L PBS洗涤2次, 再用900 μL PBS悬浮菌体, 获得静息细胞.再将细胞置于30 ℃金属浴温浴5 min后加入100 μL、500 mmol/L的3-氰基吡啶, 30 ℃、120 r/min反应10 min.转化结束后取10 μL转化液通过苯酚-次氯酸钠法测定酶活.
腈水解酶在转化腈类底物合成羧酸的过程中, 同时也会按照等摩尔比产生氨气, 为此, 检测出氨含量也就能够获得理论上催化所产生的羧酸含量, 并由此来表征酶活性.通过Phenol-Hypochlorite法测定氨含量快速、灵敏、简便, 该反应过程中, 亚硝基铁氰化钠在碱性条件下催化氨先后与苯酚以及次氯酸钠生成蓝色可溶化合物, 该化合物在630 nm处紫外吸收强, 因此通过紫外分光光度计即可检测其生成量, 从而计算出羧酸的生成量[8].酶活(1 U)为在生物转化反应的标准条件下, 每分钟生成1 μmol产物烟酸(或氨)所需的酶量, 总酶活(U/mL)为每毫升发酵液中的细胞具有的酶活力单位.
HPLC检测: WATERS Atlantis dC18 column(5.0 μm, 250 mmol/L×4.6 mmol/L), Dionex Ultimate 3000;流动相: Acetonitrile/0.02% Trifluoroacetic acid(3:2);流速0.5 mL/min; 柱温30 ℃; 检测波长268 nm; 进样量2 μL.
2 结果与讨论 2.1 pH-stat法补料高密度发酵我们将菌种活化制备获得二级种子后, 接种至7 L发酵罐中开始发酵.分批发酵阶段, 菌体自然代谢葡萄糖使发酵液pH降低, 此时仅流加氨水控制pH不低于6.75.由图 1可知, 发酵进行4 h后, 葡萄糖已经基本耗尽, 此时开始进入补料发酵阶段, 并通过补料培养基与氨水的调控流加使pH稳定在6.8左右.发酵至83.5 h, 测得整个发酵过程的最高酶活为558.6 U/mL, 之后菌体生物量还在增长, 但酶活开始逐步下降, 可能是长时间发酵导致重组菌中的质粒出现部分丢失; 发酵时间延长至110 h时, 菌体浓度基本达到恒定, 此时, 发酵罐中的代谢物可能对菌体的生长代谢产生了明显的抑制作用, 最后补料的葡萄糖在罐中出现残留也证明菌体的代谢已经明显放缓, 整个发酵过程菌体OD600最高达到136.8, DCW为61.97 g/L.
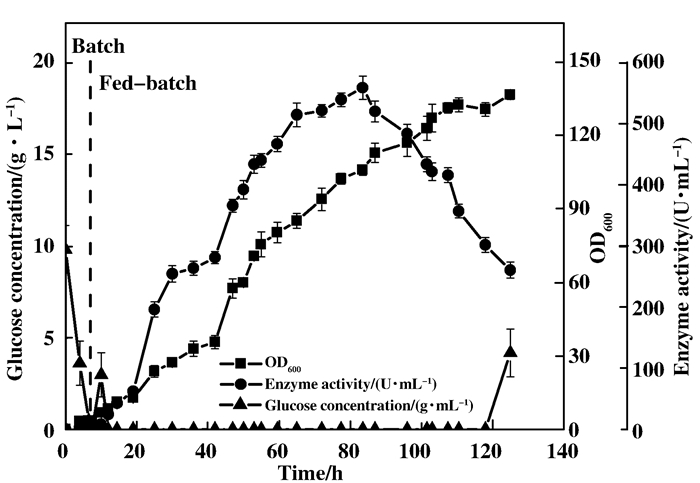
|
图 1 E.coli BL21(DE3)-NIT的pH-stat高密度发酵 Fig.1 High cell-density cultivation of E.coli BL21(DE3)-NIT based on pH-stat mode |
大肠杆菌的高密度发酵策略主要分为直接反馈控制、非直接反馈控制以及非反馈控制[7].在考虑发酵策略时, 我们认为pH-stat策略不需要对菌体的发酵情况进行深入了解, 对于发酵设备也没有很高的要求, 并且通过以葡萄糖作为补料培养基, pH值的变化能够实时反应菌体的碳源代谢情况, 从而判断发酵情况.因此, 最终选择了pH-stat方式作为我们的发酵策略, 实验结果也证明pH-stat策略确实能够帮助我们高效获取腈水解酶.
2.2 温度对重组菌E.coli BL21(DE3)-NIT酶活的影响为了评估生物催化剂的应用性能, 我们又对收集的重组菌细胞催化性质进行了考察.温度是生物催化剂反应速率的一个重要影响因素, 因此, 首先对重组菌的最适反应温度以及在不同温度下的酶活半衰期进行了评价.
如图 2, 当催化反应温度介于20~50 ℃范围内时, 随着温度的提升, 重组菌酶活也呈现出增长的趋势, 并在50 ℃时静息细胞酶活达到最高值, 该研究结果反映出细胞的最适反应温度为50 ℃, 高于文献报道的产腈水解酶的恶臭假单胞菌P. putida MTCC 5110 (35 ℃)[9]以及红球菌Rhodococcus sp. NDB1165(45 ℃)[10], 但低于拟无支酸菌Amycolatopsis sp. IITR 215(55 ℃)[11].温度的升高对重组菌酶活的促进作用也逐渐增强, 可能是由于温度升高的同时, 生物转化体系内的分子热运动加剧, 从而加速了底物与酶分子的接触反应; 而随着温度继续上升, 重组菌酶活开始下降, 可能是因为催化反应温度过高时, 酶分子的高级结构迅速解折叠, 使得高温对酶活的破坏作用超过了分子热运动所带来的促进作用, 使得酶活降低.
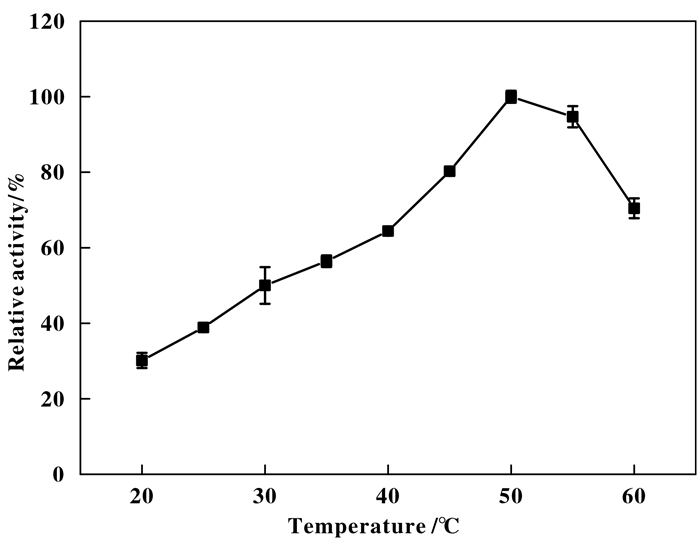
|
图 2 E.coli-BL21(DE3)-NIT在不同温度下的相对酶活 Fig.2 Relative enzyme activity of E.coli-BL21(DE3)-NIT under different temperatures |
接下来为了研究不同温度下重组菌的酶活半衰期, 我们将重组菌制备成静息细胞, 置于4、30、40、50和60 ℃温度下, 并间隔12 h取样测定酶活性(图 3).经计算, 重组菌全细胞在这些温度下的t1/2分别为177.7、150.7、64.2、22.9和7.0 h.考虑到在进行转化反应时, 除了温度以外, 来自底物的毒性作用也会对酶活有着不可逆的破坏作用, 因此我们在后期的批次转化投料实验中, 选取30 ℃作为反应温度.
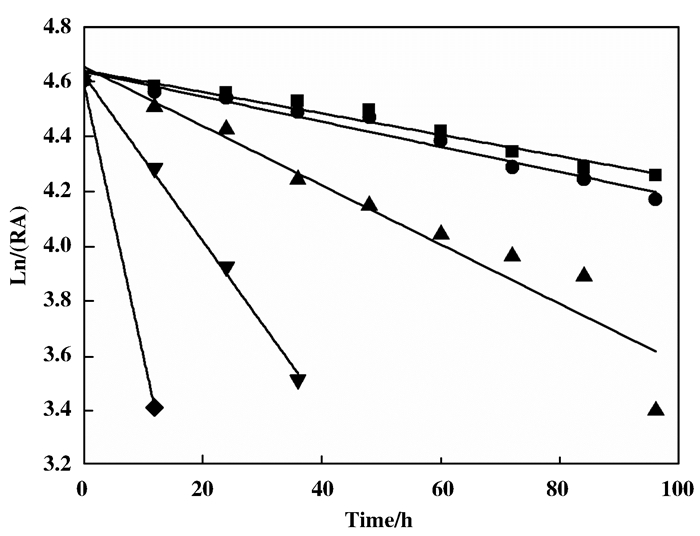
|
图 3 E.coli BL21(DE3)-NIT在4 ℃(■), 30 ℃(●), 40 ℃(▲), 50 ℃(▼)和60 ℃(◆)下的热稳定性 Fig.3 Thermostability of E.coli BL21(DE3)-NIT under 4 ℃ (■), 30 ℃(●), 40 ℃(▲), 50 ℃(▼) and 60 ℃(◆) |
pH也是酶催化反应中的一项重要参数, 我们考察了pH对重组菌的酶活以及酶活半衰期的影响.如图 4所示, 重组菌在pH 6.5、7.2、7.8的PBS缓冲液中均保持了相对较高的酶活, 其中在pH 7.2时酶活最高; 而在pH过高或过低的Tris-HCl缓冲体系和柠檬酸-柠檬酸钠缓冲体系中, 重组菌的酶活损失严重.另外, 重组菌在相同pH的不同缓冲液体系中表现出了较大的酶活差异, 这可能是由不同离子对重组菌酶活产生了不同的影响.

|
图 4 E.coli BL21(DE3)-NIT在不同pH下的相对酶活 Fig.4 Relative enzyme activity of E.coli BL21(DE3)-NIT under different pH (Tris-HCl(■), PBS(●) and Citricacid-Sodium citrate(▲)) |
如图 5所示, 在不同pH下重组菌酶活的半衰期实验中, 在pH 6.5、7.2、7.8下, 酶活半衰期分别为78.8、150.7和91.2 h.因此, 我们选择酶活和稳定性最好的pH 7.2作为后续转化研究的pH条件.
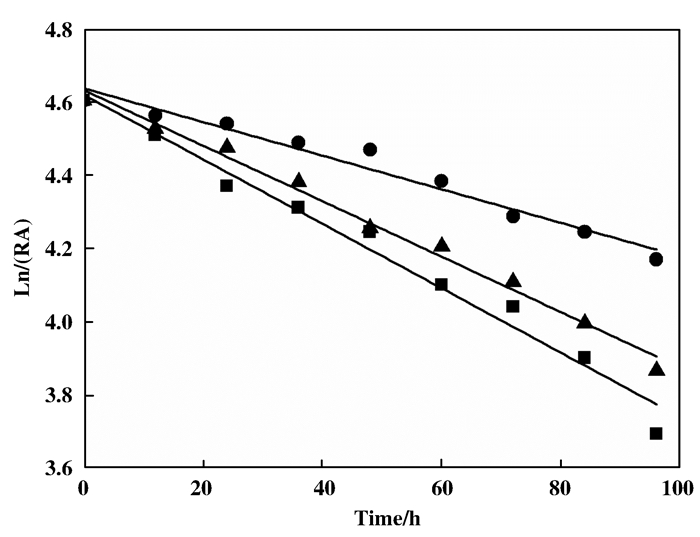
|
图 5 E.coli BL21(DE3)-NIT在pH 6.5(■), 7.2(●)和7.8(▲)下的酶活稳定性 Fig.5 pH stability of E.coli BL21(DE3)-NIT under pH 6.5(■), 7.2(●) and 7.8(▲) |
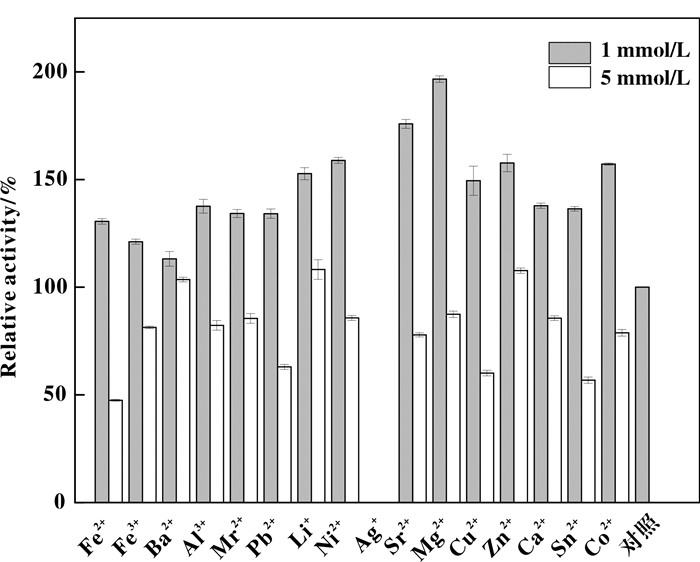
金属离子对生物催化剂也会产生重要影响, 我们考察了亚铁离子、铁离子、钡离子、铝离子、锰离子、铅离子、锂离子、镍离子、银离子、锶离子、镁离子、铜离子、锌离子、钙离子、锡离子、钴离子分别在反应体系内终浓度1和5 mmol/L的条件下, 重组菌酶活的差异.
如图 6, 在不同浓度和金属离子的环境条件下, 重组菌酶活产生了明显差异.其中, 在银离子存在下, 重组菌完全检测不到酶活, 这与腈水解酶的催化机制相符, 银离子属于巯基结合试剂, 能够结合腈水解酶催化三联体中的Cys, 使其完全丧失酶活, 而来自于P. abyssi[12]和F. solani O1[13]的腈水解酶的实验结果也与本研究基本一致; 另外, 锂、镍、镁、锡、钴等离子表现出对重组菌酶活较好的促进作用, 提升幅度超过了50%, 其中1 mmol/L镁离子对酶活的促进作用最显著, 提升幅度达到97%;当金属离子终浓度达到5 mmol/L时, 酶活均出现了不同程度的下降.
|
图 6 E.coli BL21(DE3)-NIT在1 mmol/L(■)和5 mmol/L (□)的不同金属离子下的相对酶活 Fig.6 Relative enzyme activity of E.coli BL21(DE3)-NIT under 1 mmol/L(■) and 5 mmol/L(□) of different metal ions |
在腈水解酶的底物谱中, 多种腈类底物在水中的溶解度较差, 在一些转化反应中, 可能需通过添加一些有机助溶剂来促进底物的溶解以加速反应.因此, 我们也选取了一些常见的有机溶剂(甲醇、乙醇、1, 2-丙二醇、正丁醇、正戊醇和二氯甲烷), 考察5%(V/V)和20%(V/V)浓度下对重组菌酶活的影响.由图 7可知, 甲醇、正丁醇、正戊醇和二氯甲烷在两种浓度下均表现出对重组菌酶活强烈的抑制作用, 特别是在正丁醇和正戊醇存在下, 酶活几乎完全丧失.然而, 1, 2-丙二醇在两种浓度下均能提升酶活, 相对酶活分别达到114%和138%.

|
图 7 E.coli BL21(DE3)-NIT在5%(V/V)(■)和20% (V/V)(□)的不同有机溶剂下的相对酶活 Fig.7 Relative enzyme activity of E.coli BL21(DE3)- NIT under 5%(V/V)(■) and 20%(V/V)(□) of different organic reagents |
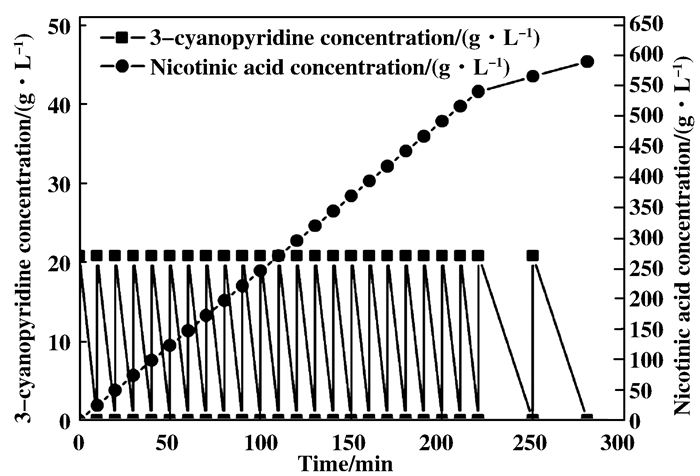
为研究该重组菌的转化潜能, 我们考察了静息细胞对3-氰基吡啶的生物转化情况.将发酵液中菌体离心分离并制备静息细胞, 转入100 mL转化体系, 以pH 7.2、100 mmol/L的磷酸钠缓冲液为反应介质, 以200 mmol/L 3-氰基吡啶为投料浓度, 在30 ℃、220 r/min条件下完成批次转化.
如图 8所示, 在280 min内转化了24批次的3-氰基吡啶, 烟酸终浓度达到了590 g/L.其中, 在前22批的投料反应中, 底物均在10 min内被完全转化, 之后转化速度明显下降, 最后两批底物均在30 min内完成转化, 通过HPLC检测转化体系中无底物残留.
|
图 8 利用E.coli BL21(DE3)-NIT进行批次投料转化合成烟酸 Fig.8 Fed-batch mode for synthesis of nicotinic acid with E.coli BL21(DE3)-NIT |
我们为降低生产成本和提高工艺效率, 对产腈水解酶的E.coli BL21(DE3)-NIT进行了pH-stat补料高密度发酵, 重组大肠杆菌最高DCW达到了61.97 g/L, 最高酶活达到了558.6 U/mL.并且, 通过对重组菌在不同环境条件下催化性质的研究, 对该酶的催化潜能有了更深入的了解, 为工艺优化以及应用提供了数据支撑.最后, 我们考察了该菌株对3-氰基吡啶的转化能力, 通过批次投料反应, 重组菌静息细胞在280 min内转化获得了590 g/L的产物, 是截至目前文献报道的生物法合成烟酸最高水平.然而, 高密度发酵周期仍然偏长, 培养基条件对于工业应用也有待进一步优化, 未来研究可从这两方面进一步提升该腈水解酶的应用潜力, 以更好地适应工业化生产的需要.
| [1] | Charles B. Catalysis in the nitrilase superfamily[J]. Curr Opin Struc Biol, 2002, 12(6): 775–782. DOI:10.1016/S0959-440X(02)00387-1 |
| [2] | Helen C P, Charles B. The nitrilase superfamily:Classification, structure and function[J]. Genome Biol, 2001, 2(1): 1–9. |
| [3] |
a. Gong J S, Lu Z M, Li H, et al. Metagenomic technology and genome mining: Emerging areas for exploring novel nitrilases[J]. Appl Micro Biotechnol, 2013, 97(15): 6603-6611. b. Zheng Li-na(郑丽娜), Xin Jia-ying(辛嘉英), Wang Yan(王艳), et al. Research progress on the influence of microwave on enzyme-catalyzed reactions and the microwave effect(微波对酶催化反应的影响及其微波效应的研究进展)[J]. J Mol Catal(China)(分子催化), 2017, 31(6): 567-574. |
| [4] | Chuck R. Technology development in nicotinate production[J]. Appl Catal A-Gen, 2005, 280(1): 75–82. DOI:10.1016/j.apcata.2004.08.029 |
| [5] | Dong T T, Gong J S, Gu B C, et al. Significantly enhanced substrate tolerance of Pseudomonas putida nitrilase via atmospheric and room temperature plasma and cell immobilization[J]. Biore Technol, 2017, 244(1): 1104–1110. |
| [6] | Velankar H, Clark K G, Preez R D, et al. Developments in nitrile and amide biotransformation processes[J]. Trends Biotechnol, 2010, 28(11): 561–569. DOI:10.1016/j.tibtech.2010.08.004 |
| [7] | Lee S Y. High cell-density culture of Escherichia coli[J]. Trends Biotechnol, 1996, 14(3): 98–105. DOI:10.1016/0167-7799(96)80930-9 |
| [8] | Gong J S, Li H, Zhu X Y, et al. Fungal His-tagged nitrilase from Gibberella intermedia:Gene cloning, heterologous expression and biochemical properties[J]. PLoS ONE, 2012, 7(11): e50622. DOI:10.1371/journal.pone.0050622 |
| [9] | Banerjee A, Kaul P, Banerjee U C. Enhancing the catalytic potential of nitrilase from Pseudomonas putida for stereoselective nitrile hydrolysis[J]. Appl Micro Biotechnol, 2006, 72(1): 77–87. DOI:10.1007/s00253-005-0255-8 |
| [10] | Prasad S, Misra A, Prakash V J, et al. A propionitrile-induced nitrilase of Rhodococcus sp. NDB 1165 and its application in nicotinic acid synthesis[J]. World J Micro Biot, 2007, 23(3): 345–353. DOI:10.1007/s11274-006-9230-5 |
| [11] | Babu V, Shilpi , Choudhury B. Nitrile-metabolizing potential of Amycolatopsis sp. ⅡTR215[J]. Proce Biochem, 2010, 45(6): 866–873. DOI:10.1016/j.procbio.2010.02.008 |
| [12] | Mueller P, Egorova K, Vorgias C E, et al. Cloning, overexpression, and characterization of a thermoactive nitrilase from the hyperthermophilic archaeon Pyrococcus abyssi[J]. Prote Expre Purif, 2006, 47(2): 672–681. DOI:10.1016/j.pep.2006.01.006 |
| [13] | Vejvoda V, Kaplan O, Bezouska K, et al. Purification and characterization of a nitrilase from Fusarium solani O1[J]. J Mol Catal B-Enzym, 2008, 50(2/4): 99–106. |
 2019, Vol. 33
2019, Vol. 33


