甲醛是典型的室内空气污染物之一, 广泛存在于建筑材料、装饰材料和家具中, 释放周期长达15年[1].甲醛对人类身体健康有着极大的危害, 且在2004年由国际癌症研究机构列为危害人类健康的致癌和致畸物质[2].臭氧也是一种常见的大气污染物, 主要来源于室外的光化学反应, 并会通过气体交换进入室内; 同时, 室内高压电器运行时也会释放臭氧.臭氧对呼吸系统具有破坏性, 导致支气管炎及肺气肿, 并会提高死亡率[3-4].世界卫生组织建议的甲醛和臭氧的准则值分别为0.10 mg/m3(30 min平均值)和100 μg/m3(8 h平均值)[5].但实际生活中, 这两种污染物浓度常常超标, 对人体造成伤害.因此, 实现二者室温下同时催化去除, 对去除室内空气污染具有重要意义.
锰氧八面体分子筛(octahedral molecular sieves, OMS)是继沸石型四面体分子筛之后又一受到大量关注和研究的分子筛材料, 其具有独特的物理化学性质和多孔结构, 可广泛用于化学传感和储能材料以及催化剂[6-8].隐钾锰矿型锰氧八面体分子筛(Cryptomelane-type OMS, OMS-2)是隧道结构为[2×2]的OMS材料, 其孔径为0.46 nm, 且隧道中心包含有钾离子(K+)作为此材料骨架的支撑[9]. OMS-2材料中仅含有少量的3价锰离子(Mn3+), 大部分的锰元素以4价锰离子(Mn4+)的形式存在. OMS-2材料中的多孔隧道型结构和混合化学态在各种不同类型的氧化还原反应的转化率和选择性方面起到重要的作用.而且, OMS-2材料具有较强的吸水性, 其表面容易吸附水分子形成活性较强的表面羟基集团, 有助于深度氧化反应的进行.
我们采用回流法、无溶剂法及水热法合成3种OMS-2催化剂, 研究催化剂表面性质对室温同时去除甲醛和臭氧的催化活性的影响, 并考察了其在水气条件下的催化活性, 还采用了多种催化剂表征手段探讨OMS-2材料的物理化学性质影响催化活性的机理.
1 实验部分 1.1 催化剂的制备无溶剂法:称取9.48 g高锰酸钾和22.05 g乙酸锰, 在玛瑙研钵中充分研磨3 h.然后将混合物加入聚乙烯瓶并密封, 80 ℃干燥4 h得到黑色粉末.然后去离子水冲洗过滤, 所得粉末在80 ℃下干燥12 h, 并在450 ℃下焙烧2 h, 此样品记为OMS-2-S.
回流法:称取6.32 g高锰酸钾溶于150 mL去离子水中, 形成高锰酸钾溶液.称取14.71 g乙酸锰溶于40 mL去离子水中, 然后量取4 mL质量分数为36%的乙酸溶液, 两者在三口烧瓶中混合均匀, 并在100 ℃下回流30 min.将之前制备的高锰酸钾溶液缓慢滴入三口烧瓶, 得到黑色浆状混合物.继续回流24 h后, 所得混合物过滤并用去离子水洗涤数次.所得固体在80 ℃干燥12 h后, 450 ℃焙烧2 ℃, 所得样品, 记为OMS-2-R.
水热法:首先, 将6.32 g高锰酸钾溶于100 mL去离子水中, 记为溶液A.其次, 将14.71 g乙酸锰同样溶于100 mL去离子水中, 记为溶液B.第3步, 将溶液B滴入溶液A中, 继续磁力搅拌.然后, 将所得混合溶液装入水热釜中, 在100 ℃水热反应24 h.过滤混合物并用去离子水洗涤数次, 所得沉淀物在80 ℃下干燥12 h, 然后450 ℃下焙烧2 h, 所得样品, 记作OMS-2-H.
1.2 催化剂的表征催化剂的晶体结构使用德国布鲁克公司的Bruker D8 Advance X射线衍射仪进行测定.衍射仪的激发靶为铜靶(Cu Kα), 波长λ为0.154 06 nm; 工作电压为40 kV, 工作电流为20 mA.测试时, 扫描范围为10° ~ 80°, 且扫描速度为6°/min.
氮气吸脱附实验使用美国麦克公司TriStar Ⅱ 3020全自动比表面积及孔隙度分析仪.测试前, 催化剂样品粉末在200 ℃进行脱气处理3 h.采用BET方法计算催化剂的比表面积, 采用BJH方法计算催化剂的孔容积, 及孔径分布曲线.
催化剂的形貌特征使用美国FEI公司生产的Sirion2000场发射扫描电子显微镜来观察, 场发射电子的真空加速电压设定为5 kV.
样品的表面元素构成及化学价态使用日本岛津Kratos公司的Axis UltraDLD光谱仪进行分析, 测试结果使用污染碳的标准结合能(C 1s 284.6 eV)进行校准.
氢气程序升温还原在美国麦克公司ChemiSorb 2720系统上进行.称取20 mg OMS-2催化剂, 氦气气氛下200 ℃脱气1 h; 降至室温后, 通入30 mL/min的5%氢氩混合气, 以10 ℃/min的升温速率加热至800 ℃.
1.3 催化剂活性评价催化活性测试在固定床反应器中进行.将50 mg粒径0.450~0.280 mm的催化剂样品用石英棉固定在内径为6 mm的U型石英管中, 用热电偶记录催化剂床层温度.实验中反应气流流速为100 mL/min, 故可得其体积空速为220 000 h-1, 质量空速为120 000 mL/(h·gcat).反应中, 气态甲醛通过多聚甲醛的解聚获得, 浓度稳定在60 ppm, 臭氧通过紫外臭氧发生装置产生, 浓度为240 ppm.通过调节鼓泡器气体流量可调控反应气流的相对湿度.通过气相色谱(天美GC7900P, FID检测器)对反应尾气中CO和CO2进行测量; 通过臭氧分析仪(赛默飞世尔Model 49i)检测反应尾气中臭氧浓度.
整个实验反应过程中, 甲醛分解的最终含碳产物有且仅有两种, 一氧化碳和二氧化碳.因此, 催化活性评价试验中, 甲醛的转化率CHCHO、二氧化碳的生成率SCO2和臭氧的分解率DO3可以由以下公式进行计算.
| $ {C_{HCHO}} = 1 - \frac{{{{[HCHO]}_{out}}}}{{{{[HCHO]}_{in}}}} = \frac{{{{[CO]}_{out}} + {{\left[ {C{O_2}} \right]}_{out}}}}{{{{\left[ {C{O_2}} \right]}_{in}}}} $ | (1) |
| $ {S_{C{O_2}}} = \frac{{{{\left[ {C{O_2}} \right]}_{out}}}}{{{{[CO]}_{out}} + {{\left[ {C{O_2}} \right]}_{out}}}} $ | (2) |
| $ D_{O_{3}}=1-\frac{\left[O_{3}\right]_{o u t}}{\left[O_{3}\right]_{i n}} $ | (3) |
上式中, [HCHO]in和[HCHO]out分别为催化反应器入口气流和出口气流中的甲醛浓度; [CO2]in是入口气流中甲醛完全氧化生成的二氧化碳的浓度; [CO]out和[CO2]out则分别是催化反应后出口气流中包含的甲醛分解生成的一氧化碳和二氧化碳的浓度; [O3]in和[O3]out分别是反应前臭氧的初始浓度和反应后尾气中残留的臭氧浓度.
2 结果与讨论 2.1 晶体结构与形貌特征不同方法制备的OMS-2催化剂的XRD图谱如图 1所示.显然, 3种OMS-2催化剂具有相同的衍射峰, 并与隐钾锰矿型OMS-2材料(JCPDS No. 29-1020)一致, 为典型的四方相(I4/m)晶型; 且3种材料均为纯相[10].从图中可知, OMS-2-S的衍射峰强度最低, 半峰宽最宽, 具有最低的结晶度和较小的晶体尺寸.通过Scherrer公式计算可知, OMS-2-R、OMS-2-S和OMS-2-H 3种催化剂的平均晶粒尺寸分别为10.2、5.0和10.7 nm.此结果表明, 不同的制备方式对OMS-2催化剂的结晶度和晶粒尺寸存在一定的影响; OMS-2-S催化剂粒径最小, 可以暴露更多的活性位, 有助于反应物的吸附和分解.
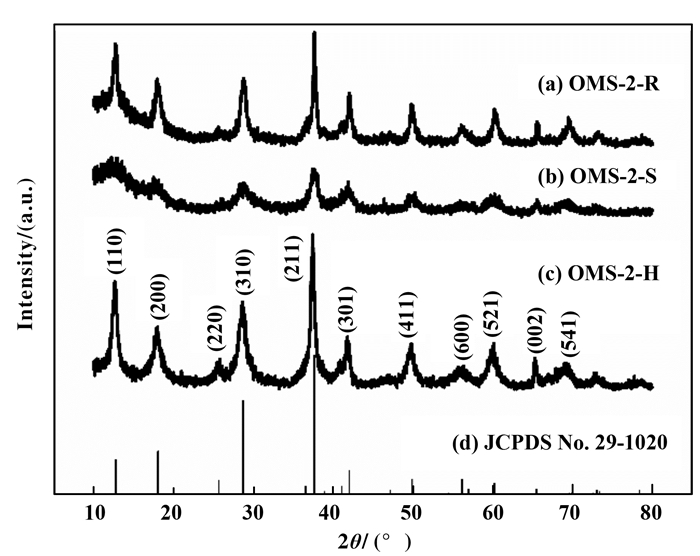
|
图 1 不同方法制备的OMS-2催化剂的XRD图谱 Fig.1 XRD patterns of OMS-2 catalysts synthesized by different methods |
图 2是3种OMS-2催化剂的SEM照片, 可见其形貌均为一维棒状, 且团聚形成复杂的表面孔道结构.但3种OMS-2催化剂纳米棒的长度和直径各不相同. OMS-2-S纳米棒较小的长度和直径也说明了OMS-2-S的结晶度较低, 暴露面积较高, 有利于反应物的吸附和反应.

|
图 2 不同方法制备的OMS-2催化剂的场发射扫描电镜照片 Fig.2 FE-SEM images of OMS-2 catalysts with different preparation methods |
图 3是不同方法制备的OMS-2催化剂样品的氮气吸脱附曲线和相应的孔径分布曲线.如图 3(a)所示, 3种OMS-2催化剂样品的氮气吸脱附曲线均出现回滞环, 可归属于Ⅱ型等温线[11].如图 3(b)所示, OMS-2-S催化剂的孔径明显集中在5~25 nm这一范围中, 并在10 nm处达到峰值, 说明合成的OMS-2-S催化剂表面孔道结构为均一的介孔结构, 有利于反应物分子在催化剂表面的扩散, 有助于催化反应的发生.
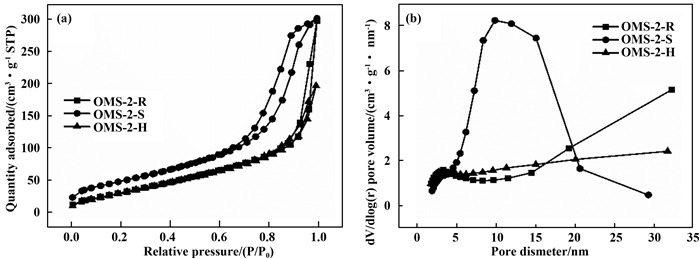
|
图 3 不同方法制备的OMS-2催化剂的氮气吸脱附曲线(a)和孔径分布曲线(b) Fig.3 N2 physisorption isotherm and pore size distribution of OMS-2 catalysts prepared by different methods |
表 1总结了不同方法制备的OMS-2催化剂的物理结构参数.从表中可知, OMS-2-S催化剂具有最大的BET面积和孔容积, 分别为180 m2/g和0.47 cm3/g. OMS-2-R和OMS-2-H催化剂具有相近的BET面积, 分别为134和131 m2/g. OMS-2-S催化剂较大的比表面积能够增加催化剂对反应物的吸附能力, 促进催化反应的进行.
| 表 1 OMS-2催化剂的结构参数 Table 1 Textural properties of OMS-2 catalysts |
不同方法制备的OMS-2催化剂的XPS测试结果如图 4所示. 图 4(a)显示了3种方法制备的OMS-2催化剂的XPS全光谱.除了无定形的碳元素(C 1s)外, 钾(K 2s、K 2p)、锰(Mn 3s、Mn 2p)、氧(O 1s)等元素的特征芯能级光电子发射谱也在全光谱中出现.因此, 3种OMS-2催化剂表面均存在K、Mn、O 3种元素.
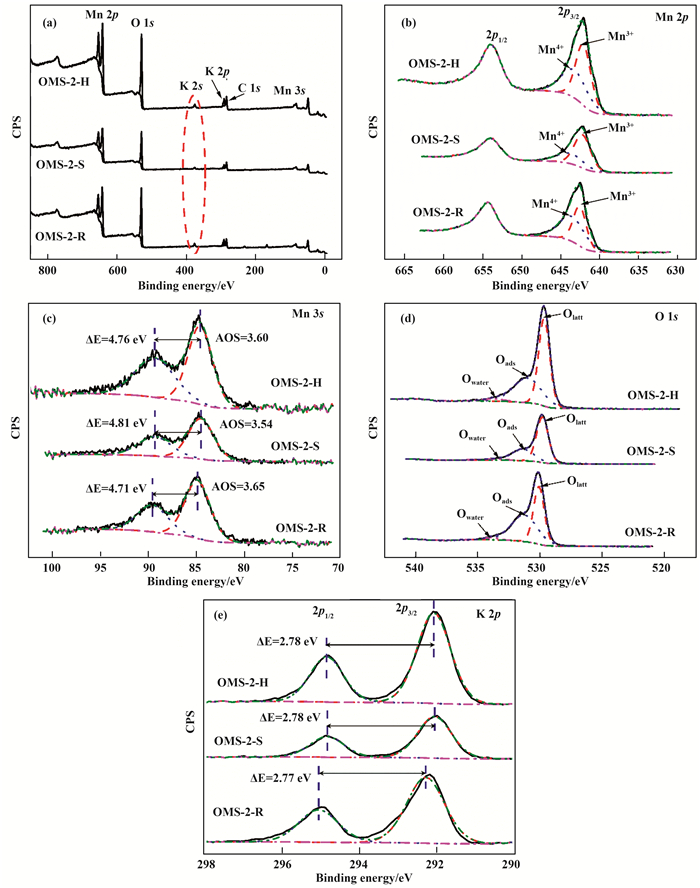
|
图 4 不同方法制备的OMS-2催化剂的XPS图谱 Fig.4 XPS full survey spectra (a), high resolution Mn 2p (b), Mn 3s (c), O 1s (d), and K 2p (e) of OMS-2 catalysts prepared by different methods |
图 4(b)显示了3种OMS-2催化剂的Mn 2p芯能级谱, 其自旋分裂为两个峰Mn 2p3/2和Mn 2p1/2.由于Mn 2p1/2更高结合能位置并未出现Mn2+导致的低信号强度的卫星峰, 故而认为催化剂中仅存在Mn3+和Mn4+两种锰离子[12].对Mn 2p3/2区域进行分峰拟合, 得到结合能范围为642.10~642.56 eV和643.26~643.86 eV两个峰, 其分别归属于Mn3+和Mn4+; 其相对含量及比例如表 2所示[13].从表 2中可知, OMS-2-S催化剂具有最高的Mn3+/Mn4+比.而根据电荷平衡, OMS-2材料中出现Mn3+时, 会伴随着氧空位的出现, 如下式所示[14].
| $ 4\text{M}{{\text{n}}^{4+}}+{{\text{O}}^{2-}}\to 4\text{M}{{\text{n}}^{4+}}+2{{\text{e}}^{-}}/\square +0.5{{\text{O}}_{2}}\to 2\text{M}{{\text{n}}^{4+}}+2\text{M}{{\text{n}}^{3+}}+\square +0.5{{\text{O}}_{2}} $ | (4) |
| 表 2 不同方法制备的OMS-2催化剂的XPS结果 Table 2 XPS Result of measurement in the OMS-2 catalysts prepared by different methods |
式中“□”代表晶格中O2-逃逸生成的阴离子空位, 即氧空位.
图 4(c)显示了3种OMS-2催化剂的Mn 3s芯能级光电子谱图, 其自旋轨道分裂能ΔEMn3s如表 2所示, 并可根据以下公式计算3种OMS-2催化剂的平均氧化态AOS[14]:
| $ A O S=8.956-1.126 \times \Delta E_{M n 3 s} $ | (5) |
因此, OMS-2-S催化剂具有最低的平均氧化态, 与其具有最高的Mn3+/Mn4+比结果相一致, 说明其表面具有丰富的氧空位.
由图 4(d)所示, 3种OMS-2催化剂的O 1s能谱均可解卷积为3个谱峰, 分别归属于催化剂表面存在的3种表面氧物种.根据文献[13, 15], 结合能位于529.68~530.10 eV的O 1s谱峰属于表面晶格氧物种(Olatt); 结合能位于531.01~531.39 eV的O 1s谱峰可归属于低配位的表面吸附氧物种(Oads), 如属于表面氧缺陷的O22-、O-或羟基集团OH等; 而结合能位于533.55~533.91 eV的O 1s谱峰则可认为是表面吸附的少量水分子.显然, 表面晶格氧物种和表面吸附氧物种是3种OMS-2催化剂表面主要的物种, 而表面吸附的水分子可以忽略不计.表面吸附氧物种与表面晶格氧物种之比Oads/Olatt结果如表 2所示, OMS-2-S催化剂上最高; 这表明OMS-2-S催化剂具有最丰富的表面吸附氧物种, 与其具有最丰富Mn3+和氧空位的结果是一致的, 因为臭氧和氧气分子在氧化物表面通常吸附在氧空位上[16].并且表面吸附氧物种比表面晶格氧物种具有更高的表面迁移率, 这在室温催化氧化反应中具有重要作用[15].
OMS-2催化剂的K 2p芯能级谱类似于Mn 2p芯能级谱, 如图 4(e)所示, 同样包括两个自旋轨道分裂峰, K 2p1/2和K 2p3/2, 且无可观测到的卫星峰[17]. 3种OMS-2催化剂的自旋轨道分裂能ΔEK2p基本相同, 说明其处于相同的配位环境中.
2.4 催化剂的氧化还原性能图 5是不同方法制备的OMS-2催化剂的H2-TPR测试结果, 催化剂在测试后均变为绿色粉末, 说明OMS-2催化剂最终还原为MnO. OMS-2-S和OMS-2-H催化剂上具有3个还原峰, 分别对应于MnO2→Mn2O3, Mn2O3→Mn3O4, Mn3O4→MnO的3步还原过程[18-19]; 而OMS-2-R的两个还原峰则对应MnO2→Mn3O4, Mn3O4→MnO的两步还原过程[18-19]. OMS-2-S催化剂3个还原峰均表现出最低的还原温度, 表明OMS-2-S催化剂上锰物种具有最强的可还原性, 表面氧物种最活泼具有最强的可移动性.
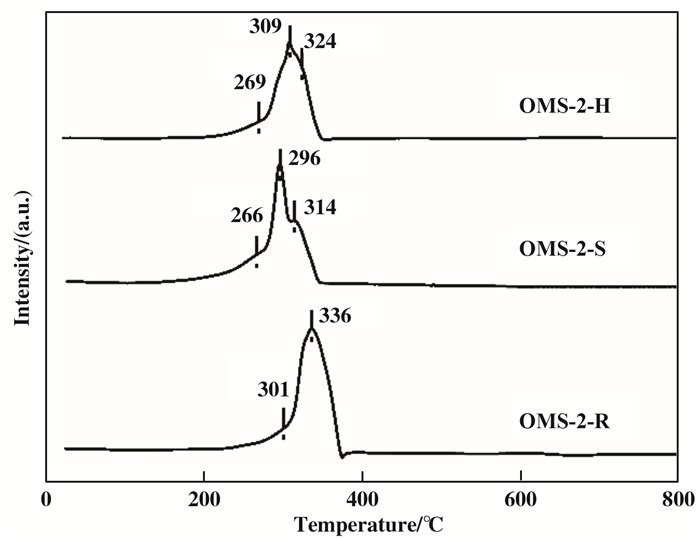
|
图 5 不同方法制备的OMS-2催化剂的氢气程序升温还原曲线 Fig.5 H2-TPR curves of OMS-2 catalysts prepared by different methods |
图 6是不同制备方法合成的OMS-2催化剂室温同时去除甲醛和臭氧的活性评价结果, 包括干空气工况和50%RH工况.实验中, 甲醛氧化分解的产物仅有CO和CO2.因此, CO和CO2的产率之和为100%;由于CO2是甲醛完全氧化的产物, 下文中仅对CO2产率进行描述.
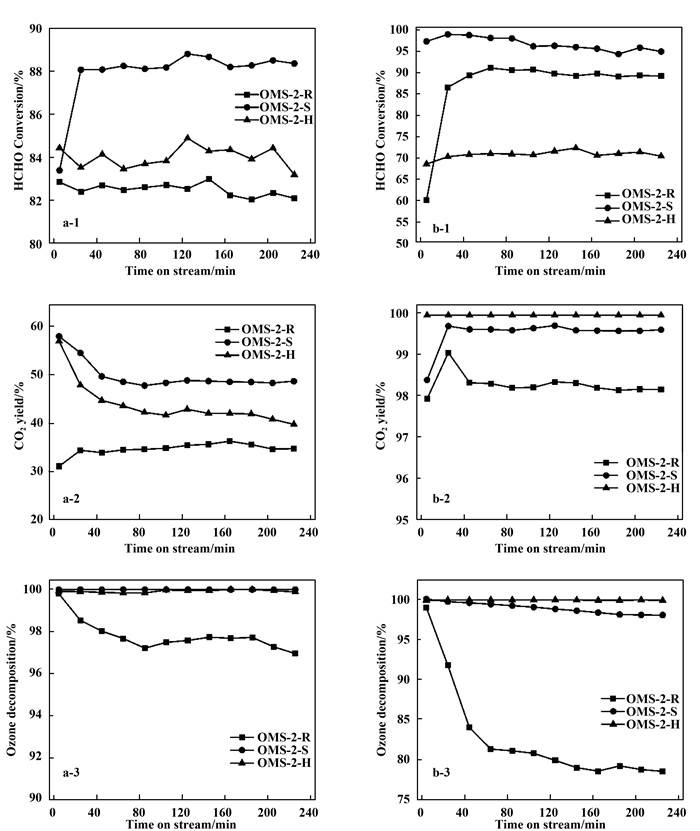
|
图 6 干空气(a)和50%RH(b)工况下OMS-2催化剂的甲醛转化率、二氧化碳产率和臭氧分解率 Fig.6 HCHO Conversion, CO2 yield, and O3 decomposition over OMS-2 catalysts under dry air (a) and 50%RH (b) conditions Reaction conditions: room temperature, 60ppm of HCHO, 240 ppm of O3, GHSV=120 000 mL·(gcat·h)-1. |
如图 6a所示, 干空气工况下室温同时去除甲醛和臭氧的催化活性测试中, 无溶剂法制备的OMS-2-S催化剂明显表现出最高的反应活性, 其甲醛转化率为~88.5%、二氧化碳产率为~48.6%、而臭氧分解率则达到100%. OMS-2-H催化剂活性次之, 而OMS-2-R催化剂活性最低. OMS-2-S催化剂上丰富的氧空位促进臭氧在其表面的分解, 并利用臭氧分解过程中生成的活性氧物种氧化甲醛生成CO、CO2和H2O.
而50%RH工况中, 如图 6b所示, OMS-2-S催化剂的甲醛转化率依然最高为95.1%;并且由于水气的加入, 二氧化碳产率也上升到99.6%;但臭氧分解率略有下降, 为98.3%.这可能是由于水气加入占据催化剂表面吸附位点, 阻碍了臭氧的吸附分解; 同时, 吸附的水分子与催化剂表面吸附的臭氧或活性氧物种反应生成羟基物种, 促进甲醛的完全氧化.
OMS-2-S催化剂具有更大的比表面积及Mn3+/Mn4+比, 说明其上具有更多的反应活性位, 可以吸附臭氧分解形成丰富的活性氧物种; 同时, 此催化剂表面氧物种具有最好的可移动性, 有利于氧物种与甲醛分子的反应.因此, OMS-2-S催化剂室温下具有最好的同时催化去除甲醛和臭氧的活性.
3 结论采用无溶剂法、固相法和水热法制备的3种隐钾锰矿型锰氧八面体分子筛OMS-2催化剂, 对其在干空气工况及50%RH工况下室温同时催化去除甲醛和臭氧的反应进行活性评价; 并对催化剂物理化学性质进行表征, 构建其与催化活性之间的联系; 主要结论如下:
(1) OMS-2-S催化剂在干空气和湿空气条件下, 均具有最高的HCHO转化率, 分别为88.5%和95.1%;且在干空气条件下具有最优的CO2产率和O3分解率, 分别为48.6%和100%;水气的加入不仅提高了其HCHO转化率, 还将其CO2产率提升至99.6%, 但同时其O3分解率降至98.3%.
(2) OMS-2-S催化剂较大的比表面积、丰富的氧空位和表面吸附氧物种, 以及表面氧物种较高的可移动性是其具有优异的催化活性的原因.
(3) 水气的加入可促进甲醛完全氧化过程的进行, 但存在与甲醛或臭氧竞争吸附的问题.
| [1] |
a. Salthammer T, Mentese S, Marutzky R. Formaldehyde in the indoor environment[J]. Chem Rev, 2010, 110(4): 2536-2572. b. Wu Zhi-jian(吴志坚), Fan Ze-yun(范泽云), Yao Xin(姚鑫), et al. Influence of environmental humidity on Au/Co3O4 catalytic property for formaldehyde oxidation at room temperature(反应气中的湿度对Au/Co3O4室温催化氧化甲醛的影响)[J]. J Mol Catal(China)(分子催化), 2017, 31(1): 22-29. |
| [2] | World Health organization/international agency for research on cancer. IARC monographs on the evaluation of carcinogenic risks to humans. Volume 88: Formaldehyde, 2-butoxyethanol and 1-tert-butoxypropan-2-ol[M]. 2004. |
| [3] | Weschler C J. Ozone in indoor environments:concentration and chemistry[J]. Indoor Air, 2000, 10(4): 269–288. DOI:10.1034/j.1600-0668.2000.010004269.x |
| [4] | Weschler C J. Ozone's impact on public health:Contributions from indoor exposures to ozone and products of ozone-initiated chemistry[J]. Environ Health Persp, 2006, 114(10): 1489–1496. DOI:10.1289/ehp.9256 |
| [5] | World Health Organization. WHO guidelines for indoor air quality: Selected pollutants[M]. 2010. |
| [6] | Shen Y F, Deguzman R N, Zerger R P, et al. Synthesis of manganese oxide octahedral molecular sieves (OMS)[M]//Tadashi H, Tatsuaki Y. Studies in Surface Science and Catalysis (Volume 83). Elsevier. 1994. 19-24. |
| [7] | Yuan J K, Laubernds K, Zhang Q H, et al. Self-assembly of microporous manganese oxide octahedral molecular sieve hexagonal flakes into mesoporous hollow nanospheres[J]. J Chem Soc, 2003, 125(17): 4966–4967. DOI:10.1021/ja0294459 |
| [8] | Li Y Z, Fan Z Y, Shi J W, et al. Modified manganese oxide octahedral molecular sieves M'-OMS-2(M'=Co, Ce, Cu) as catalysts in post plasma-catalysis for acetaldehyde degradation[J]. Catal Today, 2015, 256(1): 178–185. |
| [9] | Dharmarathna S, Suib S L. Porous Cryptomelane-type Manganese Oxide Octahedral Molecular Sieves (OMS-2); Synthesis, Characterization and Applications in Catalysis[M]//Spivey J. Metal nanoparticles for catalysis: advances and applications. Royal society of chemistry, 2014. 235-250. |
| [10] | Espinal A E, Zhang L C, Chen C H, et al. Nanostructured arrays of semiconducting octahedral molecular sieves by pulsed-laser deposition[J]. Nat Mater, 2010, 9(1): 54–59. |
| [11] | Thommes M, Kaneko K, Neimark A V, et al. Physisorption of gases, with special reference to the evaluation of surface area and pore size distribution (IUPAC Technical Report)[J]. Pure Appl Chem, 2015, 87(9/10): 1051–1069. |
| [12] | Santos V P, Soares O S, Bakker J J, et al. Structural and chemical disorder of cryptomelane promoted by alkali doping:Influence on catalytic properties[J]. J Catal, 2012, 293(1): 165–174. |
| [13] | Wang J L, Yunus R, Li J G, et al. In situ synthesis of manganese oxides on polyester fiber for formaldehyde decomposition at room temperature[J]. Appl Surf Sci, 2015, 357(1): 787–794. |
| [14] | Jia J B, Zhang P Y, Chen L. Catalytic decomposition of gaseous ozone over manganese dioxides with different crystal structures[J]. Appl Catal B-Environ, 2016, 189(1): 210–218. |
| [15] | Sun M, Li W P, Zhang B T, et al. Enhanced catalytic performance by oxygen vacancy and active interface originated from facile reduction of OMS-2[J]. Chem Engineer J, 2018, 331(1): 626–635. |
| [16] | Ma J Z, Wang C X, He H. Transition metal doped cryptomelane-type manganese oxide catalysts for ozone decomposition[J]. Appl Catal B-Environ, 2017, 201(1): 503–510. |
| [17] | Ousmane M, Perrussel G, Yan Z, et al. Highly selective direct amination of primary alcohols over a Pd/K-OMS-2 catalyst[J]. J Catal, 2014, 309(1): 439–452. |
| [18] | Liu X S, Jin Z N, Lu J Q, et al. Highly active CuO/OMS-2 catalysts for low-temperature CO oxidation[J]. Chem Engineer J, 2010, 162(1): 151–157. |
| [19] | Sun H, Chen S, Wang P, et al. Catalytic oxidation of toluene over manganese oxide octahedral molecular sieves (OMS-2) synthesized by different methods[J]. Chem Engineer J, 2011, 178(1): 191–196. |
 2019, Vol. 33
2019, Vol. 33


