醇氧化为对应的羰基化合物是最广泛的官能团转换反应之一[1], 在工业批量生产、精细化工品和香料合成等领域都具有重要意义[2-3].通常该反应使用氧化锰、氧化铬、高价碘等化学计量的氧化剂, 易产生含有重金属元素废弃物, 环境污染大, 且反应容易发生过氧化[4]. 5-羟甲基糠醛(5-HMF)同时具有羟基和醛基官能团, 是开发生物质资源综合利用最具价值的中间体.特别是将5-HMF选择性氧化成2, 5-二甲酰基呋喃(2, 5-DFF), 在化学品合成、药物合成、精细化学品、杀虫剂以及液体燃料等领域具有广泛的应用前景, 是目前研究最为深入的5-HMF转化反应之一.近年来, 基于2, 2, 6, 6-四甲基哌啶氧自由基(2, 2, 6, 6-tetramethylpiperidine-1-oxyl, TEMPO)的有机小分子催化体系氧化5-HMF制备2, 5-DFF得到了较大的发展[5-6]. TEMPO自由基催化体系具有高稳定性、高效性、高选择性以及反应条件温和等特点[7], 被广泛应用于2, 5-DFF的合成.然而传统的均相催化体系存在TEMPO催化剂难以回收、循环利用以及产物需分离提纯等问题.因此开发基于TEMPO自由基的高效、高选择性制备2, 5-DFF的异相催化体系具有重要的研究意义.
共轭微孔聚合物(conjugated microporous polymers, CMPs)是一类具有微孔结构、较高比表面、高化学稳定性和热稳定性的有机多孔材料.通过设计多样化的单体结构单元, 多个课题组合成出具有结构多样性的功能化CMPs, 在气体吸附/储存[8]、有毒污染物捕获[9]、传感器[10-11]、光电子[12]、催化[13-14]等领域具有潜在的应用前景[15]. Cooper课题组[16]首先报道了利用含有芳香炔烃和芳香卤素的单体通过Sonogashira-Hagihara偶联反应, 合成了一系列具有不同骨架结构的CMPs.此后, 该课题组将Re, Rh, Ir金属离子通过与CMPs骨架单体的含N基团锚定, 合成出了一系列金属-有机共轭微孔聚合物(MO-CMPs), 其中CMP-CpIr3共轭微孔聚合物可作为还原胺化异相催化剂, 然而该课题组并未报到该催化剂的循环催化性能[17]. Jiang等[18]选用金属卟啉单元为活性位点, 开发出第一例基于CMP的催化体系(FeP-CMP).对CMP进行功能化的FeP-CMP作为催化剂,使得反应选择性达99%, 转化率达99%, 为催化应用的发展奠定了基础.
我们采用有机单体侧链引入催化活性位点策略, 将TEMPO自由基共价嫁接到2, 5-二溴苯甲酸侧链, 并与四(4-乙炔基苯)甲烷通过Sonogashira偶联反应, 构筑TEMPO自由基功能化CMP.利用扫描电子显微镜(SEM)、红外吸收光谱(FT-IR)和核磁共振谱(NMR)等技术研究了所合成CMP-4-TEMPO的形貌和结构.通过气相色谱(GC)和NMR研究CMP-4-TEMPO催化氧化5-HMF转化为2, 5-DFF性能.催化氧化5-HMF为2, 5-DFF,结果表明CMP-4-TEMPO在温和反应条件下可将5-HMF高效、高选择性氧化成2, 5-DFF. CMP-4-TEMPO催化剂循环利用10次仍保持较高的转化率, 是优异的醇选择性氧化异相催化剂.
1 实验部分 1.1 主要实验仪器及药品实验仪器:扫描电子显微镜(HITACHI S-4800, SEM); 傅里叶红外光谱仪(FT-IR); X射线粉末衍射仪(Rigaku Ultima Ⅳ XRD); 核磁共振波谱仪(AVANCE Ⅲ 400M NMR); 气相色谱仪(GC-9160);电子顺磁共振波谱仪(ELEXSYS Ⅱ EPR); 气-质联用色谱仪(GC-MS3200).
实验药品:四苯基甲烷, 液溴, 氯仿, 二甲基亚砜(DMSO), 三苯基磷, 碘化亚铜(CuI), 双(三苯基磷)二氯化钯(Pd(PPh3)2Cl2), 二异丙胺, 无水硫酸钠(Na2SO4), 四氢呋喃(THF), 三乙胺(TEA), 四(三苯基磷)钯(Pd(PPh3)4), 2, 5-二溴苯甲酸, 四丁基氟化铵(TBAF), 甲苯(Toluene), 亚硝酸叔丁酯(TBN), 苯甲醇, 苯甲醛, 4-氨基-2, 2, 6, 6-四甲基哌啶氧自由基(4-NH2-TEMPO), 丙酮, 乙酸乙酯, 对硝基苯, 无水甲醇, 甲苯, 三氟甲苯, 乙腈均为分析纯, 水(实验室二次蒸馏水).
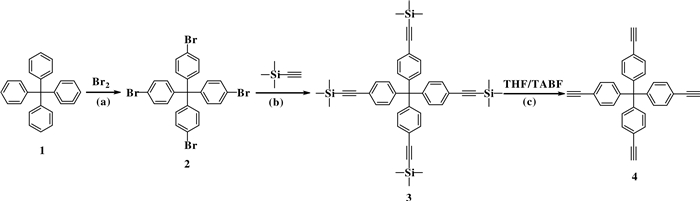
1.2 CMPs单体合成 1.2.1 四(4-乙炔基苯)甲烷(4)的合成1) 四(4-溴苯基)甲烷(2)的合成参照文献[19]:带支口圆底烧瓶加入四苯基甲烷(1.5 g, 15.6 mmol), 缓慢加入液溴(6 mL, 117.1 mmol), 搅拌20 min.用100 mL乙醇进行稀释, 再继续搅拌30 min.将沉淀物过滤, 在氯仿和乙醇(1:1 v/v, 200 mL)的混合物中煮沸10 min.待溶液冷却至室温, 将沉淀的固体过滤真空干燥, 即得到6.6 g白色固体产物四(4-溴苯基)甲烷, 产率约为66%. 1H NMR (400 MHz, CDCl3): (ppm) 7.39 (d, 8H) 7.01 (d, 8H). 13C NMR (400 MHz, CDCl3): 144.44, 132.37, 131.09, 120.82, 63.65. 2)合成四(4-((三甲基甲硅烷基)乙炔基)苯基)甲烷(3):氮气保护下将四(4-溴苯基)甲烷2.0 g(3.14 mmol), 三苯基磷143.81 mg(0.55 mmol), CuI 59.8 mg(3.14 mmol), 双(三苯基磷)二氯化钯220.4 mg(3.14 mmol), 加入三甲基乙炔基硅烷(6 mL)二异丙胺(25 mL)加入反应瓶, 超声溶解, 搅拌加热至80 ℃, 回流24 h.反应完全后, 冷却至室温, 加入二氯甲烷, 抽滤, 滤饼经柱色谱以分离纯化(洗脱剂:正己烷:二氯甲烷=30:1), 收集产物, 旋干获得白色固体, 0.87 g, 产率40%. 1H NMR (400 MHz, CDCl3): (ppm) 7.35 (d, 8H) 7.06 (d, 8H), 0.26 (s, 36H). 13C NMR(400 MHz, DMSOd6) : (ppm) 146.38, 131.93, 130.96, 120.21, 98.46, 64.78, 53.52, -0.3. 3)合成四(4-乙炔基苯)甲烷(4):四(4-((三甲基甲硅烷基)乙炔基)苯基)甲烷(0.57 g, 0.81 mmol), 四丁基氟化铵(0.86 g, 3.27 mmol), 溶于THF(14 mL), 室温下搅拌反应2 h.反应完全后, 向棕褐色反应液中加入饱和氯化铵溶液, 旋去四氢呋喃, 抽滤, 滤饼溶于二氯甲烷, 经柱色谱以分离纯化(洗脱剂:正己烷)收集产物, 旋干获得白色固体(0.24 g), 产率71 %. 1H NMR (400 MHz, DMSOd6): (ppm) 7.45 (d, 8H) 7.13 (d, 8H), 4.22 (s, 4H). 13C NMR(400 MHz, DMSOd6) : (ppm) 146.38, 131.93, 130.97, 120.31, 83.46, 81.58, 64.79.
1.2.2 2, 5-二溴-N-(2, 2, 6, 6-四甲基哌啶)苯甲酰胺(Br2-Ph-TEMPO, 7)的合成化合物7的合成参照之前我们课题组已发表工作[20]:将二氯亚砜(16 mL)加入装有2, 5-二溴苯甲酸(5.37 g, 19.2 mmol)的50 mL圆底烧瓶中, 80 ℃下搅拌, 冷凝回流1.5 h.反应完成后旋干, 获得中间产物2, 5-二溴苯甲酰氯(6).加入干燥二氯甲烷(20 mL)溶解.将上述溶液在冰浴条件下缓慢滴加入含有三乙胺(3.32 mL)和4-氨基-TEMPO(2.74 g, 16 mmol)的二氯甲烷溶液(30 mL).滴加完毕, 室温反应24 h.反应完全后, 旋干溶剂经柱色谱以分离纯化(洗脱剂:正己烷:乙酸乙酯=3:1), 收集产物, 获得橘黄色固体6.03 g (7), 产率为87%. MALDI-TOF-MS m/z:理论m/z 432.99, [M+H]+:实际m/z 433.01. 1H NMR (400 MHz, CDCl3): (ppm) 8.38 (d, 1H), 7.62 (d, 1H), 7.20 (s, 1H), 1.79 (m, 2H), 1.42 (m, 2H), 1.10 (d, 12H). 13C NMR(400 MHz, CDCl3): (ppm) 165.47, 141.75, 135.19, 133.99, 131.73, 128.92, 121.13, 117.25, 58.47, 45.13. 33.24, 20.25 (由于Br2-Ph-TEMPO自由基具有顺磁效应, 因此核磁谱添加苯肼作为还原剂).
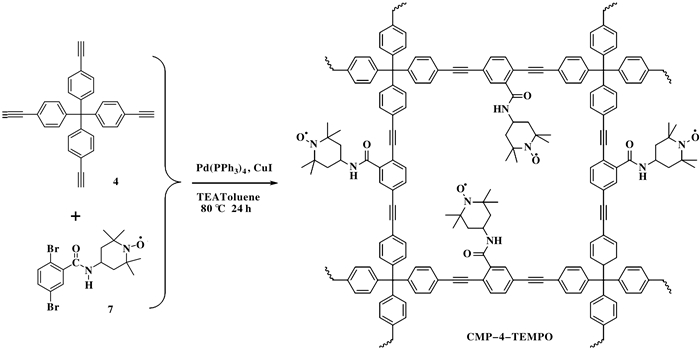
1.3 TEMPO自由基功能化CMP-4-TEMPO的合成将四(4-乙炔基苯)甲烷(156 mg, 0.375 mmol), Br2-Ph-TEMPO(215.5 mg, 0.5 mmol), 四(三苯基磷)钯(33 mg, 0.03 mmol), 碘化亚铜(12 mg, 0.06 mmol)溶于三乙胺(2 mL)和甲苯(3 mL)中, 氮气保护下80 ℃搅拌24 h.冷却至室温, 将产物分别依次用氯仿、甲醇、丙酮和乙酸乙酯洗涤, 直至洗液无色, 60 ℃真空干燥得到棕黄色固体(263 mg).
1.4 CMP-4-TEMPO催化氧化5-HMF性能测试将5-HMF(10 μL, 0.1 mmol)加入含有CMP-4-TEMPO(10 mg)催化剂的反应瓶, 加三氟甲苯(0.5 mL)、亚硝酸叔丁酯(TBN, 3 μL), 置于80 ℃烘箱反应6 h, 自然冷却, 加入内标物(对硝基苯, 0.1 mmol)离心分离, 移除固体催化剂, 通过GC-MS(气-质联用色谱仪)对液相中反应产物进行分析检测, 计算5-HMF转化为2, 5-呋喃二甲醛的转化率和选择性.
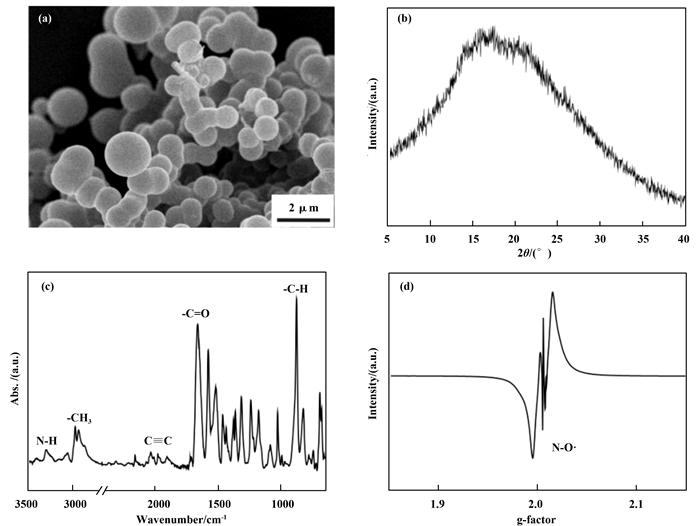
2 结果与表征 2.1 CMP-4-TEMPO形貌及结构表征共轭微孔聚合物(CMPs)具有骨架结构可设计性, 通过设计不同空间结构的CMPs单体以及单体侧链嫁接官能团等策略, 不仅能够合成空间网络结构复杂的CMPs, 还可在CMPs孔道内引进特定官能团, 合成出具有特殊功能性的CMPs.我们选择具有四面体结构的四(4-乙炔基苯)甲烷(4)为CMPs的有机单体, 如图 3所示, 利用Sonogashira偶联反应, 与侧链含有TEMPO自由基的2, 5-二溴-N-(2, 2, 6, 6-四甲基哌啶)苯甲酰胺(Br2-Ph-TEMPO, 7)有机单体反应, 合成出TEMPO自由基修饰的CMP, 即CMP-4-TEMPO.如图 1所示, 以四苯基甲烷为起始原料, 经过溴化反应, 与三甲基乙炔基硅烷偶联以及硅烷基团脱保护, 成功合成出目标CMP有机单体四(4-乙炔基苯)甲烷.另一有机单体Br2-Ph-TEMPO可通过2, 5-二溴苯甲酸与二氯亚砜反应形成2, 5-二溴苯甲酰氯(6), 随后与4-氨基-TEMPO反应获得.通过HNMR, 红外表征以及单晶结构表征, 确认所合成产物为四(4-乙炔基苯)甲烷(4)和Br2-Ph-TEMPO(7).四(4-乙炔基苯)甲烷(4)和Br2-Ph-TEMPO (7)在四(三苯基磷)钯, 碘化亚铜为催化剂, 在三乙胺和甲苯下反应24 h可获得棕黄色固体, 即CMP-4-TEMPO.扫描电子显微镜(SEM)照片(图 4a)显示CMP-4-TEMPO具有微球结构, 尺寸在1~2 μm.从粉末X-射线衍射(PXRD)结果(图 4b)可以看出CMP-4-TEMPO为无定型固体.该结果与其他类型的CMPs结果相符合, 即Sonogashira偶联反应速率的不可控性, 生成的产物无定型聚合物, 无特殊晶体结构.从傅里叶变换红外光谱图中(图 4c)可以清晰观察到分别来源于Br2-Ph-TEMPO单体的特征峰, 如N—H伸缩振动峰(3400 cm-1), CH3振动峰(2980 cm-1)以及羰基振动峰(1700 cm-1), 来源于四(4-乙炔基苯)甲烷炔基振动峰(2100 cm-1)与以及苯环的C—H弯曲振动峰(890 cm-1)和C—C骨架振动峰(1200~1450 cm-1).在固体顺磁电子共振谱图(图 4d, EPR)中可观察到g-因子为1.996~2.001处具有明显的峰, 证明所合成的CMP-4-TEMPO含有氮氧自由基.由于TEMPO自由基被限域于交联网络中, TEMPO无法自由移动, 因此其峰型有别于溶液态TEMPO自由基清晰的三重峰形态.
|
图 1 四(4-乙炔基苯基)甲烷(4)合成示意图. Fig.1 Schematic diagram of synthesis of tetrakis(4-ethynylphenyl) methane (4) Reaction conditions: (a) Br2, stirring at room temperature for 20 minutes; (b) PPh3, Pd(PPh3)2Cl2, CuI, diisopropylamine, 24 h reflux; (c) TBAF, THF, stirring at room temperature for 2 h |

|
图 2 2, 5-二溴-N-(2, 2, 6, 6-四甲基哌啶)苯甲酰胺(7)合成示意图 Fig.2 Schematic diagram of Synthesis of 2, 5-dibromo-n -(2, 2, 6, 6-tetramethylpiperidine) benzamide (7) Reaction conditions: (a) SOCl2, 80 ℃, 1.5 hours; (b) dry DCM, triethylamine, 4-NH2-TEMPO, room temperature, 24 hours. |
|
图 3 CMP-4-TEMPO合成路线示意图 Fig.3 Synthetic route diagram of CMP-4-TEMPO |
|
图 4 CMP-4-TEMPO形貌及结构表征 Fig.4 Morphology and structure characterization of CMP-4-TEMPO : (a)SEM照片; (b)粉末XRD图谱; (c)FT-IR图谱; (d)固态EPR图谱 (a) SEM image; (b) powder XRD pattern; (c) FT-IR spectrum; (d) solid state EPR spectrum |
由于CMP-4-TEMPO含有TEMPO自由基, 有望成为醇选择性氧化的异相催化剂.以5-HMF选择性氧化生成2, 5-二甲酰基呋喃为模型反应, 考察CMP-4-TEMPO在不同反应条件下的催化性能.如表 1所示, 催化体系溶剂对CMP-4-TEMPO的催化性能影响较大, 三氟甲苯和甲苯为溶剂时, CMP-4-TEMPO对5-HMF的催化性能最好, 而在乙腈、甲氧基环戊烷、2-甲基呋喃、[Bmim][BF4]离子液体和水等溶剂时催化性能较差, 故后续的反应均以三氟甲苯为溶剂.
| 表 1 不同溶剂下CMP-4-TEMPO催化氧化5-HMF转化为2, 5-DFF催化性能 Table 1 Catalytic performanceof CMP-4-TEMPO toward the oxidation of 5-HMF to 2, 5-DFF in different solvents |
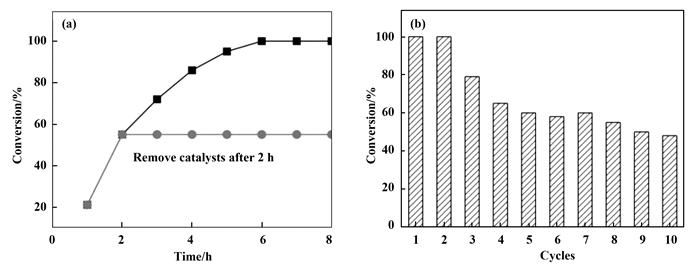
为了研究CMP-4-TEMPO催化动力学, 记录了不同反应时间5-HMF转化为2, 5-DFF的转化率.如图 5a所示, 反应进行2 h, 5-HMF的转化率即达到53%;反应进行至5 h, 5-HMF转化率达95%;当反应进行至6 h, 5-HMF完全转化成2-DFF.反应继续延长至8 h, GC-MS和高效液相色谱均仅检测到2, 5-DFF, 未检测到2, 5-呋喃二甲酸或5-甲醛基呋喃-2-甲酸, 表明CMP-4-TEMPO具有优异的选择性.为了证明CMP-4-TEMPO为异相催化剂, 反应进行2 h后将CMP-4-TEMPO固体通过离心分离, 在相同条件下让滤液继续进行反应.结果表明5-HMF转化率未发生变化.上述结果不仅证明CMP-4-TEMPO为异相催化剂, 更进一步表明CMP-4-TEMPO具有优异的稳定性, 催化反应不会产生游离的TEMPO自由基活性物种.此外, 我们还考察了CMP-4-TEMPO循环催化性能(如图 5b).待第1轮催化反应完成后, 将CMP-4-TEMPO离心分离, 用无水乙醇洗涤烘干后直接用于第2次催化反应.相同催化条件下, CMP-4-TEMPO第2次催化性能与第1次相当, 即6 h可实现5-HMF完全转化.循环利用第3次时, CMP-4-TEMPO催化5-HMF生成2, 5-DFF的转化率仍高达80%.继续延长CMP-4-TEMPO使用次数, 发现当循环到第5次时, 转化率为60%.之后为了获得较为满意的转化率, 需要将反应时间延长至10 h.可能的原因是CMP-4-TEMPO外表面的TEMPO自由基部分失活, 利用内部的TEMPO需要更长的物种扩散时间.
|
图 5 CMP-4-TEMPO催化5-HMF转化率与反应时间关系(a)及CMP-4-TEMPO循环催化性能(b) Fig.5 (a) Relationship between conversion rate of 5-HMF catalyzed by CMP-4-TEMPO and reaction time; (b) catalytic performance of CMP-4-TEMPO cycle Note that in order to achieve acceptable conversion rate, longer reaction time is required (10 h) after 5 times used of CMP-4-TEMPO catalysts |
尽管TEMPO自由基被固载化于CMPs, CMP-4-TEMPO催化5-HMF转化成2, 5-DFF的机理与TEMPO自由基均相体系催化氧化醇相似, 其催化机理如图 6所示.首先利用四(4-乙炔基苯)甲烷(4)和Br2-Ph-TEMPO(7)单体合成的CMP-4-TEMPO含有大量TEMPO自由基官能团.由于CMP-4-TEMPO为2~3 μm的微球, 其较高的外表面积布满高密度的TEMPO自由基活性位点.如图 6所示, TBN在加热条件下释放出NO2, 并将CMP-4-TEMPO表面TEMPO自由基氧化成TEMPO鎓离子, 同时NO2被还原成NO.而NO可被空气或氧气氧化成NO2. TEMPO鎓离子将5-HMF氧化成2, 5-DFF, 自身转化成TEMPO自由基, 从而完成催化循环.

|
图 6 CMP-4-TEMPO催化5-HMF转化成2, 5-DFF的机理 Fig.6 Mechanism of conversion of 5-HMF to 2, 5-DFF by CMP-4-TEMPO |
通过设计含有TEMPO自由基功能化的有机单体Br2-Ph-TEMPO(8)和四面体构型的四(4-乙炔基苯)甲烷(4), 利用Sonogashira偶联反应, 成功合成出TEMPO自由基功能化的CMP-4-TEMPO微孔有机聚合物. FT-IR和XRD结果表明CMP-4-TEMPO为上述两种单体聚合形成的无定型有机聚合物. SEM结果显示CMP-4-TEMPO为2~3 μm微球; 固态EPR谱表明CMP-4-TEMPO含有大量TEMPO自由基. CMP-4-TEMPO可将5-HMF高效、高选择性催化氧化成2, 5-DFF, 且催化剂循环利用3次仍具有较高的转化率. CMP-4-TEMPO优异的催化性能得益于其高比表面的微球结构具有丰富的固载化TEMPO自由基活性位点.鉴于TEMPO自由基被广泛应用于各类醇的选择性氧化, 因此CMP-4-TEMPO有望成为醇选择性氧化的高效、高选择以及可循环利用的异相催化剂.
| [1] |
a. Dhakshinamoorthy A, Alvaro M, Garcia H. Aerobic oxidation of benzylic alcohols catalyzed by metal-organic frameworks assisted by TEMPO[J]. ACS Catal, 2011, 1(1): 48-53. b. Zhang Nan(张楠), Li Jian-min(李建民), Liu Hai-jin(刘海津), et al. Preparation of Ag-Pd/g-C3N4 and selective oxidation of benzyl alcohol in aqueous solution (Ag-Pd/g-C3N4的制备及在水溶液中选择性氧化苯甲醇) [J]. J Mol Catal(China)(分子催化), 2019, 33(1): 75-82. c. Yan Huai-pu(闫怀普), Zhang Yue-cheng(张月成), Zhang Hong-yu(张宏宇), et al. One-pot tandem aerobic oxidation / knoevenagel condensation reaction catalyzed by magnetic nanoparticles Fe3O4@PEI@Ru(OH)x(磁性纳米粒子Fe3O4@PEI@Ru(OH)x催化的分子氧氧化醇-克脑文格尔串联反应) [J]. J Mol Catal(China)(分子催化), 2018, 32(2): 117-125. |
| [2] |
a. Parmeggiani C, Matassini C, Cardona F. A step forward towards sustainable aerobic alcohol oxidation: new and revised catalysts based on transition metals on solid supports[J]. Green Chem, 2017, 19(9): 2030-2050. b. Wang Xiao-li(王晓丽), Wu Gong-de(吴功德), Liu Xian-feng(刘献锋), et al. Selective oxidation of glycerol to glyceric acid catalyzed by supported nanosized Au/Cr2O3(负载型纳米Au/Cr2O3催化甘油氧化合成甘油酸) [J]. J Mol Catal(China)(分子催化), 2017, 31(4): 334-340. c. Li He-jian(李和健), Wu Cang-cang(吴藏藏), Zheng Li(郑丽), et al. Selective catalytic oxidation of benzyl alcohol over Cu-BTC and its derivatives(Cu-BTC及其衍生物在苯甲醇选择氧化反应中的催化活性) [J]. J Mol Catal(China)(分子催化), 2017, 31(4): 341-347. d. Zhu Jing(朱靖), Wang Yan-ping(王彦平), Li Zhe(李哲). The complete oxidation of ethanol over porous Pd/TiO2 -Al2O3 catalysts(多孔Pd/TiO2 -Al2O3催化剂上乙醇完全氧化的研究) [J]. J Mol Catal(China)(分子催化), 2017, 31(1): 1-10. |
| [3] |
a. Shang Jie(尚洁), Zhao Wen-jun(赵文军), Wang Xu(王旭), et al. Benzyl alcohol is oxidized into corresponding aldehyde or ketone by iodine in acetic acid (乙酸中碘催化氧化苄醇为相应醛或酮) [J]. J Mol Catal(China)(分子催化), 2010, 24(5): 406-410. b. Wang Jiang(王奖), Xu Ai-ju(徐爱菊), Jia Mei-lin(贾美林), et al. Gold supported on Mg-Al layered double hydroxides for selective oxidation of alcohols: the effect of Mg/Al mole ratio(Mg-Al类水滑石负载金催化醇选择氧化中Mg / Al比例的影响) [J]. J Mol Catal(China)(分子催化), 2017, 31(1): 11-21. |
| [4] | Wang Shi-yu(王时雨), Li Ming-hua(李明华), Xue Shan-shan(薛姗姗), et al. Advances in the application of nitrogen-oxygen free radicals(氮氧自由基的应用研究进展)[J]. Chemistry(化学通报), 2017, 80(11): 1002–1008. |
| [5] | Huang Bin(黄斌), Zhang Ning(张宁), Hong San-guo(洪三国), et al. Progress in molecular oxygen oxidation of organic compounds catalyzed by nitrogen-oxygen free radicals(氮氧自由基催化有机物的分子氧氧化研究进展)[J]. J Mol Catal(China)(分子催化), 2009, 23(04): 377–385. |
| [6] | Yu Yi-ling(余依玲), Gao Bao-jiao(高保娇), Li Yan-fei(李艳飞), et al. Catalytic performance of a co-catalyst containing TEMPO/immobilized schiff base copper complex in the oxidation of benzyl alcohol by molecular oxygen(TEMPO/固载化席夫碱铜配合物共催化剂在分子氧氧化苯甲醇过程中的催化性能)[J]. J Mol Catal(China)(分子催化), 2014, 28(3): 210–217. |
| [7] | Yang Guan-yu(杨贯羽), Guo Yan-chun(郭彦春), Wu Guang-hui(武光辉), et al. Nitrogen-oxygen free radical TEMPO:A highly efficient organic small molecule catalyst for the selective oxidation of alcohols(氮氧自由基TEMPO:选择氧化醇的高效有机小分子催化剂)[J]. Prog Chem(化学进展), 2007, 19(11): 1727–1735. |
| [8] | Deblase C R, Dichtel W R. Moving Beyond Boron:The emergence of new linkage chemistries in covalent organic frameworks[J]. Macromolecules, 2016, 49(15): 5297–5305. DOI:10.1021/acs.macromol.6b00891 |
| [9] | Alsbaiee A, Smith B J, Xiao L, et al. Rapid removal of organic micropollutants from water by a porous β-cyclodextrin polymer[J]. Nature, 2015, 529(7585): 190–194. |
| [10] | Das G, Biswal B P, Kandambeth S, et al. Chemical sensing in two dimensional porous covalent organic nanosheets[J]. Chem Sci, 2015, 6(7): 3931–3939. DOI:10.1039/C5SC00512D |
| [11] | Chen L, Honsho Y, Shu S, et al. Light-harvesting conjugated microporous polymers:Rapid and highly efficient flow of light energy with a porous polyphenylene framework as antenna[J]. J Am Chem Soc, 2010, 132(19): 6742–6748. DOI:10.1021/ja100327h |
| [12] | Xu Y, Jin S, Xu H, et al. Conjugated microporous polymers:Design, synthesis and application[J]. Chem Soc Rev, 2013, 42(20): 8012–8031. DOI:10.1039/c3cs60160a |
| [13] | Lin G, Ding H, Yuan D, et al. A pyrene-based, fluorescent three-dimensional covalent organic framework[J]. J Am Chem Soc, 2016, 138(10): 3302–3305. DOI:10.1021/jacs.6b00652 |
| [14] | Chen L, Yang Y, Guo Z, et al. Highly efficient activation of molecular oxygen with nanoporous metalloporphyrin frameworks in heterogeneous systems[J]. Adv Mater, 2011, 23(28): 3149–3154. DOI:10.1002/adma.v23.28 |
| [15] | Slater A G, Cooper A I. Porous materials function-led design of new porous materials[J]. Science, 2015, 348(6238): 8075–10. DOI:10.1126/science.aaa8075 |
| [16] | Jiang J X, Su F, Trewin A, et al. Conjugated microporous poly(aryleneethynylene) networks[J]. Angew Chem Int Ed, 2010, 119(45): 8728–8732. |
| [17] | Jiang J, Wang C, Laybourn A, et al. Metal-organic conjugated microporous polymers[J]. Angew Chem Inter Edit, 2011, 123(5): 1072–1075. |
| [18] | Chen L, Yang Y, Jiang D. CMPs as scaffolds for constructing porous catalytic frameworks:A built-in heterogeneous catalyst with high activity and selectivity based on nanoporous metalloporphyrin polymers[J]. J Am Chem Soc, 2010, 132(26): 9138–9143. DOI:10.1021/ja1028556 |
| [19] | Zhou B, Hu X, Zeng G, et al. Bottom-up construction of TEMPO built-in porous organic frameworks as a cathode for lithium-sulphur batteries[J]. Chem Suschem, 2017, 10(14): 2955–2961. |
| [20] | Zhuang J, Liu X, Zhang Yu, et al. Zr-metal-organic frameworks featuring TEMPO radicals:Synergistic effect between TEMPO and hydrophilic Zr-Node defects boosting aerobic oxidation of alcohols[J]. ACS Appl Mater Inter, 2019, 11(3): 3034–3043. DOI:10.1021/acsami.8b18370 |
 2019, Vol. 33
2019, Vol. 33



