2. 中国科学院大学, 北京 100039;
3. 江苏理文化工有限公司, 江苏 常熟 215536
2. University of Chinese Academy of Sciences, Beijing 100039, China;
3. Jiangsu Lee & Man Chemical Compang Limited, Changshu 215536, China
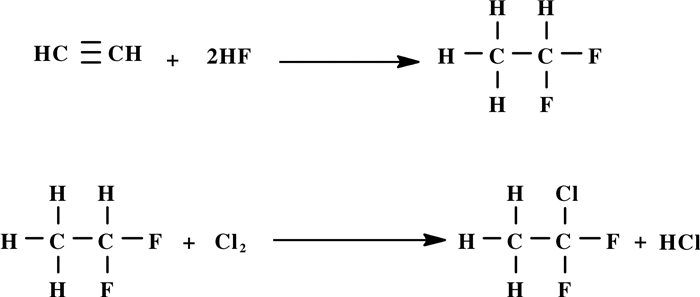
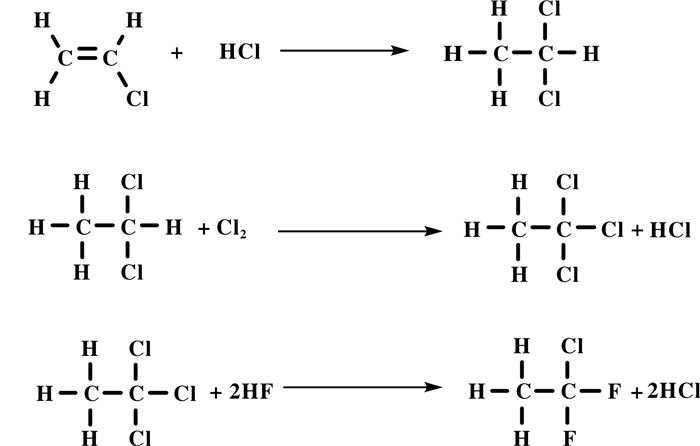
含氟烯烃(HCFC)[1]与氟碳化合物(HFCs)[2-3]的消耗臭氧潜能值(ODP)都为零, 但是含氟烯烃具有较低的温室效应潜能值(GWP), 在自然界中容易降解, 对环境友好.偏氟乙烯(VDF)是一类重要的含氟烯烃, 主要用于合成含氟树脂和氟弹性体高分子功能材料[4].从20世纪70年代开始, 聚偏氟乙烯(PVDF)逐渐被人研究和发展, 它是一类热塑性含氟聚合物功能材料, 因其含氟量和结晶度高, 具有优异的耐化学性、良好的热稳定性和较高的机械强度, 广泛应用于航天航空、建筑涂装、信息处理、医疗器械、光学仪器、核电和半导体工业等领域[5], 全球年产能超过4.3×104 t.对于高纯度的PVDF树脂, 主要用于半导体工业和锂离子电池中, 用作功能性压电和热电薄膜[6], 但是我国目前高纯度的PVDF树脂基本依赖进口[7]. VDF是合成PVDF的最主要单体之一, 见诸报道的合成VDF的方法较多, 主要有含氟化合物的热裂解、共裂解和烷烃的直接氟化等[8].
1901年, Swarts在比利时皇家学院公报上首次报道了VDF的合成, 由1, 1-二氟-2-溴乙烷与戊酸钠反应, 脱溴化氢, 合成VDF.在之后将近半个世纪内, VDF并没有被当作一种重要的化学产品, 它的合成工作几乎没有得到进展.直到1946年, 美国杜邦公司(DuPont)采用二氟二氯乙烷加热裂解, 脱氯化氢, 合成VDF [9].之后, VDF被广泛研究, 经过70多年的发展, VDF合成已经实现工业化, 如美国阿托菲纳公司(Atofina)和苏威(Solvay Solexis)等公司都建有数千吨级1, 1, 1-二氟一氯乙烷(142 b)热裂解合成VDF装置.相比而言, 国内关于VDF合成工艺和催化剂制备技术发展相对缓慢, 上海三爱富新材料股份有限公司、晨光化工研究院、浙江省化工科技集团公司等单位建有百吨级至近千吨级规模的生产装置, 使用的工艺路线均为先将1, 1-二氟乙烷(152 a)经光氯化合成, 或通过偏氯乙烯(VDC)与HF反应合成1, 1, 1-二氟一氯乙烷(142 b), 再将142 b脱HCl合成VDF[10-11].
近年来随着含氟材料的广泛应用, 氟聚合物工业发展较快, 对VDF、六氟丙烯(HFP)等单体的需求日益增加.然而目前工业上应用最广泛的技术是通过142 b热裂解脱HCl合成VDF, 尽管该合成路线具有原料廉价易得、转化率高、VDF选择性高、副产物少等优点, 但是采用电石法合成乙炔, 再经二步反应合成142 b, 该工艺路线长、能耗高, 产生的废电石渣难处理, 因严重污染环境等问题而面临淘汰, 国内企业急需结构转型.为缩短我国与国外的差距, 满足国内对VDF日益增长的需求, 降低环境污染, 创新提高VDF及含氟丙烯合成技术已刻不容缓.
国内外已有一些文献综述有关含氟烯烃, 诸如偏氟乙烯单体的物化性质、各种制备方法及其工艺特点和官能化芳香烃氟单体的合成方法[11], 我们在上述文献基础上, 主要综述偏氟乙烯的催化合成技术如热裂解、直接氟化、共裂解等的进展, 同时介绍近年来含氟丙烯的直接催化氟化合成及其机理研究进展.
1 VDF的合成方法 1.1 热裂解脱HCl合成VDF文献报道1, 1-二氟-1-氯乙烷(142 b)的主要合成方法有如下3种:
(1) 使用γ-Al2O3作为载体, 通过浸渍法制备负载Bi3+含量5%(重量百分数)和Mn2+含量3%(重量百分数)的催化剂, 在250 ℃下经HF预活化, 以乙炔为起始反应物, 在镍反应管中, 反应温度230~240 ℃, 与HF发生加氢氟化反应合成1, 1-二氟乙烷152 a, 产率97.4%.再在30 ℃下, 光氯化合成142 b, 产率94.1% (图式 1) [12].
|
图式 1 以乙炔为反应物合成142 b Scheme 1 Synthesis of 142 b with acetylene as reactant |
(2) 以氯乙烯(VC)为反应物, 首先合成甲基氯仿CH3CCl3; 再与无水HF反应, 反应温度为36~45 ℃, 反应压力0.25~0.30 MPa, 物料配比HF:CH3CCl3 = 1:2(摩尔比), 合成142 b(图式 2)[13].
|
图式 2 以氯乙烯为反应物合成142 b Scheme 2 Synthesis of 142 b with vinyl chloride as a reactant |
(3) 以氯乙烯(VC)或1, 2-二氯乙烷为反应物, 首先合成偏氯乙烯(VDC), 再与HF发生加成氟化反应, 合成142 b(图式 3)[14].
|
图式 3 以氯乙烯(VC)或1, 2-二氯乙烷(EDC)为反应物合成142 b Scheme 3 Synthesis of 142 b with vinyl chloride (VC) or 1, 2-dichloroethane (EDC) as reactant |
142 b热裂解反应合成VDF(图式 4)多数采用含镍的空不锈钢管, Ni同时作为催化剂, 在600~ 700 ℃下进行, 该反应对温度尤为敏感, 650 ℃以上反应可得到很高的转化率, 温度过高将明显降低VDF合成选择性, 形成积碳, 从而堵塞反应管, 导致连续催化合成周期短.为了降低裂解反应温度, 人们最初在反应过程中加入少量促进剂如CCl4或Cl2等, 或加入稀释剂如水蒸气或二氧化碳等进行裂解.已有文献对反应促进剂有不同的选择, 例如当加入0.5%~4%(重量百分数)的Cl2作促进剂时, 可提高142 b的转化率, 同时可使VDF的产率提高至87.5% [15a]; 若同时加入CCl4和Cl2作为促进剂, 可将VDF的选择性提高至99% [15b].若加入水蒸汽作稀释剂, 在镍反应管中, 550 ℃, 接触时间10 s, 142 b的转化率48%, VDF收率47.95%, VDF的选择性达98%以上.若加入水蒸汽, 在铜反应管中, 填充镍丝, 600 ℃, 接触时间10 s, 142 b的转化率88%, VDF收率86.2% [15c-15d].同时可降低反应温度, 没有观察到三卤代甲基的水解反应, 只发生分子内脱除HCl合成VDF.由于该反应脱HCl的同时也有少量HF脱落, 因此同时会合成如一氟一氯乙烯等副产物, 它们的含量约为总量的1%~2%.若优化反应条件, 则不加促进剂和稀释剂或无催化剂存在下该过程能获得很高的转化率和产率.

|
图式 4 142 b热裂解脱HCl合成VDF Scheme 4 142 b thermal cracking de-HCl synthesis VDF |
Wan等[16]报道了采用乙二胺四乙酸(EDTA)作为螯合剂, 用简便的水热法成功制备了均匀、分散的立方SrF2微粒.他们研究了pH值, EDTA用量和水热时间等制备条件对SrF2晶体形成的影响.将SrF2微粒在空气中500 ℃下煅烧后, 在350 ℃下, 空速为600 h-1, 用作1-氯-1, 1-二氟乙烷(142 b)热裂解合成偏氟乙烯(VDF)的催化剂.结果表明, SrF2立方微粒表现出高催化活性, 142 b的转化率为70%, VDF选择性为80%~87%.在30 h的运行时间内未观察到催化剂的显着的失活.随着反应温度升至450 ℃, 142 b的转化率接近94%, 而对VDF的选择性几乎保持不变.尽管通过常规沉淀方法制备的SrF2催化剂也显示出高转化率, 但其对VDF的选择性仅为约50%~70%.工业上合成VDF的温度为650~700 ℃, SrF2催化剂提供了在低得多的温度下生产VDF的可能的途径.
Han等[17]报道了N-掺杂有序介孔炭催化剂成功应用于142 b热裂解反应, 采用介孔分子筛模板, 脲和蔗糖分别为N源和C源制备催化剂, 通过BET, TEM, XPS和TG表征, 将其用于142 b热裂解合成VDF, 裂解反应温度从600 ~ 650 ℃降低到400 ℃, 空速为600 h-1, 得到高转化率和高选择性.该研究组又报道CaBaFx催化剂成功应用于142 b热裂解反应[18], 该催化剂与CaF2或BaF2比较, 获得高转化率和高选择性, 裂解反应温度从650~700 ℃降低到350 ℃, 裂解反应进行100 h, 催化剂没有明显失活, 142 b的转化率为50%.
国内工业生产VDF中, 裂解后的混合物经急冷后, 再经低压冷凝脱水和干燥处理, 最后经多塔分步连续处理从而达到分离目标产物.周兴贵等[19]采用二氟一氯乙烷作为原料, 空管裂解或者水蒸汽稀释裂解, 经前处理后, 通过精馏合成偏氟乙烯单体, 精馏采用三塔装置, 分别是偏氟乙烯脱轻塔脱除轻组分, 偏氟乙烯精馏塔得到偏氟乙烯单体和侧线除杂塔除去杂质和高沸物, 并回收偏氟乙烯单体和未参与反应的二氟一氯乙烷.
Baker等[20]报道了使用1, 1-二氟-2-氯乙烷(F142)热裂解脱HCl合成VDF(图式 5).他们在He环境下(He:F142 = 12:1), 加热至650 ℃, 接触时间4 s, 通过1, 1-二氟-2-氯乙烷(F142)热裂解脱HCl合成VDF, 但是他们的反应转化率只有25%, VDF的选择性只有32%.

|
图式 5 1, 1-二氟-2-氯乙烷热裂解脱HCl合成VDF Scheme 5 Thermal decomposition of 1, 1-difluoro-2- chloroethane to dehydrochlorinate to synthesize VDF |
早期报道用152 a直接进行热裂解脱氢合成VDF的方法大多因副产物多、产率低, 没有引起重视. Irving Litant等 [21a]改进了该合成方法(图式 6), 他们使用152 a(2.38 mol)与氯气(3.6 mol)在稀释剂二氟二氯甲烷(F12) (2.47 mol)存在下, 在Ni管反应器中脱氢, 反应温度650 ℃, 152 a的转化率100%, VDF的收率96.5%, 产率有明显的提高. Maher Yousef等报道在氧气和CO2等共反应气体存在下, 1, 1-二氟乙烷:O2:CO2 (摩尔比) = 1:0.50:2.0, 反应温度500 ℃, 接触时间10 s, 1, 1-二氟乙烷(152 a)在催化剂Cr2O3/Al2O3作用下, 转化率为98%.由于VDF和氟乙烯(VF)沸点不同(VDF为-86 ℃, VF为-72 ℃), 可通过精馏的方法分离得到VDF(VF为85.8%, VDF为14.2%)[21b, 22].

|
图式 6 1, 1-二氟乙烷(152 a)与氯气反应脱氢合成VDF Scheme 6 1, 1-difluoroethane (152 a) reacts with chlorine to dehydrogenate to synthesize VDF |
152 a一步合成VDF的转化率较高, 但VDF选择性相对142 b热裂解低, 该工艺不是合成VDF的主要办法, 若先将152 a光氯化转化成142 b再热裂解, 在技术上和经济上都较152 a直接脱氢优越.
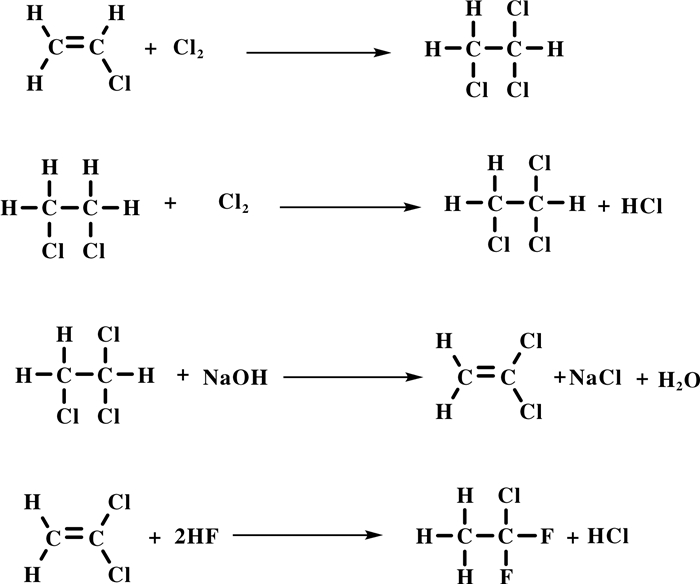
1.3 通过偏氯乙烯(VDC)一步法合成VDF偏氯乙烯(VDC)除先氟化合成142 b, 再热裂解合成VDF外, VDC直接氟化也可合成VDF(图式 7). Kaess等[23]采用CrF3或活性炭负载2.9% (重量百分数) CrF3作为催化剂, 以及主催化剂AlF3, 助催化剂为3.5% (重量百分数)钒, 锡, 镧, 反应温度200~400 ℃, HF / VDC (摩尔比)大于2, VDC几乎完全转化, VDF收率高达98.2%.当使用铬盐、La(NO3)3、NH4NO3、SnCl2、AlF3等作为催化剂, 或在AlF3上负载Cd、Cr、Fe、Mg、Mo、Ni、Zn和Zr等金属作催化剂时, 都能以高收率得到VDF[24].
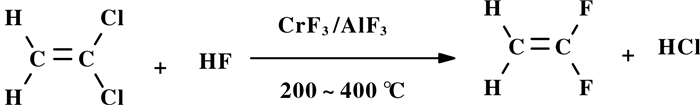
|
图式 7 偏氯乙烯(VDC)直接氟化合成VDF Scheme 7 Direct fluorination of vinylidene chloride (VDC) to VDF |
Fiske等[25]报道在Al2O3或活性炭上负载AgNO3、Co(NO3)2、La(NO3)3、SnCl2、HgNO3、Hg(NO3)2、CuCl2、FeCl3、RuCl3、ZuCl2、NaCl和CaCl2, 在275~425 ℃下用HF预氟化后作为催化剂, HF气态氟化卤代烃, VDC可直接转化为VDF.当使用催化剂Cr2O3 (12%) /NiO (6%) / Al2O3 (重量百分数)时, 415 ℃, 二氯化乙烯的转化率为61.2%, 其中13.5%转化为含氟化合物.
1989年, Elsheikh等[26]报道VDC直接氟化制备VDF.他们采用FeF3、CoF2、CrF3、NiF2和ZnF2分别与AlF3组成的复合催化剂, 采用列管式固定床反应器, 在反应体系中加入O2, 将摩尔比范围为2/1~10/1的HF和VDC混合气在400~700 ℃下通过催化床, 接触时间控制在8~15 s之间.由于使用HF水溶液作氟化剂时, 设备腐蚀问题较为严重, 该工艺配有多区段加热器, 气态条件下氟化, 解决了设备腐蚀的问题.在反应过程中, 反应温度、反应物料比、催化剂种类及活化条件、O2用量和停留时间对VDC转化率和VDF收率有较大的影响.该公司通过如下过程制备无水AlF3/过渡金属氟化物复合催化剂:在40~45 ℃下, 将Al2O3加入到HF水溶液中反应制备AlF3, 然后加入Fe、Co、Cr、Ni和Zn等过渡金属氯化物或硝酸盐水溶液进行氟化, 将反应生成的沉淀物质分离出来, 在100~175 ℃下干燥; 重复以上的步骤, 将催化剂中过渡金属的含量控制在7.5%~10% (重量百分数); 最后将沉淀物经干磨、筛分, 制备出颗粒状复合催化剂, 粒径为0.280~0.154 mm[11].当使用FeF3/AlF3催化剂时, 反应温度600 ℃, 接触时间13 s, 产物中VDF选择性为80%.
VDC一步法合成VDF工艺简单, VDC转化率高, VDF收率也较高, 但制备催化剂的过程较复杂、活化时间长, 催化剂需定期再生.
1.4 热裂解脱HF或脱氯合成VDFAtochem公司公开一条合成路线[27], 将143 a/HCl混合物转化为VDF(图式 8).他们将36 g γ-Al2O3置于管状反应器中, 首先在空气气氛下650 ℃活化, 然后在550 ℃下采用HF预活化; 143 a/HCl混合物(30.1:19.9, 36.6:18.8; 63.8:30.3(摩尔比))和空气或CO2, 以气态连续通过管状反应器, 反应温度503~551 ℃, 反应接触时间12~88 s, 反应在常压下进行, GC测试结果表明, 143 a转化率为48.6%, VDF选择性达到62.3%.当143 a转化率为91.1%, VDF产率是32.9%.若将纯净的143 a在1200 ℃下, 在铂金管或衬白金的镍管中, 反应接触时间0.01 s, 空速9700 h-1, 热裂解脱HF, 143 a的总转化率为75.4%, 143 a的转化率74.0%, VDF的选择性达98.1%, 副产物1.90%[28]. 143 a在催化剂三氟化铬存在下热裂解, 400 ℃脱除HF, VDF收率很低[29]. 143 a脱HF合成VDF, 工艺简单, 催化剂不需特殊处理, 但合成反应初始物143 a复杂, 143 a价格较高, 转化率和VDF得率不能同时兼顾, 副产物较多, 工业上用143 a制备VDF并不多见.在VDC一步法制备VDF反应过程中, 会产生大量的1, 1, 1-三氟乙烷(143 a)副产物.
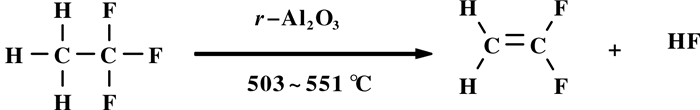
|
图式 8 1, 1, 1-三氟乙烷热裂解脱HF合成VDF Scheme 8 1, 1, 1-Trifluoroethane thermal cracking de-HF synthesis VDF |
Chen等[30]报道了2-氯-1, 1, 1-三氟乙烷热裂解合成VDF(图式 9).他们使用DMF作为溶剂, 催化体系为: 1.5 equiv的Zn/10%和CuBr/40%, PPh3, 反应温度120 ℃, 反应时间3~6 h, VDF的收率达99%.

|
图式 9 2-氯-1, 1, 1-三氟乙烷热裂解合成VDF Scheme 9 Synthesis of VDF by thermal cracking of 2-chloro-1, 1, 1-trifluoroethane |
Laidler等[31]公开1, 2-二氯-1, 1-二氟乙烷(132b) (1.0 mL, 0.010 49 mol)溶解在钠汞齐(100.0 g, 0.5% (重量百分数), 0.021744 mol Na)中, 采用醇(20 mL, 0.4916 mol)作为氢转移试剂和蒸馏水(8.9 mL, 0.4925 mol), 在温和条件下(30~35 ℃)常压脱氯合成VDF(图式 10), 产率8.86%, 具有优异的选择性(95.2%). Charles B Miller等[32-33]以偏四氯乙烷(CCl3CH2Cl)为反应物, 先氟化合成1, 2-二氯-1, 1-二氟乙烷(132 b), 然后在金属催化剂Ni存在下热裂解脱氯合成VDF, 其合成反应条件如下: 132 b(3.3 mol)和H2(6.0 mol))混合气体在490~500 ℃下通过金属Ni催化床, 反应接触时间为10 s, 有43%的132 b转化为VDF. 132 b脱氯合成VDF工艺简单, 反应温度不高, 催化剂简单, 但132 b转化率较低, 对没有132 b原料的工厂, 需采用高毒的偏四氯乙烷制备132 b, 不宜采用此法合成VDF.
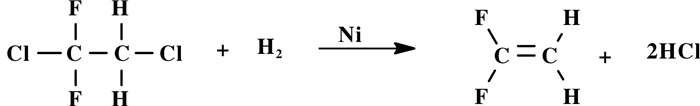
|
图式 10 1, 2-二氯-1, 1-二氟乙烷(132 b)热解脱氯合成VDF Scheme 10 1, 2-Dichloro-1, 1-difluoroethane (132 b) pyrolysis dechlorination to synthesize VDF |
在合成制冷剂二氟二氯甲烷(F12)和二氟一氯甲烷(F22)的过程中, 会分别产生副产物三氟氯甲烷(F13)和三氟甲烷(CHF3).若将F12, F22, 和F13分别和甲烷或甲醇等进行共裂解反应, 可廉价地合成VDF(图式 11), 但该合成方法的转化率和收率都很低, 不适于工业化生产.

|
图式 11 F22与甲烷共裂解合成VDF的可能机理 Scheme 11 Possible mechanism of FDF and methane co-cracking to synthesize VDF |
Kennedy等[34]报道采用氧化铝管式反应器, F22与甲烷共裂解合成VDF, 在400~800 ℃, 常压下引入O2明显增大CH4的转化率, 提高VDF的收率, 主产物为TFE和VDF, 小量副产物为C2HF3、C2H2、CHF3、C2H3F、C2H2F4、CH2F2、C3F6和CH3Cl, 并提出一个可能的反应机理(图式 11).该链引发反应为甲烷经高温热裂解得到甲基自由基和氢自由基, 然后经多个自由基反应, 得到目标产物; 他们为了验证这个可能的机理, 同时在上述氧化铝管式反应器中开展了CH4的热裂解反应研究, 尽管获得低的CH4转化率, 但是明显地发现形成C2H6产物, 他们认为这些表面反应引发热裂解反应.
韩文锋等[35]将廉价且需要强制处理的废弃物三氟甲烷作为原料, 在催化作用下生成具有较高附加值的偏氟乙烯, 具有较好的经济效益和社会效益.将甲烷、氧气、二氟一氯甲烷混合气或含三氟甲烷与二氟一氯甲烷的多种气体混合气进行混合后, 在温度550~1050 ℃, 总压力1~10 bar, 空速50~10 000 h-1的条件下进行反应, 在催化剂存在下反应生成偏氟乙烯, F22 的转化率为96.0%, 三氟甲烷的转化率99.0%, 甲烷转化率99.0%, VDF选择性为93.0%.主催化剂为镧、铈、铯稀土金属, 载体为氧化铝、氧化镁、氧化铬、氧化锆、或石墨, 助催化剂是Al、Fe、Zn、Mg、K、Ca、Ba、Cu (0~10%(重量百分数)).
Marquis等[36]报道F22与一氯甲烷(CH3Cl)共裂解合成VDF.反应温度900 ℃, 在60 min内, 31.8%的F22与18.5%的CH3Cl通过反应管, 接触时间0.72 s, VDF收率60.7%, 副产物1, 1-二氟-2-氯乙烯为1.3%.
1.6 共裂解及F12加氢脱氯合成VDFMcGrew等[37]报道二氟二氯甲烷(F12)和甲烷共裂解反应合成VDF(图式 12), 催化剂选用铜, 在石英裂解管中, 反应物F12/CH4的摩尔比范围为1/1~1/5, 反应温度为550~850 ℃, 反应接触时间为1.0~3.0 s. F12与甲烷共裂解制备VDF工艺简单, 但转化率和收率都较低, F12最高转化率为33.7%, VDF收率最高为19.9%. Julie等[38]报道以活性炭为载体, 制备负载贵金属Pt、Pd、Ir、Ru、Os和Rh的催化剂, 将其应用于F12加氢脱氯反应中, 反应温度250 ℃, F12加氢脱氯的产物发生齐聚反应合成VDF, 稳态活性从高到低的顺序为Pt > Pd >> Ir > Ru ≈ Os ≈ Rh.当F12/H2 = 1时, Pd / C催化剂对产物C2~C3烃表现出超过75%的选择性.除Pt催化剂外, TEF和VDF是主要的C2+产物.

|
图式 12 二氟二氯甲烷(F12)和甲烷共裂解合成VDF Scheme 12 Synthesis of VDF by disulfide dichloromethane (F12) and methane co-cracking |
韩文峰等[35]报道了一种将三氟甲烷与甲烷共裂解合成VDF的方法(图式 13).他们制备了一系列负载型催化剂, 主催化剂为镧、铈、铯等稀土金属, 载体为氧化铝、氧化镁、氧化铬或石墨, 助催化剂为Al、Fe、Zn、Mg、Cu.将三氟甲烷、甲烷和氧气的混合气体以1:1:0.25(摩尔比)通入装有氧化镧催化剂的反应器, 在温度为850 ℃, 压力2 bar, 空速5000 h-1的条件下反应.三氟甲烷的转化率为89%, 甲烷的转化率为78%, 偏氟乙烯的选择性为87%, 主要副产物为四氟乙烯, 其他少量副产物有乙烯、乙烷、二氟甲烷、一氟乙烯、三氟乙烯和六氟丙烯.由于甲烷催化活化一直是个难题, 该方法为甲烷的开发利用合成VDF提供了可选择的方法.
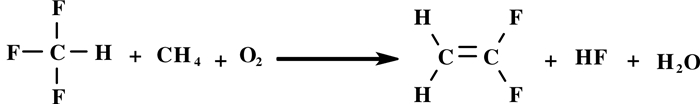
|
图式 13 三氟甲烷与甲烷共裂解合成VDF Scheme 13 Co-cracking of trifluoromethane with methane to synthesize VDF |
催化剂的制备方法:将14.04 g La(NO3)36H2O溶于225 mL蒸馏水中配成溶液, 将100 g高比表面积Al2O3分散在La(NO3)3溶液中, 形成悬浊液, 向其逐滴加入20%的NH3水溶液, 并同时开启磁力搅拌器, 直至pH=9~11, 停止反应, 静止老化12 h后进行抽滤, 将滤饼在100 ℃下干燥7~10 h后在N2气氛下500 ℃焙烧4 h, 得到5.7%(重量百分数)La2O3/Al2O3催化剂.
已经提出的三氟甲烷与甲烷共裂解合成VDF可能的反应机理如图式 14所示, 反应同样经历了甲基自由基的生成过程:
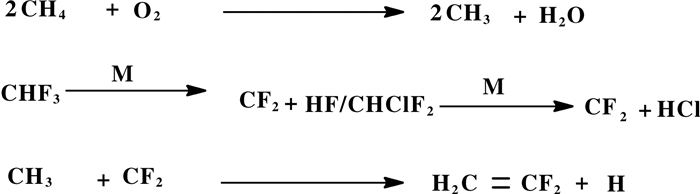
|
图式 14 三氟甲烷与甲烷共裂解合成VDF可能的反应机理 Scheme 14 Possible reaction mechanism for the synthesis of VDF by co-cracking of trifluoromethane with methane |
Olstowski等[39]报道预混合的CHF3和CH4气体通过镍裂解管, CHF3的流速为0.0112 m3/h, CH4的流速为0.0056 m3/h, 反应温度700~1100 ℃, 接触时间0.1~10 s, CHF3的转化率为26%, VDF选择性为58%. CHF3和乙烯或乙烷在上述反应条件下也能合成VDF.
Kennedy等[40]报道CClF3 (F13)和CH4在加入CaBr2后共裂解合成VDF(图式 15), 反应温度400~900 ℃.与未加入CaBr2的均相反应比较, 加入CaBr2后, 在较低温度下CClF3 (F13)和CH4的转化率明显增加, 副产物TFE明显降低, 几乎接近零, 在880 ℃以下, 合成VDF的速率明显增大.理论和实验结果证实: CClF3和CaBr2反应合成CaF2, 释放的活性Br物种选择性的形成CBrF3, Br、CH4和CBrF3共同作用提高VDF的收率.
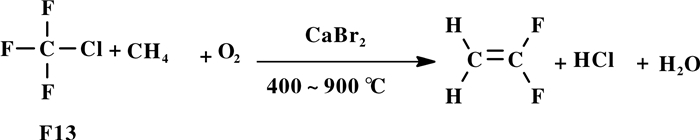
|
图式 15 三氟氯甲烷(F13)与甲烷共裂解合成VDF Scheme 15 Co-pyrolysis of chlorotrifluoromethane (F13) with methane to synthesize VDF |
Watson等[41]公开CF3Br与CH4共裂解制备VDF, CH4提供烃自由基, CF3Br的流量为0.0028 m3/h, CH4的流量为0.0025 m3/h, 反应物在Ni反应管中进行共裂解, 合成VDF, 反应温度700 ℃, 分析产物发现产物中有较多的VDF.
除以上共裂解反应合成VDF外, 还有其他物质单独热裂解合成VDF. Fozzard等[42]报道四氟环丁烷(CF2CF2CH2CH2)单独热裂解合成VDF, CF2CF2CH2CH2通过四氟乙烯和乙烯共二聚合成, 它在500~900 ℃热裂解合成VDF, 产物中含有微量四氟乙烯和乙烯, VDF的选择性最高为98.7%.
2 含氟丙烯的合成方法Luo等[43]报道采用沉淀法制备催化剂Cr2O3, 通过XRD、激光拉曼、NH3-TPD和BET表征催化剂.研究结果表明, 提高焙烧温度, 催化剂晶粒增大, 表面酸性位减少.在320 ℃, HF气相氟化2-氯-3, 3, 3-三氟丙烯合成2, 3, 3, 3-四氟丙烯反应中, 当催化剂焙烧温度为500 ℃, 显示出最高的催化活性, 2-氯-3, 3, 3-三氟丙烯的转化率为63.3%, 2, 3, 3, 3-四氟丙烯的选择性为59.0%, 1, 1, 1, 2, 3-五氟丙烷的选择性为38.0%.反应过程中积碳的产生是催化剂失活的主要原因.他们在上述实验数据的基础上, 提出了可能的反应途径(图式 16).反应物首先与HF发生加成反应, 得到氟代和氯代饱和烷烃, 然后在HF气氛下发生Cl/F交换, 得到全氟代饱和烷烃, 再经消除反应和Cl/F交换, 得到目标产物.

|
图式 16 HF气相氟化2-氯-3, 3, 3-三氟丙烯合成2, 3, 3, 3-四氟丙烯的可能途径 Scheme 16 Possible pathway for the synthesis of 2, 3, 3, 3-tetrafluoropropene from HF gas phase fluorinated 2-chloro-3, 3, 3-trifluoropropene |
我们课题组以1, 1, 1, 3, 3-五氯丙烷为原料, 开展多相催化氟化合成反式1-氯-3, 3, 3-三氟丙烯研究(图式 17) [44].以Cr、Co、Zn、Al的氯化物或其硝酸盐为原料, 共沉淀法制备一系列氧化物催化剂, ZnO/Cr2O3、CoO/Cr2O3、Al2O3/Cr2O3, 通过XRD和XPS表征该系列催化剂, 将该系列氧化物催化剂与活性炭复合, 并成功应用于1, 1, 1, 3, 3-五氯丙烷与HF经一步气相氟化反应中, 高选择性地合成反式1-氯-3, 3, 3-三氟丙烯.反应在304不锈钢管式反应器中发生, 管长50 cm, 管径20 mm, 填加10~20 g催化剂, 350 ℃下采用HF连续预活化10 h, 直到不再有水生成为止; 然后在反应温度180~220 ℃下, 1, 1, 1, 3, 3-五氯丙烷与HF的摩尔比为1:10, 1, 1, 1, 3, 3-五氯丙烷的进料量为0.6 mL/min, 常压下该复合氧化物催化剂催化合成目标产物, 转化率和选择性分别可达99.4%和98.2%.值得一提的是复合氟化催化剂应用于1, 1, 1, 3, 3-五氯丙烷选择性合成反式1-氯-3, 3, 3-三氟丙烯稳定性好.
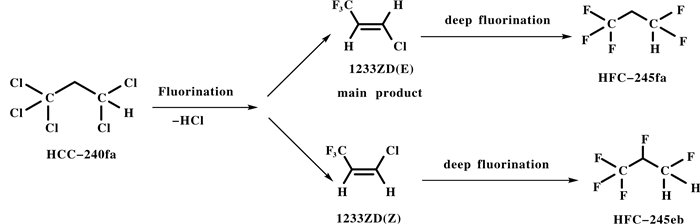
|
图式 17 多相催化氟化合成反式1-氯-3, 3, 3-三氟丙烯 Scheme 17 Heterogeneous catalytic fluorination of trans-1-chloro-3, 3, 3-trifluoropropene |
Lu等[45]报道在主催化剂氧化物Cr2O3中引入助催化剂碱土金属Mg、Ca和稀土元素La, 通过XRD、XPS和拉曼光谱表征发现: Cr2O3在预氟化过程中形成高分散的催化活性物种CrOxFy, 引入稀土元素Y阻止形成催化活性物种CrOxFy; BET测试结果显示, 掺杂稀土元素La和Y, 可提高氟化催化剂的比表面积.他们将该系列催化剂成功应用于HF气相氟化1, 1, 2, 3-四氯丙稀合成2-氯-3, 3, 3-三氟丙烯的反应中, 催化剂La/F-Cr2O3表现最好的活性和稳定性.反应条件如温度、反应物的摩尔比和接触时间均对产物分布有较大影响, 在较高温度、较大的HF / 1, 1, 2, 3-四氯丙稀和短的接触时间下, 高选择性地合成目标产物2-氯-3, 3, 3-三氟丙烯.基于产物分布数据, Lu等提出一个包含加成/消除和Cl/F交换的可能的反应途径(图式 18).反应物与HF经加成反应后, 一个可能途径是先发生Cl/F交换, 然后脱HCl, 得到目标产物; 另一个可能途径是先脱HCl, 然后发生Cl/F交换, 得到目标产物.

|
图式 18 气相氟化1, 1, 2, 3-四氯丙稀合成2-氯-3, 3, 3-三氟丙烯的可能的反应途径 Scheme 18 Possible reaction pathway for the synthesis of 2-chloro-3, 3, 3-trifluoropropene by gas phase fluorination of 1, 1, 2, 3-tetrachloropropene |
聚偏氟乙烯(PVDF)的含氟量和结晶度高, 具有优异的耐化学性、良好的热稳定性和较高的机械强度, 被广泛应用于航天航空、建筑涂装、医疗器械、光学仪器、核电和半导体工业等领域, 因此VDF单体的需求日益增加.但是目前国内VDF产能严重不足, 而且部分工艺路线因固废物污染问题面临淘汰.特别是近年来, PVDF薄膜材料应用于锂电子电池中, 制备功能性压电和热电薄膜, 这对VDF单体的纯度提出了更高的要求, 然而目前我国的制品级PVDF树脂基本依赖进口, 可能的原因是我们尚未突破VDF产物中痕量HF难于分离除去的技术难关, 因此VDF合成工艺后处理步骤中, 反应混合物首先通过酸吸收并循环利用HF, 然后通过碱吸收微量HF的方法需改进.采用廉价的VC或EDC先制备142 b再合成VDF工艺较为简单, 可以节省大量的能源、设备投资, 但若由VC或EDC合成, VDC直接催化合成VDF, 可以节省氟化生成142 b环节, 进一步降低生产成本, 是未来发展的方向.
致谢: 感谢甘肃省重点研发计划-工业类(18YF1 GA124)的支持.
| [1] |
a. Mukhopadhyay S, Tung H S, Light B A, et al. Method for producing fluorinated organic compounds, US 0197842[P], 2007. b. Merkel D C, Tung H S. Method for producing 2-chiloro-3, 3, 3-trifluoropropene (HCFC-1233XF), US 0030244[P], 2009. c. Mukhopadhyay S, Light B A. Processes synthesis of fluorinated olefins, WO 052064[P], 2009. |
| [2] | Elders G J, Ravishankara A R, Miller M K, et al. Preserving montreal protocol climate benefits by limiting HFCs[J]. Science, 2012, 335(6071): 922–923. |
| [3] | Ameduri B. From vinylidene fluoride (VDF) to the applications of VDF-containing polymers and copolymers: recent developments and future trends[J]. Chem Rev, 2009, 109(12): 6632–6686. |
| [4] |
a. Falireas P G, Ladmiral V, Debuigne A, et al. Straightforward synthesis of well-defined poly(vinylidene fluoride) and its block copolymers by cobalt-mediated radical polymerization[J]. Macromolecules, 2019, 52(3): 1266-1276. b. Banerjee S, Ladmiral V, Debuigne A, et al. Organometallic-mediated radical polymerization of vinylidene fluoride[J]. Angew Chem Int Edit Engl, 2018, 57(11): 2934-2937. c. Chen J, Wang Y, Xu X, et al. Sandwich structured poly(vinylidene fluoride)/polyacrylate elastomers with significantly enhanced electric displacement and energy density[J]. J Mater Chem A, 2018, 6(47): 24367-24377. |
| [5] |
a. Ameduri B, Fluoropolymers. The right material for the right applications[J].Chemistry, 2018, 24(71): 18830-18841. b. Banerjee S, Soulestin T, Patil Y, et al. Towards new strategies for the synthesis of functional vinylidene fluoride-based copolymers with tunable wettability[J]. Polym Chem, 2016, 7(24): 4004-4015. c. He D, Wang Y, Song S, et al. Significantly enhanced dielectric performances and high thermal conductivity in poly(vinylidene fluoride)-based composites enabled by SiC@SiO2 core-shell whiskers alignment[J]. ACS Appl Mater Interf, 2017, 9(51): 44839-44846. |
| [6] |
a. Dong L, Xiong Z, Liu X, et al. Synthesis of carbon quantum dots to fabricate ultraviolet‐shielding poly(vinylidene fluoride) films[J]. J Appl Polym Sci, 2019, 136(25): 47555-47561. b. Venkatesan S, Hidayati N, Liu I P, et al. Highly efficient gel-state dye-sensitized solar cells prepared using propionitrile and poly(vinylidene fluoride-co-hexafluoropropylene)[J]. J Power Sour, 2016, 336(30): 385-390. |
| [7] | Gong X, Chen Y, Tang C Y, et al. Crystallinity and morphology of barium titanate filled poly(vinylidene fluoride) nanocomposites[J]. J Appl Polym Sci, 2018, 135(48): 46877–46885. |
| [8] |
a. Han W, Yu H, Kennedy E M, et al. Conversion of CHF3 to CH2CF2via Reaction with CH4 and CaBr2[J]. Environ Sci Technol, 2008, 42(15): 5795-5799. b. Han W, Kennedy E M, Kundu S K, et al. Experimental and chemical kinetic study of the pyrolysis of trifluoroethane and the reaction of trifluoromethane with methane[J]. J Fluor Chem, 2010, 131(7): 751-760. |
| [9] | Jhon D C, Patrick A. Photochemical manufacture of 1, 1, 1-difluorochloroethane. US 2499129[P], 1946. |
| [10] |
a. Otto S, Heinrich K, Weltzel W, et al. Process for the manufacture of fluorethylenes. DE 1068695[P], 1959. b. Zhang Zai-li(张在利), Zeng Ben-zhong(曾本忠), Zeng Zi-min(曾子敏), et al. Method for producing vinylidene fluoride by cracking of difluoro-chloroethane (二氟一氯乙烷裂解生产偏氟乙烯的方法). CN 1428320A[P], 2003. c. Zheng Gen-tu(郑根土). Simulation study and optimization of vinylidene fluoride production process(偏氟乙烯生产过程仿真研究和优化)[J]. Chem Produ Technol(化工生产与技术), 2011, 18(5): 11-14. d. Liu Xin-min(刘新民), Wang Bing(王兵), Jing Hai-yang(荆海洋), et al. Method and apparatus for preparing vinylidene fluoride by cracking R142b (用R142b裂解制备偏氟乙烯的方法和设备), CN 101003460[P], 2007. e. Yin Cheng-da(尹程达). The reaction kinetics study about the pyrolysis of 1, 1-difluoro-1-choroethane yields vinylidene fluoride (二氟一氯乙烷裂解制取偏氟乙烯反应规律研究)[D]. East Chin Univer Sci Technol(华东理工大学), 2013. |
| [11] |
a. Zheng Hai-feng(郑海峰), Yin Hong (尹红), Yuan Shen-feng(袁慎峰), et al. Research progress in the pyrolysis of 1-chloro-1, 1-difluoroetane to vinylideng fluoride(1-氯-1, 1-二氟乙烷裂解制备偏氟乙烯的研究进展)[J]. Chem Ind Engineer Prog(化工进展), 2014, 33(1): 16-20. b. ZhuYou-liang(朱友良), Xu Xi-jun(许锡均). Manufacture of vinylidene fluoride monomer(偏氟乙烯单体的制备)[J]. Organo-Fluorine Indus(有机氟工业), 2004, 2004(4): 16-20. c. Zhu Shun-gen(朱顺根). Vinylidene fluoride monomer (偏氟乙烯单体)[J]. Organo-Fluorine Indus(有机氟工业), 2003, 2003(2) : 11-15. d. Souzy R, Ameduri B, Boutevin B. Synthesis and (co)polymerization of monofluoro, difluoro, trifluorostyrene and ((trifluorovinyl)oxy) benzene[J].Prog Polym Sci, 2004, 29(2): 75-106. |
| [12] |
a. Massonne, Joachim, Hannover, et al. Method for continuously producing vinyl fluoride, DE 2145975[P], 1973. b. Schultz N, Martens P. Process for the production of 1, 1-difluoroethylene from acetylene. CA 1087213[P], 1980. |
| [13] | Atochem C. Process for the preparation of 1-chloro-1, 1-difluoroethane. EP 297947[P], 1989. |
| [14] |
a. Beil W, Hoeppener A, Wolffund H J, et al. Method for preparing vinylidene fluoride(Verfahren zur Herstellung von Vinylidenfluorid). DE 1253702[P], 1967. b. William H, Gumprecht, Wilmington D, et al. Process for 1, 1-dichloro-1-fluoroethane. US 5051538[P], 1991. |
| [15] |
a. Miville M, James J E. Production of vinylidene fluoride, US 3246041[P], 1966. b. Liedl G. Method for producing vinyl fluoride. DE 2631658[P], 1977. c. Farken F B. Method for preparing 1, 1-difluoroethylene. DE 2044370[P], 1972. d. Meussdoerffer J N, Blecher H, Niederprum. Preparation of vinylidene fluoride, US 3830856[P], 1974. |
| [16] | Wang Z, Han W, Liu H, et al. EDTA-assisted hydrothermal synthesis of cubic SrF2 particles and their catalytic performance for the pyrolysis of 1-chloro-1, 1-difluoroethane to vinylidene fluoride[J]. Cryst Eng Comm, 2019, 21(11): 1691–1700. |
| [17] | Wang Z K, Han W F, Tang H D, et al. Preparation of N-doped ordered mesoporous carbon and catalytic performance for the pyrolysis of 1-chloro-1, 1-difluoroethane to vinylidene fluoride[J]. Micro Mes Mater, 2019, 2019(275): 200–206. |
| [18] | Wang Z K, Han W F, Tang H D, et al. CaBaFx composite as robust catalyst for the pyrolysis of 1-chloro-1, 1-difluoroethane to vinylidene fluoride[J]. Catal Commun, 2019, 2019(120): 42–45. |
| [19] | Zhou Xing-gui(周兴贵), Liang Cong-qiang(梁聪强), Wu Jun-yi(吴君毅). Preparation method of vinylidene fluoride monomer (一种偏氟乙烯单体的制备方法). CN 102838447A[P], 2012. |
| [20] | Dolbier W R, Romelaer J, Baker M. Anomalous elimination of HCl from 2-chloro-1, 1- difluoroethane. Likely involvement of a 1, 2-FCl interchange mechanism[J]. Tetra Lett, 2002, 43(45): 8075–8077. |
| [21] |
a. Litant I, Charles B, Miller, et al. Production of fluoroolefinic compounds. US 2723296[P], 1955. b. Bolmer M, Sheppard, Elsheikh, et al. Production of vinylidene fluoride from 1, 1- difluoroethane. EP 0461297(A1)[P], 1991. |
| [22] | Dynamit A G. Method for preparing vinylidene fluoride from ethylene. DE 2659712[P], 1978. |
| [23] | Franz K, Klaus, Michaud H, et al. Process for preparing vinylidene fluoride. US 3600450[P], 1971. |
| [24] | Beil W, Hoeppener A, Wolff H J, et al. Process for the preparation of vinylidene fluoride (Verfahren zur Herstellung von Vinylidenfluorid). DE 1253702[P], 1967. |
| [25] | Tom R, Fiske, Daniel W, et al. Fluorination of chlorinated hydrocarbons. US 4147733[P], 1979. |
| [26] | Maher Y, Elsheikh. Process for preparing vinylidene fluoride. US 4827055[P], 1989. |
| [27] | Maher Y, Elsheikh, Michael S, et al. Production of vinylidene fluoride. US 5177271[P], 1993. |
| [28] | Murray H, Arnold H. Method for producing vinylidene. US 3188356[P], 1965. |
| [29] | Yasunosuke O, Masayama H. Preparation of Vinylidene Flouride. JPS 54130507[P], 1979. |
| [30] | Tang X J, Chen Q Y. Ni(0) or Cu(0) catalyzed cleavage of the unactivated C-Cl bond of 2-chloro-1, 1, 1-trifluoroethane (HCFC-133a) via a single electron transfer (SET) process[J]. Chem Sci, 2012, 3(5): 1694–1697. |
| [31] | Ballard D G, Farrar J, Laidler D A, et al. Preparing vinylidene fluoride. GB 2165241A[P], 1986. |
| [32] | Calfee J D, Dayton C B, Miller, et al. Preparation of Vinylidene Fluoride. US 2734090[P], 1956. |
| [33] | Earl T, McBee. Halogenation of fluorocarbons, US 2644845[P], 1953. |
| [34] | Han W F, Kennedy E M, Mackie J C, et al. Synthesis of vinylidene fluoride via reaction of chlorodifluoromethane (HCFC-22) with methane[J]. Indus Engineer Chem Res, 2010, 49(13): 6010–6019. |
| [35] | Han Wen-feng(韩文锋), Li Yu-zhen(李雨臻), Tang Hao-dong(唐浩东), et al. Preparation method of vinylidene fluoride and preparation method of catalyst (一种偏氟乙烯的制备方法及其所用催化剂的制备方法), CN 104628514A[P], 2017. |
| [36] | David M, Marquis. Process for the pyrolysis of CHClF2 and CH3Cl to prepare CH2=CF2. US 3073870[P], 1963. |
| [37] | Frank C, McGrew, Edward H, et al. Preparation of fluorinated organic compounds. US 2687440[P], 1954. |
| [38] | Parag P, Ulkarni K, Subodh S, et al. Hydrodechlorination of dichlorodifluoromethane on carbon-supported Group Ⅷ noble metal catalysts[J]. Catal Lett, 1999, 619(3): 161–166. |
| [39] | Olstowski F. Preparation of vinylidene fluoride. US 3047637[P], 1962. |
| [40] | Han W F, Yu H, Kennedy E M, et al. Conversion of CHF3 to CH2=CF2 via reaction with CH4 and CaBr2[J]. Environ Sci Technol, 2008, 42(15): 5795–5799. |
| [41] | Franciszek, Olstowski, Jones C, et al. Watson. Preparation of vinylidene fluoride. US 3089910[P], 1963. |
| [42] | George B, Fozzard. Producing vinylidene fluoride substantially free from tetrafluoroethylene. US 3996301[P], 1976. |
| [43] | Xie Z Y, Fan J L, Cheng Y X, et al. Cr2O3 Catalysts for Fluorination of 2-Chloro-3, 3, 3-trifluoropropene to 2, 3, 3, 3-TetrafluoropropeneInd[J]. Engineer Chem Res, 2013, 52(9): 3295–3299. |
| [44] | Wang Lai-lai(王来来), Gao Ping(高平), Tian Mi(田密), et al. Method for synthesizing trans 1-chloro-3, 3, 3-trifluoropropene and preparation of its catalyst (一种合成反式1-氯-3, 3, 3-三氟丙烯的方法及其催化剂的制备), CN 106748626A[P], 2017. |
| [45] | Wei M, Kou L G, Wang B, et al. Catalytic gas-phase fluorination of 1, 1, 2, 3- tetrachloropropene to 2-chloro-3, 3, 3-trifluoropropene over the fluorinated Cr2O3- based catalysts[J]. Appl Catal A, 2015, 491: 37–44. |
 2019, Vol. 33
2019, Vol. 33


