2. 浙江师范大学 图文信息中心, 浙江省金华市迎宾大道688号, 浙江 金华 321004
2. Zhejiang Normal University, Graphic information center, No. 688 Yingbin Avenue, Jinhua City, Zhejiang Province, Jinhua 321004, China
一氧化碳(CO)是一种典型的可燃、有毒气体, 且含量过高时会严重危害人体健康, 因此有效消除CO引起了广泛关注[1].低温CO催化氧化是最经济有效的消除方法, 该技术在空气净化、汽车尾气处理、CO气体传感器以及质子膜燃料电池等方面有着广泛应用[2-3].此外, CO氧化反应还常作为催化反应基础研究中的模型反应用于研究催化领域中的一些重要科学问题如结构敏感性、构效关系等[4].主要催化剂体系包括贵金属催化剂(如Au[5-7], Pt[8-9], Pd[10-12]等)和非贵金属催化剂(如Mn[13], Ce[14]等), 这些体系均体现出较高的低温CO氧化活性.
在实际CO低温氧化环境中, 往往存在大量其他气体(如水汽和二氧化碳).大多数贵金属催化剂在CO + O2气氛中具有高活性, 但在CO2和H2O存在时极易失活.大量研究表明CO2加入导致催化剂失活的原因是CO2与CO形成竞争吸附, 并在催化剂表面形成大量碳酸盐, 从而抑制了载体中的氧物种迁移或覆盖了活性位点[15].然而水汽对催化剂反应行为的影响则存在争议.例如, Sebastian等[16]研究发现H2O的加入对Pt-ETS-10催化剂有促进作用, 是由于催化剂表面形成的-OH物种触发了新的反应路径且反应气中H2O的加入有效分解了催化剂表面的碳酸盐物种, 增加了Pt0/Ptn+的比值. Cecilia等[17]发现CuO/Ce0.9Zr0.1O2催化剂在单纯的CO氧化条件下, 100 ℃时CO转化率可达到95%, 同样的温度下, 15%CO2的加入使CO转化率降至62%, 反应气氛中10%H2O与15%CO2的同时加入使CO转化率降至10%.研究表明H2O阻碍了CO与CuO/Ce0.9Zr0.1O2催化剂的界面活性位点的接触, 因此H2O的加入明显抑制了催化剂的活性.而Liu等[18]发现H2O的加入对Au/Fe(OH)3的CO氧化无影响.
综上所述, 研究水汽对贵金属体系上CO氧化反应行为的影响有助于理解H2O的作用机制, 对现实反应条件下高效催化剂的设计也有较好的借鉴作用.因此, 我们制备了4种典型的Pt催化剂(Pt/NiO、Pt/FeOx、Pt/Co3O4和Pt/CeO2), 并研究在4种反应气氛下(98% N2+1% CO + 1% O2、1% CO+ 1% O2 + 88% N2+10% H2O、1% CO+1% O2 + 83% N2+ 15% CO2和1% CO + 1% O2 + 10% H2O+15% CO2+ 73% N2)的CO氧化反应行为.并以Pt/FeOx和Pt/CeO2为代表性催化剂, 结合分步反应和详细的动力学研究, 解释了CO2对两者反应活性的抑制作用, 以及H2O对两者催化剂的不同作用机制.
1 实验部分 1.1 催化剂制备各氧化物载体采用溶胶凝胶法制备.将Co(NO3)2·6H2O(国药, AR, 99%)、Fe(NO3)3·9H2O(国药, AR, 99%)、Ce(NO3)3·6H2O(国药, AR, 99%)或Ni(NO3)2·6H2O(国药, AR, 99%)和柠檬酸(国药, AR, 99%)以摩尔比为1:2溶于50 mL去离子水中, 并在90 ℃下搅拌至凝胶状态, 100 ℃烘干过夜.所得固体经研磨后在空气气氛中以10 ℃/min升温至500 ℃焙烧4 h, 制得不同载体MOx (M=Fe、Ce、Co、Ni).
负载型Pt催化剂采用等体积浸渍法制备.将适量Pt(NO3)2水溶液浸渍MOx载体4 h后, 90 ℃水浴炒干, 于烘箱100 ℃烘干, 最后空气气氛10 ℃/min升温至300 ℃焙烧4 h, 得到1Pt/MOx催化剂. Pt的理论负载量为1%(重量百分比).
1.2 表征通过Quantachrome Autosorb-1型N2物理吸附仪对催化剂进行比表面积测试.测试前样品在真空状态下200 ℃预处理6 h, 随后在-196 ℃下进行测试.
催化剂的物相组成由X射线粉末衍射(XRD)分析测定(Bruker, D8 Advance型).激发光源是Cu Kα靶, 其工作电压与工作电流分别为40 kV和40 mA, 且扫描范围2θ为10°~90°.其物相分析采用MDI Jade6.0软件拟合.
催化剂中各组分的化学状态、表面组成等信息由X射线光电子能谱(XPS)进行分析(Thermal Fischer ESCALAB 250Xi).激发源为单色化Al Kα X射线, 能量为1486.6 eV, 电压和功率分别为20 kV和150 W.各表面物种元素通过表面沉积碳来校正(C ls = 284.8 eV).使用XPSPEAK41对催化剂表面元素进行分析, 进而获得催化剂中表面元素的价态分布和组成含量等信息.
催化剂的还原性能通过氢气程序升温还原(H2-TPR)实验测定.还原气体为5% H2+ 95% N2混合气(经脱氧脱水后使用), 气体流速为30 mL/min, 催化剂装量为30 mg.样品首先在为5% O2 + 95% N2混合气(30 mL/min)中300 ℃下预处理1 h, 降温后切换至在5% H2+ 95% N2混合气中, 程序升温从30~800 ℃且升温速率为10 ℃/min, 通过含TCD检测器的气相色谱测定升温过程中样品耗氢量H2, H2实际消耗量用CuO外标进行标定.
1.3 CO氧化反应活性测试在固定床的反应装置中对催化剂进行活性测试. 50 mg催化剂(0.154~0.125 mm)与100 mg同粒径石英砂混合均匀装入内径为6 mm的反应管中, 4种不同的反应气体分别为98% N2+1% CO + 1% O2、1% CO+1% O2 + 83% N2+ 15% CO2、1% CO+ 1% O2 + 88% N2+ 10% H2O或1% CO + 1% O2 + 15% CO2 + 73% N2+ 10% H2O, 其空速为120 000 mL g-1h-1(气体总流速为100 mL/min).水汽由反应气通过50 ℃下保持的水汽饱和蒸汽发生器获得.反应测试前催化剂经5% H2 + 95% Ar混合气(15 mL/min)在200 ℃下预处理1 h.降温至所需测试温度后切换所需的反应混合气, 待稳定后, 采用配备TCD检测器和TDX~01填充柱的舜宇恒平GC1120气相色谱去分析反应前后气体中CO气体的百分含量.
CO转化率由如下公式计算:
| $ {\rm{CO\ conversion }}/\% = 100 \times \left( {{{[{\rm{CO}}]}_{{\rm{in}}}} - {{[{\rm{CO}}]}_{{\rm{out}}}}} \right)/{[{\rm{CO}}]_{{\rm{in}}}} $ |
其中, [CO]in为CO的入口浓度, [CO]out为CO的出口浓度.
1.4 反应动力学测试反应动力学测试在固定床的反应装置中且在微分模式下进行进行.控制CO转化率 < 15%, 消除传热和传质的影响(具体的计算见补充材料).通过质量流量计改变反应气中CO (0.3~2.0 kPa)和O2 (0.3~2.0 kPa)的初始浓度(气体总流速恒定为100 mL/min)以获得不同反应物配比, 由此可得到一系列不同的CO反应速率, 进而推导相关动力学参数.
2 结果与讨论 2.1 催化剂表征图 1是催化剂的XRD图. 1Pt/NiO催化剂上观察到的物相为NiO(JCPDS No.47-1049)和Ni(JCPDS No. 04-0850).金属Ni的出现可能与制备过程中柠檬酸的使用有关, 柠檬酸具有一定的还原性, 可能将NiO物种在高温时部分还原为金属Ni. 1Pt/FeOx催化剂的物相为赤铁矿α-Fe2O3(JCPDS No.33-0664); 1Pt/Co3O4催化剂的物相为Co3O4(JCPDS No. 42-1467); 1Pt/CeO2催化剂的物相为CeO2(JCPDS No.43-1002).此外, 图中均未发现Pt或PtOx的衍射峰, 表明Pt物种由于负载量较低(1%(重量百分比))而在载体表面高度分散.

|
图 1 1Pt/NiO、1Pt/FeOx、1Pt/Co3O4和1Pt/CeO2催化剂的XRD图 Fig.1 XRD patterns of 1Pt/NiO, 1Pt/FeOx, 1Pt/Co3O4 and 1Pt/CeO2 catalysts |
图 2是各催化剂的H2-TPR图. 1Pt/NiO催化剂在138 ℃和298~335 ℃处分别出现一个微弱的还原峰和一个较大的重叠还原峰, 分别归属于PtOx的还原以及NiO到Nin+和Ni0的还原[19].对于1Pt/FeOx催化剂, 96 ℃处的还原峰归属于PtOx的还原; 275 ℃处的还原峰归属于Fe2O3还原为Fe3O4物种[20], 而在603 ℃左右的还原峰, 归属于Fe3O4还原为FeO或Fe物种[21].对于1Pt/Co3O4催化剂, 161 ℃处的还原峰归属于PtOx物种以及Co3O4还原为Co2+; 317 ℃处的还原峰归属于Co2+还原为Co0物种[22]. 1Pt/CeO2催化剂在110 ℃处的弱还原峰归属于PtOx的还原, 而418 ℃左右的还原峰归属于表面CeO2的还原Ce[23].此外, 我们计算了各催化剂的低温还原耗氢量(< 200 ℃). 1Pt/NiO、1Pt/FeOx、1Pt/Co3O4和1Pt/CeO2催化剂的低温耗氢量分别为0.17、0.22、1.38和0.51 mmol/g.一方面, 各催化剂的低温耗氢量均大于理论值(假设催化剂中Pt全部以PtO2形式存在, 则1%(重量百分比) Pt氧化物的理论耗氢量为0.1 mmol/g), 说明该低温还原峰也包含了由于溢流作用而产生的与Pt物种接触的载体氧化物的还原.另一方面, 各催化剂的低温还原峰位置和耗氢量的差异也反应了Pt物种与载体间相互作用的不同, 继而影响反应行为.
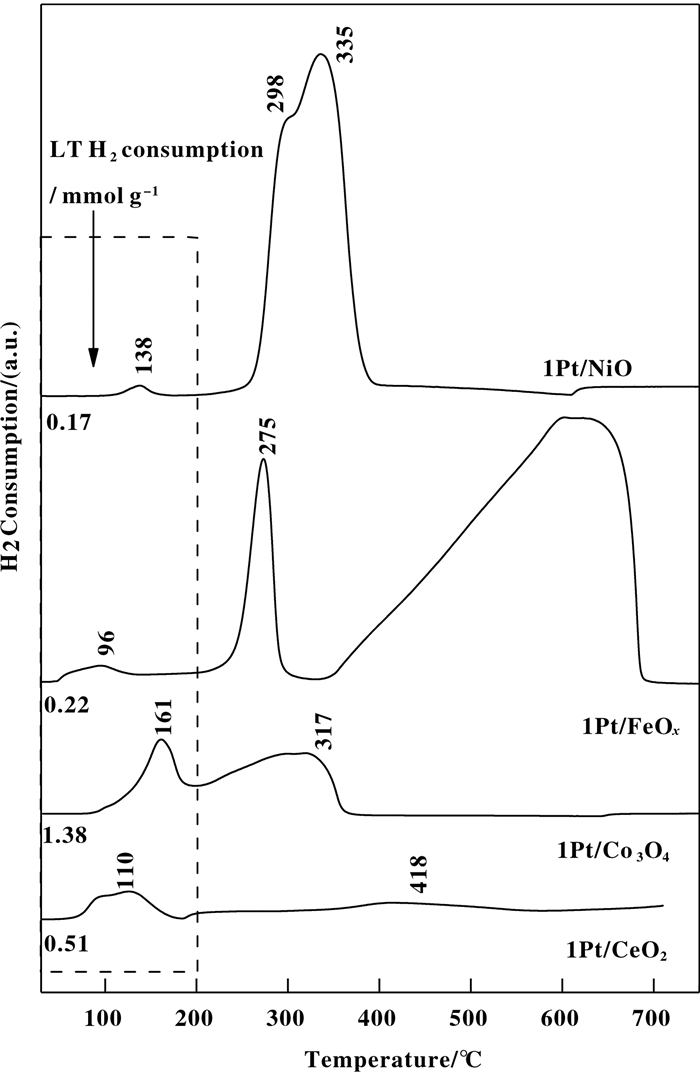
|
图 2 1Pt/NiO、1Pt/FeOx、1Pt/Co3O4和1Pt/CeO2催化剂的H2-TPR图 Fig.2 H2-TPR profiles of 1Pt/NiO, 1Pt/FeOx, 1Pt/Co3O4 and 1Pt/CeO2 catalysts |
图 3是两个代表性催化剂1Pt/CeO2和1Pt/FeOx的Pt 4f与O 1s XPS谱图.从图 3中可以看出, 新鲜(焙烧后)催化剂中含有Pt4+(BE = 74.9 eV)、Pt2+(BE = 72.6 eV)以及少量Pt0(BE = 71.4 eV)物种[24].催化剂经预还原后, Pt0物种含量明显增加, 表明部分PtOx物种被还原为金属态.此外, 在经不同条件下反应后, 催化剂中仍能发现金属态Pt物种, 说明尽管反应气氛中存在氧化性气体O2, 但金属态Pt物种依然能稳定存在.各催化剂中的Pt表面组成数据列于表 1中. 图 4中529.8、531.3和533.6 eV处的结合能分别归属于催化剂中晶格氧物种, 表面羟基和表面碳酸盐氧物种[25].
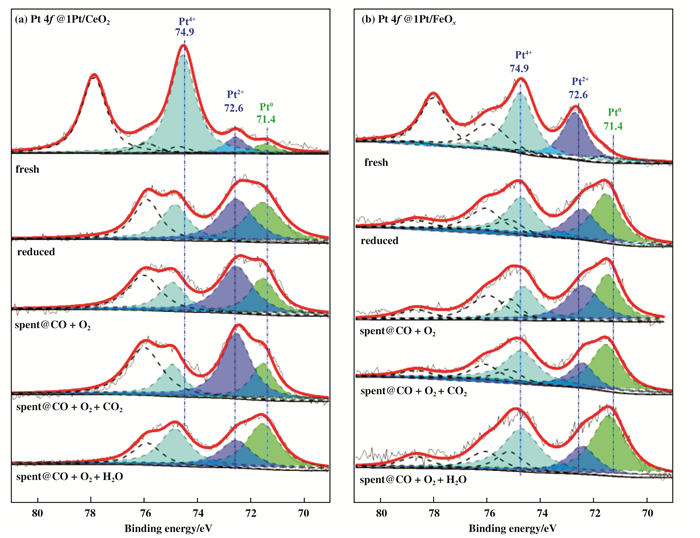
|
图 3 (a) Pt/CeO2和(b) Pt/FeOx催化剂在不同条件下的Pt 4f XPS谱图 Fig.3 Pt 4f XPS spectra of (a) Pt/CeO2 and (b) Pt/FeOx catalysts under different conditions |

|
图 4 (a) Pt/CeO2和(b) Pt/FeOx催化剂在不同条件下的O 1s XPS谱图 Fig.4 O 1s XPS spectra of (a) Pt/CeO2 and (b) Pt/FeOx catalysts under different conditions |
| 表 1 1Pt/CeO2和1Pt/FeOx催化剂在不同条件下的Pt表面组成 Table 1 Surface compositions of different Pt species in 1Pt/CeO2 and Pt/FeOx catalysts under various conditions |
图 5是4种催化剂在98% N2+1% CO + 1% O2、1% CO+1% O2 + 83% N2+ 15% CO2、1% CO+ 1% O2 + 10% H2O + 88% N2和1% CO + 1% O2 + 15% CO2 + 73% N2 +10% H2O不同气氛下的CO氧化的转化率与反应温度的关系图. 4种催化剂在不同反应气氛中表现出不同的活性.在1% CO + 1% O2气氛下, 催化剂的活性顺序为1Pt/CeO2 >1Pt/FeOx>1Pt/Co3O4 > 1Pt/NiO.当反应气中含有15%CO2时, 各催化剂均出现活性下降现象.当反应气中含有10%H2O时, 其对于1Pt/NiO、1Pt/FeOx和1Pt/Co3O4 3种催化剂表现出不同程度的活性促进作用, 且促进作用程度为1Pt/FeOx> 1Pt/Co3O4 >1Pt/NiO, 但H2O的存在对1Pt/CeO2催化剂却表现出明显抑制作用.当反应气中同时存在15% CO2 + 10% H2O时, 1Pt/CeO2催化剂的活性与1% CO + 1% O2+ 98% N2时相比下降更为明显, 表明该催化剂上同时受到CO2和H2O的双重抑制作用; 而在另3个催化剂上活性则有所提高, 表明在这些催化剂上H2O的促进作用与CO2的抑制作用相互抵消, 但H2O的促进作用更为明显.
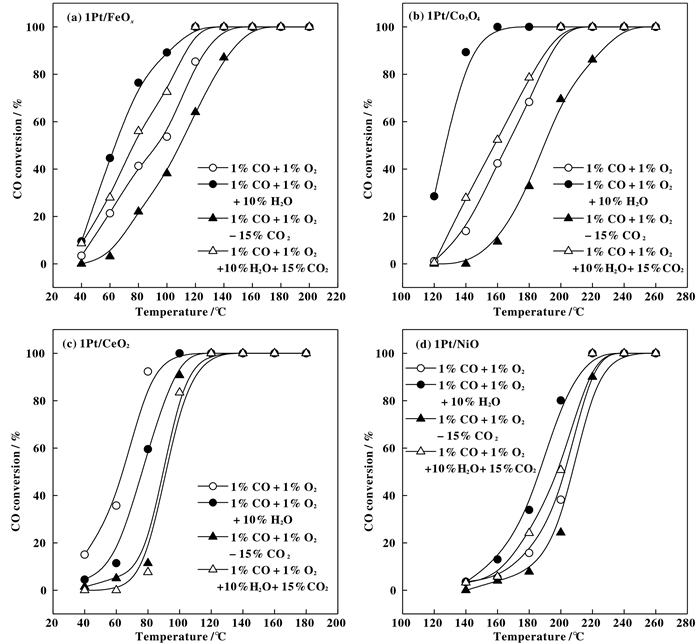
|
图 5 (a) 1Pt/FeOx、(b) 1Pt/Co3O4、(c) 1Pt/CeO2和(d) 1Pt/NiO催化剂在不同反应条件下的CO氧化反应活性图 Fig.5 Light-off curves of CO oxidation over (a) Pt/FeOx, (b) Pt/Co3O4, (c) Pt/CeO2 and (d) Pt/NiO catalysts under different reaction conditions |
为了更直观的比较各催化剂在不同反应条件下的活性, 我们对比了T50温度(CO转化率为50%时所需反应温度).如图 6所示, 在1% CO + 1% O2 + 98% N2条件下, 1Pt/CeO2催化剂的T50温度最低(64 ℃), 而1Pt/NiO催化剂的T50温度最高(203 ℃).在1% CO + 1% O2 + 15% CO2+ 83% N2条件下, 各催化剂T50温度均有所上升(活性降低).在1% CO + 1% O2 + 10% H2O+ 88% N2条件下, 除1Pt/CeO2催化剂外, 其余催化剂的T50温度均有不同程度下降(活性提高).

|
图 6 各催化剂在不同反应条件下的CO氧化反应T50温度 Fig.6 Comparison of T50 temperatures of various catalysts under different reaction conditions |
我们还考察了代表性催化剂1Pt/FeOx和1Pt/CeO2的反应稳定性, 结果如图 7a所示.对于1Pt/FeOx催化剂(反应温度为100 ℃), 在1% CO + 1% O2+98% N2条件下反应2 h后就发生快速失活现象; 而在1% CO + 1% O2 + 15% CO2 + 10% H2O + 73% N2条件下, 催化剂在反应25 h后仍保持活性稳定, 表明该催化剂具有良好的抗H2O与CO2性能.与此相反, 1Pt/CeO2催化剂(反应温度为80 ℃)在两种反应条件下均出现快速失活, 表明其稳定性较差.为了进一步探究该两种催化剂的反应行为, 我们进行了分步实验, 结果如图 7b所示.在1% CO+ 1% O2+98% N2条件下(S1)反应2 h后, 两种催化剂活性均有所下降; 当反应气中加入15% CO2后(S2), 两者活性进一步下降, 且失活速率在反应2~3 h内十分明显, 此后失活略显平缓.将CO2从反应气氛中移除后(S3), 催化剂活性有所提高, 但无法恢复到反应初期水平.随后将催化剂在反应温度下用10% H2O水汽吹扫1 h后(S4), 反应气氛重新切换成1% CO + 1% O2+98% N2(S5), 此时1Pt/CeO2催化剂活性持续下降, 而1Pt/FeOx催化剂的活性则可以恢复到初始水平(但随后缓慢下降).
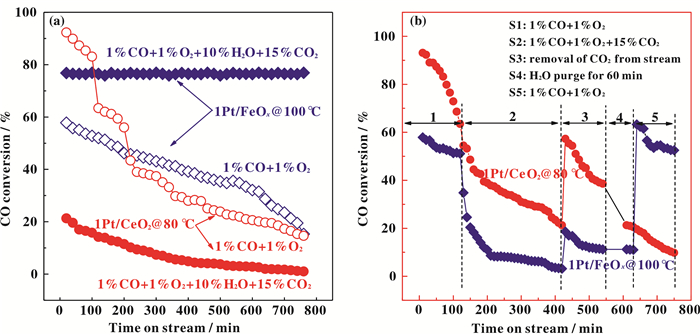
|
图 7 1Pt/CeO2和1Pt/FeOx催化剂在不同反应条件下的(a)稳定性图和(b)分步反应活性图 Fig.7 (a) stability and (b) staged reaction of 1Pt/FeOx and 1Pt/CeO2 catalysts under different reaction conditions |
对于负载于可还原性氧化物(过渡金属氧化物)载体上的Pt催化剂, 其CO氧化反应行为和构效关系已经受到广泛研究.众多文献结果表明, Pt与载体之间产生的界面位点是CO氧化的活性位, 其中Pt物种提供CO的吸附活化位置, 而载体氧化物则提供O2活化位置或者载体中的晶格氧直接参与反应[26-29].因此, 催化剂的可还原性质(尤其是低温还原性质)对反应活性起到了关键作用.本工作中, H2-TPR结果表明1Pt/CeO2和1Pt/FeOx催化剂具有较低的低温还原温度(分别为110和96 ℃), 且具有较高的耗氢量(分别为0.51和0.22 mmol/g), 因此这两种催化剂具有较高的反应活性.而1Pt/Co3O4催化剂尽管其低温耗氢量最大(1.38 mmol/g), 但由于其还原温度较高(161 ℃), 因此低温活性较低.这可能与催化剂较低的比表面积有关(1Pt/CeO2、1Pt/FeOx、1Pt/Co3O4和1Pt/NiO催化剂的比表面积分别是20.2、15.9、3.8和3.4 m2/g).
而对于CO2对反应的抑制作用在文献中也有报道. CO2作为反应产物, 容易在催化剂表面生成碳酸盐并堵塞活性位, 从而导致催化剂失活[30].为了验证这一观点, 我们比较了1Pt/CeO2和1Pt/FeOx催化剂的C 1s XPS谱图, 如图 8所示.图中位于结合能284.8和288.4 eV处的谱峰分别归属于催化剂中污染碳和碳酸盐物种[31].对于1Pt/CeO2催化剂, 在1% CO + 1% O2+98% N2条件下反应后, 碳酸盐物种表面含量由新鲜催化剂中的8.1%升高至13.2%, 表明在反应过程中有碳酸盐的生成, 从而导致催化剂的失活.该现象在1% CO + 1% O2 + 15% CO2+ 83% N2条件下更为明显(碳酸盐物种含量升高至21.8%), 进一步说明CO2的加入能加速碳酸盐的生成并加剧催化剂失活.值得注意的是, 在分步反应中(图 7b), 将CO2从反应气氛中移除能部分恢复催化剂活性, 说明除了生成表面碳酸盐外, CO2还可能与CO在催化剂表面形成竞争吸附, 从而降低反应活性(催化剂失活).但该竞争吸附很可能是可逆的, 因此将CO2移除后活性得以部分恢复(有关CO2和CO的竞争吸附我们将在动力学实验部分详细解释).在反应气氛中加入H2O后, 表面碳酸盐的含量有所降低(9.1%), 但仍高于预还原催化剂中的含量(8.1%), 因此催化剂的失活情况依然存在.对于1Pt/FeOx催化剂, 在1% CO + 1% O2+98% N2条件下的失活也可归因于表面碳酸盐的生成, 但其含量(8.5%)较1Pt/CeO2催化剂在相同条件下低, 因此失活较为缓慢(图 6).有趣的是, 在1% CO + 1% O2 + 10% H2O+ 88% N2条件下, 表面碳酸盐含量有所降低(7.0%), 表明在该催化剂上H2O的加入能有效分解碳酸盐, 从而保持其稳定性, 这些现象与图 4的O 1s XPS谱图现象一致.

|
图 8 (a) 1Pt/CeO2和(b) 1Pt/FeOx催化剂在不同条件下的C 1s XPS谱图 Fig.8 C 1s XPS spectra of (a) Pt/CeO2 and (b) Pt/FeOx catalysts under different conditions |
因此, 由分步反应结果(图 7b)和XPS结果(图 8)可以得出结论, 1Pt/CeO2和1Pt/FeOx催化剂在1% CO + 1% O2+98% N2条件下均出现的失活现象, 是由于在反应过程中, 催化剂的表面生成了碳酸盐(在CO2加入的情况下尤为明显).而H2O的加入对于1Pt/CeO2催化剂的失活并无缓解; 而对于1Pt/FeOx催化剂, H2O的加入能促进碳酸盐的分解, 进而促进其稳定性.
2.3 反应动力学研究上述的实验结果在一定程度上解释了1Pt/CeO2和1Pt/FeOx催化剂上CO2导致的催化剂失活原因, 以及H2O对表面碳酸盐的分解作用.但我们也推测CO2可能与CO存在竞争吸附的情况(因为分步反应中CO2的移除能恢复一部分催化活性); 更为重要的是, H2O的存在不仅保持了1Pt/FeOx催化剂的稳定性, 更提高了反应活性.为了澄清上述问题, 我们进行了动力学实验, 考察了4种不同反应气氛下(1%CO + 1%O2+ 98%N2、1%CO+1%O2 + 15%CO2 + 83%N2、1%CO+ 1% O2 + 10%H2O+ 88%N2或1%CO + 1% O2+ 15%CO2 + 10%H2O+ 73%N2)1Pt/CeO2和1Pt/FeOx催化剂上的CO氧化反行为.
通过排除传质传热影响的动力学数据(表S1-S2, 图S1-S2), 我们得到了不同反应条件下1Pt/CeO2和1Pt/FeOx催化剂上的表观反应速率常数(kapp)以及CO和O2的反应级数, 结果列于表 2中.首先, 1Pt/CeO2催化剂上, 当反应气中加入CO2或H2O或CO2 + H2O时, 其表观速率常数由1%CO + 1%O2 + 98%N2条件下的5.76×10-6下降为0.94~2.42×10-6, 表明反应受到CO2或H2O的抑制, 与宏观反应结果一致(图 4c); 其次, CO分压的反应级数随着CO2或H2O或CO2 + H2O的加入有所增加(由0.20增加至0.31~0.39), 表明CO2或H2O在反应过程中与CO形成竞争吸附, 导致CO在催化剂表面的覆盖度降低, 从而导致活性降低.而对于O2的反应级数, 在4种反应条件下均保持基本不变(0.01~0.04), 表明气相氧物种并未直接参与反应.对于1Pt/FeOx催化剂, 在反应中加入15% CO2时, 表观速率常数有所降低(由1.52×10-6降至1.04×10-6), 而在反应中加入10% H2O后, 速率常数提高了一倍(3.02×10-6), 表明H2O的加入对催化活性有促进作用.在上述的4种反应气氛下, CO与O2反应级数分别在0.27~0.62和0.02~0.04之间; 在1% CO + 1% O2 + 98% N2反应条件下, CO的反应级数为0.27, 当反应气氛引入CO2后, 发现反应级数从0.27增加至0.53, 当反应气氛引入H2O后, 发现反应级数从0.27增加至0.60, CO反应级数的升高是由于CO2和H2O的加入与CO在催化剂上形成明显的竞争吸附, 削弱了CO的吸附.但CO2和H2O的加入对反应活性有不同的影响, H2O有促进作用, 而CO2对其有抑制作用.图S3中我们对实验值和根据推导的动力学参数计算的理论值进行了比较和误差分析, 发现实验值和理论值相吻合且误差值在15%以内, 表明推导的动力学参数是可靠的.
| 表 2 1Pt/CeO2和1Pt/FeOx催化剂在4种反应条件下的动力学数据 Table 2 Kinetic data of Pt/FeOx catalyst under four reaction conditions |
我们通过动力学数据(表S3和S4)进一步计算了两种催化剂在不同反应条件下的表观活化能.由阿伦尼乌斯图(图 9)推导出的表观活化能数据列于表 2.对于1Pt/CeO2催化剂, 其在1% CO + 1% O2 + 98% N2反应条件下活化能为20.8 ± 1.7 kJ/mol; 在1% CO+ 1% O2 + 10% CO2 + 88% N2反应条件下活化能为51.5 ± 4.2 kJ/mol, H2O的加入使活化能升高为40.7 ± 5.0 kJ/mol.当同1% CO + 1% O2 + 15% CO2 + 10% H2O+ 73% N2时, 活化能为57.4 ± 3.3 kJ/mol, 相比于1% CO+ 1% O2 + 10% H2O + 88% N2条件下更高, 所得结果都与图 5c中宏观反应活性一致.不同反应条件下的活化能再次证明了H2O与CO2对CO氧化催化均具有抑制作用.对于1Pt/FeOx催化剂, 其在1% CO + 1% O2 + 98% N2反应条件下活化能为33.5 ± 4.1 kJ mol-1; 在1% CO+1% O2 + 15% CO2 + 83% N2反应条件下活化能为44.1 ± 3.8 kJ mol-1, H2O的加入使活化能降低为17.1 ±3.5 kJ mol-1, 和图 2a中H2O的促进作用相对应.当同1% CO + 1% O2 + 15% CO2 + 10% H2O+ 73% N2时, 活化能为28.6 ± 3.4 kJ mol-1, 相比于1% CO+ 1% O2 + 10% H2O + 88% N2条件下略高, 比1% CO+ 1% O2 + 98% N2时低, 所得结果都与图 5a反应活性一致.不同反应条件下的活化能再次证明了H2O对CO氧化催化具有促进作用, 而CO2对其有抑制作用.

|
图 9 (a) 1Pt/CeO2和(b) 1Pt/FeOx催化剂在不同反应条件下的表观活化能Arrhenius图 Fig.9 Arrhenius plots of (a) 1Pt/CeO2 and (b) 1Pt/FeOx catalysts under various reaction conditions |
大量文献已报道研究了Pt负载于还原性氧化物载体(CeO2、Fe2O3和TiO2)上的CO氧化反应机理, 通常认为反应发生在金属与载体界面(界面反应)[32-33], 即CO吸附在表面Pt原子上, 氧物种通常吸附于载体上或者是晶格氧参与了化学反应, 后者(晶格氧参与反应)中O2的反应级数几乎为0, 因此反应可能遵循Mars van-Krevelen(M-K)机理. CO在表面Pt原子上经化学吸附与载体中的晶格氧反应, 产生氧空位后被气相中的氧原子填充.
在反应气氛中加入H2O后, 1Pt/FeOx催化剂的活性增加, 有可能引发了新的反应例如水汽变换反应(CO + H2O → CO2 + H2).但在本反应中, 我们并未检测到任何H2的生成, 而且该催化剂在CO+H2O反应条件下, 低温时并不发生反应(图S4).因此水汽变换反应的可能性可以排除.
通过分析上述实验结果, 我们猜测H2O的促进作用可能是由于H2O促使CO氧化引发了一条与纯相气氛(1% CO + 1% O2 + 98% N2)中不同的新反应路径.例如, Sun等[34]通过DFT计算和实验结果相结合探究了H2O的促进作用, 表明了CO分子和在Au上解离形成的羟基基团-OH(H2O)之间的反应相比于CO与表面O物种反应更容易.而且, Jin等[35]通过实验结果表明在FeO(111)/Pt(111)催化剂上H2O的作用是活化FeO(111)上的晶格氧, 在FeO(111)-Pt(111)界面形成的羟基基团, 进一步与CO反应生成CO2. Lin等[36]也探究了富氢条件下Ir/Fe(OH)x催化剂上的CO氧化,发现H2O解离形成-OH基团从而促进CO氧化. Wang等[37]探究了单原子Pt在Pt1/CeO2催化剂上CO氧化时H2O的促进作用机理, 通过同位素追踪和DFT理论计算, 说明有一半的H2O直接参与了反应, 由于CO与-OH(H2O解离)反应形成羧基中间体, 之后H从羧基中脱离与晶格-OH再次生成H2O, 因此作者认为反应遵循M-K机理.
基于动力学结果和文献调研, 我们推导了不同反应条件下的反应基元步骤, 如表 3所示.在1% CO + 1% O2 + 98% N2或1% CO + 1% O2 + 15% CO2 + 83% N2条件下, 基元步骤如下: CO化学吸附在表面Pt原子上(eq. 1); CO与晶格氧反应生成CO2(eq. 2); CO2从Pt表面脱附(eq. 3);气相氧填充氧空位(eq. 4). Eq.2是决速步, 其反应速率表达式r= kKCOPCO[M-O]/(1+KCOPCO+KCO2PCO2), 其中[M-O]是催化剂表面晶格氧的浓度.反应速率随着CO的分压增加而增加, 随着CO2分压的增加而减少, 与动力学结果一致, 并与CO2的抑制作用相符合.由于CO2浓度在反应条件为CO + O2时非常低, 因此表达式由r=kKCOPCO[M-O]/(1+KCOPCO+KCO2PCO2)简化为r=kKCOPCO [M-O]/(1+KCOPCO).而在CO + O2 + H2O条件下, 其基元步骤包括CO的化学吸附(eq. 1’); H2O在载体上解离形成-OH物种(eq. 2’); CO和-OH之间的界面反应形成了羧基物种-COOH(RDS, eq. 3’); -COOH分解为CO2和-H(eq. 4’); -H和-OH反应形成H2O(eq. 5’); 气相中的O2填补氧空位(eq.6’), 因此反应速率表达式r = kKCOPCOKH2OPH2O/[(1+KCOPCO)(1+KH2OPH2O)].
| 表 3 Pt/FeOx和Pt/CeO2催化剂在不同反应条件下的基元步骤 Table 3 Proposed elementary steps on Pt/FeOx和Pt/CeO2 catalyst under different conditions |
根据上述基元步骤推导的反应速率方程以及表S1~S2中的动力学数据, 我们采用非线性拟合方法拟合了动力学参数, 结果列于表 4.对于1Pt/CeO2催化剂, 其本征反应速率常数k在1% CO + 1% O2 +98% N2条件下为2.68×10-5 mol g-1 s-1, 但在CO2或H2O存在条件下, 其数值均大幅度下降, 分别为0.70×10-5 mol g-1 s-1和1.57×10-5mol g-1 s-1.同时, CO吸附平衡常数也由1% CO + 1% O2 + 98% N2条件下的1.30 kPa-1分别降低为0.24 kPa-1和0.58 kPa-1, 而CO2和H2O的吸附平衡常数皆为11.1 kPa-1, 表明CO2或H2O的加入与CO形成了竞争吸附且CO2和H2O的吸附更强, 导致CO在催化剂表面的覆盖度降低, 从而抑制了催化活性.而对于1Pt/FeOx催化剂, 其本征反应速率常数k在1% CO + 1% O2 + 98% N2条件下为0.73×10-5 mol g-1 s-1, 但在H2O存在条件下, 其数值提高了一倍(1.84×10-5 mol g-1 s-1), 表明CO与羟基间的反应更为快速(大于CO和晶格氧间的反应速率).同时, CO吸附平衡常数也由1% CO + 1% O2 + 98% N2条件下的1.10 kPa-1分别降低为0.41和0.57 kPa-1, 表明CO2或H2O的加入与CO形成了竞争吸附且CO2和H2O的吸附更强, 导致CO在催化剂表面的覆盖度降低.值得注意的是, H2O的加入尽管降低了CO的表面覆盖度, 但由于CO与H2O在表面解离形成的羟基间的反应更加容易, 导致反应活性升高(反应速率常数变大).因此, 动力学结果解释了2种催化剂在不同反应条件下的行为差异. CO2与CO的竞争吸附是导致催化剂活性降低的原因之一, 而H2O对1Pt/FeOx催化剂的促进作用可归因于CO与表面羟基间的快速反应.但为何H2O对1Pt/CeO2催化剂无促进作用目前尚不清楚, 需要进一步实验探讨.
| 表 4 Pt/CeO2和Pt/FeOx催化剂在不同反应条件下推导出的动力学参数(反应温度= 80 ℃) Table 4 Derived kinetic parameters of Pt/CeO2and Pt/FeOx catalysts under different reaction conditions (T = 80 ℃) |
我们对1Pt/NiO、1Pt/FeOx、1Pt/Co3O4和1Pt/CeO2 4种催化剂进行了CO氧化活性及其抗H2O和抗CO2性能的研究, 发现在1% CO + 1% O2+ 98% N2气氛中, 催化剂的活性顺序为1Pt/CeO2 >1Pt/FeOx>1Pt/Co3O4 >1Pt/NiO, 当反应气中含有15%CO2、10%H2O或15%CO2+10%H2O时, CO2的存在严重抑制了催化剂的CO催化活性, 而H2O对于1Pt/NiO、1Pt/FeOx和1Pt/Co3O4 3种催化剂表现出不同程度的促进作用, 对于1Pt/CeO2催化剂却表现出抑制作用.实验结果表明CO2的加入一方面会生成表面碳酸盐, 另一方面与CO形成竞争吸附, 两者导致了催化剂活性和稳定性的降低.而H2O的加入对1Pt/CeO2催化剂的活性抑制作用可归因其与CO的竞争吸附; 但对于1Pt/FeOx催化剂, H2O的加入对催化剂稳定性和反应活性有明显促进作用, 可归因于H2O的加入能有效地分解碳酸盐物种, 因此维持了催化剂的稳定性; 而CO与载体上H2O解离形成-OH的界面反应较快, 开辟了一条新的反应路径, 从而提高了催化活性.
| [1] |
Wu H C, Liu L C, Yang S M. Effects of additives on supported noble metal catalysts for oxidation of hydrocarbons and carbon monoxide[J]. Appl Catal A:Gener, 2001, 211: 159–165.
DOI:10.1016/S0926-860X(00)00869-3 |
| [2] |
Yuan Y, Kozlova A P, Iwasawa Y, et al. Supported Au catalysts prepared from Au phosphine complexes and as-precipitated metal hydroxides:characterization and low-temperature CO oxidation[J]. J Catal, 1997, 170: 191–199.
DOI:10.1006/jcat.1997.1752 |
| [3] |
Pozdnyakova O, Teschner D, Wootsch A, et al. Preferential CO oxidation inhydrogen (PROX) on ceria-supported catalysts, part Ⅱ:Oxidation states and surface species on Pd/CeO2 under reaction conditions, suggested reaction mechanism[J]. J Catal, 2006, 237(1): 17–28.
|
| [4] |
McClure S M, Goodman D W. New insights into catalytic CO oxidation on Pt-group metals at elevated pressures[J]. Chem Phys Lett, 2009, 469(1/3): 1–13.
|
| [5] |
Li Jing(李靖), Wang Jiang(王奖), Jia Mei-lin(贾美林), et al. Preparation of Ni-Al mixed oxide/mesoporous hangjin 2# clay-supported gold catalyst and their catalytic performance for CO oxidation Ni-Al(复合氧化物/介孔杭锦2#土负载Au催化剂制备及其CO氧化催化性能)[J]. J Mol Catal (China)(分子催化), 2018, 32(6): 530–539.
|
| [6] |
Zhu Lin-hua(祝琳华), Li Feng-long(李奉隆), Si Tian(司甜), et al. Preparation of layered clay-supported gold catalysts and catalytic activity for CO oxidation at room temperature(层状粘土负载的金催化剂制备及其常温催化氧化活性)[J]. J Mol Catal (China)(分子催化), 2016, 30(1): 46–53.
|
| [7] |
Su Hui-juan(苏慧娟), Xu You-bing(许有兵), Xu Xiu-feng(徐秀峰), et al. Low temperature CO oxidation over KOH-modified Au/Al2O3 catalysts(KOH修饰的Au/Al2O3催化剂对低温CO氧化反应的催化性能)[J]. J Mol Catal(China)(分子催化), 2011, 25(1): 44–48.
|
| [8] |
Ko E Y, Park E D, Lee H C, et al. Supported Pt-Co catalysts for selective CO oxidation in a hydrogen-rich stream[J]. Angew Chem Inter Edit, 2007, 46(5): 734–737.
DOI:10.1002/anie.200603144 |
| [9] |
Nie L, Mei D, Xiong H, et al. Activation of surface lattice oxygen in single-atom Pt/CeO2 for low-temperature CO oxidation[J]. Science, 2017, 358(6369): 1419–1423.
DOI:10.1126/science.aao2109 |
| [10] |
Jin M, Liu H, Zhang H, et al. Synthesis of Pd nanocrystals enclosed by {100} facets and with sizes < 10 nm for application in CO oxidation[J]. Nano Res, 2010, 4(1): 83–91.
|
| [11] |
Lang S M, Fleischer I, Bernhardt T M, et al. Low-temperature CO oxidation catalyzed by free palladium clusters:Similarities and differences to Pd surfaces and supported particles[J]. ACS Catal, 2015, 5(4): 2275–2289.
DOI:10.1021/cs5016222 |
| [12] |
Wang L, Pu C, Xu L, et al. Effect of supports over Pd/Fe2O3 on CO oxidation at low temperature[J]. Fuel Proce Technol, 2017, 160: 152–157.
DOI:10.1016/j.fuproc.2017.02.037 |
| [13] |
Liang S, Bulgan F T G, Zong R, et al. Effect of phase structure of MnO2 nanorod catalyst on the activity for CO oxidation[J]. J Phys Chem C, 2008, 112(14): 5307–5315.
DOI:10.1021/jp0774995 |
| [14] |
Mao De-shou(冒德寿), Luo Zi-hao(罗子豪), Li Zhi-yu(李智宇), et al. Transition metal doped ceria-zirconia solid solution templated by tobacco for catalytic oxidation of CO(烟草模板制备掺杂过渡金属铈锆固溶体及其催化氧化CO性能研究)[J]. J Mol Catal (China)(分子催化), 2018, 32(4): 315–324.
|
| [15] |
Fujitani T, Nakamura I. Mechanism and active sites of CO oxidation over single-crystal Au surfaces and a Au/TiO2(110) model surface[J]. Chin J Catal, 2016, 37(10): 1676–1683.
DOI:10.1016/S1872-2067(16)62516-0 |
| [16] |
Sebastian V, Irusta S, Mallada R, et al. Selective oxidation of CO in the presence of H2, CO2 and H2O, on different zeolite-supported Pt catalysts[J]. Appl Catal A:Gener, 2009, 366(2): 242–251.
DOI:10.1016/j.apcata.2009.06.044 |
| [17] |
Antonio C J, ArangoD A, RicoP V, et al. The influence of promoters (Zr, La, Tb, Pr) on the catalytic performance of CuO-CeO2 systems for the preferential oxidation of CO in the presence of CO2 and H2O[J]. Catal Today, 2015, 253: 115–125.
DOI:10.1016/j.cattod.2015.02.012 |
| [18] |
Liu H, Kozlov A I, Kozlova A P, et al. Active oxygen species and reaction mechanism for low-temperature CO oxidation on an Au catalyst prepared from Fe2O3-supported Au(PPh3)(NO3) and as-precipitated iron hydroxide[J]. Phys Chem Chem Phys, 1999, 1(11): 2851–2860.
DOI:10.1039/a901358j |
| [19] |
Sapi A, Halasi G, Kiss J, et al. In situ DRIFTS and NAP-XPS exploration of the complexity of CO2 hydrogenation over size-controlled Pt nanoparticles supported on mesoporous NiO[J]. J Phys Chem C, 2018, 122(10): 5553–5565.
DOI:10.1021/acs.jpcc.8b00061 |
| [20] |
Li P, Miser D E, Rabiei S, et al. The removal of carbon monoxide by iron oxide nanoparticles[J]. Appl Catal B:Environ, 2003, 43(2): 151–162.
DOI:10.1016/S0926-3373(02)00297-7 |
| [21] |
Zielinski J, Zglinicka I, Znak L, et al. Reduction of Fe2O3 with hydrogen[J]. Appl Catal A:Gener, 2010, 381(1/2): 191–196.
|
| [22] |
Xia Y, Dai H, Zhang L, et al. Ultrasound-assisted nanocasting fabrication and excellent catalytic performance of three-dimensionally ordered mesoporous chromia for the combustion of formaldehyde, acetone, and methanol[J]. Appl Catal B:Environ, 2010, 100(1/2): 229–237.
|
| [23] |
Liu H H, Wang Y, Jia A P, et al. Oxygen vacancy promoted CO oxidation over Pt/CeO2 catalysts:A reaction at Pt-CeO2 interface[J]. Appl Surf Sci, 2014, 314: 725–734.
DOI:10.1016/j.apsusc.2014.06.196 |
| [24] |
Jain D, Madras G. Mechanistic Insights and kinetics of CO oxidation over pristine and noble metal modified Fe2O3using diffuse reflectance infrared Fourier transform spectroscopy[J]. Indus Engineer Chem Res, 2017, 56(8): 2008–2024.
DOI:10.1021/acs.iecr.6b04856 |
| [25] |
Qi L, Cheng B, Yu J, et al. High-surface area mesoporous Pt/TiO2 hollow chains for efficient formaldehyde decomposition at ambient temperature[J]. J Hazard Mater, 2016, 301: 522–530.
DOI:10.1016/j.jhazmat.2015.09.026 |
| [26] |
Ro I, Aragao I B, Chada J P, et al. The role of Pt-FexOy interfacial sites for CO oxidation[J]. J Catal, 2018, 358: 19–26.
DOI:10.1016/j.jcat.2017.11.021 |
| [27] |
Chen H, Liu Y, Yang F, et al. Active phase of FeOx/Pt catalysts in low-temperature CO oxidation and preferential oxidation of CO reaction[J]. J Phys Chem C, 2017, 121(19): 10398–10405.
DOI:10.1021/acs.jpcc.7b01392 |
| [28] |
An K, Alayoglu S, Musselwhite N, et al. Enhanced CO oxidation rates at the interface of mesoporous oxides and Pt nanoparticles[J]. J Am Chem Soc, 2013, 135(44): 16689–16696.
DOI:10.1021/ja4088743 |
| [29] |
Mu R, Fu Q, Xu H, et al. Synergetic Effect of surface and subsurface Ni species at Pt-Ni bimetallic catalysts for CO oxidation[J]. J Am Chem Soc, 2011, 133(6): 1978–1986.
DOI:10.1021/ja109483a |
| [30] |
Boccuzzi F, Chiorino A, Manzoli M, et al. Au/TiO2nanosized samples:A catalytic, TEM, and FTIR study of the effect of calcination temperature on the CO oxidation[J]. J Catal, 2001, 202(2): 256–267.
DOI:10.1006/jcat.2001.3290 |
| [31] |
Mudiyanselage K, Senanayake S D, Feria L, et al. Importance of the metal-oxide interface in catalysis:In situ studies of the water-gas Shift reaction by ambient-pressure X-ray photoelectron spectroscopy[J]. Angew Chem Inter Edit, 2013, 52(19): 5101–5105.
DOI:10.1002/anie.201210077 |
| [32] |
Zielinski J, Zglinicka I, Znak L, et al. Reduction of Fe2O3 with hydrogen[J]. Appl Catal A:Gener, 2010, 381(1/2): 191–196.
|
| [33] |
Li N, Chen Q Y, Luo L F, et al. Kinetic study and the effect of particle size on low temperature CO oxidation over Pt/TiO2 catalysts[J]. Appl Catal B:Environ, 2013, 142.
|
| [34] |
Sun K, Kohyama M, Tanaka S, et al. Roles of water and H2 in CO oxidation reaction on gold catalysts[J]. J Phys Chem C, 2018, 122(17): 9523–9530.
DOI:10.1021/acs.jpcc.8b01802 |
| [35] |
Jin Y, Sun G, Xiong F, et al. Water-activated lattice oxygen in FeO(111) islands for low-temperature oxidation of CO at Pt-FeO interface[J]. J Phys Chem C, 2016, 120(18): 9845–9851.
DOI:10.1021/acs.jpcc.6b02256 |
| [36] |
Lin J, Qiao B, Li L, et al. Remarkable effects of hydroxyl species on low-temperature CO (preferential) oxidation over Ir/Fe(OH)x catalyst[J]. J Catal, 2014, 319: 142–149.
DOI:10.1016/j.jcat.2014.08.011 |
| [37] |
Wang C, Gu X K, Yan H, et al. Water-mediated mars-van krevelen mechanism for CO oxidation on ceria-supported single-atom Pt1catalyst[J]. ACS Catal, 2016, 7(1): 887–891.
|
 2019, Vol. 33
2019, Vol. 33


