近年来, 来自化学、纺织、塑料、皮革以及食品等行业废水排放造成的环境污染问题引发人们的高度关注.废水中主要污染物是有机染料, 这些水溶性染料在感官上令人不悦, 消耗溶解氧并且阻碍太阳光穿透, 从而影响水生生物生长, 对生态环境造成严重破坏.亚甲基蓝(MB)是经常使用的碱性染料, 这种染料会对人类的生存和身心健康产生严重影响, 如心跳增加、呕吐腹泻等.因此, 从工业废水中去除这种染料已经成为一件紧迫且至关重要的事情[1].目前, 常用的工业废水处理方法包括吸附法、光催化法、离子交换法、化学氧化等[2].其中光催化法被认为是最具前途的方法之一[3].
TiO2半导体具有良好的生物和化学稳定性, 具有无与伦比的光化学分解能力, 是废水净化研究最为广泛的光催化材料[4-5].然而, 由于TiO2宽带隙和光生电子空穴对的快速复合以及TiO2较低的量子效率限制, 阻碍了TiO2的广泛应用[6].光吸收是光催化过程中的重要一环, 开发全太阳光谱光催化剂成为当前研究热点[7], 将TiO2的光吸收从紫外光区扩展到可见光区和近红外光区, 例如掺杂金属和非金属[8-9]或与其他带有较窄带隙的金属氧化物偶联[10].实验结果表明:掺杂Fe、Co和Ni等过渡金属改性TiO2, 可以减小带隙宽度和降低光生电子空穴对的复合, 能显著提高TiO2的光催化活性[11].
石墨烯及其衍生物具有较高的比表面积和优越的电子迁移率, 与常规半导体材料相比具有独特的电学和电子特性[12-15], 能够有效分离光生电子和空穴并抑制它们的复合[16-21].另外, 石墨烯π-π相互作用使其具有优异的吸附性能, 其光学吸收、机械强度和化学稳定性使其成为光催化高效助催化剂[12-13], 例如石墨烯-TiO2异质结构光催化剂的光催化活性得到增强[14].但是, 由于TiO2带隙较宽(3.2 eV), 导致石墨烯改性TiO2没有可见光响应[22].因此, 我们提出石墨烯负载Co掺杂TiO2废水处理用光催化制备构想.
限制TiO2-Co/rGO催化剂应用的主要问题之一是将光催化剂与反应溶液分离, 磁性光催化剂提供了一种在磁场中分离催化剂和水溶液的实用方法.因此, 在这项研究中, 我们制备了一种由rGO负载的新型Fe3O4@SiO2@TiO2-Co光催化剂.通过设计Fe3O4核芯为催化剂提供磁性.为了防止由于铁离子破坏TiO2晶体结构而导致的TiO2催化活性的降低, 利用SiO2对Fe3O4进行封装. Fe3O4@SiO2@TiO2-Co/rGO具有分散性好, 吸附性强, 易回收的特点.同时以亚甲基蓝(MB)为降解对象, 研究Co掺杂量、溶液pH值、MB溶液初始浓度以及各种干扰离子(Cl-、SO42-、CO32-)对光催化活性的影响.
1 实验部分 1.1 试剂与仪器氧化石墨烯, 深圳图灵进化科技有限公司生产; Fe3O4, 洛阳彤润信息科技有限公司生产; 钛酸正丁酯(TBOT)、正硅酸乙酯(TEOS)、亚甲基蓝(MB)、十二烷基苯磺酸钠(SDBS)、硝酸钴、氨水、硝酸、盐酸、无水乙醇, 均来自天津市科密欧化学试剂有限公司; 去离子水为实验室自制.
D8 Advance型X射线衍射仪, 德国Bruker-AXE公司; S-3400型扫描电子显微镜, 日本日立公司; Lambda750型紫外-可见-近红外分光光度计, 美国PE公司; CEL-LAB500系列多位光化学反应仪(光解仪), 北京中教金源科技有限公司; UV-5100B型紫外可见分光光度计, 上海元析仪器有限公司.
1.2 Fe3O4@SiO2的制备称取0.3 g Fe3O4于100 mL烧杯中, 加入50 mL稀盐酸(0.1 mol/L)超声处理15 min, 磁性分离出Fe3O4固体, 用去离子水洗涤3次.将磁性分离出的Fe3O4固体放入250 mL三颈瓶中, 加入18 mL去离子水和80 mL无水乙醇, 室温搅拌30 min后加入2 mL氨水, 搅拌30 min后加入0.6 mL TEOS, 继续搅拌反应12 h.磁性分离出Fe3O4@SiO2微球, 分别用去离子水和无水乙醇交替洗涤3次, 将产物在60 ℃下干燥12 h.
1.3 Fe3O4@SiO2@TiO2-Co的制备称取一定量Co(NO3)2于100 mL烧杯中, 依次加入1.5 mL H2O、0.2 mL HNO3和20 mL无水乙醇制成A液.称取0.2 g Fe3O4@SiO2于100 mL烧杯中, 加入20 mL无水乙醇和0.25 mL冰醋酸, 超声分散30 min后加入5 mL钛酸正丁酯, 然后在30 ℃水浴中机械搅拌30 min制成B液.将A液通过蠕动泵缓慢滴加到B液中, 搅拌均匀直至形成溶胶, 在30 ℃下陈化18 h.将所得凝胶置于80 ℃烘箱干燥24 h, 干燥后的凝胶经研磨后在450 ℃氮气气氛下焙烧2 h, 得到Co含量分别为1%、3%和5%的Fe3O4@SiO2@TiO2-Co粉末.不加Co(NO3)2制备A液, 采用相同方法得到Fe3O4@SiO2@TiO2粉末.
1.4 Fe3O4@SiO2@TiO2-Co/rGO的制备称取0.08 mg氧化石墨烯移入100 mL烧杯中, 依次加入40 mL无水乙醇和20 mL去离子水, 超声分散1 h后, 加入0.15 g SDBS, 10 min后加入0.2 g Fe3O4@SiO2@TiO2-Co粉末, 继续超声分散1 h.将反应液移入100 mL高压反应釜中, 放入120 ℃烘箱中继续反应3 h.高压反应釜冷却后磁性分离出产物, 分别用无水乙醇和去离子水洗涤3次, 产物在60 ℃下干燥24 h, 根据Co掺杂量不同, 分别命名为Fe3O4@SiO2@TiO2-Co/rGO(1%)、Fe3O4@SiO2@TiO2-Co/rGO(3%)和Fe3O4@SiO2@TiO2-Co/rGO(5%)磁性光催化剂.
1.5 光催化活性实验以可见光为光源, 通过MB光降解率来评价光催化剂催化性能.将0.1 g磁性光催化剂分散于50 mL MB溶液(10 mg/L)中, 实验在多位光化学反应仪中进行(光源为300 W氙灯).光照前应在黑暗中连续搅拌悬浮液30 min以便建立MB吸附平衡; 光照后每隔15 min取出5 mL上层清液, 离心后采用分光光度计分析测试.使用降解率(D)来衡量亚甲基蓝的降解程度(λmax=664 nm):
| $ D=\frac{{{A}_{0}}-A}{{{A}_{0}}}\times 100\% $ | (1) |
式中: A0和A分别为MB初始吸光度值和上层清液在t时刻吸光度值.
2 结果与讨论 2.1 磁性光催化剂的结构与组成从图 1(a)可以看到, 在30.0°、35.3°、42.8°、53.4°、56.8°和62.5°处出现特征衍射峰, 分别对应于220、311、400、422、511和440晶面(JCPDS NO.21-1272), 属于Fe3O4的特征衍射峰.由于SiO2处于无定形态, 因此没有观察到特征衍射峰.从图 1(b)可以看到, 在25.1°、37.7°、47.9°、53.7°, 54.9°、62.7°、68.7°、70.3°和74.9°处出现特征衍射峰, 分别对应于101、004、200、105, 211、204、116、220和215晶面(JCPDS NO.21-1272), 证明试样中TiO2晶型主要是以锐钛矿晶型为主.实验发现, Fe3O4@SiO2@TiO2-Co/rGO的X射线衍射(XRD)图谱与Fe3O4@SiO2@TiO2/rGO非常相似(如图 1(c、d、e)所示), 但掺杂Co的衍射峰强度较未掺杂Co强度有所降低, 并且随着Co掺杂量的增加, 衍射峰强度呈逐渐下降趋势.这主要源于Co与TiO2间的相互作用, 阻碍了TiO2晶粒的生长致使其结晶度发生变化[26].在图 1(c、d、e)中没有发现rGO的特征衍射峰, 这可能是因为与TiO2的特征峰重叠所致[27].

|
图 1 (a) Fe3O4@SiO2、(b) Fe3O4@SiO2@TiO2、(c) Fe3O4@SiO2@TiO2-Co/rGO(1%)、(d) Fe3O4@SiO2@TiO2-Co/rGO(3%)和(e) Fe3O4@SiO2@TiO2-Co/rGO(5%)的XRD谱图 Fig.1 XRD spectra of (a) Fe3O4@SiO2, (b) Fe3O4@SiO2@TiO2, (c) Fe3O4@SiO2@TiO2-Co/rGO(1%), (d) Fe3O4@SiO2@TiO2-Co/rGO(3%) and (e) Fe3O4@SiO2@TiO2-Co/rGO(5%) |
从图 2(a)可以看到, 氧化石墨烯多呈褶皱层状结构. Fe3O4纳米粒子呈四方体形态, 粒子尺寸在400 nm左右、分布比较均匀(如图 2(b)所示).比较图 2(b)与(c)不难发现, Fe3O4@SiO2纳米粒子表面变得更光滑并且棱角不再分明, 粒子尺寸略有增加, 平均增厚约为20~30 nm, 证明SiO2层成功包覆在Fe3O4表面上.从图 2(d、e)可以看出, Fe3O4@SiO2@TiO2-Co表面变得非常粗糙, 表面覆盖有一层细小颗粒, 这些颗粒应该是Co掺杂的TiO2, 且牢固地负载在还原氧化石墨烯片层上.上述实验结果说明: Fe3O4@SiO2表面包覆了一层掺杂Co的TiO2颗粒并成功负载到rGO片层上, Fe3O4@SiO2@TiO2-Co/rGO磁性光催化剂已经成功制备.

|
图 2 (a) rGO、(b) Fe3O4、(c) Fe3O4@SiO2、(d) Fe3O4@SiO2@TiO2-Co(3%)和(e) Fe3O4@SiO2@TiO2-Co/ rGO(3%)的SEM图片, (f) Fe3O4@SiO2@TiO2-Co/rGO(3%)的EDS数据 Fig.2 SEM images of (a) rGO, (b) Fe3O4, (c) Fe3O4@SiO2, (d) Fe3O4@SiO2@TiO2-Co(3%) and (e) Fe3O4@ SiO2@TiO2-Co/rGO(3%), EDS data of (f) Fe3O4@SiO2@TiO2-Co/rGO(3%) |
为了明确磁性光催化剂的化学组成, 实验对Fe3O4@SiO2@TiO2-Co/rGO(3%)试样进行了EDS分析, 如图 2(f)所示.结果发现试样由Fe、Si、Ti、Co、C和O元素组成, 质量百分含量分别为17.323%、7.086%、29.315%、1.468%、11.575%和24.025%, 这些成分分别对应于试样的不同结构层次.由于实验过程中对试样进行喷金处理, 因此光谱中出现了Au发射峰. EDS分析结果进一步佐证了本实验成功制备了还原氧化石墨烯负载的磁性光催化剂.
为了更清楚地观察磁粉的形态, 我们对样品进行了透射电子显微镜分析.从图 3a中可以看出, Fe3O4磁粉的四方形状更清晰.如图 3b所示, 可以清楚地看到Fe3O4@SiO2表面涂覆一层厚度约为20~30 nm的SiO2(浅色部分), 形成所谓的核-壳结构.从图 3c和3d可以看出, 掺杂TiO2的Co颗粒成功地涂覆在Fe3O4@SiO2的表面上, 形成双壳核-壳结构.并且成功地负载到rGO的表面上形成四元Fe3O4@SiO2@TiO2-Co/rGO磁性光催化剂.

|
图 3 (a) Fe3O4、(b) Fe3O4@SiO2、(c) Fe3O4@SiO2@TiO2-Co和(d)Fe3O4@SiO2@TiO2-Co/rGO的TEM图像 Fig.3 TEM images of (a)Fe3O4, (b) Fe3O4@SiO2, (c) Fe3O4@SiO2@TiO2-Co and (d)Fe3O4@ SiO2@TiO2-Co/rGO |
从磁性光催化剂的漫反射光谱(DRS)(如图 4(a)所示)可知, 纯TiO2在紫外光区有吸收, 在可见光区几乎没有吸收; Fe3O4@SiO2@TiO2/rGO复合材料相对于纯TiO2出现红移现象, 主要由于SiO2、rGO与TiO2形成复合半导体导致TiO2带隙变窄, 且有助于抑制光生电子和空穴的复合, 提高光催化剂的催化活性[28].随着Co的引入, 复合材料不仅在紫外区有吸收, 而且在可见光区的吸收强度增加, 表明Co掺杂极大促进了光催化剂对可见光的吸收.通过公式Eg=1240/λ可计算得到试样的带隙能量, 纯TiO2、Fe3O4@SiO2@TiO2/rGO和Fe3O4@SiO2@TiO2-Co/rGO(1%、3%、5%)的禁带宽度分别为3.02、2.96、2.48、2.35和2.56 eV(如图 4(b)所示).随着Co的引入, 复合材料的禁带宽度逐渐减小, 从而提高TiO2对光的响应范围, 使光催化剂可以在可见光照射下对污染物进行降解, 且在掺杂量为3%时效果最佳.
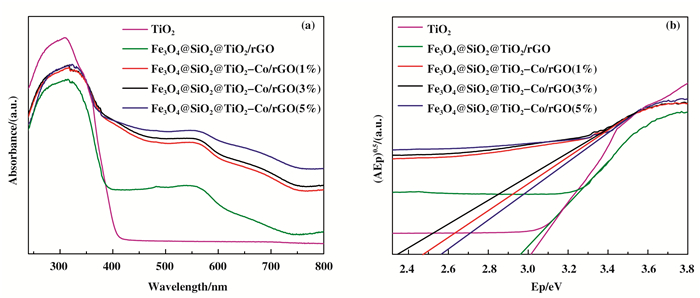
|
图 4 磁性光催化剂的(a)UV-vis DRS和(b)带隙能量曲线图 Fig.4 Plots of (a) UV-vis DRS and (b) band gap energy of magnetic photocatalyst |
通过N2物理吸附实验表征所制备的光催化剂的吸附性能, 相应的N2吸附-解吸等温曲线显示在图 5中.可以看出, Fe3O4@SiO2@TiO2-Co/rGO(3%)光催化剂具有Ⅳ型等温曲线(根据IUPAC分类), 这表明它是介孔结构.比表面积测试结果表明, 样品的比表面积为30.17 m2/g, 孔径分布主要在3.4~6.5 nm之间, 主要为4.9 nm介孔.
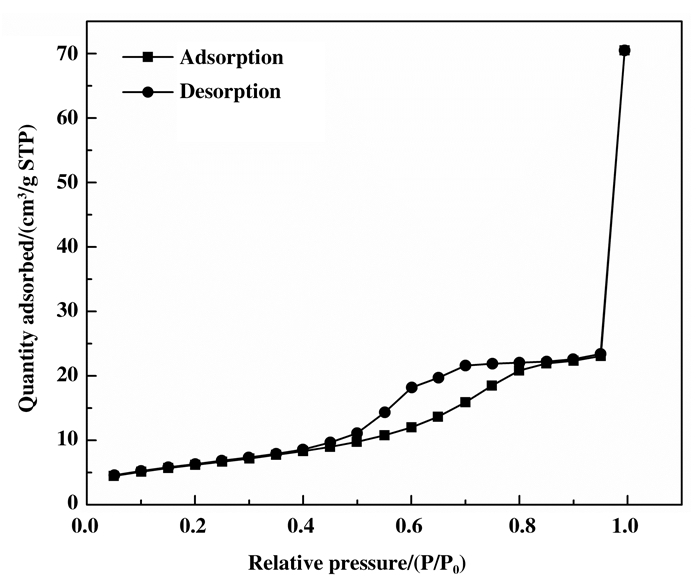
|
图 5 Fe3O4@SiO2@TiO2-Co/rGO(3%)光催化剂的氮吸附-解吸等温线 Fig.5 Nitrogen adsorption-desorption isotherms of Fe3O4@SiO2@TiO2-Co/rGO(3%) photocatalysts |
根据MB在可见光照射下光降解率研究试样的光催化活性, 结果如图 6所示.在可见光照射下, Fe3O4@SiO2没有光催化活性; TiO2、Fe3O4@SiO2@TiO2、Fe3O4@SiO2@TiO2/rGO和Fe3O4@SiO2@-Co/rGO的光催化活性较低; Fe3O4@SiO2@TiO2-Co(3%)、Fe3O4@SiO2@TiO2-Co/rGO(1%、3%、5%)的光催化活性显著提高.光照150 min后, Fe3O4@SiO2@TiO2-Co/rGO(1%、3%、5%)和Fe3O4@SiO2@TiO2-Co(3%)对MB的光降解率分别为96.86%、98.96%、93.54%和76.38%.上述实验结果表明: Co掺杂磁性光催化剂可以在可见光照射下实现对MB的光降解, 并且光催化活性与Co掺杂量密切相关, 当掺杂量为3%时, 光催化效果最好, 这与DRS分析结果是一致的.另外, 载体rGO对改善磁性光催化剂催化活性作用巨大, 相对于Fe3O4@SiO2@TiO2-Co(3%), Fe3O4@SiO2@TiO2-Co/rGO(3%)的光催化活性提高了21.58%, 这主要源于TiO2导带中的激发电子可以转移到石墨烯片层上, 因此阻止了光生电子与空穴的复合.

|
图 6 光照时间对MB光降解率的影响 Fig.6 Effect of illumination time on photodegradation rate of MB (MB=10 mg/L, catalyst loading=0.1 g/50 mL, pH=7) |
从图 7可知, Fe3O4@SiO2@TiO2-Co/rGO(3%)磁性光催化剂具有较宽的pH响应范围, 但随着pH的变化, MB光降解率还是受到很大影响.当pH=5时, 磁性光催化剂具有最佳的光降解效率, 光照120 min时MB光降解率达到99.76%;相同光照条件下, 当pH=3、7和9时, MB光降解率依次为72.67%、95.25%和55.34%.可以发现在酸性条件下光催化剂的催化活性优于碱性条件, 通常, 当pH < pHpzc和pH > pHpzc时, 光催化剂的表面电荷分别变为正或负.在pH < 7时, 光催化剂表面带有正电荷, 与形成阴离子的染料污染物之间通过静电吸引作用而显示出更好的吸附效果, 进而提高其光催化活性[29-30].但即使在碱性条件下, 磁性光催化剂仍然显示出超过55%的光降解率, 说明该磁性光催化剂具有较宽的pH响应范围和较高的应用价值.
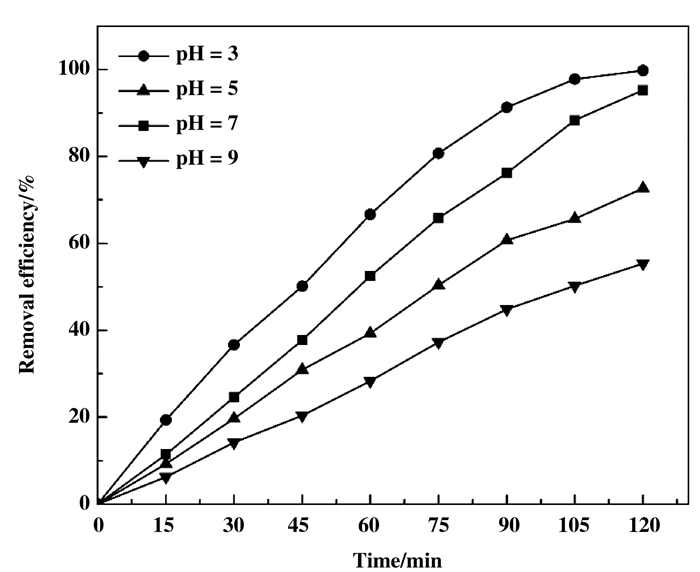
|
图 7 pH对MB光催化降解的影响 Fig.7 Effect of pH on photodegradation rate of MB (MB=10 mg/L, catalyst loading=0.1 g/50 mL) |
从图 8可知, 光照120 min后, 当MB初始浓度从5 mg/L增加到50 mg/L时, MB光降解率从99.87%急剧下降到50.28%.其主要原因可能是随着MB初始浓度的增加, 染料分子在催化剂表面上累积的数量增加, 导致催化剂活性部位的数量相对减少, 因此, 羟基自由基的产生相对减少, 所以导致光降解率降低[31].但从MB光降解绝对量考虑, 适当提高MB初始浓度对于实际应用还是有益的.
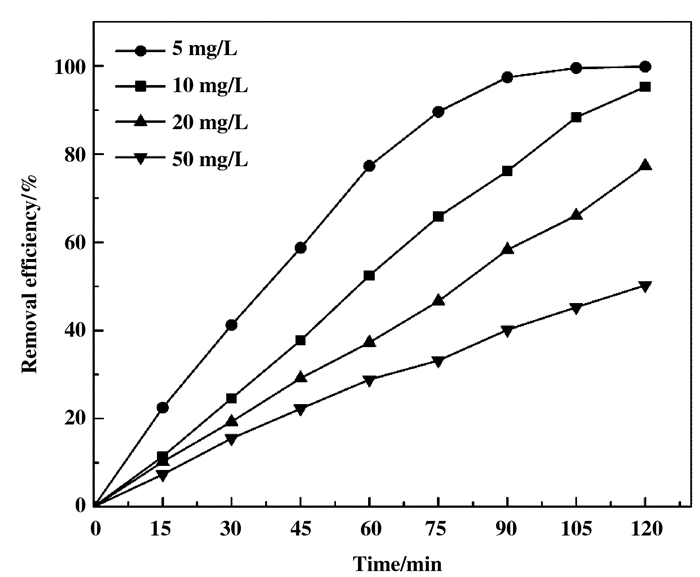
|
图 8 初始浓度对MB光降解率的影响 Fig.8 Effect of initial concentration on photodegradation rate of MB (pH=7, catalyst loading=0.1 g/50 mL) |
为了研究催化剂负载量对MB光催化降解的影响, 使用的催化剂用量从0.05~0.5 g.结果如图 9所示.观察到光催化活性随催化剂负载量的增加而增加, 直至催化剂负载量为0.5 g, 降解效率反而下降, 这可能是由于高负荷的催化剂可能会导致催化剂的凝聚和沉淀, 并降低催化剂表面光电子的吸收.

|
图 9 催化剂用量对MB光降解速率的影响 Fig.9 Effect of catalyst amount on photodegradation rate of MB (MB=10 mg/L, pH=7) |
工业废水中通常含有多种阴阳离子, 这会影响待处理液的离子强度, 从而干扰磁性光催化剂的光催化效率[32-33].实验采用单独和复合方式研究C1-、CO32-和SO42-对光催化效率的影响, 结果如图 10所示.实验结果表明:干扰离子的存在将严重降低磁性光催化剂的光催化效率, 阴离子对MB光降解率的影响次序依次为(SO42-+ C1- + CO32-)> SO42-> C1- > CO32-, 相对应的MB光降解率分别降到60.54%、71.48%、78.13%和82.67%.其主要原因是这些阴离子会与空穴和羟基自由基发生反应, 导致空穴和羟基自由基的数量减少; 另外, 这些阴离子的存在与染料污染物之间竞争吸附和与光催化剂反应, 导致光催化剂的催化活性降低[34].
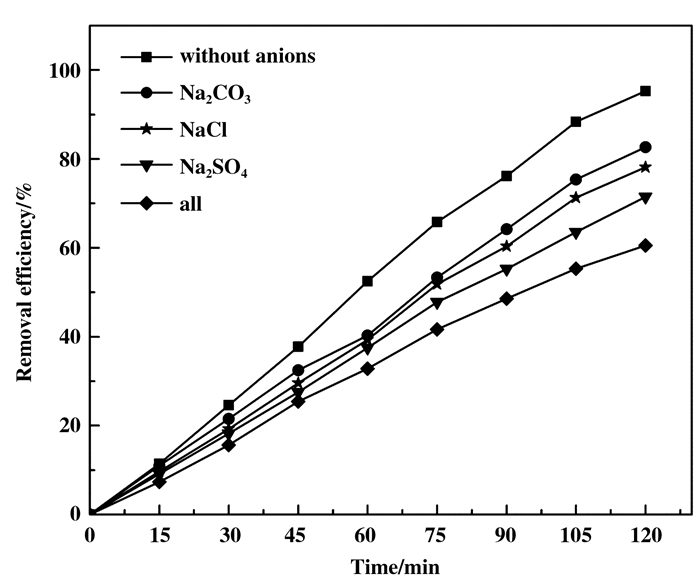
|
图 10 干扰离子对MB光降解率的影响 Fig.10 Effect of interfering ions on photodegradation rate of MB (MB=10 mg/L, pH=7, catalyst loading=0.1 g/50 mL) |
无论从环境保护还是经济的角度考虑, 磁性光催化剂的回收和重复使用都显得十分重要, 我们也对上述问题进行了探究.反应160 min后, 用磁铁分离回收催化剂, 用水洗涤3遍, 60 ℃干燥后重复使用, 结果如图 11和12所示. Fe3O4@SiO2@TiO2- Co/rGO磁性光催化剂完成一次光降解实验后, 通过施加外部磁场就能实现磁性光催化剂与被处理溶液的快速分离(如图 11所示), 证明该磁性光催化剂具有良好的磁性能, 完全能够实现回收再利用的功能.从图 12可知, 磁性光催化剂重复使用7次, MB光降解率从初次97.32%下降至90.25%.光催化剂的催化活性下降是因为催化剂表面对污染物的吸附, 导致表面活性位点减少, 活性位点主要是催化剂表面的氧缺位.上述实验结果表明:磁性光催化剂经过7次重复使用后, 仍然保持90%以上的光降解率, 证明该磁性光催化剂具有良好的重复使用性能.

|
图 11 用磁铁分离Fe3O4@SiO2@TiO2-Co/rGO Fig.11 Separation of Fe3O4@SiO2@TiO2-Co/rGO by the magnet |
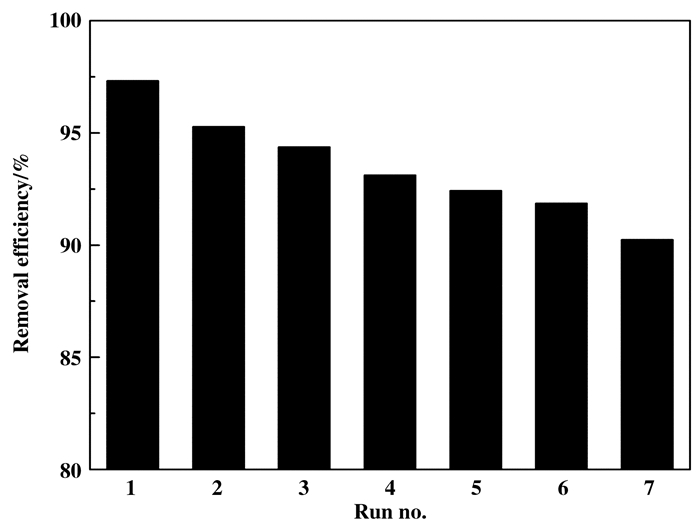
|
图 12 光催化剂在7个循环使用中的降解效率 Fig.12 Degradation efficiency of photocatalyst at 7 recovery cycles (MB=10 mg/L, catalyst loading=0.1 g/50 mL, pH=7) |
采用溶胶-凝胶法和水热法成功制备了Fe3O4@SiO2@TiO2-Co/rGO复合纳米粒子(磁性光催化剂), 通过多种手段对磁性光催化剂进行了表征, 并以MB为光降解对象研究磁性光催化剂的光催化性能.磁性光催化剂平均粒子尺寸约在400 nm, Co掺杂的TiO2成功包覆在Fe3O4@SiO2核壳纳米粒子表面, Co的引入导致磁性光催化剂带隙变窄, 并对可见光有较强吸收, 弱酸性环境更有利于磁性光催化剂光催化效能的发挥.在我们的实验条件下, 150 min内MB最大去除率达到98.24%, 重复使用7次MB光降解率仅下降7.07%, 因此该磁性光催化剂在污水处理方面具有很好的应用前景.
| [1] |
Li Y H, Du Q J, Liu T H, et al. Comparative study of Methylene Blue dye adsorption onto activated carbon, graphene oxide, and carbon nanotubes[J]. Chem Engineer Res Des, 2013, 91(2): 361–368.
DOI:10.1016/j.cherd.2012.07.007 |
| [2] |
Prasad B, Ghosh C, Chakraborty A, et al. Adsorption of arsenite (As3+) on nano-sized Fe2O3 waste powder from the steel industry[J]. Desalination, 2011, 274(1/3): 105–113.
|
| [3] |
Benjwal P, De B, Kar K K. 1-D and 2-D morphology of metal cation co-doped (Zn, Mn) TiO2 and investigation of their photocatalytic activity[J]. Appl Surf Sci, 2018, 427: 262–272.
DOI:10.1016/j.apsusc.2017.08.226 |
| [4] |
Lin L, Wang H, Jiang W, et al. Comparison study on photocatalytic oxidation of pharmaceuticals by TiO2-Fe and TiO2-reduced graphene oxide nanocomposites immobilized on optical fibers[J]. J Hazard Mater, 2017, 333: 162–168.
DOI:10.1016/j.jhazmat.2017.02.044 |
| [5] |
Nguyen D C T, Cho K, Oh W. Synthesis of frost-like CuO combined graphene-TiO2 by self-assembly method and its high photocatalytic performance[J]. Appl Surf Sci, 2017, 412: 252–261.
DOI:10.1016/j.apsusc.2017.03.248 |
| [6] |
Lv K, Fang S, Si L, et al. Fabrication of TiO2 nanorod assembly grafted rGO (rGO@TiO2-NR) hybridized flake-like photocatalyst[J]. Appl Surf Sci, 2017, 391: 218–227.
DOI:10.1016/j.apsusc.2016.03.195 |
| [7] |
Wang Y, Tao J, Wang X, et al. A unique Cu2O/TiO2 nanocomposite with enhanced photocatalytic performance under visible light irradiation[J]. Ceram Inter, 2017, 43(6): 4866–4872.
DOI:10.1016/j.ceramint.2016.12.130 |
| [8] |
Moradi H, Eshaghi A, Hosseini S R, et al. Fabrication of Fe-doped TiO2 nanoparticles and investigation of photocatalytic decolorization of reactive red 198 under visible light irradiation[J]. Ultrason Sonochem, 2016, 32: 314–319.
DOI:10.1016/j.ultsonch.2016.03.025 |
| [9] |
Kalantari K, Kalbasi M, Sohrabi M, et al. Synthesis and characterization of N-doped TiO2 nanoparticles and their application in photocatalytic oxidation of dibenzothiophene under visible light[J]. Ceram Inter, 2016, 42(13): 14834–14842.
DOI:10.1016/j.ceramint.2016.06.117 |
| [10] |
Yanga X, Wanga Y, Wanga Z, et al. Preparation of CdS/TiO2 nanotube arrays and the enhanced photocatalytic property[J]. Ceram Inter, 2016, 42(6): 7192–7202.
DOI:10.1016/j.ceramint.2016.01.109 |
| [11] |
Huang Qiong(黄琼), Ren Xiao-min(任晓毓), Xing Yu-yuan(邢钰媛), et al. Preparation of Bi2WO6/Bi-TiO2 composite photocatalyst and its catalytic performance for oxidation of formaldehyde(Bi2WO6/Bi-TiO2复合光催化剂的制备及催化氧化甲醛性能研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(3): 247–257.
|
| [12] |
Aleksandrzak M, Kukulka W, Mijowska E. Graphitic carbon nitride/graphene oxide/reduced graphene oxide nanocomposites for photoluminescence and photocatalysis[J]. Appl Surf Sci, 2017, 398: 56–62.
DOI:10.1016/j.apsusc.2016.12.023 |
| [13] |
Xiang Q, Cheng F, Lang D. Hierarchical layered WS2/graphene-modified CdS nanorods for efficient photocatalytic hydrogen evolution[J]. ChemSusChem, 2016, 9(9): 996–1002.
DOI:10.1002/cssc.201501702 |
| [14] |
Niu X, Yu J, Wang L, et al. Enhanced photocatalytic performance of TiO2 nanotube based heterojunction photocatalyst via the coupling of graphene and FTO[J]. Appl Surf Sci, 2017, 413: 7–15.
DOI:10.1016/j.apsusc.2017.03.220 |
| [15] |
Krishna R, Titus E. Nickel induced re-structuring of 2D graphene to 1D graphene nanotubes:Role of radical hydrogen in catalyst assisted growth[J]. Appl Surf Sci, 2017, 424: 87–92.
DOI:10.1016/j.apsusc.2017.02.060 |
| [16] |
Niu X, Yan W, Zhao H, et al. Synthesis of Nb doped TiO2 nanotube/reduced graphene oxide heterostructure photocatalyst with high visible light photocatalytic activity[J]. Appl Surf Sci, 2018, 440: 804–813.
DOI:10.1016/j.apsusc.2018.01.069 |
| [17] |
Zhang Q, Ye S, Song X, et al. Photocatalyst based on TiO2 nanotube arrays codecorated with CdS quantum dots and reduced graphene oxide irradiated by c rays for effective degradation of ethylene[J]. Appl Surf Sci, 2018, 442: 245–255.
DOI:10.1016/j.apsusc.2018.02.139 |
| [18] |
Lv H, Liu Y, Tang H, et al. Synergetic effect of MoS2 and graphene as cocatalysts for enhanced photocatalytic activity of BiPO4 nanoparticles[J]. Appl Surf Sci, 2017, 425: 100–106.
DOI:10.1016/j.apsusc.2017.06.303 |
| [19] |
Xu Y, Mo Y, Tian J, et al. The synergistic effect of graphitic N and pyrrolic N for the enhanced photocatalytic performance of nitrogen-doped graphene/TiO2 nanocomposites[J]. Appl Catal B, 2016, 181: 810–817.
DOI:10.1016/j.apcatb.2015.08.049 |
| [20] |
Zhao Y, Liu L, Cui T, et al. Enhanced photocatalytic properties of ZnO/reduced graphene oxide sheets (rGO) composites with controllable morphology and composition[J]. Appl Surf Sci, 2017, 412: 58–68.
DOI:10.1016/j.apsusc.2017.03.207 |
| [21] |
Zhou K, Zhu Y, Yang X, et al. Preparation of graphene-TiO2 composites with enhanced photocatalytic activity[J]. New J Chem, 2011, 35(2): 353–359.
DOI:10.1039/C0NJ00623H |
| [22] |
Ma X Y, Xiang Q J, Liao Y L, et al. Visible-light-driven CdSe quantum dots/graphene/TiO2 nanosheets composite with excellent photocatalytic activity for E-coli disinfection and organic pollutant degradation[J]. Appl Surf Sci, 2018, 457: 846–855.
DOI:10.1016/j.apsusc.2018.07.003 |
| [23] |
Li Z Q, Wang H L, Zi L Y, et al. Preparation and photocatalytic performance of magnetic TiO2-Fe3O4/graphene (RGO) composites under vis-light irradiation[J]. Ceram Inter, 2015, 41(9): 10634–10643.
DOI:10.1016/j.ceramint.2015.04.163 |
| [24] |
Zhan J, Zhang H, Zhu G. Magnetic photocatalysts of cenospheres coated with Fe3O4/TiO2 core/shell nanoparticles decorated with Ag nanopartilces[J]. Ceram Inter, 2014, 40(6): 8547–8559.
DOI:10.1016/j.ceramint.2014.01.069 |
| [25] |
Xin T, Ma M, Zhang H, et al. A facile approach for the synthesis of magnetic separable Fe3O4@TiO2, core-shell nanocomposites as highly recyclable photocatalysts[J]. Appl Surf Sci, 2014, 288: 51–59.
DOI:10.1016/j.apsusc.2013.09.108 |
| [26] |
Xiao H, Guo W J, Sun B, et al. Mesoporous TiO2 and Co-doped TiO2nanotubes/reduced graphene oxide composites as electrodes for supercapacitors[J]. Electro chimica Acta, 2016, 190: 104–117.
DOI:10.1016/j.electacta.2016.01.040 |
| [27] |
Savio A, Fletcher J, Robles H F. Sonosynthesis of nanostructured TiO2 doped with transition metals having variable bandgap[J]. Appl Catal A, 2013, 39(3): 2753–2765.
|
| [28] |
Jiao Lin-juan(焦琳娟), Li Yong-hao(李永豪), Wu Xiao-ying(吴晓莹). Preparation and photocatalytic performance of Fe3+-doped Fe3O4@SiO2@TiO2 photocatalysts(Fe3+掺杂Fe3O4@SiO2@TiO2型光催化剂的制备及其光催化性能)[J]. Chem Res Appl(化学研究与应用), 2018, 30(9): 1416–1422.
DOI:10.3969/j.issn.1004-1656.2018.09.002 |
| [29] |
Li Y X, Wang H, Peng S Q. Tunable photodeposition of MoS2 onto a composite of reduced graphene oxide and CdS for synergic photocatalytic hydrogen generation[J]. J Phys Chem C, 2014, 118(34): 19842–19848.
DOI:10.1021/jp5054474 |
| [30] |
Li Y X, Wang J X, Peng S Q, et al. Photocatalytic hydrogen generation in the presence of glucose over ZnS-coated ZnIn2S4 under visible light irradiation[J]. Inter J Hydro Ener, 2010, 35(13): 7116–7126.
DOI:10.1016/j.ijhydene.2010.02.017 |
| [31] |
Akpan U G, Hameed B H. Parameters affecting the photocatalytic degradation of dyes using TiO2-based photocatalysts:A review[J]. J Hazard Mater, 2009, 170(2/3): 520–529.
|
| [32] |
Kashif N, Ouyang F. Parameters effect on heterogeneous photocatalysed degradation of phenol in aqueous dispersion of TiO2[J]. J Environ Sci, 2009, 21(4): 527–533.
DOI:10.1016/S1001-0742(08)62303-7 |
| [33] |
Calza P, Pelizzetti E. Photocatalytic transformation of organic compounds in the presence of inorganic ions[J]. Pure Appl Chem, 2001, 73(12): 1839–1848.
DOI:10.1351/pac200173121839 |
| [34] |
Li Y X, Lu G X, Li S B. Photocatalytic hydrogen generation and decomposition of oxalic acid over platinized TiO2[J]. Appl Catal A, 2001, 214(2): 179–185.
DOI:10.1016/S0926-860X(01)00491-4 |
 2019, Vol. 33
2019, Vol. 33


