2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049
甲醛是挥发性有机物(VOCs)的一种, 挥发性有机物是形成臭氧以及PM2.5的重要前驱物, 它们与NOx、SO2、颗粒物等相互作用导致光化学烟雾等严重环境问题的发生[1-2].而且, VOCs会通过呼吸道进入人体, 会对人体健康和社会安全造成一定的影响[3-5].国家出台了《大气污染防治行动计划》以及《“十三五”挥发性有机物污染防治工作方案》等一系列法规, 进一步加大对VOCs排放的控制和治理力度[6].
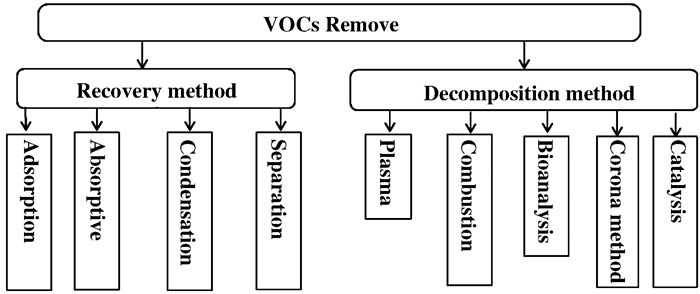
VOCs治理在技术上大体分为两类, 即回收法和分解法[8], 见图 1.
|
图 1 VOCs消除的技术分类(授权转载于文献[8], 中国环保产业版权2012) Fig.1 Technical classification of VOCs elimination(Reprinted with permission from references[8], Copyright 2012, China Environmental Protection Industry) |
催化技术具有高的消除效率、氧化温度低、应用范围广、设备简单、无二次污染物等优点, 是VOCs消除研究最多也是最有效的技术之一[7-9].甲醛广泛存在于室内、车内或车间等密闭空间、工业园区/隧道等开放与半开放空间, 去除甲醛的技术有吸附法、光催化消除法和热催化氧化法[9].吸附法在工业上已被大量采用, 缺点是需要定时脱附再生. Li等[61]就曾通过NH4F向TiO2中掺杂N以及F制备的F-N-TiO2, 利用蓝色发光二极管作为光源用于降解甲醛, 其中F-N-TiO2(1:6)样品经过400 ℃煅烧后在波长400~535 nm下催化活性最高, 但目前光催化技术应用于VOCs消除的研究及其应用仍处于初级阶段, 且催化效率有待进一步提高[60-61].我们聚焦于热催化氧化甲醛的机理和催化材料进展, 并对潜在研究热点和方向进行展望[10].
1 甲醛催化氧化机理甲醛的催化氧化反应一般符合Mars-van Krevelen机理[11-12], 即首先反应物与催化剂产生氧空位.第二步是催化剂被解离吸附的氧补充氧缺位而重新氧化, 得以再生[13].但对于不同催化剂, 往往体现出不同的催化机理.
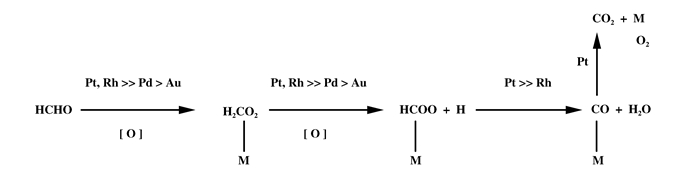
1.1 产生甲酸盐及甲酸中间产物的过程催化剂中助剂的掺杂会对催化机理产生一定的影响, 如碱性金属的掺杂会使催化剂表面OH基团增多从而使反应机理发生变化. Pt/TiO2以及Na-Pt/TiO2催化剂催化甲醛的机理不同, Na的加入使催化剂表面产生大量的OH, OH参与和甲醛的反应, 得到甲酸中间体而不是甲酸盐, 具体反应机理见图 2和图 3 [14-17].
|
图 2 贵金属(Pt、Rh、Pd、Au)/TiO2催化氧化甲醛的反应机理(授权转载于文献[15], 今日催化版权2007) Fig.2 Reaction mechanism of formaldehyde oxidation catalyzed by noble metals (Pt, Rh, Pd, Au)/titanium dioxide(Reprinted with permission from references [15], copyright 2007, Catalysis Today) |
|
图 3 Na-Pt/TiO2催化剂催化氧化甲醛的反应机理(授权转载于文献[17], 环境科学与技术版权2013) Fig.3 Reaction mechanism of catalytic oxidation of formaldehyde over Na-Pt/TiO2 catalyst(Reprinted with permission from references [17], copyright 2013, Environmental Science & Technology) |
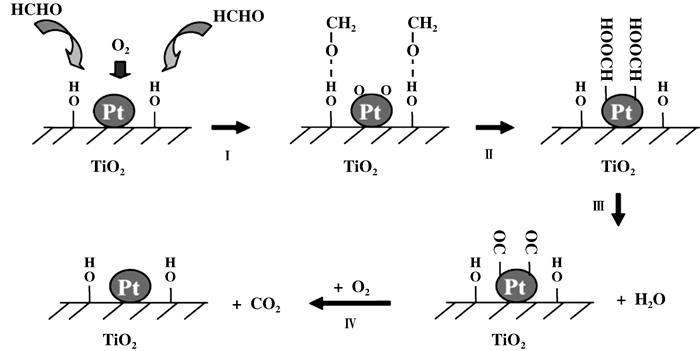
载体作为催化剂的一部分, 会与金属组分相互作用, 而催化反应机理不同.如负载在三维有序大孔材料载体(Three-dimensional ordered macroporous, 3DOM)上的Au/CeO2催化氧化甲醛的反应机理, 见图 4.研究发现HCHO在Au3+和Au0状态下催化机理不同, 在Au3+存在的情况下, 催化活性较高, Au3+将CeO2表面还原为Ce2O3, 吸附到Ce2O3上的甲醛得到转移的活性氧生成甲酸, 其中Au3+决定反应的转化效率.在金属态Au0存在情况下, 吸附到CeO2上的甲醛得到Au0转移的活性氧生成甲酸, 然后直接分解为CO2和H2O, Au0在其中不是关键步骤[18].

|
图 4 3DOM Au/CeO2催化氧化甲醛的反应机理(授权转载于文献[18], 应用催化B:环境版权2012) Fig.4 Reaction mechanism of formaldehyde oxidation catalyzed by 3DOM Au/CeO2(Reprinted with permission from references [18], copyright 2012, Applied Catalysis B-Environmental) |
Sekin等[19]讨论了金属氧化物(MnO2)与HCHO发生化学反应的反应方程和反应机理(g:气态, a:吸附态), 甲醛与吸附氧物种产生吸附态甲酸, 然后裂解为甲酸盐, 最后分解为CO2.
| $ \begin{array}{*{20}{l}} {{\rm{HCHO}}({\rm{g}}) + {\rm{O}}({\rm{a}}) \to {\rm{HCHOO}}({\rm{a}})}\\ {{\rm{HCHOO}}({\rm{a}}) \to {\rm{HCOO}}({\rm{a}}) + {\rm{H}}({\rm{a}})}\\ {{\rm{HCOO}}({\rm{a}}) \to {\rm{H}}({\rm{a}}) + {\rm{C}}{{\rm{O}}_2}({\rm{g}})}\\ {2{\rm{H}}({\rm{a}}) + {\rm{O}}({\rm{a}}) \to {{\rm{H}}_2}{\rm{O}}} \end{array} $ |
研究报道了石墨烯-MnO2混合催化剂对甲醛氧化的机理[20-21], 甲醛首先被锰氧化物表面的活性氧氧化成甲酸盐物种, 被活化的氧气分子通过Mn4+/Mn3+氧化还原循环被转移到Mn的活性位点, 石墨烯作为导电体降低了电子转移率, 提高了Mn4+和Mn3+之间的电荷转移速率, 从而提高了整个过程的效率.
综上, 甲醛氧化的机理主要受到催化活性位、表面OH物种、活性氧以及表面吸附等的影响.
2 催化剂根据催化剂组成可分为负载型贵金属催化剂[22-24]和过渡金属氧化物催化剂[25-27].
2.1 负载型贵金属催化剂贵金属催化剂性能与金属种类、载体以及催化剂的结构形貌等都有关系.目前用于HCHO氧化的贵金属催化剂通常以Pt、Pd、Au、Ag等为活性组分, 其他贵金属高温易氧化, 不太适于催化氧化反应.常见的载体有SiO2、Al2O3、分子筛、TiO2、特殊形貌的金属氧化物等.
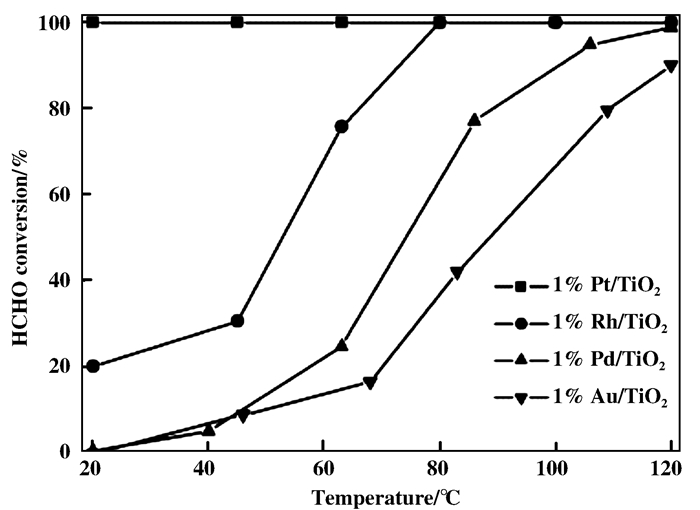
2.1.1 铂催化剂An等制备的Pt/SiO2和Pt/SBA-15催化剂可分别在室温以及50 ℃下将HCHO完全氧化[28], SiO2作为载体会影响Pt粒子的粒径和价态, 进而影响催化剂的氧化还原性能. Chang-bin Zhang等[15]将贵金属(Pt Rh Pd Au)分别负载到TiO2载体上用于HCHO氧化.其中Pt更利于甲酸盐的降解, 故其活性顺序排列为: Pt/TiO2 > Rh/TiO2 > Pd/TiO2 > Au/TiO2, 其中1%(重量百分比)Pt/TiO2可以在20 ℃下将HCHO完全氧化为CO2(GHSV=50 000 h-1), 见图 5.研究者认为高分散的Pt也是催化剂高活性的主要因素之一.另外, 该研究小组[16]还将2%(重量百分比)Na作为助剂加入到催化剂中, 发现2%(重量百分比)Na-1%(重量百分比)Pt/TiO2具有最好的催化活性和稳定性, 可在室温下将HCHO完全转化(GHSV=300 000 h-1).后续研究发现Na+的掺杂会使催化剂表面产生大量的OH, 介孔和大孔的存在既可提高催化剂的吸附能力, 也有利于反应物和产物的扩散和运输, 使催化剂活性得到提高.
|
图 5 各种贵金属负载在TiO2上用于甲醛的催化氧化(授权转载于文献[14], 应用催化B-环境版权2006) Fig.5 Catalytic oxidation of formaldehyde by various noble metals supported on titanium dioxide(Reprinted with permission from references[14], copyright 2006, Applied Catalysis B: Environmental) |
Pd作为高催化活性的贵金属, 也常用于甲醛催化氧化的研究. Park等[29]将Pd负载到一系列的分子筛(Bata、USY、ZSM-5、HM10、Zeo-13X)上用于甲醛的催化氧化, 它们对HCHO都具有较好的催化活性, 其中Pd/Beta分子筛催化效果最好(T50<40 ℃). O’Shea等[30]制备Pd-Mn/Al2O3催化剂用于甲醛的催化氧化, 反应过程中Pd和MnOx的分解, 导致较少的活性氧转移, 低温催化活性低.研究过程中发现水分的加入导致催化剂钝化, 会对催化剂氧化HCHO的性能产生不利影响. Hai-bao Huang等[31]制备了一系列还原性和氧化性Pd/TiO2催化剂, 其中Pd的价态不同, 在室温下对甲醛(HCHO)进行催化氧化, 结果发现还原性催化剂比氧化性催化剂活性要高, 前者的HCHO转化率接近100%, 后者HCHO的转化率要比前者低18%, 表明金属态活性组分更有利于甲醛氧化.
2.1.3 金催化剂Bing-bing Chen等[32]利用沉积-沉淀法制备1%Au(w)/γ-Al2O3催化剂, 可在100 ℃将甲醛完全氧化. Yue-nian Shen等[33]报道的Au/CeO2催化剂, 发现催化剂活性与Au粒子的分散度和大小有关, 高分散的Au粒子可为HCHO氧化提供更多的活性位点.反应过程中金属粒子容易发生团聚, 孔材料作为载体可提高活性组分的分散度, 进一步提高催化剂的活性.故通过胶体模板法合成的3DOM Au/CeO2催化剂, 解决了Au/CeO2的聚集问题[34]; CeO2载体中掺杂Co3O4制备的3DOM Au/CeO2-Co3O4催化剂可以在39 ℃下将HCHO完全氧化, 因为CeO2和Co3O4之间的相互作用促进了表面氧物种的迁移和Au物种的活化[35], 见图 6.二维有序大孔载体材料, 负载的金催化剂即Au/Co3O4-CeO2, 也可在室温下将50%的甲醛氧化[36].

|
图 6 Au/CeO2-Co3O4对甲醛的催化氧化(授权转载于文献[35], 应用催化B:环境版权2012) Fig.6 Catalytic efficiency of Au on CeO2-Co3O4 support for formaldehyde(Reprinted with permission from reference [35], Copyright 2012, Applied Catalysis B-Environmental) |
除Pt、Pd、Au外, 其他贵金属也有用于甲醛的催化氧化.基于3D Co3O4制备的高分散的K-Ag/Co3O4催化剂, K+的掺杂导致晶格缺陷的产生, 加强了Ag与Co3O4的相互作用, 产生更多的Co3+和晶格氧物种, 导致室温下可将55%的甲醛转化[37]. Xiu-cheng Sun等[38]在2018年将Rh以亚纳米尺度分散到TiO2载体上, 提高了活性组分Rh的分散度, 提高了催化活性.
贵金属与载体之间的相互作用、金属粒子的分散度、粒径、活性氧的迁移和活化以及金属离子的高价态和低价态氧化还原循环是HCHO氧化过程中影响催化活性的主要原因.研究者们通过对催化剂表面进行掺杂或修饰, 使催化剂表面产生氧空位或OH基团或改变载体的组成、结构与构型, 使活性组分分散均匀且不易团聚, 提高催化剂活性.
2.2 过渡金属氧化物催化剂过渡金属氧化物比贵金属热稳定性好且价格便宜, 但性能比贵金属低.但是, 过渡金属氧化物往往具有良好的电子结构、价格廉价、易于制备等特点, 作为催化剂载体甚至催化剂具有很大的潜力.近些年, 通过对金属氧化物结构、形貌、尺寸和缺陷等的研究和开发, 其整体性能已接近贵金属.
2.2.1 单一过渡金属氧化物(1) 氧化锰
自2002年研究者发现相比较其他金属氧化物(CuO, Fe2O3, La2O3, V2O5, TiO2等), MnOx结构多样、性质丰富, 对HCHO的催化活性高, 其研究已经成为催化氧化中的热点.不同形貌的MnOx(α-、β-、γ-、δ-MnO2)用于甲醛的催化氧化, 实验对比发现δ-MnO2催化甲醛的活性最高[39], 见图 7.实验制备茧状、海胆状以及蜂巢状的MnO2[40], 发现蜂巢状的催化剂具有独特的孔结构, 在甲醛的催化氧化过程中表现出较高的催化活性.金属氧化物中掺杂碱金属也有利于提高催化剂活性, 如:空心结构的KxMnO2纳米球催化剂可在80 ℃下将甲醛完全转化[41], 该催化剂的活性优于OMS-2、传统的MnOx粉末、以及Pd-Mn/Al2O3.形态变化可以改善影响催化活性的因素, 如比表面积、低温还原性和活性相.通过水热法制备了负载型MnO2纳米片, 发现其催化活性提高[42-43].另外, 通过对MnO2表面进行修饰或掺杂, 使其表面产生不同的孔结构, 提高比表面积, 产生不饱和Mn和O原子, 大大促进了甲醛的吸附和氧化[44-48].

|
图 7 不同形貌的MnO2对甲醛催化活性的影响(授权转载于文献[41], 英国皇家化学学会版权2016) Fig.7 Effect of different morphologies of MnO2 on the catalytic activity of formaldehyde(Reprinted with permission from reference [41], Copyright 2016, RSC Advances) |
(2) 氧化钴
采用模板法制备的介孔Co3O4与采用沉淀法制备的Co3O4相比, 前者在25 ℃下转化甲醛20.3%, 而后者仅有2.5%[49], 催化剂活性的差异是因为采用硬模板法制备的介孔Co3O4具有高比表面积和大量表面活性物质的孔道结构, 使反应物能够扩散并进行表面反应.采用“纳米浇注”法制备二维Co3O4和三维Co3O4催化剂, 其中3D Co3O4可在130 ℃下将甲醛完全转化[50].与采用沉淀法制备nano-Co3O4相比, 发现催化活性顺序为:三维Co3O4>二维Co3O4>nano-Co3O4, 见图 8.研究者发现3D Co3O4比表面积最大, 暴露的(220)晶面含有较多的Co3+, 可以增加阴离子缺陷的数量, 促进氧在气相中的吸附和活化, 为氧化反应提供了较多的活性位点.
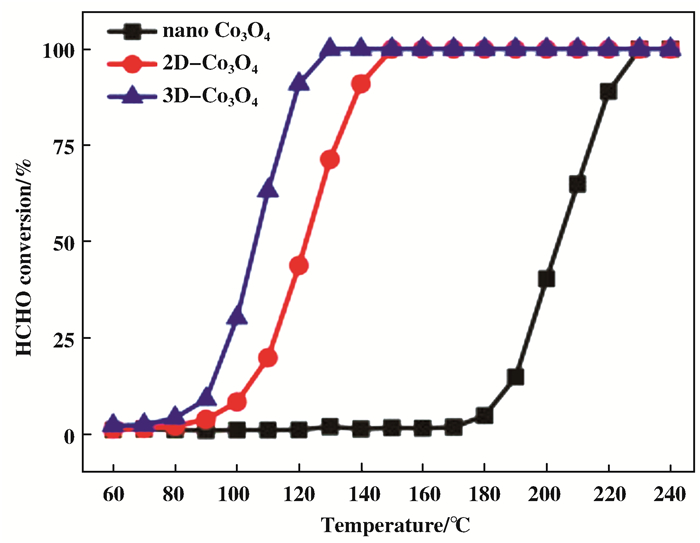
|
图 8 不同的Co3O4催化剂用于甲醛催化氧化的性能(授权转载于文献[50], 应用催化B:环境版权2013) Fig.8 Formaldehyde catalytic performance of the different Co3O4 catalysts(Reprinted with permission from reference [50], Copyright 2013, Applied Catalysis B-Environmental) |
(3) 其他过渡金属氧化物
相对于锰和钴氧化物, CeO2单独作为催化剂研究的不多, 主要集中在形貌和尺寸对催化活性的影响[51]. Cr2O3催化剂研究的较少, 有报道在130 ℃下可将500 ppm的甲醛全部氧化[52].
2.2.2 多元金属氧化物催化剂一些单一的金属氧化物不能在低温下转化HCHO, 其他元素如: Ce、Sn、Zr和Cu逐渐加入到锰和钴氧化物中, 以制备锰和钴基的复合催化剂.常见的复合氧化物有MnCeOx、CuMnOx、CoCeOx、CoMnOx等.主要的制备方法有:溶胶凝胶法、共沉淀法以及沉积沉淀法, 其中沉积沉淀法制备的催化剂比溶胶-凝胶以及共沉淀法制备的催化剂具有更多的Mn4+种类和更丰富的晶格氧, 对甲醛的完全氧化具有更高的催化活性[53], 见图 9. Li Lu等[18]发现在Co3O4-CeO2中引入MnOx可提高Co3O4的分散度, 并且增加表面活性氧的数目, 这是该复合催化剂催化活性提高的主要原因.在Mn基复合型催化剂中, Mn的价态比单一MnOx催化剂中Mn的价态要高[54-56], 高价态的Mn和表面活性氧物种是催化剂活性提高的主要因素.
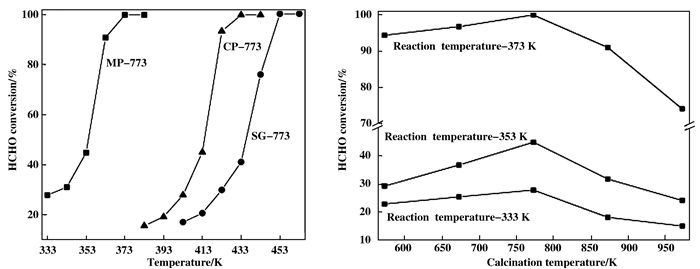
|
图 9 制备方法以及煅烧温度对MnOx-CeO2催化剂用于HCHO氧化活性的影响(授权转载于文献[53], 应用催化B:环境版权2006) Fig.9 Effect of preparation method and calcination temperature on the activity of MnOx-CeO2 catalyst for HCHO oxidation(Reprinted with permission from reference [53], Copyright 2006, Applied Catalysis B-Environmental) |
近年来, 金属有机骨架材料(MOFs)由于其结构可调、比表面积大、孔隙率高等优点, 被广泛用于催化方向, 包括VOCs治理.如Co-MOF-74展现出良好的CO氧化性能, MnxCoy-MOF对甲苯具有优异的催化氧化活性[57-59].但是将MOFs用于甲醛为主的VOCs的催化氧化研究还很少.近来, 光热协同催化技术可通过光照的协助不仅可降低催化的反应温度, 而且也可实现催化剂制备成本的降低[62], 将光热协同催化用于甲醛等VOCs的氧化降解具有一定的优势.
3 催化氧化反应装置目前甲醛的催化氧化测试装置主要是利用装有甲烷转化炉的气相色谱进行检测, 整个装置分为:进气—流量控制—反应装置—检测装置—尾气处理装置.具体反应装置图见10.
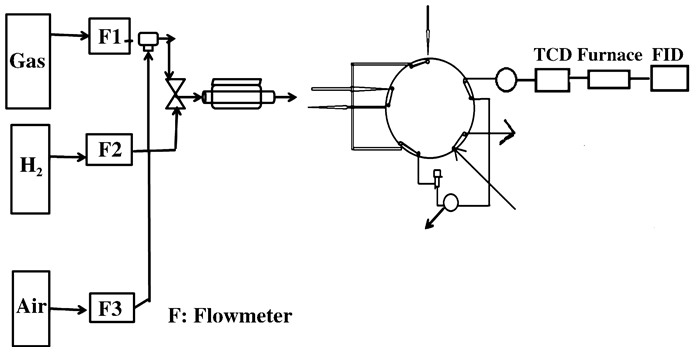
|
图 10 甲醛催化氧化反应装置图 Fig.10 Diagram of formaldehyde catalytic oxidation reaction unit |
甲醛氧化机理对于贵金属催化剂相对已经比较清楚, 但在复合氧化物催化剂上如协同作用机制仍有待进一步研究.对于甲醛氧化催化剂的商业化, 如何提高贵金属活性组分的分散度、过渡金属氧化物的催化活性和稳定性, 包括利用MOF材料的优势以及缺陷的引入以及光热协同作用的利用, 将是近期和未来研究的重点.
| [1] |
Liu Chun-yu(刘春宇). Discussion on hazard analysis and treatment technology of industrial VOC(关于工业VOC的危害分析及治理技术探讨)[J]. Chem Enter Manage (China)(化工管理), 2017, 36: 89–91.
|
| [2] |
Yang Zhong-qing(杨仲卿), Liu Xian-wei(刘显伟), Du Xue-sen(杜学森), et al. Research progress on thermal oxidation of volatile organic waste gas(挥发性有机废气热氧化技术研究进展)[J]. Chem Indus Engineer Prog (China)(化工进展), 2017, 36(10): 3866–3875.
|
| [3] |
Peng Yu-qing(彭雨晴). Analysis and prospect of VOCs waste gas treatment in China(关于我国VOCs废气治理的现状分析及展望探讨)[J]. Technolo Wind (China)(科技风), 2018, 16: 133.
|
| [4] |
McGwin G, Lienert J, Kennedy J I. Formaldehyde exposure and asthma in children:A systematic review[J]. Environ Health Perspect, 2010, 118: 313–317.
DOI:10.1289/ehp.0901143 |
| [5] |
Kim S, Park J C. Environment-friendly Hwangtoh composite aterials using water soluble resin for indoor air quality and human health[J]. J Compos Mater, 2010, 44: 905–913.
DOI:10.1177/0021998309344643 |
| [6] |
The state council on the issuance of air pollution prevention and control action plan notice(国务院关于印发大气污染防治行动计划的通知)[J]. Res Environ Inhabit (China)(资源与人居环境), 2013, 9: 20-24.
|
| [7] |
Fan Z, Zhang Z, Fang W, et al. Low-temperature catalytic oxidation of formaldehyde over Co3O4 catalysts prepared using various precipitants[J]. Chin J Catal, 2016, 37(6): 947–954.
DOI:10.1016/S1872-2067(15)61086-5 |
| [8] |
Liu Yuan(刘媛), Wang Yuan-yuan(王鸯鸯), Yang Wei(杨威). Analysis of volatile organic waste gas treatment technology(浅析挥发性有机废气治理技术)[J]. Chin Environ Prot Indus (China)(中国环保产业), 2012, 11: 40–43.
|
| [9] |
Rezaee A, Rangkooy H, Jonidi-Jafari A, et al. Surface modification of bone char for removal of formaldehyde from air[J]. Appl Sur Sci, 2013, 286: 235–239.
DOI:10.1016/j.apsusc.2013.09.053 |
| [10] |
Li Wei-bin(黎维彬), Gong Hao(龚浩). Recent progress in catalytic combustion to remove VOCs pollutants(催化燃烧去除VOCs污染物的最新进展)[J]. Acta Phys-Chim Sin (China)(物理化学学报), 2010, 26(04): 885–894.
DOI:10.3866/PKU.WHXB20100436 |
| [11] |
Wang J L, Yunus R, Li J G, et al. In situ synthesis of manganese oxides on polyester fiber for formaldehyde decomposition at room temperature[J]. Appl Sur Sci, 2015, 357: 787–794.
DOI:10.1016/j.apsusc.2015.09.109 |
| [12] |
Sidheswaran M A, Destaillats H, Sullivan D P, et al. Quantitative room-temperature mineralization of airborne formaldehyde using manganese oxide catalysts[J]. Appl Catal B-Environ, 2011, 107(1/2): 34–41.
|
| [13] |
Pei J J, Zhang J S S. Critical review of catalytic oxidization and chemisorption methods for indoor formaldehyde removal[J]. Hvac R Res, 2011, 17(4): 476–503.
|
| [14] |
Zhang C, He H, Tanaka K-i. Catalytic performance and mechanism of a Pt/TiO2 catalyst for the oxidation of formaldehyde at room temperature[J]. Appl Catal B-Environ, 2006, 65(1/2): 37–43.
|
| [15] |
Zhang C, He H. A comparative study of TiO2 supported noble metal catalysts for the oxidation of formaldehyde at room temperature[J]. Catal Today, 2007, 126(3/4): 345–350.
|
| [16] |
Zhang C, Liu F, Zhai Y, et al. Alkali-metal-promoted Pt/TiO2 opens a more efficient pathway to formaldehyde oxidation at ambient temperatures[J]. Angew Chem Int Ed Eng, 2012, 51(38): 9628–9632.
DOI:10.1002/anie.201202034 |
| [17] |
Nie L, Yu J, Li X, et al. Enhanced performance of NaOH-modified Pt/TiO2 toward room temperature selective oxidation of formaldehyde[J]. Environ Sci Technol, 2013, 47(6): 2777–2783.
DOI:10.1021/es3045949 |
| [18] |
Liu B, Li C, Zhang Y, et al. Investigation of catalytic mechanism of formaldehyde oxidation over three-dimensionally ordered macroporous Au/CeO2 catalyst[J]. Appl Catal B-Environ, 2012, 111/112: 467–475.
DOI:10.1016/j.apcatb.2011.10.036 |
| [19] |
Sekine Y. Oxidative decomposition of formaldehyde by metal oxides at room temperature[J]. Atmos Environ, 2002, 36(35): 5543–5547.
DOI:10.1016/S1352-2310(02)00670-2 |
| [20] |
Lu L, Tian H, Yang Q, et al. Graphene-MnO2 Hybrid nanostructure as a new catalyst for formaldehyde oxidation[J]. J Phys Chem C, 2016, 120(41): 23660–23668.
DOI:10.1021/acs.jpcc.6b08312 |
| [21] |
Wang J L, Zhang G K, Zhang P Y, et al. Graphene-assisted photothermal effect on promoting catalytic activity of layered MnO2 for gaseous formaldehyde oxidation[J]. Appl Catal B-Environ, 2018, 239: 77–85.
DOI:10.1016/j.apcatb.2018.08.008 |
| [22] |
Yang X Y, Shen Y N, Yuan Z F, et al. Ferric ions doped 5A molecular sieves for the oxidation of HCHO with low concentration in the air at moderate temperatures[J]. J Mol Catal A-Chem, 2005, 237: 224–231.
DOI:10.1016/j.molcata.2005.04.059 |
| [23] |
Zhang Y B, Shen Y N, Zhu H Y, et al. Gold catalysts supported on the mesoporous nanoparticles composited of zirconia and silicate for oxidation of formaldehyde[J]. J Mol Catal A-Chem, 2010, 316: 100–105.
DOI:10.1016/j.molcata.2009.10.006 |
| [24] |
Minico S, Scire S, Galvagno S, et al. Catalytic combustion of volatile organic compounds on gold/iron oxide catalysts[J]. Appl Catal B-Environ, 2000, 28: 245–251.
DOI:10.1016/S0926-3373(00)00181-8 |
| [25] |
Wang Y, Zhu A, Shi C, et al. Three-dimensional ordered mesoporous Co-Mn oxide:A highly active catalyst for "storage-oxidation" cycling for the removal of formaldehyde[J]. Catal Commun, 2013, 36: 52–57.
DOI:10.1016/j.catcom.2013.03.007 |
| [26] |
Tian H, He J, Ma C, et al. Highly active manganese oxide catalysts for low-temperature oxidation of formaldehyde[J]. Micro Mes Mater, 2012, 151: 397–402.
DOI:10.1016/j.micromeso.2011.10.003 |
| [27] |
Zhu L, Wang J, Zhang P, et al. Cerium modified birnessite-type MnO2 for gaseous formaldehyde oxidation at low temperature[J]. Appl Catal B-Environ, 2017, 211: 212–221.
DOI:10.1016/j.apcatb.2017.04.025 |
| [28] |
An N, Zhang W, Pan B, et al. Catalytic oxidation of formaldehyde over different silica supported platinum catalysts[J]. Chem Eng J, 2013, 215: 1–6.
|
| [29] |
Park S J, Bae I, Cho B K, et al. Oxidation of formaldehyde over Pd/Beta catalyst[J]. Chem Eng J, 2012, 195/196: 392–402.
DOI:10.1016/j.cej.2012.04.028 |
| [30] |
O'Shea V, Alvarez-Galvan M C, Arias P L, et al. Influence of feed composition on the activity of Mn and PdMn/Al2O3 catalysts for combustion of formaldehyde/methanol[J]. Appl Catal B-Environ, 2005, 57(3): 191–199.
DOI:10.1016/j.apcatb.2004.11.001 |
| [31] |
Huang H, Leung D Y C. Complete oxidation of formaldehyde at room temperature using TiO2 supported metallic Pd nanoparticles[J]. ACS Catal, 2011, 1(4): 348–354.
DOI:10.1021/cs200023p |
| [32] |
Chen B, Zhu X, Shi C, et al. Complete oxidation of formaldehyde at ambient temperature over γ-Al2O3 supported Au catalyst[J]. Catal Commun, 2013, 42: 93–97.
DOI:10.1016/j.catcom.2013.08.008 |
| [33] |
Shen Y N, Yang X Z, Wang Y Z, et al. The states of gold species in CeO2 supported gold catalyst for formaldehyde oxidation[J]. Appl Catal B-Environ, 2008, 79(2): 142–148.
DOI:10.1016/j.apcatb.2007.09.042 |
| [34] |
Zhang J, Jin Y, Li C Y, et al. Creation of three-dimensionally ordered macroporous Au/CeO2 catalysts with controlled pore sizes and their enhanced catalytic performance for formaldehyde oxidation[J]. Appl Catal B-Environ, 2009, 91(1/2): 11–20.
|
| [35] |
Liu B, Liu Y, Jing P, et al. Three-dimensionally ordered macroporous Au/CeO2-Co3O4 catalysts with nanoporous walls for enhanced catalytic oxidation of formaldehyde[J]. Appl Catal B-Environ, 2012, 127: 47–58.
DOI:10.1016/j.apcatb.2012.08.005 |
| [36] |
Ma C Y, Mu Z, Li J J, et al. Mesoporous Co3O4 and Au/Co3O4 catalysts for low-temperature oxidation of trace ethylene[J]. J Am Chem Soc, 2010, 132(8): 2608–2613.
DOI:10.1021/ja906274t |
| [37] |
Bai B Y, Li J H. Positive effects of K+ ions on three-dimensional mesoporous Ag/Co3O4 catalyst for HCHO oxidation[J]. ACS Catal, 2014, 4(8): 2753–2762.
DOI:10.1021/cs5006663 |
| [38] |
Sun X C, Lin J, Wang X D, et al. Complete oxidation of formaldehyde over TiO2 supported subnanometer Rh catalyst at ambient temperature[J]. Appl Catal B-Environ, 2018, 226: 575–584.
DOI:10.1016/j.apcatb.2018.01.011 |
| [39] |
Dai Z J, Yu X W, Ke Q F, et al. Nanocrystalline MnO2on an activated carbon fiber for catalytic formaldehyde removal[J]. Rsc Advances, 2016, 6(99): 97022–97029.
DOI:10.1039/C6RA15463H |
| [40] |
Yu X H, He J H, Wang D H, et al. Facile Controlled Synthesis of Pt/MnO2 Nanostructured Catalysts and Their Catalytic Performance for Oxidative Decomposition of Formaldehyde[J]. J Phys Chem C, 2011, 116: 851–860.
|
| [41] |
Chen H M, He J H, He H, et al. Self-assembly of novel mesoporous manganese oxide nanostructures and their application in oxidative decomposition of formaldehyde[J]. J Phys Chem C, 2007, 111: 18033–18038.
DOI:10.1021/jp076113n |
| [42] |
Sekine Y, Nishimura A. Removal of formaldehyde from indoor air by passive type air-cleaning materials[J]. Atmos environ, 2001, 35: 2001–2007.
DOI:10.1016/S1352-2310(00)00465-9 |
| [43] |
Zhou L, He J, He H, et al. Facile in-situ synthesis of manganese dioxide nanosheets on cellulose fibers and their application in oxidative decomposition of formaldehyde[J]. J Phys Chem C, 2011, 115(34): 16873–16878.
DOI:10.1021/jp2050564 |
| [44] |
Wang J L, Li J E, Yu J G, et al. The effect of manganese vacancy in birnessite-type MnO2 on room-temperature oxidation of formaldehyde in air[J]. Appl Catal B-Environ, 2017, 204: 147–155.
DOI:10.1016/j.apcatb.2016.11.036 |
| [45] |
Rong S P, Li K Z, Zhang P Y, et al. Potassium associated manganese vacancy in birnessite-type manganese dioxide for airborne formaldehyde oxidation[J]. Catal Sci Technol, 2018, 8: 1799–1812.
DOI:10.1039/C7CY02121F |
| [46] |
Xu Y, Greeley J, Mavrikakis M. Effect of subsurface oxygen on the reactivity of the Ag(111) surface[J]. J Am Chem Soc, 2005, 127: 12823.
DOI:10.1021/ja043727m |
| [47] |
Wang J, Zhang P, Li J, et al. Room-temperature oxidation of formaldehyde by layered manganese oxide:Effect of water[J]. Environ Sci Technol, 2015, 49(20): 12372–12379.
DOI:10.1021/acs.est.5b02085 |
| [48] |
Tian H, He J H, Ma C Y, et al. Highly active manganese oxide catalysts for low-temperature oxidation of formaldehyde[J]. Micro Mes Mater, 2012, 151: 397–402.
DOI:10.1016/j.micromeso.2011.10.003 |
| [49] |
Ma C Y, Wang D H, Hao Z P, et al. Investigation of formaldehyde oxidation over Co3O4-CeO2 and Au/Co3O4-CeO2 catalysts at room temperature:Effective removal and determination of reaction mechanism[J]. Environ Sci Technol, 2011, 45(8): 3628–3634.
DOI:10.1021/es104146v |
| [50] |
Bai B Y, Arandiyan H, Li J H. Comparison of the performance for oxidation of formaldehyde on nano-Co3O4, 2D-Co3O4, and 3D-Co3O4 catalysts[J]. Appl Catal B-Environ, 2013, 142: 677–683.
|
| [51] |
Ma L, Wang D S, Li J H, et al. Ag/CeO2 nanospheres:Efficient catalysts for formaldehyde oxidation[J]. Appl Catal B-Environ, 2014, 148/149: 36–43.
DOI:10.1016/j.apcatb.2013.10.039 |
| [52] |
Xia Y S, Dai H X, Zhang L, et al. Ultrasound-assisted nanocasting fabrication and excellent catalytic performance of three-dimensionally ordered mesoporous chromia for the combustion of formaldehyde, acetone, and methanol[J]. Appl Catal B-Environ, 2010, 100(1/2): 229–237.
|
| [53] |
Tang X, Li Y, Shen W, et al. MnOx-CeO2 mixed oxide catalysts for complete oxidation of formaldehyde:Effect of preparation method and calcination temperature[J]. Appl Catal B-Environ, 2006, 62(3): 265–273.
|
| [54] |
Liu X S, Lu J Q, Qian K, et al. A comparative study of formaldehyde and carbon monoxide complete oxidation on MnOx-CeO2 catalysts[J]. J Rare Earth, 2009, 27: 418.
DOI:10.1016/S1002-0721(08)60263-X |
| [55] |
Wen Y R, Tang X, Li J H, et al. Impact of synthesis method on catalytic performance of MnOx-SnO2 for controlling formaldehyde emission[J]. Catal Commun, 2009, 10: 1157–1160.
DOI:10.1016/j.catcom.2008.12.033 |
| [56] |
Pei J J, Han X, Liu Y, et al. Performance and kinetics of catalytic oxidation of formaldehyde over copper manganese oxide catalyst[J]. Build Environ, 2015, 84: 134–141.
DOI:10.1016/j.buildenv.2014.11.002 |
| [57] |
Li X L, Zhang W, Li R, et al. Palladium nanoparticles immobilized on magnetic porous carbon derived from ZIF-67 as efficient catalysts for the semihydrogenation of phenylacetylene under extremely mild conditions[J]. Chemcatchem, 2016, 8: 1111–1118.
DOI:10.1002/cctc.201501283 |
| [58] |
Yu G L, Sun J, Zhu G S, et al. Cobalt-based metal organic framework as precursor to achieve superior catalytic activity for aerobic epoxidation of styrene[J]. Rsc Advances, 2014, 4: 38804–38811.
DOI:10.1039/C4RA03746D |
| [59] |
Chen H R, Shen K, Li Y W, et al. Nanoreactor of MOF-derived yolk-shell Co@C-N:Precisely controllable structure and enhanced catalytic activity[J]. ACS Catal, 2018, 8: 1417–1426.
DOI:10.1021/acscatal.7b03270 |
| [60] |
Yu L, Wang L, Sun X B, et al. Enhanced photocatalytic activity of rGO/TiO2 for the decomposition of formaldehyde under visible light irradiation[J]. J Environ Sci, 2018, 73: 138–146.
DOI:10.1016/j.jes.2018.01.022 |
| [61] |
Li Y, Jiang Y, Peng S. Nitrogen-doped TiO2 modified with NH4F for efficient photocatalytic degradation of formaldehyde under blue light-emitting diodes[J]. J Hazard Mater, 2010, 182(1/3): 90–96.
|
| [62] |
Yu X X, Zeng J, Xuan Y M. A direct solar photo-thermal conversion of methanol into hydrogen[J]. Energy Technol, 2019, 7(7): 1900299.
DOI:10.1002/ente.201900299 |
 2019, Vol. 33
2019, Vol. 33


