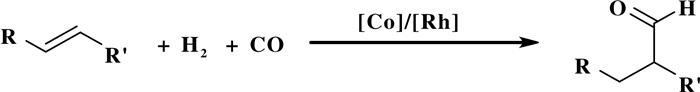
1938年, 德国人Otto Roelen在研究费-托合成(Fischer-Tropsch Process)时首次发现了以烯烃、CO和H2为原料合成醛类化合物的羰基合成过程(OXOProcess); 随着研究的深入, 这一名词逐渐被“氢甲酰化反应(Hydroformylation)”取代(图 1).目前, 氢甲酰化反应是工业合成醛类化合物最重要的合成策略之一, 也是化工生产中规模最大的均相催化反应之一[1-2].尽管羰基化反应在工业生产中取得了很好的商业价值, 然而在合成高值含羰化合物的区域选择性调控方面仍有一定难度[1-4].
|
图 1 氢甲酰化反应通式 Fig.1 General formula for hydroformylation |
在各种不同类型羰基化反应中, 不饱和烯烃或炔烃参与的羰基化反应研究最为广泛和深入[1-4].不饱和烯烃或炔烃羰基化反应主要采用过渡金属钌、钴、镍、铁、钯、铑等催化体系.在这些催化体系中, 钯和铑的催化活性相对较高、实用性较强[1-6].
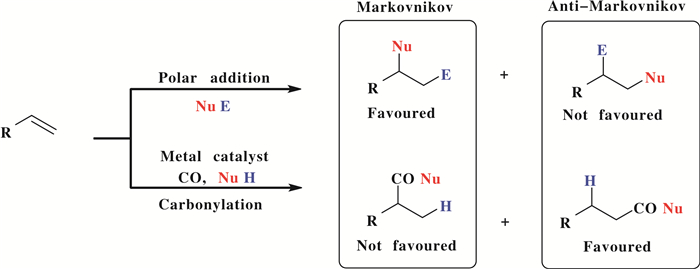
近年来, 化学工作者发展了许多羰基化反应体系, 这些反应体系往往具有较高的直链选择性.相比之下, 具有支链选择性烯烃的羰基化反应通用的催化体系报道仍然较少[7].如图 2所示, 一般来说, 烯烃的大多数亲电加成反应都遵循马尔可夫尼科夫规则(Markovnikov Rule).在Nu-E与烯烃的加成反应中, 生成的仲碳正离子(RCH+CH2E)比伯碳正离子(RCEHCH2+)更稳定, 这种中间体稳定性进而控制了反应的区域选择性; 随后, 反应得到相应的支链产物.然而, 在过渡金属催化的烯烃反应中, 如氢氰化、硅氢化和羰基化反应(氢甲酰化、氢羧基化、氢酯化和胺羰基化反应)则可能生成直链产物.在烯烃的羰基化反应中生成支链产物比较困难.事实上, 在均相催化中, 以优秀的区域选择性实现烯烃的加成反应仍是一个极具挑战的目标[8].
|
图 2 烯烃羰基化反应的产物分布 Fig.2 The product distribution carbonylation reactions of olefins |
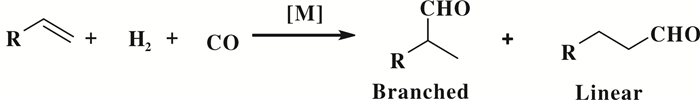
1938年, Roelen等[1]首次发现了钴催化烯烃的氢甲酰化反应, 这类反应具有优秀的原子经济性.随着对该反应过程的研究深入, 化学工作者发展了以金属铑为催化剂合成醛类化合物的新方法(图 3).目前, 通过氢甲酰化反应得到的醛类化合物年产量达到千万吨(图 3).
|
图 3 烯烃的氢甲酰化反应通式([M]是催化剂) Fig.3 General formula for hydroformylation of olefins, [M] is catalyst |
图 4是氢甲酰化反应可能的机理[1].首先, 烯烃插入M—H键(A)的形成M-烷基中间体(B).随后, CO迁移插入M—C键中, 得到M-酰基化合物(C).接着, M-酰基化合物在氢气的作用下, 得到醛类化合物(D), 同时再生M—H物种, 反应继续进行.值得注意的是, 在烯烃的氢甲酰化反应中, 有可能同时生成支链型醛和直链型醛等产物.因此, 以高区域选择性实现烯烃的氢甲酰化反应合成醛类化合物有一定挑战[9].

|
图 4 氢甲酰化反应可能的机理 Fig.4 Proposed mechanism of hydroformylation |
近年来, 化学工作者对氢甲酰化反应进行了深入的研究, 并取得了一系列成果.一般来说, 末端烯烃的氢甲酰化反应倾向于生成直链醛, 选择合适配体可以获得近乎完美的直链选择性[10].烯烃的支链醛产物在医药、精细化工等领域有着重要的作用, 特别是具有对映选择性的醛类在医药中有着极其重要的作用[11].
2018年, 张绪穆等[12]开发了一种新颖的不对称膦配体L1, 并将配体L1应用到铑催化1, 1-二取代烯烃的不对称氢甲酰化反应中.如图 5所示, 该不对称氢甲酰化反应体系以Rh(acac)(CO)2和配体L1金属催化剂前体、在CO/H2=0.25/0.25 MPa的条件下以高收率、高直链选择性、高对映选择性得到相应的不对称醛类产物.该反应体系使用不对称双膦配体L1调控反应的区域选择性.基于这一双膦配体L1调控氢甲酰化反应区域和对映选择性的策略, 为大规模工业化生产不对称醛类化合物提供了可能.

|
图 5 铑催化烯烃的不对称氢甲酰化反应 Fig.5 Rh-catalyzed asymmetric hydroformylation of alkenes |
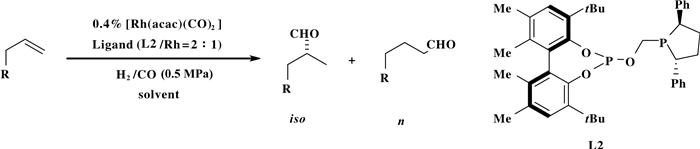
最近, Clarke等[13]发展了一种不对称膦配体L2, 并将配体L2运用到脂肪烯烃的不对称氢甲酰化反应中(图 6).该反应体系以Rh(acac)(CO)2和配体L2为催化剂前体、在H2/CO=0.5 MPa的条件下, 以良好的产率、中等支链选择性、高对映选择性得到相应的醛类产物.该反应体系通过不对称膦配体L2调控反应区域和对映选择性的策略, 有望实现各种脂肪烯烃通过不对称氢甲酰化反应得到相应的不对称醛类产物.
|
图 6 烯烃的不对称氢甲酰化反应 Fig.6 Enantioselective hydroformylation of alkenes |
羧酸是一类重要的有机酸, 广泛的应用到制药、材料、食品工业、精细化学品等领域中[14-17].然而, 烯烃参与的羟羰基化反应有可能同时得到支链羧酸或直链羧酸两种产物.支链羧酸或直链羧酸都具有重要的应用价值.如支链羧酸(如2-芳基丙酸)是非甾体类药物的重要组成部分, 而直链羧酸(如肉桂酸)是一类重要的化合物, 在精细化工领域有着广泛的应用[18].
烯烃的氢羧基化反应(hydroxycarbonylation)具有体系简单、原子经济性高等优点.过渡金属催化烯烃与CO和H2O的羰基化反应一般称作氢羧基化反应.在工业和有机合成中氢羧基化反应被广泛用于制备羧酸化合物(图 7)[18].

|
图 7 烯烃的羟羰基化反应([M]是催化剂) Fig.7 Hydroxycarbonylations of olefins, [M] is catalyst |
1953年, Reppe等[19-20]首次研究乙炔羰基化制备丙烯酸的反应.其中, 1969年, Kutepow等[21]在氢羧基化反应领域中取得了关键性的进展, 他们开发了一种基于钯催化的氢羧基化反应新催化体系, 该钯催化体系使得氢羧基化反应的效率得到了显著提升.近年来, Drent[22-24]、Sheldon[25]、van Leeuwen[26]、Mecking[27]和Wendt[28]等不断深入地研究氢羧基化反应, 他们尝试引进新的配体、添加剂、改善工艺条件来提高反应的效率和选择性.通常, 烯烃氢羧基化反应的催化活性中心的生成需要金属、配体和添加剂等共同作用.其中, 配体或添加剂调控烯烃氢羧基化反应的区域选择性.
近年来, 化学工作者对烯烃的氢羧基化反应过程进行了深入的研究, 并在其区域选择性调控等方面积累了一定的经验.图 8是烯烃的氢羧基化反应可能的机理[9], 如图所示, 首先, 烯烃插入Pd—H键(物种A)的形成Pd-烷基中间体(物种B).随后, CO迁移插入Pd-烷基键中, 得到钯酰基化合物(物种C).接着, 物种C在亲核试剂(H2O)的进攻下, 得到羧酸产物(物种D), 同时再生Pd—H物种(物种A), 反应继续进行.然而, 在烯烃的氢羧基化反应中, 反应有可能同时生成支链型羧酸和直链型羧酸等产物.因此, 需要研究合适的反应体系, 以高区域选择性实现烯烃的氢羧基化反应.
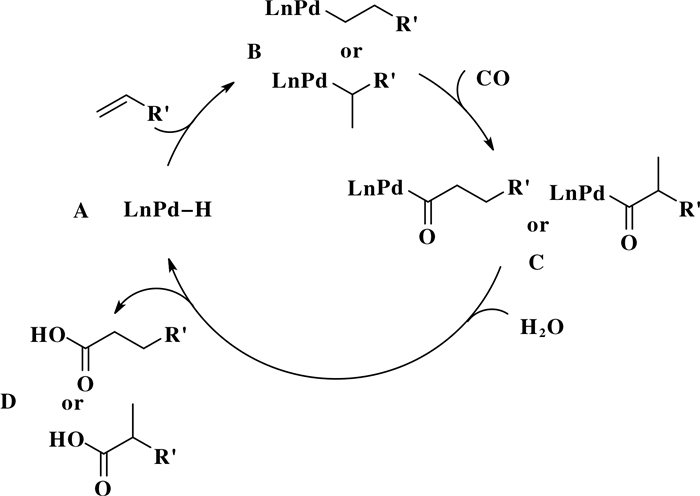
|
图 8 羟羰基化反应可能的机理 Fig.8 Proposed mechanism for hydroxycarbonylation |
2010年, Clarke等[29]开发了一种新型的钯配合物I, 该配合物I能应用到催化烯烃不对称氢羧基化反应(图 9).该反应体系以配合物I为催化剂、20%(摩尔百分比)对甲苯磺酸和为添加剂、3 MPa CO为羰源、在加入2.5当量水的条件下, 通过不对称氢羧基化反应得到相应地具有对映选择性的羧酸产物.在标准条件下, 支链型产物的ee值(对映体过量)最大达到80%.由于双膦配体不利于生成支链型产物, 导致该催化体系反应产物区域选择性较差(最优l/b=1.1).基于不对称双膦配体调控反应的区域和对映选择性的策略, Clarke小组也将此策略应用到不对称氢酯化反应中.
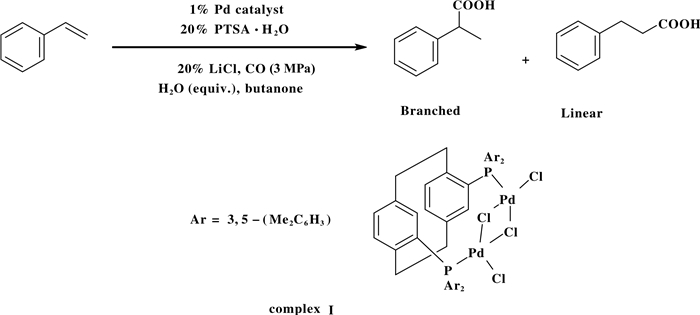
|
图 9 烯烃的对映选择性羟基羰基化反应 Fig.9 Enantioselective hydroxycarbonylation of styrene |
长链二羧酸可作为合成各种聚合材料的原料[30], 是一种有较高价值的含羰基化合物.长链脂肪烯烃的氢羧基化反应为合成这种羧酸化合物提供了可能. 2016年, Mecking等[27]开发了一种新型的烯烃氢羧基化反应体系.如图 10所示, 该氢羧基化反应体系以配合物(dtbpx)Pd(OTf)2为催化剂、水和CO为原料, 实现了各种双键在不同位置的或不同链长的烯烃氢羧基化反应并得到相应的高支链选择性的长链二羧酸化合物.作者通过机理实验研究了反应可能的机理, 实验研究表明烯烃的异构化是决定反应速率和区域选择性的关键步骤.

|
图 10 钯催化异构化不饱和脂肪酸的羟羰基化反应 Fig.10 Pd-catalyzed isomerizing hydroxycarbonylation of unsaturated fatty acids |
2018年, 李跃辉等[31]发展了一种铁(Ⅲ)盐调控钯催化羰基化反应生成羧酸的方法, 该反应区域选择性由Fe(Ⅲ)盐调控(图 11).在廉价、易得的铁(Ⅲ)盐为助催化剂的条件下, 多种芳香族和脂肪族烯烃氢羧基化反应以中等至优秀的产率和区域选择性得到相应的羧酸.在相似的条件下, 通过简单地改变铁(Ⅲ)盐种类, 烯烃氢羧基化反应的区域选择性可由支链选择性(>99/1, FeCl3)反转为直链选择性(99/1, Fe(OTf)3).实验发现该铁(Ⅲ)盐调控钯催化羰基化反应区域选择性策略同样适应于以芳基乙醇为底物的反应.初步机理研究表明阴离子效应主要是影响了烯烃插入Pd-H这一关键步骤.

|
图 11 铁(Ⅲ)盐调控钯催化烯烃的羟羰基化反应 Fig.11 Fe(Ⅲ) salt effect in the carbonylation reaction |
最近, Beller等[32]第一次在水相中实现了具有空间位阻烯烃的氢羧基化反应, 并以良好的收率和区域选择性得到羧酸化合物(图 12).该氢羧基化反应体系以一种新型的配体L3和Pd(acac)2催化体系、AcOH/H2O为溶剂, 在温和条件下实现烯烃的氢羧基化反应.在保持反应活性的情况下, 催化体系表现出较好的稳定性, 该氢羧基化反应体系可以循环使用25次.此外, 在反应体系中, 乙烯也能以较高的TON(TON> 350 000; TON: turnOver number)和TOF(TOF> 15 000; TOF: turnover frequency)获得相应的羧酸产物.实验研究表明, 该反应体系以三、四取代烯烃为底物时, 氢羧基化反应能以较高的收率转化为相应的羧酸产物.
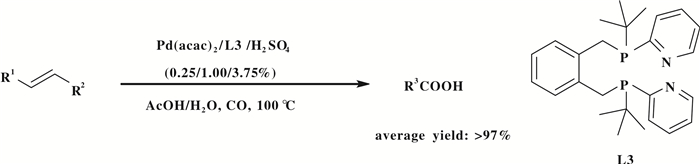
|
图 12 在水相中烯烃的羟羰基化反应 Fig.12 Hydroxycarbonylation of alkenes in aqueous media |
总的来说, 近几十年来, 在烯烃参与的氢羧基化反应中, 化学工作者一直致力于解决反应的区域选择性和活性不高等问题.但仍有两大局限需要突破: 1)反应缺乏有效调节区域选择性的方法; 2)反应活性有待提高.针对以上问题, 人们尝试设计新配体或开发新的催化模式来解决这些问题.
3 氢酯化反应研究进展在烯烃转化反应中, 烯烃参与的氢酯化反应是最重要的反应之一[1].在工业生产中, 大量不同种类的烯烃(炔烃)直接通过羰基化反应转化为酯类化合物(年产约100 t/年)[1-3].近年来, 化学工作者开发了一系列过渡金属催化烯烃氢酯化反应, 这类反应具有底物适用范围广、官能团容忍性好、反应活性高等优点而受到化学工作者极大地关注.
氢酯化反应是羰基化反应的一种基本反应类型, 也被称作烷氧羰基反应(Alkoxycarbonylation/Hydroesterification), 是均相催化在工业上的重要应用之一[2-3, 8].通常, 氢酯化反应是指以过渡金属为催化剂(如钯、铑)、烯烃(炔烃、联烯、卤代烃等)为原料、CO为羰基源、醇(硫醇、酚等)为亲核试剂, 一步法制备酯类产物的反应过程(图 13)[2-3].
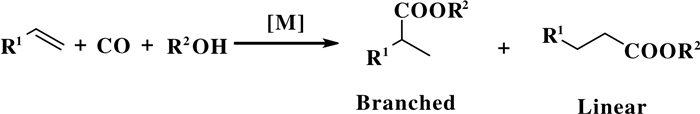
|
图 13 烯烃的氢酯化反应通式([M]是催化剂) Fig.13 General formula for hydroesterification of olefins, [M] is catalyst |
1953年, Reppe等[20]首次开发了一种以过渡金属Ni(CO)4为催化剂的烯烃氢酯化反应.如图 14所示, 该氢酯化反应体系以Ni(CO)4为催化剂、CO为羰基源、醇为亲核试剂得到相应的酯类化合物.随后, 这一氢酯化反应体系被应用到工业化中生产各种酯类化合物.和氢羧基反应(羧酸化合物)相比, 氢酯化反应产物(酯类化合物)纯化过程较为简单.
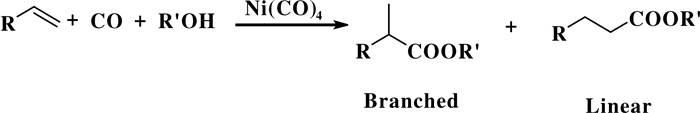
|
图 14 镍催化烯烃的氢酯化反应 Fig.14 Ni-catalyzed hydroxycarbonylation of olefin |
图 15是氢酯化反应可能的机理[8].如图所示, 首先, 烯烃插入Pd—H键(物种A)的形成钯烷基中间体(物种B).随后, CO迁移插入Pd—C键(物种B)中, 得到钯酰基化合物(物种C).接着, 钯酰基化合物(物种C)在亲核试剂醇(D)的进攻下, 得到酯化产物(化合物E), 随之Pd—H物种(物种A)生成, 反应继续.值得注意的是, 在烯烃的氢酯化反应中, 由于烯烃的双键异构化, 可能导致反应同时生成支链型酯类化合物和直链型酯类化合物等产物.因此, 需要开发合适的配体或催化模式, 以高区域选择性实现烯烃的氢酯化反应.
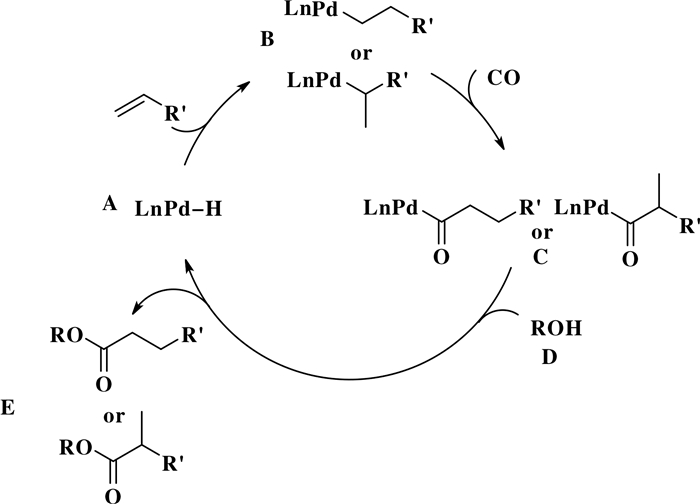
|
图 15 氢酯化反应可能的机理 Fig.15 Proposed mechanism hydroesterification |
1993年, Drent等[22]发展了一种以2-吡啶二苯基膦为单膦配体的高效均相钯催化剂, 该催化剂以高区域选择性实现丙炔一步法制备MMA(甲基丙烯酸甲酯)的烷氧羰基化反应过程(图 16).反应体系Pd(OAc)2和2-吡啶二苯基膦为催化剂前体、含弱配位阴离子甲磺酸为助剂, 实现了丙炔一锅法高效率(TOF=50 000)和高选择性地(99.95%)制备MMA的过程.研究表明2-吡啶二苯基膦有助于形成阳离子型钯, 这类阳离子型钯催化剂调控反应的区域选择性和反应效率.此外, 利用2-吡啶二苯基膦配体中P和N配位原子活化金属钯策略, 对调控反应的效率和区域选择性起着至关重要的作用.
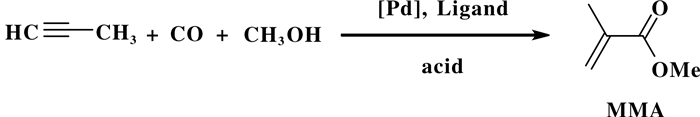
|
图 16 钯催化丙炔合成甲基丙烯酸甲酯 Fig.16 Pd-catalyzed synthesis MMA |
基于类似配体调控区域选择性的策略, 2004年, Cole-Hamilton等[33]发展了一种高效的钯金属和双膦配体共同催化的氢酯化反应体系(图 17).该反应体系以零价钯Pd2(dba)3和双(二叔丁基膦甲基)苯(L4)为催化体系、以甲磺酸为助催化剂, 在温和条件下实现了末端或内烯烃的氢酯化反应, 反应的直链选择性达到99%.研究表明以双(二叔丁基膦甲基)苯(L4)为配体组成的钯氢物种对反应区域选择性具有决定性作用.
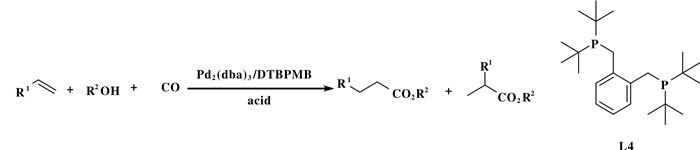
|
图 17 钯催化烯烃的氢酯化反应 Fig.17 Methoxycarbonylation of alkenes catalysed by palladium |
值得一提的是, 2016年, Beller小组[8]发展了一种以PdX2和N-苯基吡咯膦(L5)组成的催化剂体系, 该体系实现了长链脂肪族烯烃的具有支链选择性的氢酯化反应体系(图 18).反应体系以PdCl2为金属催化剂、以4 MPa CO为羰基源、在配体L5作用下实现了长链脂肪族烯烃氢酯化反应并以高支链选择性得到相应的酯类化合物.值得注意的是, 该反应体系底物普适性较好, 多种脂肪族和芳香族烯烃、多种醇类都能通过氢酯化反应得到相应的支链酯类化合物.实验研究表明, 配体L5的空间位阻效应和电子效应对调控氢酯化反应的区域选择性具有决定性作用.
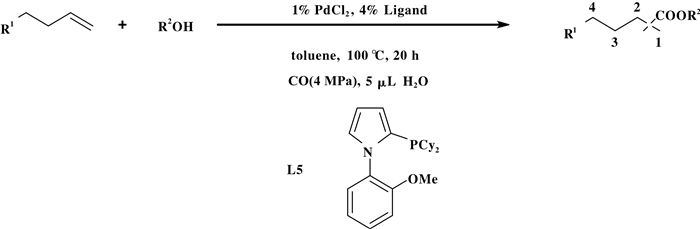
|
图 18 钯催化烯烃的马氏烷氧羰基化反应 Fig.18 Palladium-catalysed Markovnikov alkoxycarbonylation of alkenes |
目前, 羰基化反应的烯烃底物仅局限于末端烯烃或少部分内烯烃.由于二、三、四取代的烯烃具有较大的位阻和烯烃双键较难迁移等原因, 导致这些烯烃参与的反应活性急剧下降[34].但这些烯烃的氢酯化产物是一些常见的天然产物、药物重要的组成部分. 2018年, Beller等[35]首次报道了一种钯催化大位阻或低活性烯烃的氢酯化反应体系(图 19), 这些烯烃包括:三取代、四取代和1, 1-二取代等烯烃.该反应体系以Pd(acac)2和1, 3-双叔丁基(2-吡啶基)膦)丙烷(L6)或1, 4-双叔丁基(2-吡啶基)膦丁烷(L7)为催化体系, 在适宜的的条件下, 以高收率和高直链选择性实现了各类不同取代烯烃的氢酯化反应.
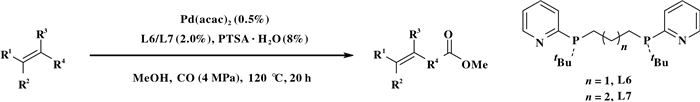
|
图 19 钯催化四取代烯烃烷氧羰基化反应 Fig.19 Palladium-catalysed alkoxycarbonylation of tetra-substituted alkenes |
基于前人的工作, 2018年, 中科院兰州化物所李跃辉等[36]开发了一种新型双功能配体L8, 该配体(L8)和钯金属组成催化体系催化炔烃的氢酯化基化反应(图 20).在温和条件下(60 ℃), 该反应体系以L8为配体、PdCl2为金属催化剂前体实现了各种脂肪族和芳香族炔烃的氢酯化反应并得到相应的支链α, β-不饱和酯.实验分析表明Pd(L8)Cl2晶体结构和已知的Ph2P(2-Py)相比, 李跃辉等人开发的双功能配体L8与Pd中心具有更强的协同作用.毫无疑问, 在炔烃的氢酯化反应中, 这种协同作用有助于获得更高的反应活性和更好的支链选择性.

|
图 20 钯催化炔烃的烷氧羰基化反应 Fig.20 Pd-catalysed alkoxycarbonylation of alkynes |
酰胺是天然产物和医药中间体重要组成部分(图 21).此外, 酰胺化合物还被应用于精细化工、新材料、天然橡胶、树脂、医药等领域[37].传统上, 主要有两种制备方法合成酰胺化合物: 1)胺与羧酸或酰氯的缩合反应[38]; 2)酰胺酸的成环反应[39].然而, 这些制备方法存在反应条件苛刻、底物耐受性差等问题.胺羰基化反应具有优秀的原子经济性、底物耐受性好等优点、并能一步法构建酰胺化合物, 因而受到化学工作者极大的关注[1-4].
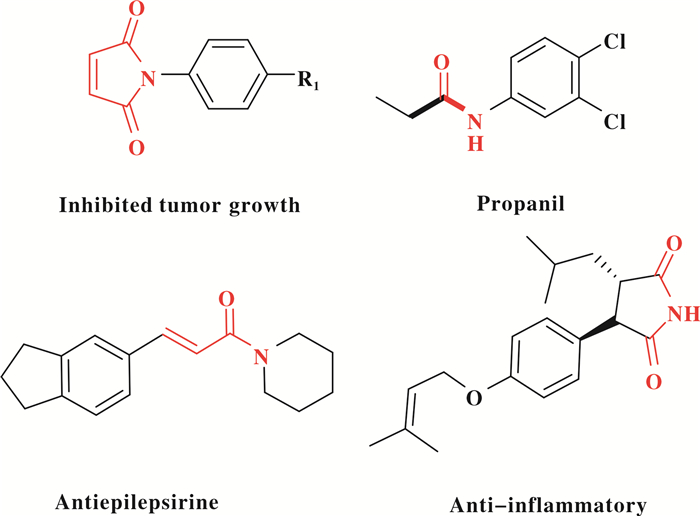
|
图 21 具有生物活性的酰胺化合物 Fig.21 Selective examples of bioactive amides |
胺羰基化反应(aminocarbonylation/hydroaminocarbonylation)一般指的是在过渡金属催化下, 以CO等为羰源、氨或胺为亲核试剂、以烯烃(炔烃等)为底物合成酰胺的反应过程(图 22).

|
图 22 烯烃的胺羰基化反应([M]是催化剂) Fig.22 Aminocarbonylation of olefins, [M] is catalyst |
图 23是烯烃参与的胺羰基化反应可能的机理, 如图所示, 首先, 烯烃插入Pd—H键(物种A)形成Pd-烷基中间体(物种B).随后, CO迁移插入Pd—C键中(物种B), 得到钯酰基化合物(物种C).接着, 钯酰基化合物(物种C)在胺基化合物(D)作用下发生胺解, 得到酰胺化合物(E), 同时再生Pd—H物种(物种A), 反应继续进行.值得注意的是, 在烯烃的胺羰基化反应中, 反应有可能同时生成支链型酰胺和直链型酰胺等产物.因此, 需要开发出合适的反应体系, 以高区域选择性实现烯烃的胺羰基化反应.
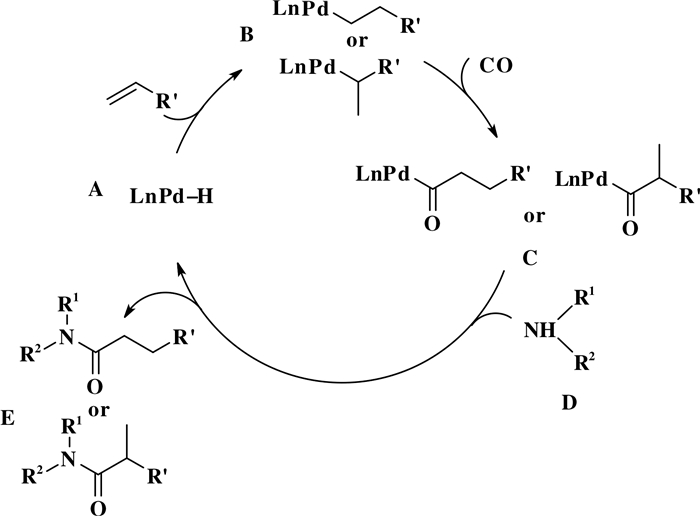
|
图 23 胺羰基化反应可能的机理 Fig.23 Proposed mechanism aminocarbonylation |
20世纪50年代, Reppe等[40]首次发现了以过渡金属Co配合物为催化剂的胺羰基化反应体系.随后, 化学工作者开发了多种过渡金属催化胺羰基化反应, 例如镍、铁、钌等金属.然而, 苛刻的反应条件(高温、高压)、不可避免的副产物(甲酰胺)和有限的底物范围等缺点阻碍了这些方法的进一步应用. 1989年, Jagers等[41]在胺羰基化反应上取得突破性进展, 首次将钯金属应用到胺羰基化反应中, 这一发现提高了胺羰基化反应活性.近年来, 钯催化烯烃胺羰基化反应得到了广泛的关注, 这其中Cole-Hamilton[42]、Liu[43]、Alper[44]、Beller[45]等分别进行了深入的研究.
2002年, Chung等[46]开发了首例Co/C为非均相催化剂的胺羰基化反应体系(图 24).该体系以7 MPa CO为羰源, 以中等收率实现了苯胺和烯烃的胺羰基化反应并得到了相应的酰胺化合物.由于该反应体系缺少区域选择性调控手段(如配体等), 导致该胺羰基化反应的区域选择性仍有待提高.

|
图 24 钴催化烯烃的胺羰基化反应 Fig.24 Co-catalysed aminocarbonylation of alkenes |
廉价金属钴催化较低, 钴催化的胺羰基化反应底物范围较窄[46]. 2014年, Dyson等[43]开发了一种简单的钯催化胺羰基化反应体系(图 25).该胺羰基化反应体系以氯化钯和商品化单膦配体为催化体系、CO为羰源, 在适宜的条件下芳香胺和烯烃以高收率和支链选择性得到酰胺化合物.值得注意的是, 该胺羰基化反应体系不需要额外添加任何酸、碱和其他添加剂为助催化剂.然而, 该胺羰基化反应体系不能兼容脂肪族胺类底物.这可能是因为脂肪族胺类底物的碱性太强, 破坏反应体系中催化活性Pd—H物种, 阻碍反应顺利进行.

|
图 25 钯催化烯烃的胺羰基化反应 Fig.25 Pd-catalysed aminocarbonylation of alkenes |
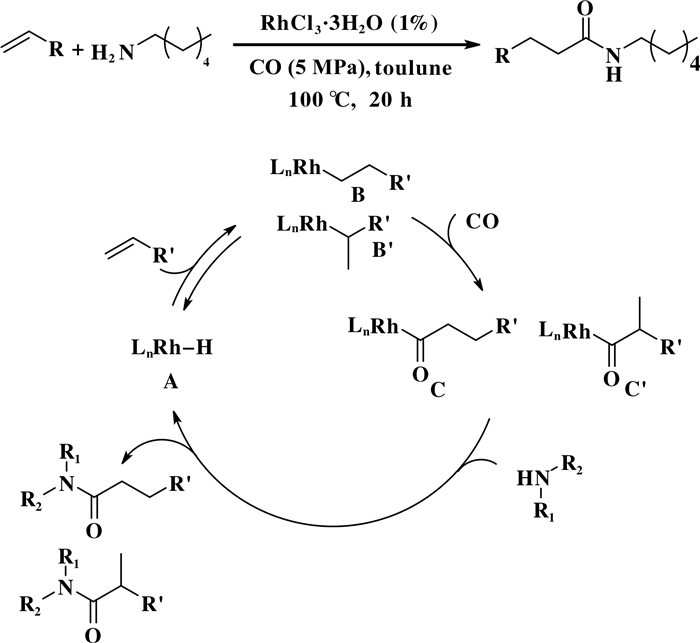
2015年, 李跃辉和Beller等[47]开发了一种新型铑催化烯烃胺羰基化反体系(图 26).
|
图 26 铑催化烯烃的胺羰基化反应 Fig.26 Rh-catalysed aminocarbonylation of alkenes |
在无需配体参与反应情况下, 该反应体系以RhCl3为催化剂, 以较高的产率(最高94%)和直链选择性(直链/支链>99/1)反应得到酰胺化合物.作者也尝试提出该反应可能的机理, 如图 26所示, 1)在CO和胺的作用下RhCl3原位生成催化活性物种Rh—H(物种A); 2)烯烃插入Rh—H键(物种A)得到两种构型的Rh烷基物种(物种B或B’); 3) CO插入Rh—C物种生成铑酰基物种(物种C或C’); 4)脂肪胺进攻铑酰基物种生成目标酰胺化合物, 同时得到Rh-H(物种A), 反应继续进行.
2016年, Alper等[44]开发了一种基于配体调控烯烃与胺的胺羰基化反应区域选择性的反应体系(图 27).该胺羰基化反应体系在使用相同助催化剂的条件下, 通过简单改变配体实现了烯烃的胺羰基化反应区域选择性的改变, 并分别以较高的产率得到直链或支链酰胺化合物.如图 4.7所示, 该胺羰基化反应体系在CH3CN为溶剂的条件下, 以硼酸和5-氯水杨酸为助催化剂、三(4-甲氧苯基)膦为配体(L9)、以高直链选择性和高收率生成酰胺化产物.然而, 该反应体系在丁酮(butan-2-one)为溶剂的条件下、以1, 3, 5, 7-四甲基-6-苯基-2, 4, 8-三氧杂-6-磷酰金刚烷(L10)为配体、以高收率和高区域选择性实现了酰胺化反应并得到相应的支链酰胺化产物.实验研究表明在该反应体系中配体的性质决定了反应的区域选择性.

|
图 27 钯催化烯烃选择性的胺羰基化反应 Fig.27 Pd-catalysed selective aminocarbonylation of alkenes |
2016年, Beller等[48]发展了一种钯催化脂肪胺盐酸盐的胺羰基化反应体系.该反应体系以PdCl2和配体L11为催化体系, 多种烯烃和脂肪胺盐酸盐以高收率和支链选择性得到酰胺化合物(图 28).考虑到底物的易获得性、反应具有良好的产率和支链选择性等优点, 该方法有望补充现有的合成酰胺化合物的方法.研究表明配体对调控区域选择性具有决定性作用.

|
图 28 烯烃和苄胺的胺羰基化反应 Fig.28 Aminocarbonylation of alkenes and benzylamine |
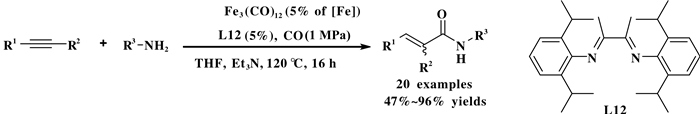
α, β-不饱和酰胺化合物是重要的有机合成中间体, 在材料、生物医药等领域有重要的应用[49-51].近年来, 过渡金属催化炔烃与一氧化碳的胺羰基化反应引起了化学工作者的关注.在这方面, 羰基铁催化的胺羰基化反应是一个非常有吸引力的研究方向. 2011年, Beller课题组[49]发展了一个通用的羰基铁催化炔烃胺羰基化反应体系(图 29).该反应体系以Fe3(CO)12为催化剂、双胺化合物L12为配体、在CO压力为1 MPa的条件下, 廉价、易得的胺和炔烃以高产率和直链选择性生成了一系列结构多样的α, β-不饱和酰胺化合物.该方法具有较高化学选择性和直链选择性, 而且不需要昂贵的催化剂来催化这种新型环境友好的羰基化反应.
|
图 29 铁催化炔烃的胺羰基化反应 Fig.29 Fe-catalysed aminocarbonylation of alkynes |
2017年, Alper等[52]开发了一种基于配体和添加剂共同调控胺羰基化反应区域选择性的策略(图 30).该胺羰基化反应体系通过简单的改变配体和添加剂, 可以选择性地生成直链或支链α, β-不饱和酰胺化合物.该反应体系以炔烃与胺为底物、硼酸和BCSA(5-氯水杨酸)为助催化剂、1, 2-双(二叔丁基膦甲基)苯(DTBPMB)为配体, 以较高收率和直链选择性生成相应的α, β-不饱和酰胺产物.然而, 当以1, 3-双(二苯基膦基)丙烷为配体和对苯甲磺酸为助催化剂, 该反应体系生成支链α, β-不饱和酰胺产物.实验研究表明, 除了配体的性质和结构调控反应区域选择性外, 助催化剂(质子给体)还可以促进LnPd-H中间体的生成, 这对反应的区域选择性至关重要.
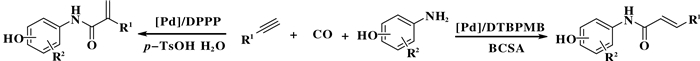
|
图 30 钯催化炔烃选择性的胺羰基化反应 Fig.30 Pd-catalysed selective aminocarbonylation of alkynes |
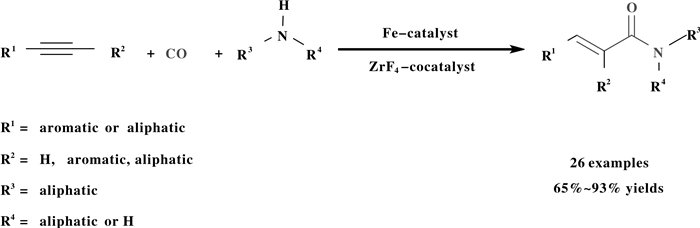
2019年, 李跃辉等开发了一种无配体参与的ZrF4为助催化剂羰基铁催化炔烃胺羰基化反应体系(图 31).以廉价、易得、商品化的ZrF4为助催化剂, 可以取得比以氮或膦为配体的胺羰基化反应更好的效率和产率.该胺羰基化反应体系适用于多种芳基或烷基取代的炔烃胺羰基化反应并能以良好至优秀的产率生成相应的α, β-不饱和酰胺.实验研究表明, ZrF4对铁催化炔烃胺羰基化反应活化效应是通过ZrF4中F与胺中H—N形成氢键和ZrF4促进Fe3(CO)12解离成单核Fe(CO)x实现的.该工作为非贵金属催化炔烃的胺羰化反应提供了更高效的方法, 同时也为如何有效提升羰化反应的效率带来了新的思路.
|
图 31 钯催化炔烃胺羰基化反应 Fig.31 Pd-catalysed aminocarbonylation of alkynes |
1938年首次实现CO参与的羰基化反应至今, 其已被应用于多种高值含羰基化合物的制备, 如制备醛、酸、酯、酮、酰胺等重要的有机中间体和化工产品.近年来, 丁奎岭、夏春谷、黄汉民、雷爱文、史一安、Alper、Beller等小组对羰基化反应做了大量系统的研究工作, 如拓宽羰基化反应类型和条件、提高反应效率和区域选择性、寻找CO替代物等方面取得了一系列的成果.
在过去的70年间, 羰基化反应的底物范围、催化剂种类、羰基源种类、官能团化产物种类都取得了很大进步.反应底物从最初的烯烃和炔烃, 扩展到芳烃、有机卤化物、杂环化合物、硝基化合物、醇、醚、酚、酯、胺等; 催化剂种类, 从最初的非均相钴、镍催化剂, 扩展到现今的多种类型催化剂, 如非均相/均相催化中的非贵金属催化剂(镍、铜、铁)、均相催化中的贵金属催化剂(铑、钌、铱、钯)、非金属催化剂(硒、硫)以及酸碱催化剂(酸、碱)等; 羰基源种类从最初的CO, 扩展到CO2、甲酸、甲酸酯、甲醛/多聚甲醛、羰基金属(如(Mo(CO)6)等羰基源; 官能团化产物种类从最初的醛, 扩展到羧酸、酯、酰胺等产物.
然而, 目前羰基化反应仍然存在诸多问题.如羰基化反应底物类型和启动方法有限、反应选择性(化学选择性、区域选择性、对映选择性)或反应活性仍不理想、某些羰基化反应过程机制不明确等.导致这些问题产生的主要原因可能是过渡金属与CO间存在强配位作用或CO2因其具有热力学稳定性和动力学惰性等原因.目前, 化学工作者主要精力集中在设计和制备能够有效调节羰基化反应中间体的配体或添加剂和寻找新的催化体系, 以期提高现有反应体系的转化效率并开发出新的羰基化反应类型, 最终希望实现以绿色、廉价、可循环的C1资源(如二氧化碳)为羰基源高效和高选择性地制备高值含羰基化学品的目标.
| [1] |
Franke R, Selent D, Börner A. Applied hydroformylation[J]. Chem Rev, 2012, 112(11): 5675–5732.
DOI:10.1021/cr3001803 |
| [2] |
a. Beller M. Catalytic Carbonylation Reactions[M]. Berlin: Springer-Verlag, 2006. b. Zhao Sheng-li(赵胜利), Zhang Qin-sheng(张勤生), Ma Zhan-wei(马占伟), et al. Palladium-catalyzed dicarbonylation of acetylene: Efficient synthesis of dicarboxylic acid dimethyl esters (钯催化的乙炔双羰化-高效合成丁烯二酸二甲酯)[J]. J Mol Catal(China)(分子催化), 2017, 31 (5): 411-418. c. AI Sha·Nulahong(艾沙·努拉洪), Ma Ya-ya(马亚亚), Mo Wen-long(莫文龙), et al. Preparation of nano Au/TS-1 catalyst and catalytic performance for the carbonylation of methanol(纳米Au/TS-1催化剂的制备及用于甲醇羰基化体系)[J]. J Mol Catal(China)(分子催化), 2017, 31 (2): 121-131. |
| [3] |
Kollar L. Modern Carbonylation Methods[M]. Weinheim: Wiley-VCH, 2008.
|
| [4] |
Peng J B, Wu F P, Wu X F. First-row transition-metal-catalyzed carbonylative transformations of carbon electrophiles[J]. Chem Rev, 2019, 119(4): 2090–2127.
DOI:10.1021/acs.chemrev.8b00068 |
| [5] |
Valeur E, Bradley M. Amide bond formation: Beyond the myth of coupling reagents[J]. Chem Soc Rev, 2009, 38: 606–631.
DOI:10.1039/B701677H |
| [6] |
Hebrard F, Kalck P. Cobalt-catalyzed hydroformylation of alkenes: Generation and recycling of the carbonyl species, and catalytic cycle[J]. Chem Rev, 2009, 109(9): 4272–4282.
DOI:10.1021/cr8002533 |
| [7] |
Brennfhree A, Neumann H, Beller M. Palladium-catalyzed carbonylation reactions of alkenes and alkynes[J]. ChemCatChem, 2009, 1(1): 28–41.
DOI:10.1002/cctc.200900062 |
| [8] |
Li H Q, Dong K W, Jiao H, et al. The scope and mechanism of palladium-catalysed markovnikov alkoxycarbonylation of alkenes[J]. Nat Chem, 2016, 9: 1159–1166.
|
| [9] |
Beller M, Seayad J, Tillack A, et al. Catalytic markovni- kov and anti-markovnikovfunctionalization of alkenes and alkynes: Recent developments and trends[J]. Angew Chem Inter Edit, 2004, 43(26): 3368–3398.
DOI:10.1002/anie.200300616 |
| [10] |
Deng Y, Wang H, Sun Y, et al. Principles and applications of enantioselective hydroformylation of terminal disubstituted alkenes[J]. ACS Catal, 2015, 5(11): 6828–6837.
DOI:10.1021/acscatal.5b01300 |
| [11] |
Fernandez-Perez H, Etayo P, Panossian A, et al. Phosphine-phosphinite and phosphine-phosphite ligands: Preparation and applications in asymmetric catalysis[J]. Chem Rev, 2011, 111(3): 2119–2176.
DOI:10.1021/cr100244e |
| [12] |
You C, Li S, Li X, et al. Design and application of hybrid phosphorus ligands forenantioselective Rh-catalyzed anti-markovnikov hydroformylationof unfunctionalized 1, 1-disubstituted alkenes[J]. J Am Chem Soc, 2018, 140(15): 4977–4981.
DOI:10.1021/jacs.8b00275 |
| [13] |
Lu L, Fuentes J A, Janka M E, et al. High iso aldehyde selectivity in the hydroformylation of short-chainalkenes[J]. Angew Chem Inter Edit, 2019, 58(7): 2120–2124.
DOI:10.1002/anie.201811888 |
| [14] |
Ostermann T. Building Blocks for the Feed Industry: Oxea Expands production capabilities for butyric acid and propionic acid[M]. OXEAGmbH: Monheim am Rhein, 2017.
|
| [15] |
Burdock G A. Fenaroli' Shandbook of Flavor Ingredients[M]. CRC Press: Boca Raton, 2009.
|
| [16] |
Korstanje T J, van der Vlugt J I, Elsevier C J, et al. Hydrogenation of carboxylic acids with a homogeneous cobalt catalyst[J]. Science, 2015, 350(6258): 298–302.
DOI:10.1126/science.aaa8938 |
| [17] |
Kerenkan A E, Béland F, Do T O. Chemically catalyzed oxidative cleavage of unsaturated fatty acids and their derivatives into valuable products for industrial applications: A review and perspective[J]. Catal Sci & Technol, 2016, 6(4): 971–987.
|
| [18] |
Julia-Hernandez F, Moragas T, Cornella J, et al. Remote carboxylation of halogenated aliphatic hydrocarbons with carbon dioxide[J]. Nature, 2017, 545: 84–88.
DOI:10.1038/nature22316 |
| [19] |
Cornils B, Herrmann W A, Beller M, et al. Applied Homogeneous Catalysis with Organometallic Compounds: Acomprehensive Handbook[M]. Weinheim: Wiley-VCH, 2017.
|
| [20] |
Reppe W, Kröper H. Carbonylierung Ⅱ. carbonsäuren und ihre derivate ausolefinischenverbindungen und kohlenoxyd[J]. Justus LiebigsAnnalen der Chemie, 1953, 582: 38–71.
DOI:10.1002/jlac.19535820103 |
| [21] |
von Kutepow N, Bittler K, Neubauer D. Carbonylation of olefinicallyunsaturated compounds: US[P], 3437676A. 1969.
|
| [22] |
Drent E, Arnoldy P, Budzelaar P H M. Efficient palladium catalysts for the carbonylation of alkynes[J]. J Org Chem, 1993, 455(2): 247–253.
|
| [23] |
Drent E, Arnoldy P, Budzelaar P H M. Homogeneous catalysis by cationic palladium complexes. Precision catalysis in the carbonylation of alkynes[J]. J Org Chem, 1994, 475(1): 57–63.
|
| [24] |
Crawford L, Cole-Hamilton D J, Drent E, et al. Mechanism of alkyne alkoxycarbonylation at a Pd catalyst with P, N hemilabile ligands: A density functional study[J]. Chem Eur J, 2014, 20(43): 13923–13926.
DOI:10.1002/chem.201403983 |
| [25] |
Verspui G, Feiken J, Papadogianakis G, et al. Catalytic conversions in water: Part 11: Highly active water-soluble palladium-catalysts in the hydrocarboxylation of olefins and the alternating copolymerization of CO and olefins in water[J]. J Mol Catal A: Chem, 1999, 146(2): 299–307.
|
| [26] |
del Río I, Ruiz N, Claver C, et al. Hydroxycarbonylation of styrene with palladium catalysts: The influence of the mono- and bidentate phosphorus ligand[J]. J Mol Catal A: Chem, 2000, 161(1): 39–48.
|
| [27] |
Goldach V, Falivene L, Caporaso L, et al. Single-step access to long-chain α, ω-dicarboxylic acids by isome- rizing hydroxycarbonylation of unsaturated fatty acids[J]. ACS Catal, 2016, 6(12): 8229–8238.
DOI:10.1021/acscatal.6b02622 |
| [28] |
Ionescu A, Laurenczy G, Wendt O F. Regioselectivity in aqueous palladium catalysedhydroxycarbonylation of styrene: A catalytic and mechanistic study[J]. Dalton Transactions, 2006, 32: 3934–3940.
|
| [29] |
Konrad T M, Fuentes J A, Slawin A M Z, et al. Highly enantioselective hydroxycarbonylation and alkoxycarbonylation of alkenes using dipalladium complexes as precatalysts[J]. Angew Chem Inter Edit, 2010, 49(48): 9197–9200.
DOI:10.1002/anie.201004415 |
| [30] |
Johnson R W, Fritz E. Fatty acids inindustry: Properties, Derivatives, Applications[M]. Marcel: Dekker Inc, 1989.
|
| [31] |
Huang Z, Cheng Y, Chen X, et al. Regioselectivity inversion tuned by iron(Ⅲ) salts inpalladium-catalyzed carbonylations[J]. Chem Commun, 2018, 54: 3967–3970.
DOI:10.1039/C8CC01190G |
| [32] |
Sang R, Kucmierczyk P, Dühren R, et al. Synthesis of carboxylic acids by palladium-catalyzed hydroxycarbonylation[J]. Angew Chem Inter Edit, 2019, 58(40): 14365–14373.
DOI:10.1002/anie.201908451 |
| [33] |
Rodriguez C J, Foster D F, Eastham G R, et al. Highly selective formation of linear esters from terminal and internal alkenes catalysed by palladium complexes of bis-(di-tert-butylphosphinomethyl) benzene[J]. Chem Commun, 2004, 15: 1720–1721.
|
| [34] |
Vasseur A, Bruffaerts J, Marek I. Remote functionalization through alkene isomerization[J]. Nat Chem, 2016, 8: 209–219.
DOI:10.1038/nchem.2445 |
| [35] |
Liu J, Dong K, Franke R, et al. Development of efficient palladium catalysts for alkoxycarbonylation of alkenes[J]. Chem Commun, 2018, 54: 12238–12241.
DOI:10.1039/C8CC07470D |
| [36] |
Qi H M, Huang Z J, Wang M L, et al. Bifunctional li- gands for Pd-catalyzed selective alkoxycarbonylation of alkynes[J]. J Catal, 2018, 363: 63–68.
DOI:10.1016/j.jcat.2018.04.007 |
| [37] |
Pattabiraman V R, Bode J W. Rethinking amide bond synthesis[J]. Nature, 2011, 480: 471–479.
DOI:10.1038/nature10702 |
| [38] |
Kim S, Lim C J. Radical-Mediated γ-functionalizations of α, β-unsaturated carboxylic amides[J]. Angew Chem Inter Edit, 2004, 43(40): 5378–5380.
DOI:10.1002/anie.200460820 |
| [39] |
Feuillet F J P, Cheeseman M, Mahon M F, et al. Stereoselective synthesis of (E)-trisubstituted α, β-unsatura- ted amides and acids[J]. Org & Biomole Chem, 2005, 3(16): 2976–2989.
|
| [40] |
Reppe W, Main H. Dodecacarbonyltriruthenium cata- lysed carbonylation of amines and hydroamidation of olefins[J]. J Organomet Chem, 1986, 309: 333–344.
DOI:10.1016/S0022-328X(00)99635-9 |
| [41] |
Jagers E, Koll H P, Ger, Offen. DE[P], 3812737, 1989, Chem Abstr, 1990, 112: 77951.
|
| [42] |
Eastham G R, Furst M R L, Cole-Hamilton D J. Selective formation of α, ω-ester amides from the aminocarbo- nylation of castor oil derived methyl 10-undecenoate and other unsaturated substrates[J]. Catal Sci & Technol, 2014, 4(8): 2332–2339.
|
| [43] |
Liu H, Yan N, Dyson P J. Acid-free regioselective aminocarbonylation of alkenes[J]. Chem Commun, 2014, 50(58): 7848–7851.
DOI:10.1039/C4CC02167C |
| [44] |
Xu T, Sha F, Alper H. Highly ligand-controlled regioselective Pd-catalyzed aminocarbonylation of styrenes with aminophenols[J]. J Am Chem Soc, 2016, 138(20): 6629–6635.
DOI:10.1021/jacs.6b03161 |
| [45] |
Fang X, Jackstell R, Beller M. Selective palladium-catalyzed aminocarbonylation of olefins with aromatic amines and nitroarenes[J]. Angew Chem Inter Edit, 2013, 52(52): 14089–14093.
DOI:10.1002/anie.201308455 |
| [46] |
Sang I L, Seung U S, Chung Y K. Catalytic one-pot synthesis of N-phenyl alkyl amides from alkene and aniline in the presence of cobalt on charcoal under carbon monoxide[J]. Chem Commun, 2002, 12: 1310–1311.
|
| [47] |
Dong K W, Fang X J, Jackstell R. Rh(I)-catalyzed hydroamidation of olefins via selective activation of N-H bonds in aliphatic amines[J]. J Am Chem Soc, 2015, 137(18): 6053–6058.
DOI:10.1021/jacs.5b02218 |
| [48] |
Liu J, Li H, Spannenberg A, et al. Selective palladium-catalyzed aminocarbonylation of olefins to branched Amides[J]. Angew Chem Inter Edit, 2016, 55(43): 13544–13548.
DOI:10.1002/anie.201605104 |
| [49] |
Driller K M, Prateeptongkum S, Jackstell R, et al. A general and selective iron-catalyzed aminocarbonylation of alkynes: Synthesis of acryl-and cinnamides[J]. Angew Chem Inter Edit, 2011, 50(2): 537–541.
DOI:10.1002/anie.201005823 |
| [50] |
Xu J X, Wu X F. Palladium-catalyzed carbonylative cyclization of terminal alkynes and anilines to 3-substituted maleimides[J]. Adv Syn & Catal, 2018, 360(17): 3376–3380.
|
| [51] |
Pizzetti M, Russo A, Petricci E. Microwave-assisted aminocarbonylation of ynamides by using catalytic[Fe3(CO)12] at low pressures of carbon monoxide[J]. Chem Eur J, 2011, 17(16): 4523–4528.
DOI:10.1002/chem.201100447 |
| [52] |
Sha F, Alper H. Ligand-and additive-controlled Pd-catalyzed aminocarbonylation of alkynes with aminophenols: highly chemo-and regioselective synthesis of α, β-unsaturated amides[J]. ACS Catal, 2017, 7(3): 2220–2229.
DOI:10.1021/acscatal.7b00367 |
| [53] |
Huang Z, Dong Y, Li Y, et al. Enhancing ligand-free Fe-catalyzed aminocarbonylation of alkynes by ZrF4[J]. ChemCatChem, 2019, 11(21): 5236–5240.
DOI:10.1002/cctc.201900995 |
 2019, Vol. 33
2019, Vol. 33


