2. 中国科学院大学, 北京 100049;
3. 盐城师范学院 化学与环境工程学院, 江苏 盐城 224007
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. School of Chemistry and Environmental Engineering, Yancheng Teachers University, Yancheng 224007, China
CO是一种廉价、丰富且有用的C1分子, 目前已有多项CO利用技术实现了产业化, CO羰基化就是一种有效利用CO的关键技术路线[1].羰基化反应是以CO作为羰基源, 在催化剂的催化作用下, 在有机分子间(内)插入一个羰基, 生成不同类型的含羰基化合物.脲是一类重要的含氮羰基化合物, 可采用胺氧化羰基化反应取代传统的光气法进行制备; 作为羰基合成领域的一类重要转化, 胺的氧化羰基化具有反应原料廉价易得、原子利用率高和环境友好(唯一的副产物为水)等特点, 备受研究者关注[2-3].
迄今为止, 面向胺氧化羰基化过程已经发展了包括非金属(主要为S、Se、Te化合物体系)和金属在内的多种催化体系.其中, 以金属催化剂为主.按催化活性中心的金属元素分类, 催化剂中Ⅷ和IB族贵金属占多数, 由廉价金属构成的多相催化体系仅有少数几例报道.氧化剂方面, 氧气相比于铜盐、过碳酸盐、过硫酸盐等常用氧化剂为绿色清洁, 直接使用空气作为氧化剂也是后续发展的趋势, 但是该体系的问题在于CO与空气爆炸极限问题(12.5%~74%), 因此该反应也需要能够在CO与空气爆炸极限之外进行.也有报道直接采用电化学辅助的方法, 直接避免使用氧化剂, 从而避免使用CO与空气混合气体作为反应气氛.我们将对胺氧化羰基化合成脲类化合物的催化剂以及应用作详细综述.
1 非金属催化硫、硒、碲等非金属可以作为氧化羰基化合成脲的催化剂. 1960年, 美国孟山都化学品公司的Franz及同事首次报道将NH3、CO和S混合, 在特定的反应条件下, 可以得到较高产率的脲素以及其他取代脲类化合物, 在该条件下, 芳胺的反应性是很差的, 当加入一定量的叔胺作为催化剂时, 在无溶剂的条件下, 能够得到较高产率的二芳基脲类化合物[4-5], 但是在该反应中需要大量的硫.
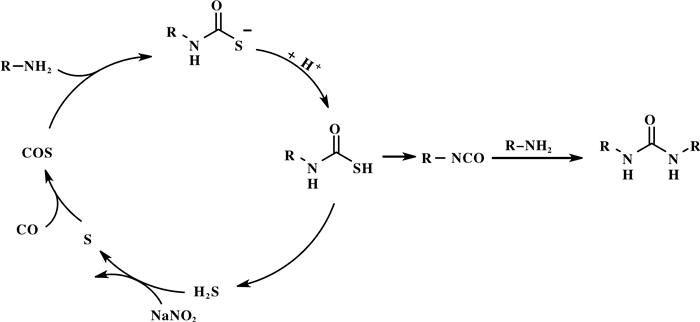
随后Mizuno等[6]对该反应进行了更为详细的研究, 认为该反应首先是CO与S反应生成S=C=O; 硫羰基与胺反应生成硫代氨基甲酸盐, 最后硫代氨基甲酸盐经氧化剂氧化后形成相应的脲类化合物.夏春谷课题组[7]报道硫催化的胺氧化羰基化反应, 亚硝酸钠作为氧化剂, 能够将反应中生成的H2S氧化生成S后再次参与到反应当中, 完成催化循环(图 1).
|
图 1 硫催化氧化羰基化可能的反应机理 Fig.1 Proposed mechanism of sulfur-catalyzed oxidative carbonylation of amine |
硒跟硫的化学性质非常接近, 因此具有与硫相似的催化性能, Sonoda等首次报道Se作为催化剂能够催化胺的氧化羰基化制备脲类化合物, 硒作为催化剂进行胺的氧化羰基化反应条件较为温(常温常压即可), 因此, 和硒催化胺的氧化羰基化反应是在非金属催化剂中报道最多的[8-9].与硫催化该反应的机理一样, 在硒催化下, 由胺和CO在常温常压下反应得到硒代氨基甲酸铵, 该中间体可通过13C, 77Se NMR进行结构确定[10], 然后经氧化剂氧化氨解就得到目标产物.对其反应机理进一步研究认为, 此类反应的活性物种是硒羰基物种(Se=C=O), 因其中间体中存在一个Se=C双键(由Se与羰基间存在微弱的4Pπ-2Pπ相互作用而产生), 使得胺可以更容易的进攻Se=C=O中的碳原子.这被认为是以CO作为羰源参与反应时, 有效活化CO分子的方式之一, 因此, 基于Se催化活化CO的特性, 目前已发展了众多Se催化胺类化合物氧化羰基化的反应体系(图 2).

|
图 2 硒催化胺氧化羰基化合成脲 Fig.2 Se-catalyzed oxidative carbonylation of amine |
Se、SeO2、硒酸盐、有机硒化合物以及含硒离子液体作为胺氧化羰基化的催化剂时, 能够将一级脂肪胺、芳胺、二级胺转化为对应的含羰基化合物.值得一提的是当同时存在一级胺、二级胺时, 硒催化剂能够以非常高的收率得到不对称脲类化合物, 这些不对称脲类化合物中, 有众多是具有生物活性脲类衍生物[11-13].虽然此前提及硒兼具多相催化与均相催化的优点, 催化剂在反应后能够分离, 但是大部分情况下, 产物也是固体, 而且硒羰基在有机物中是能够溶解的, 想实现催化剂的完全分离也并不容易; 此外, 在反应后会生成一些具有恶臭的硒物种, 该物种有可能是对人体有害的.对于硒基催化剂来说, 这两个固有问题限制了硒催化剂进一步的应用.
Kambe等[14-15]首次报道了Te与其同一主族的S、Se一样, 具有催化胺与CO生成脲的活性, 但是大部分产物是甲酰胺.在不加任何氧化剂时, 由于生成的H2Te不稳定, 容易分解成为Te和H2, 使得该反应能够发生, 最后生成脲以及氢气.在反应体系中, 加入硝基苯后, 脲的选择性大大的提高, 硝基苯在这里起到类似氧化剂的作用, 最终生成苯胺.此后, 少见Te作为该反应的催化剂报道.
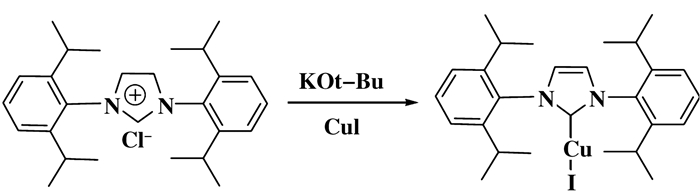
2 非贵金属催化非贵金属催化的胺类化合物制备脲的研究并不多, Cu, Co, W等非贵金属可用于催化胺的氧化羰基化合成脲.简单的铜盐就具备该反应的催化活性, 1961年英国专利最早报道卤化铜催化胺氧化羰基化合成脲类化合物[16]; 2015年, Casiello等[17]报道以水作为溶剂, 在100 ℃, 3.4 MPa CO, 0.6 MPa O2条件下, 10%(摩尔分数) CuCl2作为催化剂, 在无需添加任何碱和助剂的条件下, 可以催化伯胺、仲胺生成对应的脲, 同时也可以利用该催化剂合成氨基甲酸酯、环脲、恶唑烷酮等含氮羰基化合物.铜卡宾配合物在该反应中表现出更加优异的活性, 将铜卡宾用于胺的氧化羰基化合成脲, 在以丁胺为探针底物的反应中发现, 金属卡宾上的配位离子对催化剂活性有显著的影响[18].含碘离子的IPrCuI(图 3)具有最好的催化活性, 原料转化率和产物选择性分别达到100%和99%, 而IPrCuBr只有9%的转化率, IPrCuCl几乎没有活性, 说明碘在反应中起了非常重要的作用. CuI也能催化该反应, 但结果明显劣于铜卡宾.该反应体系在CO/O2爆炸极限内有很好的活性, 但是若将CO/O2比例调整到爆炸极限之外时, 催化活性, 明显下降.
|
图 3 IPrCuI的合成 Fig.3 The synthesis of IPrCuI |
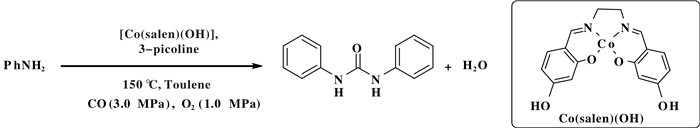
钴配合物也可用于催化胺的氧化羰基化反应, 其中钴席夫碱(Co-Salen)配合物的研究较为常见.在如下反应中Co(salen)为催化剂, 实现了一级脂肪胺、二级胺、醇胺以及芳胺等胺类化合物转合成环状或非环状的脲类化合物.该反应以甲苯为溶剂, 在1.2 MPa CO/O2 (5:1)的混合气气氛下、温度为100 ℃的条件下, 得到了较高收率脲类化合物.在该反应中, 有机含氮化合物作为有机碱能够促进该反应, 提高Co(salen)催化剂的催化性能[19]. Chen等[20]研究了不同Co(salen)对反应的影响, Co(salophen)(OH)2是苯胺氧化羰基化中Co(salen)型催化剂中活性最好的一个催化剂, 在反应中添加吡啶类化合物作为助剂, 能够提高该催化剂的活性和反应的选择性, 2-甲基吡啶和3-甲基吡啶对反应有较好的促进作用(图 4).
|
图 4 Co(salen)催化苯胺的氧化羰基化反应 Fig.4 Co(salen) catalyzed oxidative carbonylation of aniline |
Li等[21]采用Co(OAc)2、菲啰啉、硅藻土作为原料, 制备了Co-N-CN@硅藻土催化材料, 以该材料作为催化剂, 催化胺氧化羰基化合成脲.结果表明该催化剂在温和条件下, 并以廉价的空气作为氧化剂, 表现出非常好的催化活性以及较宽的底物适用性.而且, 该催化剂经循环使用6次后, 催化剂活性并无明显失活, 表现出良好的稳定性.
钨基催化剂用于催化胺氧化羰基化反应的研究主要是由McElwee-White研究团队展开, 其团队发展了以W(CO)6/I2/碱催化剂体系.以W(CO)6为催化剂, I2作为氧化剂, K2CO3为碱, 在CO压力为8 MPa, 90 ℃下催化胺类的氧化羰基化反应, 一级脂肪胺、二级胺、醇胺以及脂肪二胺均可生成相应的脲类化合物, 苯胺可能由于其较弱的亲核性, 所以并没有反应活性[22-24].将K2CO3换为4-二甲氨基吡啶(DMAP), 以W(CO)6/I2/DMAP催化剂体系, 能够实现芳胺的转化[25], 该催化体系的底物适用性较W(CO)6/I2/K2CO3更广(图 5).

|
图 5 W(CO)6/I2/Base催化剂体系作用下胺类化合物氧化羰基化反应 Fig.5 W(CO)6/I2/base catalyzed oxidative carbonylation of amine |
金属Pd是胺氧化羰基化中最为常见的催化剂之一, 可催化胺类化合物羰基化生成脲类化合物或者草酰胺类化合物.不管是Pd的配合物还是负载型Pd催化剂, 一般都需要卤素离子(尤其是碘)作为助剂, 才能够有效的提高该反应的催化活性, 在无卤素助剂的情况下, 一般不能够有效催化芳胺类化合物的转化, 仅仅能够转化脂肪胺类化合物.
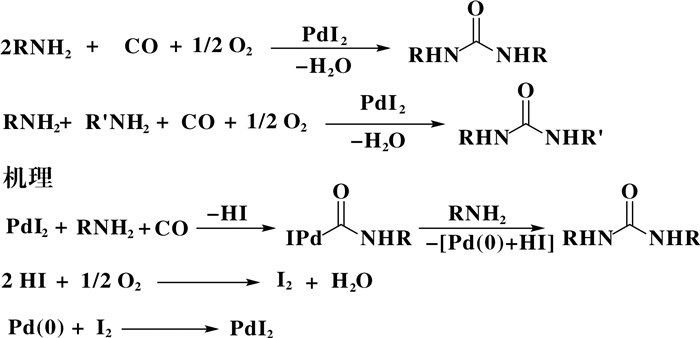
意大利德拉卡拉布里亚大学的研究人员Gabriele等[26-27]在均相Pd-I催化胺氧化羰基化合成脲类化合物中做了大量研究工作, 研究发现PdI2具有较高的催化活性, 这是因为在反应的还原消除过程中PdI2在反应中生成了Pd(0)和HI, HI被O2氧化生成I2, I2可将Pd(0)氧化从而使催化剂PdI2再生, 促进反应的进行(图 6).以CO2作为反应溶剂, K2PdI4作为催化剂, 脂肪胺的反应活性并没有明显提高, 但是苯胺的活性显著增加, 说明在CO2的存在下能够促进芳胺类化合物的转化[28].在PdI2/ KI-[bmim][BF4]反应体系中, 催化剂能够循环使用多次, 活性并无明显下降[29]. Ferretti等[30]最新报道了微克级的Fe能够显著促进Pd-I催化体系中的活性.
|
图 6 Pd-I催化氧化羰基化可能的反应机理 Fig.6 Proposed mechanism of Pd-I catalyzed oxidative carbonylation of amine |
在均相反应体系中, N-杂环卡宾(NHC)是一类在过渡金属催化的偶联反应中广泛采用的配体. N-杂环卡宾钯配合物作为催化剂的氧化羰基化反应体系中, 催化剂用量少, 活性高. Pd卡宾化合物在该反应中也表现出有优异的催化活性, 兰州化物所夏春谷课题组报道Pd-NHC催化苯胺的氧化羰基化.将咪唑碘盐与醋酸钯合成Pd(NHC)2, Pd(NHC)2在室温下能够与苯胺反应生成NHC-Pd-苯胺的配合物, 同样的也合成了含有三苯基膦、吡啶配体的卡宾配合物.将这些催化剂应用于苯胺氧化羰基化中, 结果发现Pd(I2-NHC)2与NHC-Pd-苯胺的活性接近, 说明NHC-Pd-苯胺是活性中间体, 由于配体离去能力的差异, 使得不同配体的活性有明显差异, 活性顺序为: Pd(I2-NHC)2 = NHC-Pd-An > NHC-Pd-PPh3 > NHC-Pd-Py > Pd(I-NHC)2(图 7)[31-32].

|
图 7 Pd-NHC催化苯胺氧化羰基化 Fig.7 Pd-NHC catalyzed oxidative carbonylation of aniline |
使用负载型催化剂的优势在于反应结束后产物易于分离, 并且提高了催化剂的使用率.兰州化物所石峰课题组在多相Pd催化剂在胺氧化羰基化中研究较多, Pd/ZrO-SO42-催化胺类化合物氧化羰基化合成脲类化合物, 脂肪胺在该反应体系中比芳香族胺更容易发生反应, 反应性更高[33].超低负载量的Pd/TiO2催化剂在不需要任何有机配体, 无溶剂的条件下, 苯胺以及苄胺的转化频率(TOFs)分别达到了126 000和250 000 h-1, 催化剂经过10次以上的循环适用, 活性依然能够保持[34].
Rh基催化剂在羰基合成反应中, 是一个活性非常好的催化剂, 在胺的氧化羰基化反应中也体现出非常出色的催化活性.在Rh/C-SnI2-CoCl2的催化体系中, 在反应压力(PCO = 4.48 MPa, PO2 = 0.32 MPa)不变的情况下, 低温反应有利于脲的生成, 升高反应温度后, 氨基甲酸酯的收率提高, 不同反应溶剂对该反应也具有较大影响, 在极性溶剂中有利于脲的生成(图 8)[35].

|
图 8 LiI促进Rh/C催化苯胺氧化羰化合成二苯基脲 Fig.8 LiI promoted Rh/C catalyzed oxidative carbonylation of aniline |
以磷酸氢钛作为载体, 负载Rh3+的二胺配合物后制得γ-TiPRhx催化剂, 以苯胺的氧化羰基化合成脲反应来对催化剂的活性进行评价, 在5 MPa的CO和O2的混合气体中, 以CH3CN为溶剂, Ph- NH3+I-为助剂, 温度低于100 ℃时, 反应物的转化率能够接近100%, 催化剂能够经过多次回收利用, 重复利用的催化剂活性依然与新鲜催化剂活性相差不大[36].在硅胶担载的Rh-离子液体催化体系(Rh-DMImBF4/SiO2)中, 芳胺转化率能够达到95%, 脲的选择性能够达到98%以上[37]. Park等[38]报道采用3%(摩尔分数)的Co2Rh2双金属纳米颗粒作为催化剂, 催化脂肪胺以及芳胺高效转化为脲类化合物, 在该催化反应体系中, 无需添加任何的助剂, 而且催化剂经过回收后, 仍然能够保持与新鲜催化剂基本一致的活性.
羰基钌配合物[Ru(CO)3I3]NBu4在苯胺经氧化羰基化合成二苯基脲中是一个活性很好的催化剂, 在100 ℃, 0.1 MPa CO/O2 (2 :1)的反应条件下, 目标产物(二苯基脲)的选择性大于99%.反应机理研究表明, [Ru(CO)3I3]+首先离去一个CO得到中间体[Ru(CO)2I3]+(Ⅱ), [Ru(CO)2I3]+与苯胺配位形成羰基钌-苯胺物种[(ArNH)Ru(CO)2-I2]-(Ⅲ), 随后经过CO的迁移插入可得到羰基钌-酰基物种[(ArNHCO)Ru(CO)2I2]-(Ⅴ), V通过另一分子胺的亲核进攻可得到脲类化合物, 钌氢中间体-[HRu(CO)2I2]-(Ⅵ)则继续与苯胺生成钌胺配合物, 最后再次氧化后与苯胺配位后得到羰基钌-苯胺物种(Ⅲ), 实现催化剂的循环(图 9)[39].
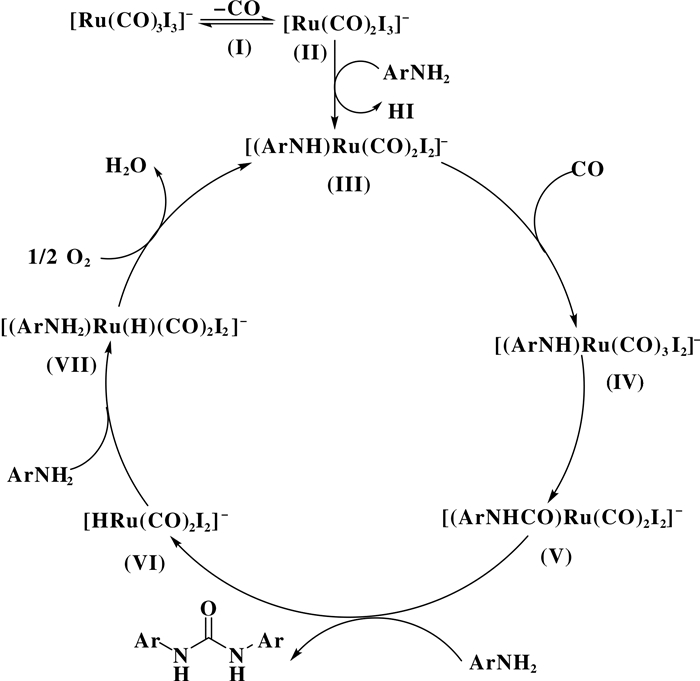
|
图 9 钌配合物NBu4[Ru(CO)3I3]+催化苯胺氧化羰基化及机理 Fig.9 The possible mechanism of NBu4[Ru(CO)3I3]+ catalyzed oxidative carbonylation |
相比于Pd、Rh、Ru等贵金属, Au作为羰基合成的催化活性中心的研究相对较少, 起步也较晚, 但却取得了非常引入注目的成果.兰州化物所邓友全课题组发展了聚合物负载的纳米金催化剂, 在5 MPa的CO/O2 (4:1)的混合气体中, 在175 ℃下反应1~3 h后, 苯胺的转化频率TOFs能够达到1475 h-1, 二苯基脲的选择性为99%, 催化剂循环使用12次以上, 均能够保持其活性[40].金粉(1000 nm)作为催化剂, 用于催化胺的氧化羰基化反应, 乙睛作溶剂, 在0.1 MPa的CO/O2混合气体中, 在相对低温度(45 ℃)下即可反应可生成脲类化合物, 当反应物为脂肪胺时, 所得到的目标产物产物的产率较高, 但是该反应体系对苯胺的催化效果不佳[41]. Au-Pd/MOF双金属催化剂在温和条件下(90 ℃, 0.6 MPa CO, 0.2 MPa O2), 催化伯胺的氧化羰基化制备脲时表现出超高的协同催化作用, Au-Pd/MOF催化剂的活性是Au/MOF的95倍, 是Pd/MOF的16倍.但是该催化剂的底物适用性较窄, 芳胺和仲胺不能够反应(图 10)[42].
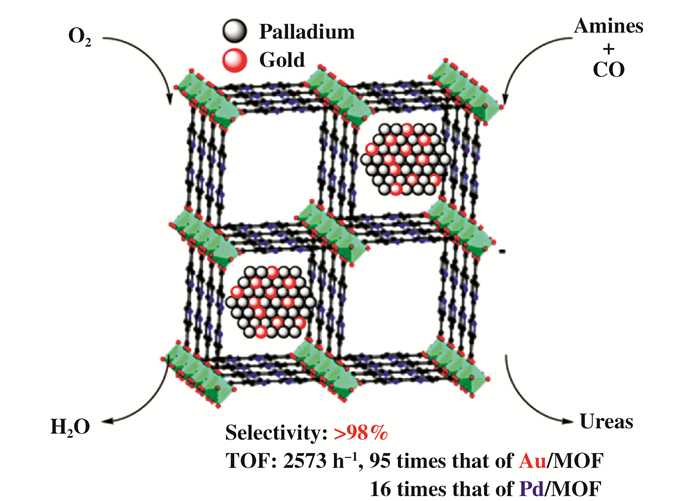
|
图 10 Au-Pd协同催化胺的氧化羰基化反应 Fig.10 Au-Pd catalyzed oxidative carbonylation |
近年来, 随着团簇化学的兴起, 越来越多具有优异催化活性的团簇被报道.金团簇在多种催化体系中表现出较好的活性, 目前已有报道将金团簇用于催化胺类化合物氧化羰基化反应. 图 11中所示的卡宾支撑的Au(Ⅰ)/Au(0)混合价态的Au3团簇能够活化伯胺及CO, 并且在氧化羰基化中表现出很好的活性.研究认为该反应模拟了多相催化剂的过程, Au3团簇实现了均多相的融合[43].最近, 又有研究报道了多核AuI团簇(Au4I, Au8I)及双金属AuIAgI团簇(Au4I AgI), 其中, 线性的Au4I团簇能够在温和条件下实现伯胺和CO的活化, 将胺类化合物转化为脲, 而双金属Au4I AgI团簇在均相条件下的催化活性超过了Au4I团簇以及用团簇制备的纳米粒子的活性[44].
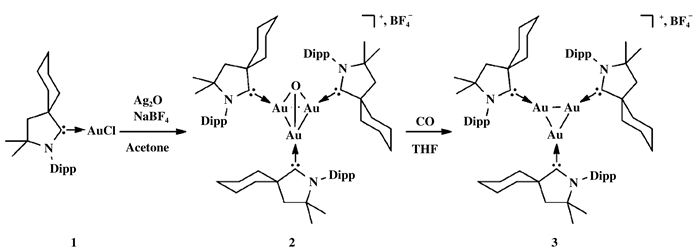
|
图 11 合成Au3团簇 Fig.11 Synthesis of trinuclear gold clusters |
我们最近报道从诱导Au(Ⅰ)-Cu(Ⅰ)双金属聚合物解聚出发并研究其解聚行为, 利用现代表征技术发现[Au(NHC)2][CuI2]双金属聚合物解聚过程中, Cu促进了胺与[Au(NHC)2]+的配体交换行为, 而且在解聚过程中Cu体现出可逆氧化还原行为, Cu(Ⅰ) → Cu(Ⅱ) → Cu(Ⅰ).受此启发, 通过整合的d10金属配合物的响应行为以及隐含在其中固有的协同催化功能信息, 开发了一种新型的高效催化剂用于胺的氧化羰基化反应. [Au(NHC)2][CuI2]双金属催化剂在胺氧化羰基化合成脲的过程中表现出非常明显的催化协同效应对照实验发现, 在该体系中, Au, Cu, I三者是缺一不可的(图 12).发现在反应前后, 催化剂可能发生“再组装”行为, 因而有望将该催化剂通过最终产物与活性催化剂在特定溶剂中的溶解度差异实现产物与催化剂的分离与循环, 分离后的催化剂循环使用5次后, 未见明显失活(图 13).同时, 该催化体系也表现出非常好的底物适用性, 能够将不同取代基的一级胺、二级胺及其盐酸盐转化成为相应的脲类化合物(产率: 77%~99%), 尤其是对于直链脂肪胺类化合物, 能够在室温条件下实现高效转化(产率: 99%).鉴于该催化体系能够催化转化一级胺和二级胺, 因此在合成不对称脲的过程当中该催化体系也表现不错, 能够得到中等以上的不对称脲收率[45].

|
图 12 吗啉氧化羰基化 Fig.12 Oxidative carbonylation of morpholine |

|
图 13 催化剂分离, 循环实验 Fig.13 The separation procedure and cycle experiments |
常规条件下, 在CO作为羰源的氧化羰基化反应中, 必须使用空气(O2)作为氧化剂, 首要问题必须要解决CO与空气爆炸极限的问题, 而且该问题也在一定程度上制约了氧化羰基化反应的发展.近年来, 采用电化学辅助氧化方式也能够达到同样的目的, 该方法无需额外添加氧化剂, 从源头上避免了爆炸极限的问题.
采用Pd催化剂, 利用电化学的方法, 可以避免使用氧气(氧化剂), 在常压CO气氛下, 实现脲类化合物的合成.邓友全课题组报道了采用电化学的方法, 以Pd(PPh3)2Cl2 + Cu(OAc)2为催化剂, Bu4NClO4为电解液, 阳极电位固定0.9 V vs SCE, 在30 ℃以及0.1 MPa的CO条件下, 成功的将胺类化合物转化为对应的脲类化合物, 脲的产率能够达到90%以上(图 14)[46].随后, Feroci等人也报道了另外一例电化学辅助胺氧化羰基化合成脲, 在该反应中以石墨电极为工作电极, Pt电极为对电极, 以Pd(OAc)2, PdCl2, Pd(PPh3)4中其中一种作为催化剂, n-Bu4NBF4作为电解液, NaOAc作为碱, 阳极电位固定0.4 V vs SCE, 在50 ℃以及0.1 MPa的CO条件下, 也能够得到较高收率的脲类化合物; 在该反应过程中, 溶剂对反应影响较为明显, CH3CN是效果最佳的溶剂.
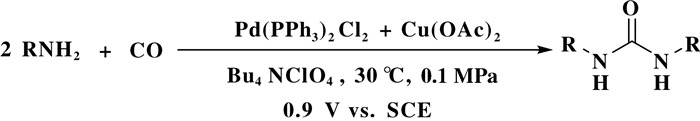
|
图 14 电化学辅助胺氧化羰基化合成脲 Fig.14 Synthesis of ureas by electrocatalytical carbonylation of amines |
除了采用胺氧化羰基化法合成脲类化合物外, 还有取代法(碳酸二甲酯、尿素)、CO作为羰源的还原羰基化法CO2作为羰源的羰基化法、甲酰胺法、重排法等非光气法被报道.但是对比发现:采用取代法时, 碳酸二甲酯(Ⅰ)或者尿素(Ⅱ)均采用CO2或CO作为C1合成子合成所得, 然后再进一步与胺反应生成脲类化合物, 从反应路线上看, 若直接采用CO2或CO作为C1合成子合成脲类化合物则更具优势[47-48].采用还原羰基化(Ⅲ)时, 受制于硝基化合物的类型, 底物范围往往比较窄, 而且反应中会生成新的温室气体CO2, 若在实际应用中反应残余气体(CO和CO2混合气)的进一步分离也是一个问题[49].而对比直接采用CO2或CO合成脲的过程中, 选择CO2路线, 需要更加苛刻的反应条件, 且存在底物范围窄的问题.甲酰胺法目前发展得并不多, 而且底物受限, 催化体系受限, 还需要进一步的发展[50-51].重排法中需要特定的反应底物, 库尔提斯重排(Ⅵ)[52]需要使用危险的叠氮试剂, 霍夫曼重排(Ⅶ)[53]和洛森重排(Ⅷ)[54]还需要计量的引发剂, 受制于底物范围以及反应条件, 该类方法并不常用.相比之下, 胺的氧化羰基化合成脲类化合物具有反应原料廉价易得、底物范围广、反应条件温和、原子利用率高和环境友好(唯一的副产物为水)等优势.
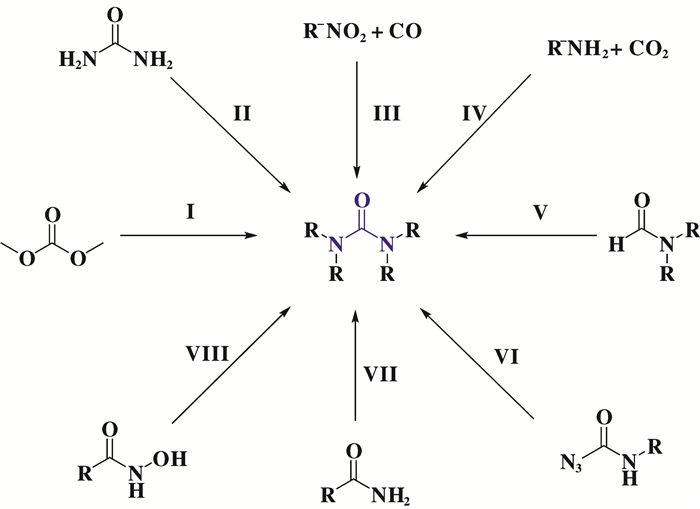
|
图 15 合成脲的其他方法 Fig.15 Other methods for synthesis of ureas |
近年来, 众多脲类化合物被广泛应用于农药与医药等领域[3, 55].一些脲类化合物已在农业上广泛用于除草剂、杀虫剂、杀菌剂, 植物生长调节剂(类细胞分裂素)[56].在医学上作为医药或者医药中间体已有众多脲类化合物分子用于降血糖药物、HIV病毒抑制剂[57]、抗癌药物[58]、蛋白激酶抑制剂[59]、载药体以及诊断神经性疾病(如阿尔兹海默症及帕金森症)的荧光染料分子.除此之外, 也在生物传感器, 离子识别, 小分子凝胶以及有机小分子催化剂等方向的应用也备受关注[60].随着应用研究的日趋深入, 脲类含氮羰基化合物的应用范围会更加广阔.
CO是一种廉价、丰富且有用的C1分子, 将其作为羰基源参与氧化羰基化反应中可以合成各种有用的羰基化合物, 是实现CO高值化利用的重要技术之一.最近, 采用胺氧化羰基化合成脲类化合物的研究日益受到重视, 并取得了一定的进展.胺的氧化羰基化合成脲类化合物具有反应原料廉价易得、底物范围广、反应条件温和、原子利用率高和环境友好(唯一的副产物为水)等特点, 已经表现出在实际应用中替代传统光气法的巨大潜力.开发更为高效的催化剂, 尤其是使用廉价的过渡金属, 如Cu、Co替代Pd, Rh, Au等贵金属催化剂或将该反应体系中的均相催化剂多相化是以后该反应体系中催化剂研究的重点.该反应体系中CO与空气爆炸极限的问题仍然是制约氧化羰基化反应发展的关键问题所在.研发新工艺使反应能够在爆炸极限外高效进行, 对氧化羰基化反应发展与应用具有重要的意义, 同时, 开发其他间接氧化方式, 如电催化、光催化等, 避免直接使用氧化剂是该反应今后发展重要方向和趋势.最后, 加快脲类化合物应用的开发, 如脲类衍生物热解异氰酸酯技术、脲类化合物作为农药和医药中间体等方面的应用, 也能够推进上游路线的快速发展.
| [1] |
Peng J B, Geng H Q, Wu X F. The Chemistry of CO:Carbonylation[J]. Chem, 2019, 5(3): 526–552.
|
| [2] |
Liu Q, Zhang H, Lei A. Oxidative carbonylation reactions:Organometallic compounds (R-M) or hydrocarbons (R-H) as nucleophiles[J]. Angew Chem Int Ed, 2011, 50(46): 10788–10799.
DOI:10.1002/anie.201100763 |
| [3] |
Ghosh A K, Brindisi M. Urea derivatives in modern drug discovery and medicinal chemistry[J]. J Med Chem, 2020, 63(6): 2751–2788.
|
| [4] |
Franz R A, Applegath F. New synthesis of ureas. Ⅰ. Reaction of ammonia, carbon monoxide, and sulfur[J]. J Org Chem, 1961, 26(9): 3304–3305.
DOI:10.1021/jo01067a065 |
| [5] |
Franz R A, Applegath F, Morriss F V, et al. New synthesis of areas. Ⅲ. Reaction of aromatic amines with carbon monoxide and sulfur[J]. J Org Chem, 1961, 26(9): 3309–3312.
DOI:10.1021/jo01067a067 |
| [6] |
Mizuno T, Matsumoto M, Nishiguchi I, et al. Facile synthesis of urea derivatives under mild conditions[J]. Heteroat Chem, 1993, 4(5): 455–458.
|
| [7] |
Peng X, Li F, Xia C. A highly efficient sulfur-catalyzed oxidative carbonylation of primary amines and β-amino alcohols[J]. Synlett, 2006, 8: 1161–1164.
|
| [8] |
Sonoda N, Yasuhara T, Kondo K, et al. New synthesis of ureas. Reaction of ammonia or aliphatic amines with carbon monoxide in the presence of selenium[J]. J Am Chem Soc, 1971, 93(23): 6344.
DOI:10.1021/ja00752a099 |
| [9] |
Mizuno T, Nakai T, Mihara M. Efficient solvent-free synthesis of urea derivatives using selenium-catalyzed carbo-nylation of amines with carbon monoxide and oxygen[J]. Synthesis, 2010, 24: 4251–4255.
|
| [10] |
Fujiwara S, Miyoshi N, Ogawa A, et al. A mechanistic study of the selenium-catalyzed carbonylation of secondary amines with carbon monoxide[J]. J Phys Org Chem, 1989, 2(4): 359–362.
DOI:10.1002/poc.610020407 |
| [11] |
Sonoda N. Selenium assisted carbonylation with carbon monoxide[J]. Pure Appl Chem, 1993, 65(4): 699–706.
DOI:10.1351/pac199365040699 |
| [12] |
Tian F, Chen Y, Wang X, et al. Oxidative carbonylation of aromatic amines with CO catalyzed by 1, 3-dialkylimidazole-2-selenone in ionic liquids[J]. J Chem, 2015: 210806.
|
| [13] |
Kim H S, Kim Y J, Lee H, et al. Ionic liquids containing anionic selenium species:Applications for the oxidative carbonylation of aniline[J]. Angew Chem Int Ed, 2002, 41(22): 4300–4303.
DOI:10.1002/1521-3773(20021115)41:22<4300::AID-ANIE4300>3.0.CO;2-V |
| [14] |
Kambe N, Kondo K, Ishii H, et al. Tellurium-catalyzed reaction of amines with carbon monoxide[J]. Angew Chem Int Ed, 1979, 18(7): 547–548.
DOI:10.1002/anie.197905471 |
| [15] |
Kambe N, Kondo K, Ishii H, et al. Tellurium-catalyzed carbonylation of amines with carbon monoxide[J]. Bull Chem Soc Jpn, 1981, 54(5): 1460–1464.
DOI:10.1246/bcsj.54.1460 |
| [16] |
Brackman W. A process for the prepartion of N, N-substituted ureas[P]. UK: GB868460A, 1961.
|
| [17] |
Casiello M, Iannone F, Cotugno P, et al. Copper(Ⅱ)-catalysed oxidative carbonylation of aminols and amines in water:A direct access to oxazolidinones, ureas and carbamates[J]. J Mol Catal A:Chem, 2015, 407: 8–14.
DOI:10.1016/j.molcata.2015.06.007 |
| [18] |
Zheng S, Li F, Liu J, et al. A novel and efficient (NHC)CuI (NHC=N-heterocyclic carbene) catalyst for the oxidative carbonylation of amino compounds[J]. Tetrahedron Lett, 2007, 48(33): 5883–5886.
DOI:10.1016/j.tetlet.2007.06.049 |
| [19] |
Saliu F, Putomatti B, Rindone B. Nitrogen-containing organobases as promoters in the Cobalt(Ⅱ)-Schiff base ca-talyzed oxidative carbonylation of amines[J]. Tetrahedron Lett, 2012, 53(28): 3590–3593.
DOI:10.1016/j.tetlet.2012.05.015 |
| [20] |
Chen L J, Bao J, Mei F M, et al. Oxidative carbonylation of aniline to N, N'-diphenyl urea catalyzed by Cobalt(Ⅱ)-Schiff base complex/pyridine catalytic system[J]. Catal Commun, 2008, 9(5): 658–663.
DOI:10.1016/j.catcom.2007.07.016 |
| [21] |
Li J, Tu D-h, Li Y, et al. Co-N-doped carbon nanotubes supported on diatomite for highly efficient catalysis oxidative carbonylation of amines with CO and air[J]. Appl Catal A, 2018, 549: 112–116.
DOI:10.1016/j.apcata.2017.09.030 |
| [22] |
Mc Cusker J E, Main A D, Johnson K S, et al. W(CO)6-catalyzed oxidative carbonylation of primary amines to N, N'-disubstituted ureas in single or biphasic solvent systems[J]. J Org Chem, 2000, 65(17): 5216–5222.
DOI:10.1021/jo000364+ |
| [23] |
McCusker J E, Qian F, McElwee-White L. Catalytic oxidative carbonylation of aliphatic secondary amines to tetrasubstituted ureas[J]. J Mol Catal A:Chem, 2000, 159(1): 11–17.
DOI:10.1016/S1381-1169(00)00164-3 |
| [24] |
Qian F, McCusker J E, Zhang Y, et al. Catalytic oxidative carbonylation of primary and secondary diamines to cyclic ureas. Optimization and substituent studies[J]. J Org Chem, 2002, 67(12): 4086–4092.
DOI:10.1021/jo0109319 |
| [25] |
Zhang L, Darko A K, Johns J I, et al. Catalytic oxidative carbonylation of arylamines to ureas with W(CO)6/I2 as catalyst[J]. Eur J Org Chem, 2011, 31: 6261–6268.
|
| [26] |
Gabriele B, Salerno G, Mancuso R, et al. Efficient synthesis of ureas by direct palladium-catalyzed oxidative carbonylation of amines[J]. J Org Chem, 2004, 69(14): 4741–4750.
DOI:10.1021/jo0494634 |
| [27] |
Gabriele B, Mancuso R, Salerno G, et al. A novel and efficient method for the Pd-catalyzed oxidative carbonylation of amines to symmetrically and unsymmetrically substituted ureas[J]. Chem Commun, 2003, 4: 486–487.
|
| [28] |
Della Ca N, Bottarelli P, Dibenedetto A, et al. Palladium-catalyzed synthesis of symmetrical urea derivatives by oxidative carbonylation of primary amines in carbon dioxide medium[J]. J Catal, 2011, 282(1): 120–127.
|
| [29] |
Mancuso R, Raut D S, Della Ca N, et al. Catalytic oxidative carbonylation of amino moieties to ureas, oxa-mides, 2-oxazolidinones, and benzoxazolones[J]. ChemSusChem, 2015, 8(13): 2204–2211.
DOI:10.1002/cssc.201500343 |
| [30] |
Ferretti F, Barraco E, Gatti C, et al. Palladium/iodide catalyzed oxidative carbonylation of aniline to diphenylurea:Effect of ppm amounts of iron salts[J]. J Catal, 2019, 369: 257–266.
DOI:10.1016/j.jcat.2018.11.010 |
| [31] |
Zheng S, Peng X, Liu J, et al. N-Heterocyclic carbene-palladium complexes as efficient catalysts for the oxidative carbonylation of amines to ureas[J]. Helv Chim Acta, 2007, 90(8): 1471–1476.
DOI:10.1002/hlca.200790152 |
| [32] |
Zheng S Z, Peng X G, Liu J M, et al. N-heterocyclic carbene-palladium complex catalyzed oxidative carbonylation of amines to ureas[J]. Chin J Chem, 2007, 25(8): 1065–1068.
DOI:10.1002/cjoc.200790196 |
| [33] |
Shi F, Deng Y, Si Ma T, et al. A novel ZrO2-SO2-4-supported palladium catalyst for syntheses of disubstituted ureas from amines by oxidative carbonylation[J]. Tetrahedron Lett, 2001, 42(11): 2161–2163.
DOI:10.1016/S0040-4039(01)00124-1 |
| [34] |
Liu S, Dai X, Wang H, et al. Organic ligand and solvent free oxidative carbonylation of amine over Pd/TiO2 with unprecedented activity[J]. Green Chem, 2019, 21(15): 4040–4045.
DOI:10.1039/C9GC01577A |
| [35] |
Prasad K V, Chaudhari R V. Activity and selectivity of supported Rh catalysts for oxidative carbonylation of aniline[J]. J Catal, 1994, 145(1): 204–215.
|
| [36] |
Giannoccaro P, De Giglio E, Gargano M, et al. Rh3+ and Rh3+-diamine complexes intercalated in γ-titanium hydrogen phosphate. Synthesis, characterisation and catalytic activity towards aniline oxidative carbonylation processes[J]. J Mol Catal A:Chem, 2000, 157(1): 131–141.
|
| [37] |
Zhang Q, Shi F, Deng Y. Preparation of SiO2-gel supported ionic liquid catalyst and its application in synthesis of N, N'-Disubstituted ureas from amines[J]. Chin J Catal, 2004, 25(8): 607–610.
|
| [38] |
Park J H, Yoon J C, Chung Y K. Cobalt/Rhodium hete-robimetallic nanoparticle-catalyzed oxidative carbonylation of amines in the presence of carbon monoxide and mole-cular oxygen to ureas[J]. Adv Synth Catal, 2009, 351(9): 1233–1237.
DOI:10.1002/adsc.200900106 |
| [39] |
Mulla S A R, Rode C V, Kelkar A A, et al. Activity of homogeneous transition metal catalysts for oxidative carbonylation of aniline to N, N'-diphenyl urea[J]. J Mol Catal A:Chem, 1997, 122(2): 103–109.
|
| [40] |
Shi F, Deng Y. Polymer-immobilized gold catalysts for the efficient and clean syntheses of carbamates and symmetrical ureas by oxidative carbonylation of aniline and its derivatives[J]. J Catal, 2002, 211(2): 548–551.
|
| [41] |
Zhu B, Angelici R J. Non-nanogold catalysis of carbon monoxide oxidative amination[J]. J Am Chem Soc, 2006, 128(45): 14460–14461.
DOI:10.1021/ja065706t |
| [42] |
Duan H, Zeng Y, Yao X, et al. Tuning synergistic effect of Au-Pd bimetallic nanocatalyst for aerobic oxidative carbonylation of amines[J]. Chem Mater, 2017, 29(8): 3671–3677.
DOI:10.1021/acs.chemmater.7b00544 |
| [43] |
Jin L, Weinberger D S, Melaimi M, et al. Trinuclear gold clusters supported by cyclic (alkyl)(amino)carbene ligands:Mimics for gold heterogeneous catalysts[J]. Angew Chem Int Ed, 2014, 53(34): 9059–9063.
DOI:10.1002/anie.201404665 |
| [44] |
Smirnova E S, Munoz Molina J M, Johnson A, et al. Polynuclear gold[AuI]4, [AuI]8, and bimetallic[Au4I AgI] complexes:C-H functionalization of carbonyl compounds and homogeneous carbonylation of amines[J]. Angew Chem Int Ed, 2016, 55(26): 7487–7491.
DOI:10.1002/anie.201603200 |
| [45] |
Cao Y, Yang J G, Deng Y, et al. Amine-responsive disassembly of AuI-CuI double salts for oxidative carbonylation[J]. Angew Chem Int Ed, 2020, 59(5): 2080–2084.
DOI:10.1002/anie.201914089 |
| [46] |
Yang H, Deng Y, Shi F. Synthesis of dialkylureas by electrocatalytical carbonylation of aliphatic amines under mild conditions[J]. J Mol Catal A:Chem, 2001, 176(1/2): 73–78.
|
| [47] |
Wagh G D, Pathare S P, Akamanchi K G. Sulfated-tungstate-catalyzed synthesis of ureas/thioureas via transami-dation and synthesis of forchlorofenuron[J]. Chem Select, 2018, 3(25): 7049–7053.
|
| [48] |
Nagaraju N, Kuriakose G. A new catalyst for the synthesis of N, N-biphenylurea from aniline and dimethyl carbonate[J]. Green Chem, 2002, 4(3): 269–271.
|
| [49] |
Chen L J, Mei F M, Li G X. Cobalt schiff base complexes with symmetric or asymmetric ligands:syntheses and application for the redox carbonylation of aniline to diphenyl urea[J]. React Kinet Catal Lett, 2009, 98(1): 99–105.
DOI:10.1007/s11144-009-0073-6 |
| [50] |
Kondo T, Kotachi S, Tsuji Y, et al. Novel ruthenium-complex-catalyzed synthesis of ureas from formamides and amines[J]. Organometallics, 1997, 16(12): 2562–2570.
DOI:10.1021/om970201k |
| [51] |
Kumar G S, Kumar R A, Kumar P S, et al. Copper catalyzed oxidative coupling of amines with formamides:A new approach for the synthesis of unsymmetrical urea derivatives[J]. Chem Communi, 2013, 49(59): 6686–6688.
DOI:10.1039/c3cc42381f |
| [52] |
Lebel H, Leogane O. Curtius rearrangement of aromatic carboxylic acids to access protected anilines and aromatic ureas[J]. Org Lett, 2006, 8(25): 5717–5720.
DOI:10.1021/ol0622920 |
| [53] |
Katuri J V P, Nagarajan K. Hofmann rearrangement of primary carboxamides and cyclic imides using DCDMH and application to the synthesis of gabapentin and its potential peptide prodrugs[J]. Tetrahedron Lett, 2019, 60(7): 552–556.
DOI:10.1016/j.tetlet.2019.01.025 |
| [54] |
Porcheddu A, Delogu F, De Luca L, et al. From lossen transposition to solventless "Medicinal Mechanochemistry"[J]. ACS Sustainable Chem Eng, 2019, 7(14): 12044–12051.
|
| [55] |
Vishnyakova T P, Golubeva I A, Glebova E V. Substituted ureas. Methods of synthesis and applications[J]. Russ Chem Rev, 1985, 54(3): 249–261.
|
| [56] |
Ricci A, Bertoletti C. Urea derivatives on the move:cytokinin-like activity and adventitious rooting enhancement depend on chemical structure[J]. Plant Biol, 2009, 11(3): 262–272.
|
| [57] |
J Jadhav P K, Ala P, Woerner F J, et al. Cyclic urea Amides:HIV-1 protease inhibitors with low nanomolar potency against both wild type and protease inhibitor resistant mutants of HIV[J]. J Med Chem, 1997, 40(2): 181–191.
|
| [58] |
Li H Q, Lv P C, Yan T, et al. Urea derivatives as anticancer agents[J]. Anti-Cancer Agents Med Chem, 2009, 9(4): 471–480.
DOI:10.2174/1871520610909040471 |
| [59] |
Dumas J, Smith R A, Lowinger T B. Recent developments in the discovery of protein kinase inhibitors from the urea class[J]. Current Opinion in Drug Discovery & Development, 2004, 7(5): 600–616.
|
| [60] |
Volz N, Clayden J. The Urea Renaissance[J]. Angew Chem Int Ed, 2011, 50(51): 12148–12155.
DOI:10.1002/anie.201104037 |
 2020, Vol. 34
2020, Vol. 34


