2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
能源是人类社会生存和发展的基础, 能源消耗量的增加侧面反映经济社会的快速发展[1-3].伴随全球经济迅猛发展, 化石能源逐渐枯竭, 人类正面临着严重的能源危机以及气候变暖问题[4-5].因此, 转变能源消耗方式、发展清洁能源, 对于保障能源安全、加强环境保护、减少温室气体排放, 实现国民经济可持续发展具有重要意义(如图 1)[6-8].在众多的清洁能源中, 氢能由于具有热值高、可再生、贮存运输方便、二氧化碳零排放等特性而被认为是能源转化与存储的理想形式[9-10].

|
图 1 世界能源消费结构的转变 Fig.1 Changes in the structure of world energy consumption |
目前规模最大的制氢方式是化石燃料制氢, 如从石脑油、天然气等重整制氢, 其次是电解水和生物制氢等方式.近年来, 光催化、光电催化制氢也成为研究的热点, 但是这些技术离工业化尚有一定的距离.甲醛(HCHO)作为一种大宗工业品, 是甲醇最主要的下游产品, 同时也可以从生物质转化得来, 它是一种廉价易得、制备方式多样、安全的氢载体.利用甲醛制氢的同时, 还能够消除甲醛对空气及废水的污染, “变废为宝”, 满足能源和清洁环境的双重需求, 符合可持续发展的理念[11-12].
甲醛可以通过热催化的方式分解制氢, 但是相较而言, 光催化分解甲醛制备氢气则具备更多优点.首先, 这个反应可以利用太阳能驱动, 太阳能分布范围广泛, 取之不尽, 用之不竭, 被认为是21世纪最清洁的可再生能源, 但是现在人们仅仅利用了辐射到地球表面太阳辐射能量的0.05%[13-15].其次, 可见光驱动催化甲醛制氢的反应条件温和, 在室温下就可以进行, 可见光催化甲醛制氢技术同样可以用于消除其他有机污染物.对可见光驱动甲醛产氢光催化体系的系统研究将对解决能源和环境问题具有重要的理论意义.
1 甲醛的工业生产甲醛(HCHO), 俗称“蚁醛”, 1855年被沙俄科学家亚历山大首次发现.甲醛的相对摩尔质量为30.03 g/mol, 由于甲醛的分子量比较小, 其分子间的范德华力较弱, 沸点为-19.5 ℃, 熔点为-92 ℃.甲醛蒸汽与空气能够形成比较容易爆炸的混合物, 遇明火或者高温可以爆炸(空气中的爆炸极限体积分数为7%~73%).甲醛是可燃性气体, 其闪点温度和自燃温度分别为56和430 ℃, 相对密度为1.081~1.085 g/cm3, 常温常压下, 甲醛是一种无色、易挥发具有刺激性气味的气体.甲醛的分子极性较强, 极易溶于水、醇、酮、醚以及苯等常见溶剂, 其中30%~40%的甲醛水溶液, 具有杀菌和防腐的功效, 被称为福尔马林溶液.
一个甲醛分子含有一个碳氧双键(C=O)和两个碳氢(C—H)键.碳原子的3个SP2杂化轨道构成在同一平面上的3个σ键, 碳氧原子之间由于P轨道发生重叠而形成1个π键, π键与3个σ键所形成的平面相互垂直.作为最简单的羰基化合物, 甲醛羰基上的氧原子含有一对孤对电子, 这使得甲醛分子很容易和Lewis酸发生相互作用, 转变为吸附态的甲醛.在氧原子的存在下, 羰基碳原子的电子云更加偏向氧, 导致甲醛具有亲电性, 容易受到亲核试剂的进攻, 所以甲醛分子的化学性质十分活泼.
甲醛是重要的化工产品, 2018年世界甲醛总产能约为9.6×107 t, 其中美国甲醛的总产能约占世界甲醛总产能的11.4%.我国生产甲醛的企业约有500家, 甲醛的总产能约为3.9×107 t, 占世界甲醛总产能的40.5%.目前我国生产的甲醛90%以上是以甲醇为原料制取的.利用甲醇通过空气氧化制备甲醛始于1867年, 德国科学家霍夫曼是使用甲醇空气氧化法在实验室条件下成功制备出甲醛的第一人, 他以Pt为催化剂实现了这个过程.接着Plank等人在1910年发明了后来广泛应用于催化甲醇氧化制甲醛的Ag催化剂, 但是直到1925年, 德国BASF公司才实现甲醇空气氧化法的大规模工业化应用.甲醇空气氧化法的催化剂历经多次改进, 代表性的催化剂有电解银催化剂以及由Adkins和Peterson在1931年发明的铁钼氧化物催化剂.目前以甲醇为原料通过空气氧化法制备甲醛的主要工艺是以银作为催化剂的甲醇过量法(俗称“银法”)和采用混合金属氧化物作为催化剂的空气过量法(俗称“铁-钼法”).
“银法”是工业生产甲醛的一种最重要方法, 在银法制甲醛的发展之初使用银网以及浮石银作为催化剂, 后来逐渐发展出了电解银催化剂[16-17].我国对“银法”工艺的研究开始于20世纪50年代, 当时是依靠引进前苏联的技术、以浮石银作为催化剂.浮石银催化剂的制备首先需要将浮石粉碎为适当大小的颗粒, 而后在硝酸银溶液中浸渍并在高温条件下煅烧制备得到.但是浮石银催化剂制备步骤多、需要使用大量的硝酸, 产生的废弃物较多, 排放较多的氮氧化物.浮石银催化剂中活性组分Ag的含量仅有35%~40%, 催化剂的比活性较低, 反应过程中原料甲醇的消耗较高.电解银催化剂由于制备容易、性能高, 逐渐取代浮石银催化剂成为主流的银催化剂.我国的电解银催化剂研究始于上世纪80年代, 上海复旦大学的邓景发院士[18]联合上海试剂厂, 开发了我国的第一代电解银催化剂.
电解银催化剂是利用二次电解法制备的[19].相比浮石银催化剂, 电解银催化剂具有更多优点, 电解银催化剂是拥有许多单晶银须的晶态银, 比表面积较大, 因此其催化效果比较好.使用电解银催化制备甲醛的工艺简单、反应温度低、甲醛收益高, 因此目前银法工艺制甲醛主要采用的是电解银催化剂.尽管“银法”工艺使用非常广泛, 但是利用该工艺制备甲醛的过程也存在许多缺点, 如银法工艺中原料甲醇的消耗量很高, 催化剂层对甲醇原料气流的阻力比较大, 这会导致催化剂的流失严重.由于反应过程温度较高约为600~720 ℃, 催化剂容易产生烧结现象, 使得催化剂活性降低.催化剂对反应中的Fe, S等毒物较敏感, 容易造成催化剂中毒, 进而影响催化剂的寿命, 需要频繁更换[20-21].
1931年, 世界首个以铁钼法制备甲醛的专利出现, 之后的十几年陆续出现铁钼催化剂制备、改造以及回收的报道.铁钼催化剂的主要活性组分是以铁盐(硝酸铁和氯化铁)和钼酸盐(钼酸铵和钼酸钠)为原料, 通过共沉积的方法制备得到的Fe2(MoO4)3 [22]. 1965年瑞典的Perstorp公司首次采用铁钼催化剂实现了甲醛的工业生产, 在反应过程中, 催化剂床层温度约为350 ℃, 反应器内压力为1.2~3.0 MPa.反应完成后, 体系中生成的甲醛被送入吸收塔, 用水进行吸收, 采用间接冷却式的双塔吸收并且通过控制吸收塔的水流量来调节甲醛溶液的浓度.
铁钼法催化甲醇空气氧化制备甲醛的工艺具有更多的优势:首先, 相比银法反应的高温, 铁钼法的反应温度相对较低, 仅为320~380 ℃, 反应过程能耗较低; 催化剂对反应过程中产生的毒物不敏感, 催化剂寿命较长可以达到12~18个月; 铁钼法催化甲醇空气氧化制备甲醛的过程中, 甲醇的转化率较高可达98%~99%, 甲醛的收率也比较高, 可以达到91%~94%;铁钼法制备过程中获得的甲醛溶液浓度比较高, 约为37%~35%, 有利于后续在三醛树脂, 季戊四醇等产品的制备过程中直接使用[23].但是, 铁钼催化剂的使用过程中同样存在一定的缺点, 在较高的反应温度下, 铁钼催化剂局部与高浓度的甲醇反应催化剂会发生相分离, 分解为FeMnO4和MoO3两种物质, 伴随MoO3催化剂逐渐升华, 会生成活性和选择性较低的Fe2O3, 造成催化剂失活.与此同时, 催化剂的抗压能力下降, 催化剂易碎, 这一现象会加剧活性组分的流失, 进一步导致催化剂失活[24].
以甲醇为原料制备甲醛还可以采用高温条件下甲醇直接脱氢制备甲醛的方法: CH3OH=CH2O+H2(ΔHR, 700 ℃=92.7 kJ/mol), 在不使用任何催化剂的情况下甲醛的转化率可以达到45%, 甲醛的收率可以达到20%.甲醇直接脱氢制备甲醛的反应是吸热反应, 反应温度升高甲醇的转化率逐渐增加, 但是同时副反应也会增多, 因此不能通过简单的升温来提高甲醛的收率, 需要开发高效的催化剂.甲醇直接脱氢制备甲醛最早使用的催化剂是铜催化剂, 后续又逐渐发展出了金属催化剂(Ag, Ag-Cu合金, Zn), 金属氧化物催化剂(ZnO, SiO2, MgO), 碳酸盐催化剂(Na2CO3)和沸石催化剂等.
| 表 1 “银法”和“铁钼法”催化剂的对比 Table 1 Comparison of "Silver method" and "Iron-molybdenum method" catalysts |
在Cu催化剂的使用过程中, 氧的存在会影响催化剂的活性.在氧浓度比较低的情况下, 甲醇脱氢的速率会显著降低.为了解决这一问题, 研究人员对Cu基催化剂进行了一系列的修饰改进, 来提高催化剂催化甲醇脱氢的活性和选择性.如将纳米Ag修饰到Cu催化剂的表面, 制备的合金催化剂不仅可以提高甲醇的转化率, 还能够提高甲醛的选择性.对于金属氧化物催化剂而言, 甲醇分子可以通过化学吸附作用(氢键作用)吸附于催化剂的表面, 并在助催化的协同作用下实现甲醇分子的高效脱氢制备甲醛.含氧酸盐同样具有催化甲醇脱氢制备甲醛的活性, 在众多的含氧酸盐中, NaCO3具有较高催化甲醇脱氢制备甲醛的活性, 甲醇的转化率和甲醛的选择性都比较高, 并且在NaCO3催化剂中添加活性炭组分后活性会明显提高.由于Na+在甲醇脱氢反应中起到重要的催化作用, Na+掺杂的缺铝型ZSM-5沸石催化剂, 在该反应中表现出比较高的甲醇转化率和甲醛选择性, 不同催化剂催化甲醇脱氢制甲醛的转化率和选择性如表 2所示.
| 表 2 不同催化剂催化甲醇脱氢制甲醛的转化率和选择性 Table 2 Conversion rate and selectivity of different catalysts for catalytic dehydrogenation of methanol to formaldehyde |
甲醛还可以用甲烷(CH4)原料来制备.从热力学角度讲, 以甲烷为原料生产甲醛的反应焓变小于零(127 ℃, -69 kcal/mol; 727 ℃, -71.2 kcal/mol), 是一个强放热反应, 反应可以自发进行, 并且低温对反应更加有力.但是, 考虑到甲烷分子的惰性, 通常需要提高反应温度才可以使体系中活化的甲醛分子数增加, 进而提高其转化率.然而反应温度的提高, 同样会导致反应中甲烷分子转化为甲醛的选择性降低, 并且温度升高后, 甲醛分子更容易发生深度氧化, 转化为CO2和H2O.因此, 不能通过简单加热的方法来提高甲醛的产率, 开发高效的催化剂成为解决这一问题的关键.
以甲烷为原料制备甲醛的方法有一百多年的发展历史, 1902年, Bone和Wheeler在对静态体系的研究中发现, 常温常压下甲烷可以缓慢转化为甲醛; 1905年, Lance和Elworthy第一次获得了该反应的相关专利, 他们指出在FeSO4存在的情况下, 甲烷可以被双氧水氧化形成甲醛; 1947年Holm等[35]首次发现N2O可以作为氧化剂, 在400~600 ℃的反应温度下, 当甲烷与氧气的体积比为1:37时, 将甲烷转化为甲醛.在第二次世界大战以后, 德国又发展了Ag2O/BaO2催化剂用于催化甲烷选择性氧化制甲醛[36]; 1970年, Cuillis和Mann等[37-38]发现Pd/ThO2和Pd/Al2O3催化剂可以催化氯甲烷与空气的混合气制备甲醛, 但是这些催化剂的活性都比较低.直到1986年, 基于MoOx催化剂的研究成果出现, 才使得甲烷氧化制甲醛的产率得到大幅度提升, Ohler等[39]发明了MoO3/SiO2催化剂, 研究结果表明, 甲烷选择性氧化制甲醛的反应过程中, 约有质量分数为5.0×10-5~5.0×10-4 mg/kg的Mo(Ⅵ)被还原成Mo(Ⅳ), 并认为其反应机理为O2与已还原的Mo物种反应形成过氧物种, 甲烷再与过氧物种反应生成甲醛.通过对反应动力学模型的研究, 发现反应温度和CH4/O2比值直接影响反应中甲醛收率, 研究者认为担载4.5%(质量分数)的MoOx/SiO2催化剂可以获得7.0%的理论甲醛收率.
但是甲烷氧化制备甲醛的反应过程中, 甲烷在MoO3催化剂表面容易生成CO2, 进而影响产物甲醛的选择性.为了提高甲醛的选择性, Spencer[40]提出了使用V2O5/SiO2催化剂催化该反应, 研究结果显示在相同的反应条件下, V2O5/SiO2催化剂催化甲烷氧化制备甲醛的活性要比MoO3/SiO2催化剂高, 当甲烷的转化率在5%时, 甲醛的收率可以达到32.5%.但是目前对于氧化钒催化剂催化甲烷氧化制备甲醛机理的认识出现了很大分歧, Dobler等[41]认为VOx/SiO2催化剂上VOx负载量小于5%(质量分数)时, 具有Td对称性的还原态钒离子通过电子传递可以活化气相中的O2(O2(g)→2O*(ads)), 生成的O*(ads)再与CH4反应生成HCHO; 而当负载量大于5%(质量分数)时, V2O5/SiO2催化剂上晶格氧同时参与了反应, 更有学者认为端氧物种V=O是甲烷选择氧化生成甲醛的活性物种. Zhao等[42]认为, 由于V=O在反应过程中太过稳定, 所以并非是催化该反应的活性中心, 并且VOx系列催化剂上有明显的载体效应, V-O-support物种在此反应中起的作用比V=O更大, 因此V-O-support位则很有可能是催化该反应的活性中心.
此外, Anderson等[43]发现Cu2+掺杂的Fe-ZSM-5双功能氧化还原催化剂, 可以催化甲烷氧化制备甲醛, 但是该催剂对甲醛的选择性并不高.随后Sojka等[44]改进了该催化剂, 在ZnO催化剂表面担载氧化还原对来催化甲烷氧化反应, 催化机理可以被理解为: Cu+/Cu2+氧化还原对作为活性中心使得催化剂的表面O2分子活化, 而在Fe2+/Fe3+催化剂的表面甲烷分子被活化(图 2).研究结果显示伴随反应温度的升高, 甲醛的选择性逐渐降低, 当反应温度为750 ℃时, 甲醛的产率最佳.这主要是由于在催化剂的表面阳离子以库仑电对的形式富集, 在温度较低时可以改变催化剂的选择性, 使得产物中甲醛的选择性提高到43%.

|
图 2 Cu-Fe-ZnO催化甲烷氧化制甲醛的机理图 Fig.2 Cu-Fe-ZnO catalytic mechanism of methane oxidation to formaldehyde |
近年来, 以二甲醚(CH3OCH3)为原料逐渐成为研究的热点, 因为人们越来越关注二甲醚向1, 2-二甲氧基乙烷、二甲氧基甲烷、二甲氧基二甲醚、乙醇以及甲醛的转化. 1966日本首次实现了二甲醚制甲醛的工业化, 1983年我国太原化工厂制备了α-Al2O3载体担载的三氧化钨催化剂用于催化二甲醚氧化制备甲醛[45]; 1984年美国科学家Lewis等[46]首次提出了以Bi-Mo催化剂催化二甲醚转化制备甲醛的方法, 但是该催化剂的转化率并不高, 仅有14%~46%, 并未得到广泛应用, 所以在很长一段时间内, 甲醛的制备仍然是采用以甲醇为原料的制备工艺.伴随对甲醇空气氧化法制甲醛机理的深入研究, 人们发现中间体CH3O*的存在是制备甲醛的关键步骤. 1996年日本科学家Michikazu等[47]首次发现吸附态的二甲醚可以在CeO2表面解离形成CH3O*中间体. 2000年Ouyang等[48]发现在ZrO表面也存在该现象, 这些发现为以二甲醚为原料制备甲醛提供了很好的理论基础.经过对CH3O*活性物种形成机理的分析(图 3), 研究人员发现催化剂中的晶格氧发挥了重要作用, 因此负载型金属氧化物催化剂成为了研究的重点, 常用的催化二甲醚转化制甲醛的金属氧化物催化剂是MoOx催化剂和VOx催化剂.

|
图 3 以CH3OCH3为原料的甲醛的制备机理 Fig.3 Preparation mechanism of formaldehyde using CH3OCH3 as raw material |
2002年, Liu等[49]在甲醇制甲醛的铁钼催化剂的基础上, 首次采用具有二维结构的MoOx和VOx作为催化剂, 成功催化二甲醚选择性氧化制备甲醛.研究结果表明, 在240 ℃, MoOx-Al2O3催化二甲醚制备甲醛的选择性可达80%~98%, 明显高于Lewis等人专利报道的Bi-Mo催化剂的选择性.在后续研究中, Liu等[50]阐明了MoOx/ZrO2催化剂的反应活性位点、表面钼原子的密度等因素对催化剂活性的影响.结果表明, ZrMo2O8和MoO3是催化剂的活性组分, 随着表面钼原子密度(2.2~6.4 Mo/nm2)的增加, 其反应活性显著增加.然而当催化剂表面Mo原子的表面密度增加到一定程度后, 由于MoOx物种的存在使得MoO3和ZrMo2O8两个活性组分分离, 因此二甲醚的转化率逐渐降低.
随着对二甲醚氧化制甲醛机理的深入研究, 研究人员逐渐意识到催化剂表面H2生成的速率会影响CH3O*中C—H键的活化, 进而直接影响二甲醚转化制甲醛的活性以及选择性. Zhang等[51]在Al2O3载体表面修饰了可还原性的氧化物SnOx, ZrOx, SnOx和FeOx, 使催化剂具有高的产氢活性, MoOx-Al2O3催化甲醛转化的选择性显著提高.表面修饰不同氧化物的催化剂中, MoOx/SnOx-Al2O3、MoOx/ZrOx-Al2O3、MoOx/CeOx-Al2O3和MoOx/FeOx-Al2O对甲醛的选择性分别为97.7%、98.6%、98.8%和99.7%.
目前对于MoOx催化剂的研究比较多, MoOx催化剂中晶格氧的存在更有利于含氧活性物种的吸附脱氢, 这是二甲醚氧化制甲醛反应的决速步骤. 2003年后, 人们还发现VOx可以催化二甲醚氧化制甲醛, 但相关的研究报道非常少, 如Huang等[52]利用前躯体浸渍法合成了VOx/Al2O3和MOx/Al2O3催化剂, 将该催化剂用于催化二甲醚氧化制甲醛, 并利用XRD, UV-Vis, H2-TPR和NH3-TPD和吡啶吸附红外等技术对催化剂的结构和性能进行了一系列表征.他们发现浸渍法制备的VOx/Al2O3和MOx/Al2O3催化剂具有高分散度和高催化氧化能力, 在以二甲醚为原料制甲醛的反应中表现出较好的催化活性.他们还比较了负载型MoOx和VOx催化二甲醚选择性氧化制甲醛的性能[53], 研究结果表明:两类催化剂在低温下都具有良好的催化性能, VOx比MoOx所需的反应温度更低, 300 ℃的反应条件下, 二甲醚转化率为20%, 甲醛选择性为70%, 并且催化剂的载体选择对活性有很大影响, 使用酸性载体时, VOx催化剂的选择性更高, 稳定性更好.
不同载体对催化剂反应活性的影响不同, Zhang等[54]研究了SBA-15, α-Al2O3, ZSM-5和MgO催化剂载体担载的MoO3催化二甲醚转化的活性, 结果显示仅在SBA-15, α-Al2O3, ZSM-5等载体中的Mo以MoO3的形式存在, 而在MgO载体的表面, Mo以MoOx的形式存在.不同载体担载的MoO3中, Mo的电子结合能完全不同, 这是由于不同载体表面的晶格氧和羟基含量是不同的, MoO3-α-Al2O3和MoO3-MgO表面晶格氧的含量最多, 而MoO3-SBA-15和MoO3-ZSM-5表面羟基含量最多, α-Al2O3中高含量的晶格氧和L酸性位点使得其更有利于甲醛的形成[42].
甲醛还可以从二氧化碳(CO2)制备, CO2是一种温室气体, 利用CO2催化加氢的方法制备甲醛, 符合CO2资源化的特点, 具有很高的研究价值[44]. 1913年, Benjamin Moore等[55]首次发现在紫外光照射下, U2O3胶体可以催化CO2和H2O反应制备甲醛; 1952年, Serono等[56]以金属镁为催化剂, 催化CO2和H2O反应成功制备甲醛; 1977年, Salnikova等[57]发现溶液中的镁可以将碳酸盐分解产生的CO2转化为甲醛; 1980年, Aurian-Blajeni等[58]发现在光照条件下, TiO2和WO3等金属半导体催化剂可以催化二氧化碳和水反应制备甲醛; 1982年, Ulman等[59]发现光照条件下半导体催化剂表面担载过渡金属氧化物可以催化二氧化碳还原制备甲醇, 甲醛和甲酸; 1986年, Chiang等[60]首次报道了利用锆茂金属([cp2Zr(H)(Cl)]n, [cp=η5-C5H5])催化CO2还原制备甲醛.这些研究结果表明从二氧化碳得到甲醛是可行的, 其反应机理是在催化剂存在的条件下, 首先产物与催化剂配合, 随后配合物中的C—O键断裂得到[cp2Zr(H)(Cl)]2O和甲醛.此外, Corriu等[61]报道了在叔胺存在下, CO2可以插入有机硅烷的Si—H键中形成一种稳定的硅烷基, 在65~85 ℃的反应温度下硅烷基会逐渐分解产生甲醛. Sebastien等[62]报道了以PtCu/SiO2为催化剂催化CO2转化制备甲醛的结果, 研究结果显示在150 ℃的反应条件下, 当H2与CO2的比为20:1时, 甲醛的产氢速率可达0.84×10-4 mol·min-1·g-1, 但是其选择性并不高, 同时会有0.2×10-4 mol·min-1·g-1的甲醇生成. Lee等[63]报道了在温和的反应条件(1×105 Pa, CO2, 室温)以频哪醇硼烷(B-H)作为还原剂(如图 4), 通过钌基催化剂催化CO2还原制备HCHO的实验结果.

|
图 4 钌催化的CO2还原为甲醛衍生物 Fig.4 Ruthenium-catalyzed reduction of CO2 to formaldehyde derivatives |
在CO2转化制甲醛的发展史上先后出现了酶催化、电催化和光催化的研究方法, 以及众多的金属氧化物催化剂, 配位金属催化剂等, 但是CO2分子十分稳定, 分子的活化需要合适的反应温度、压力和催化剂, 并且CO2加氢反应的产物分布宽, 包括甲醇、甲烷等, 这也就意味着反应选择性无法得到保证, 所以目前已经发现的催化剂活性和选择性都比较低, 以CO2为原料制备甲醛的方法目前还未得到实际应用.
除了以甲醇、甲烷、二甲醚和二氧化碳为原料制备甲醛, 还有其他制备甲醛的方法, 比如以液化石油气为原料的非催化氧化法制备甲醛.在第二次世界大战以前, 由于甲醇未得到大规模的工业化生产, 美国的Celanese公司采用以液化石油气为原料的非催化氧化技术来生产甲醛, 该技术的装置生产能力可以达到140 t/年, 伴随甲醇实现大规模工业化生产, 使用该方法制备甲醛的企业逐渐减少.
2 甲醛在氢能源中的应用甲醛做为氢载体相较于其他原料具有运输安全、含氢量高、易转化的特性, 近年来从甲醛制氢逐渐得到科学界的重视.但是起初甲醛制氢的速率非常慢, 所以该现象在一百年中很少有人关注, 直到20世纪90年代, 人们才发现甲醛溶液在强碱性条件下会释放出氢气, 金属纳米催化剂Pt[64], Au[65], Ag[66]和Pd[67]等可以催化该反应, 并且反应过程中催化剂表现出很高的活性和稳定性.由于反应物甲醛和水都是廉价易得的原料, 这些原料的使用降低了制备氢气成本, 值得一提的是, 在该反应中水分子同样做为氢原子的供应方, 所以利用甲醛水溶液在碱性条件下制氢符合“氢经济”的理念, 并且反应过程中不会产生任何含碳物质, 贵金属催化剂不易失活, 是一种非常高效的制氢方法, 可以满足氢气大规模制备和实际应用的需求.
目前常用的催化甲醛产氢的方法包含热催化和光催化两种.热催化分解方法是目前工业上处理易挥发有机污染物最常用的技术手段, 热催化分解方法中, 有机分子通过扩散、吸附和表面反应等一系列物理化学过程发生催化转化, 催化剂的存在显著降低了反应的活化能, 使得反应条件变温和.甲醛的热催化分解法是在催化剂表面将甲醛分解产生CO2和H2O, 其机理可以描述为:甲醛首先在催化剂表面发生吸附, 并与催化剂表面的羟基发生反应生成-OCH2OH, -OCH2OH分解产生氢气和-OCHO, -OCHO继续与水反应生成-OCH(OH)2, -OCH(OH)2分解产生氢气和二氧化碳[68], 该反应催化剂成本低、催化效率高、循环稳定性好, 但是反应中产生的CO2气体会导致温室效应.
在碱性条件下利用金属催化剂催化甲醛溶液产氢则不会产生CO2等温室气体, Lu等[12]利用各种分子结构不同的多元醇作为溶剂, 制备了不同形貌的Ag纳米晶体(如图 5), 如利用1, 2-丙二醇溶液制备出Ag纳米线, 1, 3-丙二醇溶液制备出Ag纳米棒, 1, 3-丁二醇溶液中制备出Ag纳米立方体, 1, 4-丁二醇溶液中制备出Ag纳米球, 并将所制备的纳米金属应用于催化HCHO溶液产氢的反应中, 研究结果显示纳米Ag催化HCHO溶液产氢反应为结构敏感反应, 催化剂的活性强烈依赖于其形貌, 纳米银立方体具有最高的催化性能, 纳米银线催化性能最差.

|
图 5 不同分子结构多元醇还原合成纳米Ag晶体的TEM图 Fig.5 TEM images of colloidal Ag particles (a) Ag nanowires prepared in 1, 2-PG; (b) versatile Ag nanorods prepared in 1, 3-PG; (c) Ag nanocubes prepared in 1, 3-BG; (d) Ag nanospheres prepared in 1, 4-BG |
利用太阳能光催化技术催化甲醛产氢也取得了一系列进展[69-72].在染料敏化光催化分解甲醛制氢的反应体系中, 不同的染料分子发挥了截然不同的作用.与曙红EY, 罗丹明B等染料分子相对比, 以四-羧基苯基卟啉为敏化剂光催化降解甲醛效率最佳.可见光持续照射12 h后, 四-羧基苯基卟啉敏化二氧化钛光催化体系的甲醛降解率高达85%, 降解速率保持在5%/h以上, 可见光继续光照6 h, 降解率可以达到90%以上[73].此外, 电子给体与催化剂之间的相互作用同样会影响光催化分解甲醛产氢的活性, Li等[74]对比了在单组分电子给体和混合体系(草酸, 甲酸, 甲醛)电子给体中Pt/TiO2催化剂的催化活性, 研究结果显示, 在单组分系统中电子给体的效率如下: H2C2O4 > HCOOH > HCHO.该顺序与电子给体在TiO2上的吸附亲和力是一致的, 表明电子给体与催化剂表面相互作用强度对光催化分解制氢反应有显著影响.因此对催化甲醛制氢的光催化剂的研究可以从提高催化剂与甲醛分子的相互作用入手来提高其活性.
由于甲醛制氢方法的差异, 催化剂催化甲醛产氢的机理不同, 对热催化技术催化甲醛产氢反应机理的研究, 要涉及到甲醛的坎尼扎罗反应(Cannizzaro反应)[75].坎尼扎罗反应简单来说是指是无α氢的醛在碱性催化剂的作用下发生歧化反应, 生成醇和羧酸.我们以最简单的甲醛为例详细描述该机理, 如图 6所示, 在碱性条件下, 体系中的-OH首先会进攻甲醛的C=O基团发生亲核加成反应, 形成一个比较稳定的四面体型中间体, 四面体型中间体会与体系中的-OH反应失去一个质子变成双负离子坎尼扎罗反应中间体(-O-CH2-O-).由于坎尼扎罗中间体中的氧原子带有负电荷使得甲醛中碳原子排斥电子的能力增强, 当具有双负离子的坎尼扎罗中间体与甲醛发生反应时, 会使的碳上的氢原子带一对电子以氢负离子的形式离去转移至甲醛的羰基碳, 进而形成一个醇盐负离子(CH3O-)和一个羧酸根负离子(HCOO-).
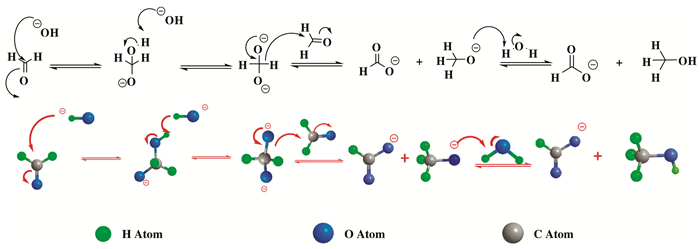
|
图 6 坎尼扎罗反应机理 Fig.6 The reaction route of Cannizzaro reaction |
1887年Loew等在对坎尼扎罗反应的研究中发现, 在强碱性条件下, 甲醛水溶液释放出氢气, 只是产氢速率非常慢, 1993年, Ashby等[76]首次提出了利用甲醛产氢的机理, 当高浓度的碱与甲醛接触时会生成坎尼扎罗反应的中间体, 该中间体与水反应则会产生氢气(图 7).由于反应物甲醛和水廉价易得, 降低了制备氢气成本, 并且水分子同样做为氢原子的供应方, 所以利用甲醛水溶液在碱性条件下制氢符合“氢经济”的理念.并且该反应中没有碳氧化物生成, 避免了催化剂失活, 因此利用热催化方法催化甲醛产氢是一种非常高效的制氢方式, 使得氢气的大规模制备和应用成为可能.
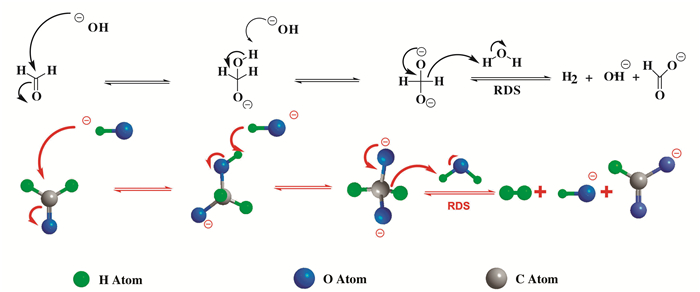
|
图 7 甲醛制氢反应的机理图 Fig.7 Mechanism of formaldehyde hydrogen reaction |
与传统的热催化的机理相比, 光催化技术催化甲醛产氢的机理是截然不同的, 众多研究结果显示, 在光催化甲醛产氢的反应中, 甲醛是作为电子牺牲试剂发挥作用的.如图 8所示, Ling等[77]利用溶胶凝胶法制备了PdO/LaCoO3异质结光催化剂, 用于光照条件下催化甲醛溶液产氢.研究结果显示通过在LaCoO3中掺杂PdO可以有效地调节催化剂的带隙和费米能级, 使其更适用于在可见光条件下催化甲醛制氢.异质结的存在可以极大地促进电荷的产生, 提高对可见光的利用效率, 有效的抑制光生电子和空穴的复合进而提高光催化活性.
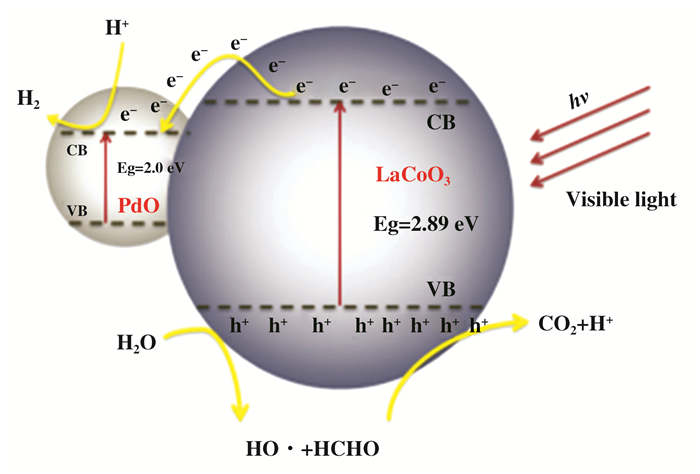
|
图 8 PdO/LaCoO3催化剂可见光条件下催化甲醛溶液产氢的机理 Fig.8 Photocatalytic mechanism of PdO/LaCoO3 heterojunction |
在光催化甲醛产氢的反应中, 甲醛分子式作为牺牲试剂参与到反应体系中.我们以比较常见的Pt/TiO2催化剂为例, 来阐述光催化分解甲醛制氢的机理.如图 9所示, 在光照条件下, 半导体光催化剂Pt/TiO2吸收入射光子产生光生电子和光生空穴, 在催化剂表面, 水分子发生还原反应生成氢气.甲醛分子与催化剂表面的光生电子以及羟基自由基发生氧化反应生成HCOOH和H+, 甲醛分解产生H+和HCOO-, 所产生的HCOO-会与光照生成的空穴发生反应生成H+和CO2气体, 而体系中的H+则会与光照产生的电子发生还原反应生成氢气.
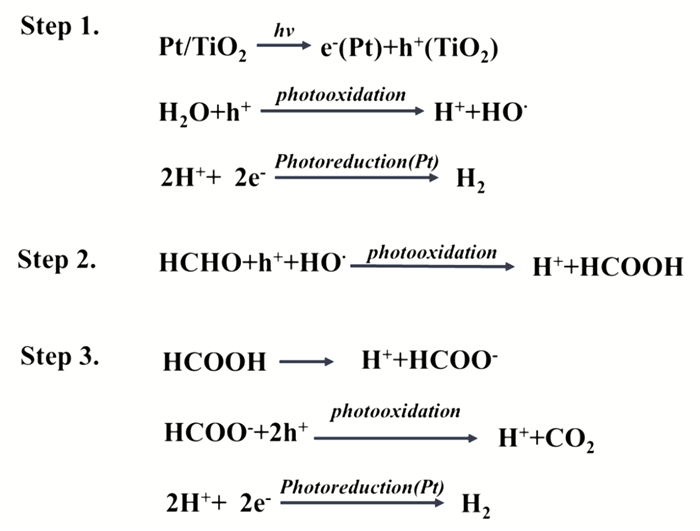
|
图 9 光催化甲醛产氢的反应过程 Fig.9 Photocatalytic reaction of formaldehyde to produce hydrogen |
均相配位催化剂在催化甲醛制氢反应中并不常见, Dominic, Heim等[78-79], 首次报道了碱性条件下Ru配位的均相催化剂催化甲醛产氢的反应, 并通过同位素示踪实验对催化反应的机理进行了系统的研究, 此外作者还研究了催化剂的不同配体对催化反应活性的影响, 研究结果显示: 2 h的反应时间内配体的差异会对反应速率造成一定的影响, 但是当反应时间达到24 h后, 配体对反应速率的影响就不明显了, 这样就可以通过调控配体类型来改变催化剂所适用反应体系, 该配位催化剂在较宽的浓度范围以及酸碱度范围内都保持了较高的稳定性.
贵金属催化剂是目前使用最多的甲醛制氢催化剂.贵金属催化剂中含有未被填满的d轨道, 表面易吸附反应物分子, 且吸附强度适中, 易于形成中间“活性化合物”, 因而具有较高的催化活性, 成为诸多领域重要的催化剂材料.以金催化剂为例, 当金催化剂被制备成纳米数量级的超细粉末后, 其比表面积显著增加, 该性质使得纳米金粒子催化剂与较大尺寸的金催化剂表现出不同的催化性能, 通常认为这与金粒子的表面特性、体积以及量子尺寸效应等因素密切相关.多相贵金属催化剂中贵金属以颗粒状高分散于载体上(可负载于金属氧化物或分子筛等载体表面), 这样催化剂可以结合两种材质的不同性质, 催化活性更好.
现阶段常用的催化HCHO产氢催化剂主要是Au、Pd、Ag、Rh等贵金属催化剂, 目前大量的研究工作致力于优化催化剂的结构, 探究催化剂的结构与催化活性之间的关系, 这些研究为室温条件下提高HCHO制氢的活性提供了理论指导. Bi等[80]利用多元醇法制备了具有不同形貌的金催化剂, 并以室温下催化HCHO制氢的反应为探针反应, 研究纳米Au催化剂的形貌对其催化活性的影响(如图 10).通过对比Au纳米片、Au纳米球、经NaBH4还原的纳米球催化产氢活性结果发现, 纳米Au催化剂催化甲醛产氢的活性强烈依赖于纳米Au的形貌和结构.在4种不同形貌的纳米Au催化剂中, Au纳米片具有最高的催化活性, 在32 min时, 催化剂的催化产氢速率可以达到145 mL·min-1·g-1.研究人员认为, Au纳米片高催化产氢活性是由于其特殊的片状结构和暴露较多的(111)面导致的.

|
图 10 不同形貌的纳米金的电镜图 Fig.10 Electron micrographs of nano-gold with different shapes |
此外, Pd基贵金属催化剂由于其尺寸和形貌可控, 高原子利用率, 高选择性以及优异的催化性能被广泛应用于催化转化的各个领域.众所周知, 对于Pd基贵金属催化剂而言, 形状、大小和形貌等会影响催化剂的表面配位数, 因而成为影响Pd基贵金属催化活性的关键因素.目前用于制备不同形貌的纳米Pd催化剂的方法有很多, Niu等[81]以醋酸钯为前驱体, 利用水热合成法在反应体系中加入油胺, 以甲醛作为还原剂, 控制反应温度为100 ℃来调控Pd催化剂的形貌, 通过改变油胺的用量可以制备包含四面体、八面体、二十面体等不同相貌的纳米Pd晶体.众多研究结果显示, Pd基催化剂在室温下催化甲醛产氢的反应中同样表现优异的活性, Hu等[82]制备了一种中空的纳米Pd管(图 11), 所制备的催化剂可以作为一种高效的产氢催化剂, 室温条件下即可催化甲醛水溶液产生氢气.相比较于其他的Pd催化剂, Pd纳米管显示出更高的催化活性及稳定性, 通过进一步优化反应温度、甲醛浓度、以及NaOH浓度等反应条件, 产氢的速率可以得到进一步的提高.此外, Pd纳米管除了可以催化甲醛产氢还可以催化乙醛、丙醛、苯甲醛等醛类产氢, 并且催化剂在这些反应中同样表现出高的催化活性.

|
图 11 Pd纳米管的透射电镜图 Fig.11 TEM image of Pd nanotubes |
在催化甲醛产氢的反应中, 贵金属催化剂由于其低丰度、价格昂贵等缺点限制了其大规模应用, 一些非贵金属催化剂由于其较好的催化活性和原料廉价易得等优点成为研究热点.在众多的非贵金属催化剂中, 铜是人类使用较早的非贵金属催化剂, 相比于传统的块状铜, 纳米级别的铜具有表面积大、量子尺寸效应、宏观量子隧道效应等优点[83].纳米铜催化剂应用广泛, 在催化加氢, 催化脱氢以及催化氢解等领域都有非常好的应用.其中利用纳米铜催化剂催化甲醛产氢是一种变废为宝的催化方案, 符合可持续发展的目标, 引起了很多研究人员的关注[84].
Bi等[85]发现纳米铜催化剂在催化甲醛产氢的反应中具有较高的活性和较好的循环稳定性, 当温度从0升高到60 ℃时, 氢在纳米铜催化剂表面的产氢速率可以从2.34增加到140 mL·min-1·g-1. Yi等[86]通过NaBH4还原的方法在Y2O3催化剂的表面负载了纳米铜催化剂, 研究结果表明在Y2O3催化剂载体的表面形成了一层Y(OH)3薄膜, 该物质在催化反应中起到了富集OH-1的作用(如图 12)所以催化剂在较低的碱浓度时即可以表现出比Cu催化剂更好的催化甲醛产氢的活性, 当NaOH的浓度为0.05 mol/L时, Cu/Y2O3的活性是纳米Cu催化剂的7.8倍.

|
图 12 Cu/Y2O3催化剂催化甲醛产氢的机理图 Fig.12 The catalytic mechanism of hydrogen production from formaldehyde over Cu/Y2O3 catalyst |
金属氧化物催化剂在催化甲醛产氢的反应中金属氧化物同样发挥着不同的作用. Chowdhury等[87]通过原位光沉积的方法将贵金属Pt负载在半导体TiO2表面制备了Pt/TiO2催化剂, 在催化反应中以甲醛做为牺牲试剂, 以Pt/TiO2为光催化剂催化甲醛制氢.研究结果表明在TiO2表面担载贵金属Pt助催化剂, 可以有效抑制电子/空穴复合过程, 体系的酸碱度, TiO2表面Pt的担载量, 催化剂浓度, 甲醛浓度等因素都会影响到产氢速率.并且与太阳光驱动的产氢效率(1.24%)相比, 紫外光驱动产氢的表观量子产率(QY)更高可以达到10.91%.
Du等[88]采用胶体沉积法制备了Pd/ZnO催化剂, 这种复合型的催化剂的使用, 不但可以降低贵金属Pd的用量, 还可以防止催化剂表面Pd纳米粒子的团聚.在Pd-ZnO催化剂中, 由于ZnO是一种可还原的载体, 并且Pd纳米粒子对氧气亲和力较高, 催化剂在经过高温煅烧后, 会在金属Pd的周围产生PdOx物种, 导致催化剂的表面能降低, 最终形成具有核壳结构的Pd@PdOx/ZnO纳米催化剂, 所制备的催化剂在催化甲醛制氢的反应中表现优异.密度泛函理论计算结果(如图 13)显示, 甲醛可以在Pd@PdOx/ZnO催化剂表面产生CH2(O-)2中间体, 该中间体随后解离成CO2和H, 水分子可以在ZnO载体表面解离成H和OH, 来自甲醛和水的两个H原子结合产生氢气, 从而实现甲醛溶液的高效产氢.

|
图 13 Pd@PdOx/ZnO催化剂表面甲醛产氢反应的能量变化的结构图及催化剂表面过渡态 Fig.13 The energy change diagrams of the formaldehyde hydrogen production reaction on the Pd@PdOx/ZnO catalyst surface, and the structural diagrams of several transition states on the catalyst surface |
就利用传统的热催化技术催化甲醛产氢的方案而言, 目前几乎所有催化甲醛制氢体系都需要在强碱性条件下进行, 但是碱性条件下, 甲醛容易发生坎尼扎罗反应影响产氢效率, 并且碱性溶液的后处理比较复杂, 容易造成二次污染.为了解决这一问题, 实现甲醛溶液在无碱介质中高效产氢, 研究人员也进行了广泛的研究探索, 研究结果显示金属氧化物催化剂恰好可以解决这一问题. Li等[89]利用MgO负载Ag纳米颗粒制备了一种室温条件下高效催化甲醛水溶液产氢的非均相催化剂, 该催化剂对反应条件的要求十分简单, 不需要强碱性环境, 对比与之前对产氢反应的研究, 由于O2和H2共存时会发生氢氧复合, O2的存在不利于产氢反应的进行, 但是在该反应体系中通过增加反应体系的氧分压产氢活性却可以显著提高, 当O2的压力为0.5 MPa时, 反应的转换频率最高.研究人员利用理论计算与实验探究相结合的方法, 首次成功解释了氧气的存在可以提高产氢活性的机理(如图 14).研究表明甲醛和水分子存在的条件下氧气可失去两个电子, 从而在催化剂的表面存在一种稳定的活性氧物种-MgO/Ag-·OOH, 该物种具有自由基的特性, 是催化甲醛和水分子产氢反应的活性中心.

|
图 14 Ag-MgO催化剂表面甲醛产氢反应的能量变化的结构图及催化剂表面过渡态 Fig.14 The energy change diagram of the formaldehyde hydrogen production reaction on the Ag-MgO catalyst surface, and the structural diagrams of several transition states on the catalyst surface |
能源是人类社会赖以生存和发展的基础.全球经济的快速发展和世界人口的增长使得能源的需求量不断增加.在众多能源类型中, 氢被认为是一种无碳环保的新能源载体.目前, 产生氢气的方法有很多, 利用甲醛产生氢气, 可在消除空气及工业废水中的甲醛的同时获得氢, 满足人们对提升能源利用效率和降低环境污染的双重需求.甲醛制氢催化剂的进一步改进可通过多种方式进行, 如通过合金化的方法, 降低贵金属催化剂用量的同时, 调控催化剂表面的反应活性位点, 提高金属基催化剂催化甲醛产氢的活性.事实上, 不同晶面的原子排布以及吸附位点的数目差异对甲醛分子、水分子以及氢原子的吸附能有重要影响, 因而暴露不同晶面的合金催化剂会表现出催化甲醛产氢的活性差异, 所以我们可以制备选择性暴露不同晶面的合金催化剂来提高其催化活性.另外, 催化剂表面微区荷电性质的变化也会使催化剂表现出不同的活性.通过表面预吸附高电负性的卤素离子调节催化剂的表面电荷性质, 并利用其高电负性和空间占位的特点提高催化剂活性.此外, 催化剂上更有效的电荷转移和分离, 可使光生电子的寿命得以延长, 使催化剂载体具有更高效电子传输能力,也是催化剂产氢活性进一步提高的重要方法.相信通过不断努力, 未来可见光催化甲醛制氢催化剂的活性会得到大幅提升.
致谢: 本文得到国家重点研发计划(No.2018YFB1502000)和国家自然科学基金(21433007, 21673262)资助.
| [1] |
Koopmans R, Duyvendak J W. The political construction of the nuclear energy issue and its impact on the mobilization of anti-nuclear movements in western europe[J]. Soc Prob, 1995, 42(2): 235–251.
DOI:10.2307/3096903 |
| [2] |
Cognola G, Gorbunova O, Sebastiani L, et al. Energy issue for a class of modified higher order gravity black hole solutions[J]. Phys Rev D, 2011, 84(2): 1–19.
|
| [3] |
Williams M C, Strakey J, Sudoval W, et al. Fossil energy fuel cells program[J]. J Power Sour, 2006, 159(2): 1241–1247.
|
| [4] |
Conforti P, Giampietro M. Fossil energy use in agriculture:an international comparison[J]. Agr Ecosyst & Environ, 1997, 65(3): 231–243.
|
| [5] |
Cicia G, Cembalo L, Giudice T D, et al. Fossil energy versus nuclear, wind, solar and agricultural biomass:insights from an Italian national survey[J]. Energy Policy, 2012, 42(3): 59–66.
|
| [6] |
Kamat P V. Meeting the clean energy demand:Nanostructure architectures for solar energy conversion[J]. J Phys Chem C, 2007, 111(7): 2834–2860.
DOI:10.1021/jp066952u |
| [7] |
Srirangan K, Akawi L, Moo-Young M, et al. Towards sustainable production of clean energy carriers from biomass resources[J]. Appl Energy, 2012, 100(2012): 172–186.
|
| [8] |
Liao H, Wei Y. A Study on the difference and inequality of world energy consumption and their changes[J]. Chin Soft Ence, 2010, 20(10): 6–14.
|
| [9] |
Wu T, Zhu G, Jha A K, et al. Hydrogen production with effluent from an anaerobic baffled reactor (ABR) using a single-chamber microbial electrolysis cell (MEC)[J]. Inter J Hydro Energy, 2013, 38(25): 11117–11123.
DOI:10.1016/j.ijhydene.2013.03.029 |
| [10] |
Midilli A, Ay M, Dincer I, et al. On hydrogen and hydrogen energy strategies:current status and needs[J]. Renew & Sust Energy Rev, 2007, 9(3): 255–271.
|
| [11] |
Bi Y, Lu G. Iodide ions control galvanic replacement growth of uniform rhodium nanotubes at room temperature[J]. Chem Commun, 2008, 47: 6402–6404.
|
| [12] |
Bi Y, Lu G. Morphology-controlled preparation of silver nanocrystals and their application in catalysis[J]. Chem Lett, 2008, 37(5): 514–515.
|
| [13] |
Lewis N S. Toward cost-effective solar energy use[J]. Science, 2007, 315(5813): 798–801.
DOI:10.1126/science.1137014 |
| [14] |
Li Z, Moreau L, Arking A. On solar energy disposition:A perspective from observation and modeling[J]. Bull Am Meteo Soc, 1997, 78(1): 53–70.
DOI:10.1175/1520-0477(1997)078<0053:OSEDAP>2.0.CO;2 |
| [15] |
Gust D, Moore T A, Moore A L. Mimicking photosynthetic solar energy transduction[J]. Account Chem Res, 2001, 34(1): 40–48.
DOI:10.1021/ar9801301 |
| [16] |
Chu Zhao-hua(储昭华). Application of electrolytic silver catalyst in formaldehyde production(电解银催化剂在甲醛生产中的应用)[J]. Middle Nitrogen Fertilizer Plant(中氮肥), 1999, 1999(6): 38–41.
|
| [17] |
Jin Hong(淦洪), Li Xiao-xiu(李晓秀), Zhou Ping(周萍), et al. Preparation conditions of electrolytic silver catalyst(电解银催化剂的制备工艺条件)[J]. Forestry Sci & Technol(林业科技), 2001, 26(3): 42–51.
|
| [18] |
Deng Jing-fa(邓景发). Discussion on some problems of electrolytic silver catalyst used in formaldehyde production(电解银催化剂用于甲醛生产的若干问题探讨)[J]. Petrochem Indus(石油化工), 1979, 8(7): 463–467.
|
| [19] |
Liu Zhen-hua(刘镇华). Engineering design of formaldehyde changing pumice silver to electrolytic silver catalyst(甲醛改浮石银为电解银催化剂工程设计)[J]. Hunan Chem Indus(湖南化工), 1987, 1987(3): 23–25.
|
| [20] |
Chen Chang-zhi(陈昌志), Ming Gang(明刚), Wen Dong(文东). The practical application of silver catalyst in formaldehyde production(银催化剂在甲醛生产中的实际应用)[J]. Guizhou Chem Indus(贵州化工), 2002, 27(1): 36–37.
DOI:10.3969/j.issn.1008-9411.2002.01.014 |
| [21] |
Deng Jing-fa(邓景发), Xiang Yi-fei(项一非), Ye Liang-yun(叶良云), et al. Catalytic oxidation of methanol on concentrated silver catalyst to produce concentrated formaldehyde(甲醇在电结晶银催化剂上催化氧化制浓甲醛)[J]. Chin J Catal(催化学报), 1983, 4(4): 266–271.
|
| [22] |
Li Su-yan(李速延), Feng Jian-li(封建利), Gao Chao(高超), et al. Study on iron-molybdenum catalyst for methanol oxidation to formaldehyde(甲醇氧化制甲醛铁钼催化剂研究)[J]. Indus Catal(工业催化), 2012, 20(8): 35–39.
DOI:10.3969/j.issn.1008-1143.2012.08.007 |
| [23] |
Wang Yan-ming(王彦明), Jiang De-shuang(姜德双). Comparison of silver catalyst method and iron-molybdenum catalyst method for producing formaldehyde(银催化剂法和铁钼催化剂法生产甲醛的比较)[J]. Small Nitrogen Fertilizer Plant(小氮肥), 2002, 2002(1): 7–8.
|
| [24] |
He Jin-wei(和进伟), Xu Liang-liang(徐亮亮), Guo Wei-ping(郭卫平). Research on the activity of catalysts for the oxidation of methanol to formaldehyde and iron-molybdenum(甲醇氧化制甲醛铁钼催化剂活性研究)[J]. Contemp Chem Indus(当代化工), 2014, 43(3): 457–459.
DOI:10.3969/j.issn.1671-0460.2014.03.046 |
| [25] |
Takagi K, Morikawa Y, Ikawa T. Catalytic activities of coppers in the various oxidation states for the dehydrogenation of methanol[J]. Chem Lett, 1985, 14(4): 527–530.
DOI:10.1246/cl.1985.527 |
| [26] |
Sodesawa T. Dynamic change in surface area of Cu in dehydrogenation of methanol over Cu-SiO2 catalyst prepared by ion exchange method[J]. React Kinet & Catal Lett, 1984, 24(3): 259–264.
|
| [27] |
Dong Y, Dai W L, Li J L, et al. Direct dehydrogenation of methanol to formaldehyde over novel Ag-containing ceramics[J]. Chem Lett, 2001, 30(6): 534–535.
DOI:10.1246/cl.2001.534 |
| [28] |
Schwab G M, Watson A M. A comparison of the flow and pulse technique for the dehydrogenation of methanol[J]. J Catal, 1965, 4(5): 570–576.
DOI:10.1016/0021-9517(65)90161-2 |
| [29] |
Meyer A, Renken A. Sodium compounds as catalysts for methanol dehydrogenation to water-free formaldehyde[J]. Chem Eng & Technol, 1990, 13(1): 145–149.
|
| [30] |
Su S, Zaza P, Renken A. Catalytic dehydrogenation of methanol to water-free formaldehyde[J]. Chem Eng & Technol, 1994, 17(1): 34–40.
|
| [31] |
Yasuyuki , Matsumura . Dehydrogenation of methanol to formaldehyde over silicalite[J]. J Catal, 1986, 100(2): 392–400.
|
| [32] |
Sagou M, Deguchi T, Nakamura S. Dehydrogenation of methanol to formaldehyde by ZnO-SiO2 and Zn2SiO4 catalysts[J]. Stu Surf Ence Catal, 1989, 44: 139–146.
DOI:10.1016/S0167-2991(09)61288-X |
| [33] |
Ren L P, Dai W L, Cao Y, et al. Novel highly active Ag-SiO2-MgO catalysts used for direct dehydrogenation of methanol to anhydrous formaldehyde[J]. Catal Lett, 2003, 85(1): 81–85.
|
| [34] |
Jiang Xiao-feng(姜晓峰), Yang Yang(杨洋), Chen Hong-lin(陈洪林). Preparation of Zn-Sr-SiO2 catalyst and its catalytic performance for the dehydrogenation of methanol to form anhydrous formaldehyde(催化剂Zn-Sr-SiO2的制备及其对甲醇脱氢制备无水甲醛的催化性能)[J]. Syn Chem(合成化学), 2019, 27(6): 465–469.
|
| [35] |
Holm M M, Reichl E H. Oxidation of methane to formaldehyde[R]. US: Office of Miliary Government for Germany, 1947.
|
| [36] |
Hashimoto Y, Muralidhar M, Koshizuka N, et al. Improvement in superconducting properties of air processed Ba2Cu3Oy with Ag2O addition[J]. Phys Proce, 2014, 58: 66–69.
DOI:10.1016/j.phpro.2014.09.017 |
| [37] |
Cullis C F, Keene D E, Trimm D L. Studies of the partial oxidation of methane over heterogeneous catalysts[J]. J Catal, 1970, 19(3): 378–385.
|
| [38] |
Mann R S, Dosi M K. Kinetics of vapor-phase oxidation of methyl alcohol on vanadium pentoxide-molybdenum trioxide catalyst[J]. J Catal, 1973, 28(2): 282–288.
|
| [39] |
Ohler N, Bell A T. Selective oxidation of methane over MoOx/SiO2:Isolation of the kinetics of reactions occurring in the gas phase and on the surfaces of SiO2 and MoOx[J]. J Catal, 2005, 231(1): 115–130.
|
| [40] |
Spencer N D. The effect of sodium on the MoO3-SiO2-catalyzed partial oxidation of methane[J]. J Catal, 1990, 126(2): 546–554.
|
| [41] |
Dobler J, Pritzsche M, Sauer J. Oxidation of methanol to formaldehyde on supported vanadium oxide catalysts compared to gas phase molecules[J]. J Am Chem Soc, 2005, 127(31): 10861–10868.
DOI:10.1021/ja051720e |
| [42] |
Zhao C, Wachs I E. Selective oxidation of propylene over model supported V2O5 catalysts:Influence of surface vanadia coverage and oxide support[J]. J Catal, 2008, 257(1): 181–189.
|
| [43] |
Anderson J R, Tsai P. ChemInform abstract:Methanol from oxidation of methane by nitrous oxide over Fe-ZSM-5 catalysts[J]. Cheminform, 1988, 19(11): 1435–1436.
|
| [44] |
Sojka Z, Herman R G, Klier K. Selective oxidation of methane to formaldehyde over doubly copper iron doped zinc oxide catalysts via a selectivity shift mechanism[J]. J Chem Soc Chem Commun, 1991, 3: 185–186.
|
| [45] |
Taiyuan chemical factory laboratory technology group (太原化工厂研究室工艺组). Preparation of industrial formaldehyde by using methanol by-product dimethyl ether(利用生产甲醇副产物二甲醚制取工业甲醛)[J]. Shanxi Chem Indus(山西化工), 1983, 1983(1): 8–13.
|
| [46] |
Lewis R M, Ryan R C. Conversion of di: Methyl ether to formaldehyde-using a bismuth, molybdenum, copper catalyst[P]. US: US4439624-A, 1984.
|
| [47] |
Michikazu , Hara , Miyuki . Thermal conversion of methoxy species on dimethyl ether adsorbed CeO2[J]. J Phys Chem B, 1996, 100(34): 14462–14467.
DOI:10.1021/jp960891q |
| [48] |
Ouyang F, Yao S. Infrared study of ZrO2 surface sites using adsorbed probe molecules. 2. dimethyl ether adsorption[J]. J Phys Chem B, 2000, 104(47): 11253–11257.
DOI:10.1021/jp002509m |
| [49] |
Liu H, Cheung P, Iglesia E. Effects of Al2O3 support modifications on MoOx and VOx catalysts for dimethyl ether oxidation to formaldehyde[J]. Phys Chem Chem Phys, 2003, 5(17): 3795–3800.
DOI:10.1039/b302776g |
| [50] |
Liu H, Cheung P, Iglesia E. Structure and support effects on the selective oxidation of dimethyl ether to formaldehyde catalyzed by MoOx domains[J]. J Catal, 2003, 217(1): 222–232.
|
| [51] |
Zhang Z, Zhang Q, Jia L, et al. Effects of tetrahedral molybdenum oxide species and MoOx domains on the selective oxidation of dimethyl ether under mild conditions[J]. Catal Sci & Technol, 2016, 6(9): 2975–2983.
|
| [52] |
Huang X, Liu J, Chen J, et al. Mechanistic study of selective oxidation of dimethyl ether to formaldehyde over alumina-supported molybdenum oxide catalyst[J]. Catal Lett, 2006, 108(1/2): 79–86.
|
| [53] |
Huang X, Li Y, Xu Y, et al. Kinetics of selective oxidation of dimethyl ether to formaldehyde over Al2O3-supported VOx and MoOx catalysts[J]. Catal Lett, 2004, 97(3/4): 185–190.
DOI:10.1023/B:CATL.0000038582.88770.c9 |
| [54] |
Zhang Z Z, Zhang Q D, Jia L Y, et al. Regulation of SBA-15, γ-Al2O3, ZSM-5 and MgO on molybdenum oxide and consequent effect on DME oxidation reaction[J]. Chem Select, 2016, 1(19): 6127–6135.
|
| [55] |
Benjamin Moore, Webster T A. Synthesis by sunlight in relationship to the origin of life. synthesis of formaldehyde from carbon dioxide and water by inorganic colloids acting as transformers of light energy[J]. Proce Royal Soc London, 1913, 87(593): 163–176.
|
| [56] |
Serono C, Marchetti E, Gagliardi L. Synthesis of formaldehyde by carbon dioxide and water in presence of metallic magnesium[J]. La Rassegna Di Clinica Terapia E Scienze Affini, 1951, 50(2): 61–64.
|
| [57] |
Salnikova E N, Khrushch A P, Khidekel M L. Reduction of carbon dioxide in aqueous media[J]. Bull Acad Sci Ussr Division Chem Sci, 1977, 26(3): 635–636.
DOI:10.1007/BF01179490 |
| [58] |
Aurian-Blajeni B, Halmann M, Manassen J. Photoreduction of carbon dioxide and water into formaldehyde and methanol on semiconductor materials[J]. Solar Energy, 1980, 25(2): 165–170.
|
| [59] |
Ulman M, Tinnemans A H A, Mackor A, et al. Photoreduction of carbon dioxide to frmic acid, formaldehyde, methanol, acetaldehyde and ethanol using aqueous suspensions of strontium titanate with transition metal additives[J]. Inter J Solar Energy, 1982, 1(3): 213–222.
|
| [60] |
Chiang Michael Y, Gambarotta Sandro, Van Bolhuis, et al. Dinuclear and diamagnetic zirconium(Ⅲ) derivatives without Zr-Zr bond. Synthesis and x-ray structure of[cp2Zr(H)(Cl)]n[J]. Organometallics, 1988, 7(8): 1864–1865.
DOI:10.1021/om00098a026 |
| [61] |
Corriu R J P, Moreau J J E, Praet H. (Ethynylhydrosilane)-cobalt carbonyl complexes. reactivity of the silicon-hydrogen bond.[J]. Cheminform, 1990, 21(42): 138–139.
|
| [62] |
Sebastien B, Vendier L, Sabo-Etienne S. Borane-mediated carbon dioxide reduction at ruthenium:formation of C1 and C2 compounds[J]. Angew Chem Inter Ed, 2012, 51(7): 1671–1674.
DOI:10.1002/anie.201107352 |
| [63] |
Lee D K, Kim D S, Kim S W. Selective formation of formaldehyde from carbon dioxide and hydrogen over PtCu/SiO2[J]. Appl Org Chem, 2001, 15(2): 148–150.
|
| [64] |
Zhu X F, Chen B, Yu J G, et al. Halogen poisoning effect of Pt-TiO2 for formaldehyde catalytic oxidation performance at room temperature[J]. Appl Surf Sci, 2016, 364(28): 808–814.
|
| [65] |
Bi Y, Lu G. Preparation and catalytic activity of two-dimensionally networked gold Nanowires[J]. Chem Lett, 2006, 35(8): 914–915.
DOI:10.1246/cl.2006.914 |
| [66] |
Bi Y, Lu G. Control growth of uniform platinum nanotubes and their catalytic properties for methanol electrooxidation[J]. Electrochem Commun, 2009, 11(1): 45–49.
|
| [67] |
Li S, Hu H, Bi Y, et al. Ultra-thin TiO2 nanosheets decorated with Pd quantum dots for high-efficiency hydrogen production from aldehyde solution[J]. J Mater Chem A, 2016, 4(3): 796–800.
DOI:10.1039/C5TA08720A |
| [68] |
Shan J, Lucci F R, Liu J, et al. Water co-catalyzed selective dehydrogenation of methanol to formaldehyde and hydrogen[J]. Surf Sci, 2016, 650(8): 121–129.
|
| [69] |
Mo J, Kang Z, Yang G, et al. Thin liquid-gas diffusion layers for high-efficiency hydrogen production from water splitting[J]. Appl Energy, 2016, 177: 817–822.
DOI:10.1016/j.apenergy.2016.05.154 |
| [70] |
Liu H X, Wang M, Ma J T, et al. Modulation of HCHO, H2O and H adsorption on AgPd cocatalyst by optimizing of selective exposed facet to enhancing the efficiency of conversion toxic formaldehyde into hydrogen driven by visible light[J]. J Catal, 2019, 375: 493–506.
DOI:10.1016/j.jcat.2019.06.003 |
| [71] |
He C H, Yang O B. Hydrogen evolution by photocatalytic decomposition of water under UV irradiation over K[Bi3PbTi5O16] perovskite:Effect of cerium species[J]. Indus & Eng Chem Res, 2003, 42(3): 419–425.
|
| [72] |
Huang Y, Wei Y, Fan L, et al. Photocatalytic activities of HLaNb2O7 prepared by polymerized complex method[J]. Inter J Hydro Energy, 2009, 34(13): 5318–5325.
DOI:10.1016/j.ijhydene.2009.04.040 |
| [73] |
Yu J G, Wang S H, Low J X, et al. Enhanced photocatalytic performance of direct Z-scheme g-C3N4-TiO2 photocatalysts for the decomposition of formaldehyde in air[J]. Phys Chem Chem Phys, 2013, 15(39): 16883–16890.
DOI:10.1039/c3cp53131g |
| [74] |
Li Y, Lu G, Li S. Photocatalytic production of hydrogen in single component and mixture systems of electron donors and monitoring adsorption of donors by in situ infrared spectroscopy[J]. Chemosphere, 2003, 52(5): 843–850.
DOI:10.1016/S0045-6535(03)00297-2 |
| [75] |
Swain C G, Powell A L, Sheppard W A, et al. Mechanism of the cannizzaro reaction[J]. J Am Chem Soc, 1979, 101(13): 3576–3583.
DOI:10.1021/ja00507a023 |
| [76] |
Ashby E C, Doctorovich F, Liotta C L, et al. Concerning the formation of hydrogen in nuclear waste. Quantitative generation of hydrogen via a Cannizzaro intermediate[J]. J Am Chem Soc, 1993, 115(3): 1171–1173.
DOI:10.1021/ja00056a065 |
| [77] |
Ling F, Anthony O C, Xiong Q, et al. PdO/LaCoO3 heterojunction photocatalysts for highly hydrogen production from formaldehyde aqueous solution under visible light[J]. Inter J Hydro Energy, 2016, 41(14): 6115–6122.
DOI:10.1016/j.ijhydene.2015.10.036 |
| [78] |
Dominic V D W, Heim L E, Gedig C, et al. Ruthenium catalyzed methylation of amines with paraformaldehyde in water under mild conditions[J]. Chem Suschem, 2016, 9(17): 2343–2347.
|
| [79] |
Heim L E, Konnerth H, Prechtl M H G. Future perspectives for formaldehyde:pathways for reductive synthesis and energy storage[J]. Green Chem, 2017, 19(10): 2347–2355.
DOI:10.1039/C6GC03093A |
| [80] |
Bi Y, Lu G. Morphological controlled synthesis and catalytic activities of gold nanocrystals[J]. Mater Lett, 2008, 62(17/18): 2696–2699.
|
| [81] |
Niu Z, Zhen Y R, Gong M, et al. Pd nanocrystals with single-, double-, and triple-cavities:Facile synthesis and tunable plasmonic properties[J]. Chem Sci, 2011, 2(12): 2392–2395.
DOI:10.1039/c1sc00449b |
| [82] |
Hu H, Jiao Z, Ye J, et al. Highly efficient hydrogen production from alkaline aldehyde solutions facilitated by palladium nanotubes[J]. Nano Energy, 2014, 8: 103–109.
DOI:10.1016/j.nanoen.2014.05.015 |
| [83] |
Matolin V, Sedlacek L, MatolInova I, et al. Photoemission spectroscopy study of Cu/CeO2 systems:Cu/CeO2 nanosized catalyst and CeO2(111)/Cu(111) inverse model catalyst[J]. J Phys Chem C, 2008, 112(10): 3751–3758.
DOI:10.1021/jp077739g |
| [84] |
Martinez-Suarez L, Frenzel J, Marx D, et al. Tuning the reactivity of a Cu/ZnO nanocatalyst via gas phase pressure[J]. Phys Rev Lett, 2013, 110(8): 1–5.
|
| [85] |
Bi Y, Lu G. Nano-Cu catalyze hydrogen production from formaldehyde solution at room temperature[J]. Inter J Hydro Energy, 2008, 33(9): 2225–2232.
DOI:10.1016/j.ijhydene.2008.02.064 |
| [86] |
Yi T, Li Y, Yuan X, et al. Effect of Y2O3 supporter on the catalytic hydrogen production from an aqueous formaldehyde solution catalyzed by metal Cu loaded on Y2O3[J]. Chem J Chin Univer, 2017, 38(10): 1841–1849.
|
| [87] |
Chowdhury P, Malekshoar G, Ray M B, et al. Sacrificial hydrogen generation from formaldehyde with Pt/TiO2 photocatalyst in solar radiation[J]. Indus & Eng Chem Res, 2013, 52(14): 5023–5029.
|
| [88] |
Du L, Qian K, Zhu X, et al. Interface engineering of palladium and zinc oxide nanorods with strong metal-support interactions for enhanced hydrogen production from base-free formaldehyde solution[J]. J Mater Chem A, 2019, 7(15): 8855–8864.
DOI:10.1039/C8TA12019F |
| [89] |
Li R, Zhu X, Yan X, et al. Oxygen-controlled hydrogen evolution reaction:Molecular oxygen promotes hydrogen production from formaldehyde solution using Ag/MgO nanocatalyst[J]. ACS Catal, 2017, 7(2): 1478–1484.
|
 2020, Vol. 34
2020, Vol. 34


