2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Science, Beijing 100049, China
手性吡咯是一类重要的五元含氮杂环化合物.众多有生物活性的天然产物中都含有手性吡咯的骨架[1].基于吡咯富电子的特点, 利用不对称有机小分子和过渡金属催化实现其2-位的不对称傅克反应是获得手性吡咯化合物最为常见的方法.我们根据催化剂的分类对近十几年来该领域的研究进展作简要评述.
1 手性有机小分子催化剂2007年, Antilla课题组[2]发展了一种高效合成手性吡咯化合物的方法.该方法利用手性膦酸为催化剂催化N酰化的亚胺和取代吡咯的反应.随着吡咯氮原子上取代基空间位阻的增大ee值会有显著的降低, 吡咯环上的取代基空间空间位阻的增大ee值会有显著的降低, 而亚胺的苯环上有供电子基时则有利于ee值的提高(Scheme 1).

|
图式 1 N-酰化亚胺和取代吡咯的不对称傅克反应 Scheme 1 Enantioselective F-C reaction of pyrrole derivatives with N-acyl imines |
随后, You课题组[3]以手性膦酸实现了a, b-烯烃硝基类化合物和4, 7-二氢吲哚的不对称傅克反应.他们发现通过注射泵缓慢地加入硝基烯烃类化合物, 催化剂用量可以从5%(摩尔分数)降低至0.5%(摩尔分数), 产物的ee值从80%提高至92%, 产物的收率没有降低(Scheme 2).

|
图式 2 手性磷酸催化的4, 7-二氢吲哚类化合物和硝基烯烃类化合物的不对称傅克反应 Scheme 2 Asymmetric F-C reaction of 4, 7-dihydroindoles with nitroolefinsby chiral phosphoric acid |
同年, Wang课题组[4]利用手性二胺为催化剂用于4, 7-二氢吲哚类化合物和a, b-不饱和酮类化合物的不对称傅克烷基化反应, 获得高达91%的产率和97%的对映选择性(Scheme 3).

|
图式 3 手性伯-仲二胺催化的4, 7-二氢吲哚类化合物和a, b-不饱和酮类化合物的不对称傅克烷基化反应 Scheme 3 Enantioselective F-C alkylation of 4, 7-dihydroindoles with enones |
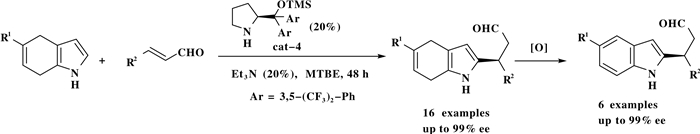
随后该课题组以手性二芳基脯氨醇硅醚为催化剂用于4, 7-二氢吲哚和α, β-不饱和醛的不对称傅克烷基化反应, 以高收率和高对映选择性合成了一系列2-取代的4, 7-二氢吲哚化合物.烷基化产物可以被对苯醌氧化成2-取代的吲哚化合物, 对映选择性没有变化(Scheme 4)[5].
|
图式 4 手性二芳基脯氨醇硅醚催化的4, 7-二氢吲哚化合物和α, β-不饱和醛的不对称傅克烷基化反应 Scheme 4 Asymmetric F-Calkylation of 4, 7-dihydroindoles with α, β-unsaturated aldehydes |
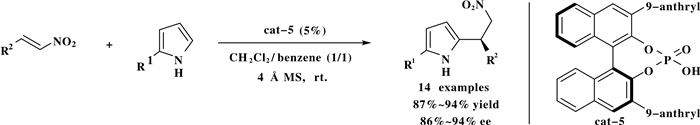
同年, You课题组[6]以手性膦酸为催化剂用于吡咯和硝基烯烃的不对称傅克烷基化反应.该方法在温和的条件下以高收率(87%~94%)和高对映选择性(86%~94%)合成了一系列2-取代或2, 5-二取代的手性吡咯化合物.作者发现吡咯氮原子上的活泼氢被取代时产物的ee值会急剧降低, 作者认为这是由于吡咯氮原子上的活泼氢被取代基取代后难以和催化剂形成氢键所致(Scheme 5).
|
图式 5 手性磷酸催化的吡咯衍生物和硝基烯烃的不对称傅克烷基化反应 Scheme 5 Chiral phosphoric acids-catalyzed asymmetric F-C alkylation of pyrroles with nitroolefins |
2011年, Antilla课题组[7]同样以手性膦酸为催化剂催化N-氨乙基吡咯类化合物和醛通过氮杂傅克反应合成了手性1, 2, 3, 4-四氢吡咯并[1, 2-a]吡嗪类化合物.反应中用到的N-氨乙基吡咯类化合物和醛都具有很好的普适性(Scheme 6).

|
图式 6 N-氨乙基吡咯类化合物和醛类化合物分子内的不对称氮杂傅克反应 Scheme 6 Asymmetric intramolecular aza-F-C reaction of N-aminoethylpyrroles with aldehydes |
Ma课题组[8]在2013年, 将手性膦酸用于吲哚和吡咯等富电子芳烃和环状N-酰化三氟甲基酮亚胺的氮杂傅克反应, 以最高收率98%和99%ee值得到了含有一个手性季碳中心的三氟甲基二氢喹唑啉类化合物(Scheme 7).

|
图式 7 三氟甲基亚胺类化合物和吲哚类化合物的不对称傅克反应 Scheme 7 Catalytic enantioselective F-C reaction of indoles with trifluoromethylimines |
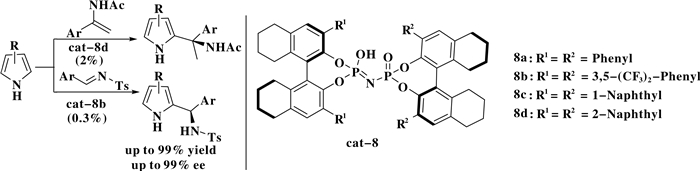
随后, Zhang课题组[9]以一类新颖的手性酰亚胺膦酸为催化剂催化吡咯与亚胺/烯胺的氮杂傅克反应, 合成了一系列含有季碳、叔碳手性中心的芳基-(2-吡咯)甲胺类化合物.该反应具有高收率(99%)、高ee值(99%)和催化剂用量低(0.3%(摩尔分数))的优点(Scheme 8).
|
图式 8 手性酰亚胺磷酸催化的不对称氮杂傅克反应 Scheme 8 Chiral imidodiphosphoric acids catalyzed enantioselective aza-F-C reactions |
同年, Yuan课题组[10]以手性二苯基脯氨醇硅醚和2-氟苯甲酸为催化剂催化3-吡咯-吲哚酮和α, β-不饱和醛的不对称Michael/F-C串联反应, 以高收率(93%)、高dr值(>99:1)和高ee值(97%)得到了一系列含有螺环的吲哚酮类化合物.随后利用对甲苯磺酸脱水合成了骨架多样化地螺环[5, 6-二氢吡啶[1, 2-a]吡咯-3, 3’-吲哚酮类衍生物(Scheme 9).

|
图式 9 3-吡咯-吲哚酮类化合物和α, β-不饱和醛的不对称Michael/F-C串联反应 Scheme 9 Asymmetric Michael/F-C Reaction of 3-pyrrolyl-oxindoles and α, β-unsaturated aldehydes |
2016年, Lin课题组[11]以螺环手性膦酸为催化剂实现了含有三氟甲基的苯并恶嗪酮和吡咯的氮杂傅克反应, 合成了一系列含有三氟甲基和手性季碳中心的二氢苯并恶嗪酮类化合物.该反应条件温和、催化剂用量低.理论计算表明底物和手性膦酸的三氢键模式是获得高收率和高ee值的关键, 同时反应中三氟甲基是形成三氢键的一个重要因素(Scheme 10).

|
图式 10 手性磷酸催化的三氟甲基苯并恶嗪酮和吡咯化合物的不对称氮杂傅克反应 Scheme 10 Asymmetric aza-F-C reaction of trifluoromethyl benzoxazinones with pyrroles |
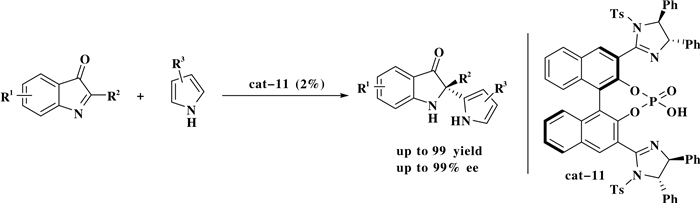
同年, Ohara课题组[12]以一种含有咪唑啉基团的新型手性膦酸为催化剂催化环状酮亚胺和吡咯的氮杂傅克反应, 合成了一系列含有手性季碳中心的吲哚啉-3-酮类化合物.该反应催化剂用量低(2%(摩尔分数)).该反应还可以扩大至克级规模, 催化剂回收后依然保持优秀的催化活性(Scheme 11).
|
图式 11 2-取代3H-吲哚-3-酮类化合物和吡咯类化合物的不对称氮杂傅克反应 Scheme 11 Enantioselective aza-F-C reaction of 2-substituted 3H-indol-3-one derivatives with pyrroles |
最近, Jiang课题组[13]以手性膦酰胺作为催化剂用于吡咯衍生物和a, b-不饱和酮的分子内环合反应, 在温和条件下以高收率(99%)和高对映选择性(93% ee)获得了一系列含有七元环和羰基的手性吡咯化合物(Scheme 12).
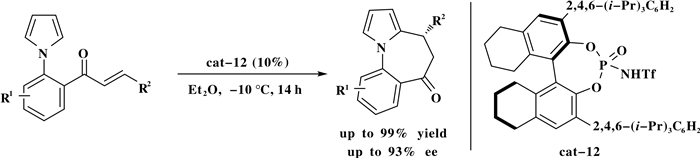
|
图式 12 手性布朗斯特酸催化的吡咯衍生物和α, β-不饱和酮的分子内环合反应 Scheme 12 Brønsted acid-catalyzed asymmetric ring-close of pyrroles with α, β-unsaturated ketones |
该课题组[14]同时实现了2-呋喃甲醇衍生物和(1H-吡咯-1-)苯胺衍生物的不对称串联环化反应.该方法高效地合成了一系列含有3个相连的手性中心的环戊[f]吡咯[1, 2-d][1, 4]-二氮杂酮衍生物(Scheme 13).
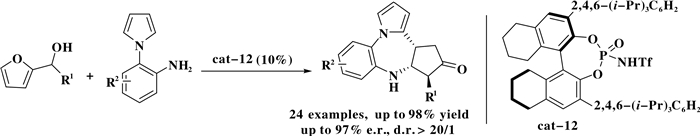
|
图式 13 手性布朗斯特酸催化的2-呋喃甲醇衍生物和(1H-吡咯-1-)苯胺衍生物的不对称串联环化反应 Scheme 13 Brønsted acid-catalyzed asymmetric cascade cyclization of 2-furylcarbinols with (1H-pyrrol-1-yl)anilines |
2006年, Evans课题组[15]以手性双-(噁唑啉)吡啶-三氟甲磺酸钪配合物为催化剂用于α, β-不饱和2-酰化咪唑类化合物和吡咯的不对称傅克反应.利用该方法通过3步实现了生物碱(+)-heliotridane的不对称合成(Scheme 14).
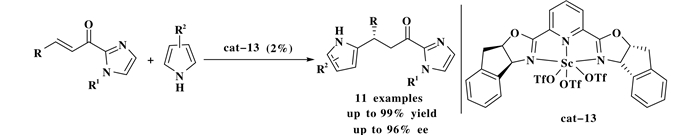
|
图式 14 手性双-(噁唑啉)吡啶-钪(Ⅲ)配合物催化α, β-不饱和2-酰化咪唑类化合物和吡咯的不对称加成反应 Scheme 14 Asymmetric additions of pyrroles to α, β-unsaturated 2-acyl imidazoles catalyzed by the bis(oxazolinyl) pyridine-scandium(Ⅲ) triflate complex |
Vila课题组[16]在2007年, 将手性Zr(Ⅳ)-BINOL配合物作为催化剂用于4, 7-二氢吲哚和a, b-不饱和羰基化合物的不对称傅克烷基化反应.随后紧接着用对苯醌氧化, 合成了一系列2-取代的吲哚类化合物, 产率和对映选择性中等(Scheme 15).

|
图式 15 Zr(Ⅳ)-BINOL配合物催化的4, 7-二氢吲哚和α, β-不饱和酮类化合物的不对称傅克烷基化反应 Scheme 15 Asymmetric F-C alkylation of 4, 7-dihydroindole with enones catalyzed by zirconium(Ⅳ)-BINOL |
随后, Trost课题组[17]以手性脯氨醇-酚双核锌配合物为催化剂用于氮原子上没有保护基的吡咯衍生物和硝基烯烃的不对称傅克烷基化反应, 合成了一系列单取代和双取代的手性吡咯衍生物(Scheme 16).

|
图式 16 双核锌催化的吡咯衍生物和硝基烯烃的不对称傅克烷基化反应 Scheme 16 Asymmetric F-C alkylation of pyrroles with nitroalkenes using a dinuclear zinc catalyst |
2009年, Arai课题组[18]以手性咪唑啉-氨基苯酚类配体和三氟甲磺酸亚铜为催化剂实现了a, b-烯烃硝基类化合物和吡咯的不对称傅克反应, 合成了含有硝基的手性吡咯化合物.实验结果表明配体苯酚环上引入硝基可以提高催化剂的活性和选择性(Scheme 17).
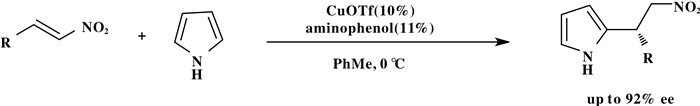
|
图式 17 手性咪唑啉-氨基苯酚类配体-三氟甲磺酸亚铜配合物催化的硝基烯烃类化合物和吡咯的不对称傅克反应 Scheme 17 Asymmetric F-C reaction of pyrrole and nitroalkenes byimidazoline-aminophenol-CuOTf complex |
同年, Vila课题组[19]以Zr(Ⅳ)/BINOL配合物为催化剂催化吡咯和2, 2, 2-三氟苯乙酮的不对称傅克烷基化反应, 合成了含有三氟甲基叔醇取代基的手性吡咯化合物(Scheme 18).
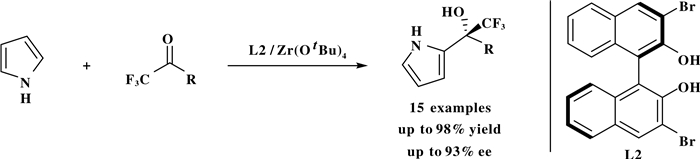
|
图式 18 Zr催化的吡咯和三氟苯乙酮类底物的不对称傅克烷基化反应 Scheme 18 Enantioselective zirconium-catalyzed F-C alkylation of pyrrole with trifluoromethyl ketones |
2010年, Singh课题组[20]以手性噁唑啉-锌配合物为催化剂用于2-烯酮取代的吡啶N-氧化物和吡咯的不对称傅克反应.该方法具有很广地底物适用性和很高地对映选择性, 即使是三取代的吡咯, ee值也可高达99%(Scheme 19).

|
图式 19 2-烯酮取代的吡啶N-氧化物和吡咯衍生物的不对称傅克反应 Scheme 19 Enantioselective F-C alkylation of pyrrole with 2-enoylpyridine N-oxides |
几乎同时, Shibata课题组[21]以锌/手性噁唑啉为催化剂用于b-三氟甲基丙烯酰胺和吡咯的不对称傅克反应.该方法以高收率(90%~99%)和高对映选择性(75%~99%ee)合成了一系列含有三氟甲基的手性吡咯化合物, 并可用于生物碱Heliotridane的三氟甲基化(Scheme 20).

|
图式 20 β-三氟甲基丙烯酰胺衍生物和吡咯衍生物的不对称傅克反应 Scheme 20 Asymmetric F-C reaction of β-trifluoromethylated acrylates with pyrroles |
Vila课题组[22]在2011年, 以Zr(Ⅳ)/BINOL催化吡咯和a-酮羧酸酯的不对称傅克反应, 合成了一系列含有手性季碳中心的叔醇吡咯类化合物.该反应可用于4, 7-二氢吲哚类化合物和a-酮羧酸酯类化合物合成2-取代的手性吲哚类化合物(Scheme 21).
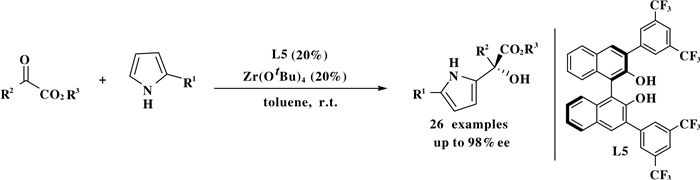
|
图式 21 Zr(Ⅳ)/BINOL催化剂催化的吡咯类化合物和α-酮羧酸酯类化合物的不对称傅克反应 Scheme 21 Asymmetric F-C alkylation of pyrroles with α-ketoesters by zirconium-(Ⅳ)/BINOL |
Jurczak课题组[23]在同一时间报道了以手性的BINOL-Ti(Ⅳ)配合物为催化剂催化吡咯和α-醛羧酸酯类化合物的不对称羟烷基化傅克反应, 以70%~96%的产率和77%~97%的ee合成了一系列含有手性醇的吡咯类化合物(Scheme 22).
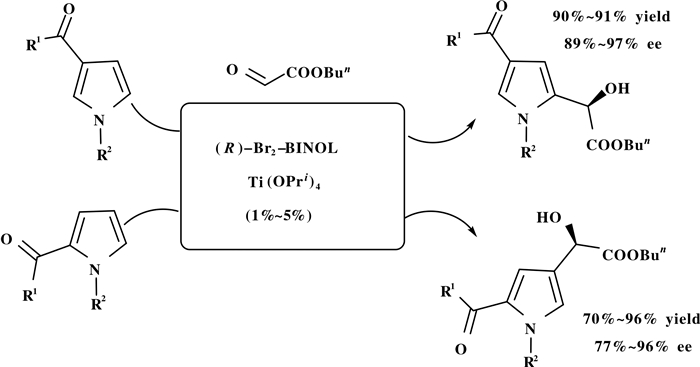
|
图式 22 手性BINOL-Ti(Ⅳ)配合物催化的酰化吡咯和乙醛羧酸酯的不对称傅克反应 Scheme 22 Enantioselective F-C reaction of acylpyrroles with glyoxylates catalyzed by BINOL-Ti(Ⅳ) |
同年, Franz课题组[24]以Indium(Ⅲ)-pybox配合物为催化剂催化吡咯类和靛红的不对称加成反应, 具有很好的区域选择性和对映选择性.靛红4位有取代基因增大空间位阻而导致反应收率降低很多, 但对映选择性没有降低(Scheme 23).
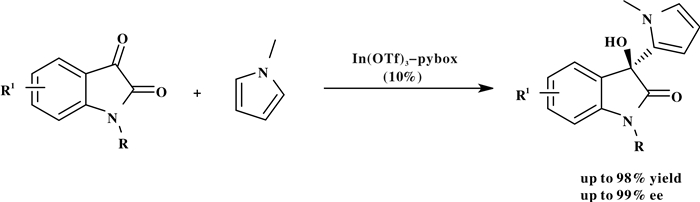
|
图式 23 Indium(Ⅲ)催化的吡咯类底物和靛红类底物的不对称加成反应 Scheme 23 Enantioselective and regioselective indium(Ⅲ)-catalyzed addition of pyrroles to isatins |
2014年, Wang课题组[25]以手性席夫碱/铜配合物为催化剂催化吡咯和靛红的不对称傅克反应, 温和的条件下以高收率和高对映选择性合成3-羟基-2-吲哚酮类化合物.六氟异丙醇作为添加剂可以显著地提高对映选择性.靛红N原子上没有保护基时, 反应的对映选择性会显著地降低, 作者通过缓慢释放底物的策略解决了这一问题(Scheme 24).

|
图式 24 Cu催化的吡咯和靛红类底物的不对称傅克烷基化反应 Scheme 24 Copper-catalyzed enantioselective F-C alkylation of pyrrole with isatins |
Chang课题组[26]在同一时间以一类新型的N, O-锌双核的手性配合物为催化剂用于吡咯和a, b-不饱和酮的不对称傅克烷基化反应.在温和条件下能高收率(99%)和高对映选择性(99%ee)合成了b-吡咯取代的二氢查耳酮衍生物(Scheme 25).

|
图式 25 双核锌催化的吡咯和查耳酮衍生物的不对称傅克烷基化反应 Scheme 25 Enantioselective F-C alkylation of pyrrole with chalcones catalyzed by a dinuclear zinc catalyst |
Wang课题组[27]在2015年, 以手性脯氨醇-酚铜络合物为催化剂用于吡咯和b, g-不饱和a-酮羧酸酯的不对称傅克反应.该方法以高收率和高对映选择性合成了一系列手性吡咯衍生物.他们利用铜和金的双金属催化高收率和高对映选择性地合成了一系列含有七元环的手性吡咯衍生物(Scheme 26).

|
图式 26 吡咯和b, g-不饱和a-酮羧酸酯的不对称傅克烷基化反应和串联环化反应 Scheme 26 Asymmetric F-C alkylation and sequential annulation of pyrrole wirh β, γ-unsaturated α-ketoesters |
同年, Liu课题组[28]设计了一种新颖地的芳甲叉双噁唑啉-铜配合物, 并将该配合物用于催化三氟甲基丙酮酸酯对吲哚的傅-克烷基化反应.合成了一系列含三氟甲基季碳手性醇的吲哚类化合物.反应的收率达到99%, 对映选择性达87% ee.吲哚环上取代基对反应活性和对映选择性有显著的影响.该反应提供了一种合成含手性三氟甲基季碳吲哚化合物的新方法(Scheme 27).

|
图式 27 三氟甲基丙酮酸酯与吲哚的傅-克烷基化反应研究 Scheme 27 Asymmetric catalytic F-C alkylation of indoles with trifluoromethyl pyruvate |
随后, Wang课题组[29]首次实现了吡咯和b, g-不饱和a-酮羧酸酯的1, 2加成.该反应以手性席夫碱铜金属配合物为催化剂通过吡咯的不对称傅克烷基化反应合成了一系列含有手性季碳中心的b, g-不饱和a-羟基羧酸酯类化合物.该反应具有良好的收率和对映选择性.吡咯氮原子上的活泼氢被取代时反应不发生, 作者认为活泼氢被取代后吡咯和催化剂间形成不了氢键才导致反应不进行(Scheme 28).
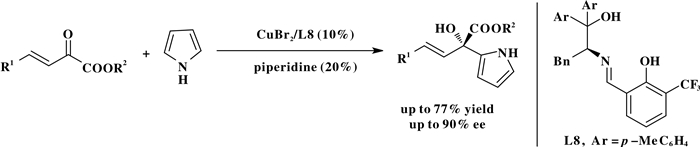
|
图式 28 吡咯和β, γ-不饱和α-酮羧酸酯的不对称傅克烷基化反应 Scheme 28 Asymmetric F-C alkylation of pyrrole and β, γ-unsaturated α-ketoesters |
Wang课题组[30]在2018年, 开发了一类来源于手性氨基酸含有三级胺的席夫碱配体.该类配体可以和CuBr2形成溶于水的的配合物形成了一种新的催化体系用于吡咯类化合物和硝基烯烃类化合物在水溶液中的不对称迈克尔加成.该反应还可以扩大至克级规模(Scheme 29).

|
图式 29 在水溶液中可溶性催化剂催化的吡咯类化合物和硝基烯烃类化合物的不对称迈克尔加成 Scheme 29 Asymmetric Michael addition of pyrroles with nitroalkenes by a water-soluble catalyst |
与此同时, Huang课题组[31]将分子内双核锌作为催化剂, 用于取代查耳酮和未保护吡咯的不对称F-C烷基化反应的研究.该方法在温和的条件下以优秀的产率(up to 99%)和优秀的对映选择性(up to 99% ee)合成了一系列β-吡咯二氢查尔酮化合物, 为该类手性化合物的研究提供了基础(Scheme 30).

|
图式 30 双锌催化剂催化的吡咯与查尔酮类化合物的不对称傅-克烷基化反应 Scheme 30 Asymmetric F-C alkylation of pyrrole with chalcones catalyzed by a dinuclear zinc catalyst |
近年来, 由于吡咯及其衍生物所特有的生物活性, 利用不对称傅克反应合成其手性化合物的研究发展迅速, 其合成方法在不断的创新和改进.选择合适的手性催化剂是不对称催化合成手性吡咯化合物中的一个挑战性任务.我们相信随着有机合成化学家们的不断努力, 催化活性更高、环境更友好的手性催化剂将被不断发现, 并应用于这一反应中.
| [1] |
Sugimoto K, Toyoshima K, Tokuyama H, et al. Protecting-group-free total synthesis of (-)-Rhazinilam and (-)-Rhazinicine using a gold-catalyzed cascade cyclization[J]. Angew Chem Int Ed, 2013, 52(28): 7168–7171.
DOI:10.1002/anie.201303067 |
| [2] |
Li G L, Rowland G B, Antilla J C, et al. Organocatalytic enantioselective Friedel-Crafts reaction ofpyrrole derivatives with imines[J]. Org Lett, 2007, 9(20): 4065–4068.
DOI:10.1021/ol701881j |
| [3] |
Sheng Y F, Li G Q, You S L, et al. Asymmetric Friedel-Crafts reaction of 4, 7-dihydroindoles with nitroolefins by chiral brønsted acids under low catalyst loading[J]. Chem Eur J, 2009, 15(14): 3351–3354.
DOI:10.1002/chem.200900033 |
| [4] |
Hong L, Sun W S, Wang R, et al. Enantioselective Friedel-Crafts alkylation of 4, 7-dihydroindoles with enones catalyzed by primary-secondary diamines[J]. Chem Eur J, 2009, 15(42): 11105–11108.
DOI:10.1002/chem.200901635 |
| [5] |
Hong L, Liu C X, Wang R, et al. Organocatalytic enantioselective Friedel-Crafts alkylation of 4, 7-dihydroindoles with α, β-unsaturated aldehydes:An easy access to 2-substituted indoles[J]. Org Lett, 2009, 11(10): 2177–2180.
DOI:10.1021/ol900461v |
| [6] |
Sheng Y F, Gu Q, You S L, et al. Chiral Bronsted acid-catalyzed asymmetric Friedel-Crafts alkylation of pyrroles with nitroolefins[J]. J Org Chem, 2009, 74(17): 6899–6901.
DOI:10.1021/jo9013029 |
| [7] |
He Y W, Lin M H, Antilla J C, et al. Direct synthesis of chiral1, 2, 3, 4-tetrahydropyrrolo[1, 2-a]pyrazines via a catalytic asymmetric intramolecular aza-Friedel-Crafts reaction[J]. Org Lett, 2011, 13(17): 4490–4493.
DOI:10.1021/ol2018328 |
| [8] |
Zhang K F, Nie J, Ma J A, et al. Chiral phosphoric acid-catalyzed asymmetric Aza-Friedel-Crafts reaction of indoles with cyclic n-Acylketimines:enantioselective synthesis of trifluoromethyldihydroquinazolines[J]. Adv Synth Catal, 2013, 355(17): 3497–3502.
DOI:10.1002/adsc.201300534 |
| [9] |
Wu K, Zhuo M H, Zhang S Q, et al. H8-BINOL chiral imidodiphosphoric acid catalyzed highly enantioselective aza-Friedel-Crafts reactions of pyrroles and enamides/imines[J]. Chem Commun, 2015, 51(38): 8054–8057.
DOI:10.1039/C5CC00685F |
| [10] |
You Y, Cui B D, Yuan W C, et al. Organocatalytic asymmetric Michael/Friedel-Crafts cascade reaction of 3-pyrrolyl-oxindoles and α, β-unsaturated aldehydes for the construction of chiral spiro[5, 6-dihydropyrido[1, 2-a]pyrrole-3, 3'-oxindoles][J]. J Org Chem, 2015, 80(11): 5951–5957.
DOI:10.1021/acs.joc.5b00597 |
| [11] |
Lou H Q, Wang Y T, Lin X F, et al. Organocatalytic asymmetric synthesis of dihydrobenzoxazinones bearing trifluoromethylated quaternary stereocenters[J]. J Org Chem, 2016, 81(5): 2019–2026.
DOI:10.1021/acs.joc.5b02848 |
| [12] |
Nakamura S, Matsuda N, Ohara M. Organocatalytic enantioselective aza-Friedel-Crafts reaction of cyclic ketimines with pyrroles using imidazolinephosphoric acid catalysts[J]. Chem Eur J, 2016, 22(28): 9478–9482.
DOI:10.1002/chem.201601573 |
| [13] |
Wei Z, Zhang J L, Jiang G X, et al. Brønsted acid-catalyzed asymmetric ring-closingalkylation of inert N-substituted pyrroles with α, β-unsaturated ketones[J]. Adv Synth Catal, 2019, 361(16): 3694–3697.
DOI:10.1002/adsc.201900546 |
| [14] |
Wei Z, Zhang J L, Jiang G X, et al. Catalytic asymmetric cascade cyclization for constructing three contiguous stereocenters in pyrrolobenzodiazepine-based cyclopentanones[J]. Org Lett, 2019, 21(8): 2790–2794.
DOI:10.1021/acs.orglett.9b00749 |
| [15] |
Evans D A, Fandrick K R. Catalytic enantioselective pyrrole alkylations of α, β-unsaturated 2-acyl imidazoles[J]. Org Lett, 2006, 8(11): 2249–2252.
DOI:10.1021/ol060576e |
| [16] |
Blay G, Fernandez I, Vila C, et al. Catalytic enantioselective Friedel-Crafts alkylation at the 2-position of indole with simple enones[J]. Tetrahedron Letters, 2007, 48(38): 6731–6734.
DOI:10.1016/j.tetlet.2007.07.090 |
| [17] |
Trost B M, Muller C. Asymmetric Friedel-Crafts alkylation of pyrroles with nitroalkenes using a dinuclear zinc catalyst[J]. J Am Chem Soc, 2008, 130(8): 2438–2439.
DOI:10.1021/ja711080y |
| [18] |
Yokoyama N, Arai T. Asymmetric Friedel-Crafts reaction of N-heterocycles and nitroalkenes catalyzed by imidazoline-aminophenol-Cu complex[J]. Chem Commun, 2009, 22: 3285–3287.
|
| [19] |
Blay G, Fernandez I, Vila C, et al. Enantioselective zirconium-catalyzed Friedel-Crafts alkylation of pyrrole with trifluoromethyl ketones[J]. Org Lett, 2009, 11(2): 441–444.
DOI:10.1021/ol802509m |
| [20] |
Singh P K, Singh V K. Enantioselective Friedel-Crafts alkylation of pyrroles catalyzed by PYBOX-DIPH-Zn(Ⅱ) complexes[J]. Org Lett, 2010, 12(1): 80–83.
DOI:10.1021/ol902360b |
| [21] |
Huang Y Y, Tokunaga E, Shibata N, et al. Enantioselective Friedel-Crafts reaction ofb-trifluoromethylated acrylates with pyrroles and its application to the synthesis of trifluorinated heliotridane[J]. Org Lett, 2010, 12(5): 1136–1138.
DOI:10.1021/ol100171z |
| [22] |
Blay G, Fernandez I, Vila C, et al. Enantioselective synthesis of tertiary alcohols through a zirconium-catalyzed Friedel-Crafts alkylation of pyrroles with g-ketoesters[J]. J Org Chem, 2011, 76(15): 6286–6294.
DOI:10.1021/jo2010704 |
| [23] |
Majer J, Kwiatkowski P, Jurczak J. Enantioselective Friedel-Crafts reaction of acylpyrroles with glyoxylates catalyzed by BINOL-Ti(Ⅳ) complexes[J]. Org Lett, 2011, 13(22): 5944–5947.
DOI:10.1021/ol202244u |
| [24] |
Gutierrez E G, Wong C J, Franz A K, et al. Enantioselective and regioselectiveindium(Ⅲ)-catalyzed addition of pyrroles to isatins[J]. Org Lett, 2011, 13(21): 5754–5757.
DOI:10.1021/ol202329s |
| [25] |
Li C, Guo F F, Wang Z Y, et al. Copper-catalyzed enantioselective Friedel-Crafts alkylation of pyrrole with isatins[J]. Org Lett, 2014, 16(12): 3192–3195.
DOI:10.1021/ol501086q |
| [26] |
Hua Y Z, Han X W, Chang J B, et al. Enantioselective Friedel-Crafts alkylation of pyrrole with chalcones catalyzed by a dinuclear zinc catalyst[J]. J Org Chem, 2014, 79(23): 11690–11699.
DOI:10.1021/jo5023712 |
| [27] |
Hu Y B, Li Y N, Wang Z Y, et al. Copper catalyzed enantioselective alkylation of pyrrole with β, γ-unsaturated α-ketoesters:application to one-pot construction of the seven-membered ring by merging a gold catalysis[J]. Org Lett, 2015, 17(16): 4018–4021.
DOI:10.1021/acs.orglett.5b01917 |
| [28] |
Yin Bo-han(殷伯翰), Fu Bin(傅滨), Liu Ji-ping(刘吉平), et al. Studies on the asymmetric catalytic Friedel-Crafts alkylation ofindoles with trifluoromethyl pyruvate catalyzed byheteroarylidene-BOX-Cu complexes(芳甲叉双噁唑啉-铜络合物催化三氟甲基丙酮酸酯与吲哚的傅-克烷基化反应研究)[J]. Chin J Org Chem(有机化学), 2015, 35(10): 2119–2124.
|
| [29] |
Sun J A, Hu Y B, Wang Z Y, et al. Copper-catalyzed chemoselective and enantioselective Friedel-Crafts 1, 2-addition of pyrrole with β, γ-unsaturated α-ketoesters[J]. J Org Chem, 2017, 82(10): 5102–5110.
DOI:10.1021/acs.joc.7b00159 |
| [30] |
Gui Y, Li Y N, Wang Z Y, et al. Enantioselective Michael addition of pyrroles with nitroalkenes in aqueous media catalyzed by a water-soluble catalyst[J]. J Org Chem, 2018, 83(14): 7491–7499.
DOI:10.1021/acs.joc.8b01141 |
| [31] |
Hua Yuan-zhao(华远照), Han Xing-wang(韩兴旺), Huang Li-hua(黄利华), et al. Asymmetric Friedel-Crafts alkylation of pyrrole with chalcones catalyzed by a dinuclear zinc catalyst(双锌催化剂催化的吡咯与查尔酮类化合物的不对称傅-克烷基化反应)[J]. Chin J Org Chem(有机化学), 2018, 38(1): 237–245.
|
 2020, Vol. 34
2020, Vol. 34


