2. EMS能源研究所 PSU-DUT联合能源研究中心 美国宾夕法尼亚州立大学, 宾州 16802, 美国
2. EMS Energy Institute, PSU-DUT Joint Center for Energy Research, The Pennsylvania State University, University Park, PA 16802, USA
两个世纪以来, 化石燃料包括煤炭、石油和天然气的利用所带来的工业发展成果对全球经济飞速增长和社会高速发展起着举足轻重的作用[1-2].但凡事都有正反两面, 人类社会在享受其带来繁荣的同时, 也面临着它所带来的危机和挑战.人类活动引起的温室气体尤其是CO2的大量排放所导致的温室效应使得全球生态环境逐渐恶化, 包括冰川融化、海平面上升、气候带北移等.值得注意的是, CO2并非一无是处, 它完全可以被看作是一种丰富的碳源, 为生产含碳增值产品和原料提供了一种替代选择[3-5].从长远的角度看, 通过化学方法将CO2加氢制取高附加值的化工产品具有重大意义[6].
与费托合成(FTS)相似, CO2加氢转化中低碳烃类的生成也是通过C—C键的形成来实现; 但是采用传统的FTS催化剂(包括Fe和Co), CO2加氢反应得到的烃类选择性较低[7-12].同时与Co基催化剂相比, Fe基催化剂除了价格优势以外, 还在逆水煤气变换反应(RWGS)上有着更高的活性[13].虽然Fe催化剂具有良好的CO2加氢性能, 但单一的Fe催化剂在选择性和活性方面远远不能满足反应要求[8, 14-16].因此众多科研工作者都认为Fe基催化剂在将CO2和H2转化为烃类这一方面有巨大的潜力, 并且已经做了大量的努力和尝试, 包括寻找合适的载体, 添加助催化剂和第二种活性组分.
Song等[17-21]在近年来的研究中发现, 在Fe基催化剂中添加少量的第二活性金属组分, 主要包括Co、Ni、Cu和Pd, 再加入K助催化剂的结构导向作用, 使得CO2的转化率和烃类产量得到了显著的提升.值得一提的是, 甲烷和C2及以上烃类在产物中的分布比例随着Fe基催化剂中第二活性金属组分添加量的改变而变化[20].在测试Fe、Ni、Cu和Pd的单一金属催化剂时, 只有Fe催化剂上的产物中存在C2及以上烃类[17, 19, 22].然而当Fe-M(M = Co, Ni, Cu和Pd)双金属催化剂中第二金属组分的添加量达到合适值时, 不论是CO2的转化率和C2+烃类都得到了显著的提升.其中尤为引人注目的是, 在催化性能类似的催化剂中Fe-Ni双金属催化剂中Ni的最佳添加量是最小的[23].
为了在分子层面上揭示镍的引入对铁基催化剂上二氧化碳加氢反应的影响, 我们通过系统的密度泛函理论(DFT)计算分别研究了单金属Fe(110)和Ni-Fe(110)表面上反应物的吸附、优势中间体以及表面上生成C1和C2烃类的反应途径.
1 计算方法和模型 1.1 计算方法自旋极化的密度泛函理论(DFT)计算在VASP(Vienna Ab-initio Simulation Package)计算程序上进行.计算得到的Fe催化剂的磁矩是2.2 μB, 与实验值相近.结合投影缀加波(PAW)[24], 用广义梯度近似(GGA)和Perdew-Burke-Ernzerhof(PBE)赝势[25]计算交换-相关能.在计算过程中, 平面波基组的截断能设定为400 eV.电子自洽相互作用能量和所有原子受力的收敛标准分别为10-5 eV和0.03 eV/Å.同时Monkhorst-Pack体系中的k-points设置为3×3×1.为避免z轴方向上重复周期表面的互相影响, 一个15 Å的真空层被构建于表面上方.在搜索过渡态时, 采用了CI-NEB(Climbing Image Nudged Elastic Band)方法, 并对所有过渡态的虚频和振动方向都进行了检验.
1.2 计算模型根据之前的文献报道, Fe(110)表面不仅具有更低的表面能, 而且在典型的CO2加氢反应条件下也更容易暴露[26-27].因此我们构建了p(3×3), 且包含4个原子层的Fe(110)表面, 用其模拟Fe表面在CO2加氢反应中的活性组分[23, 26-29]. Nørskov等人计算了过渡金属的完美表面在混杂其他过渡金属后表面的分离能, 结果表明在Fe金属中加入Pd、Ni或Co时, 分离能较低.这说明当Fe金属表面掺杂Pd、Ni或Co时, 这3种金属倾向于占据Fe金属表面的表层位置, 而非内层位置.因此, 我们采取用一个Ni原子取代Fe(110)表面一个Fe原子的方式来表示Ni-Fe双金属催化剂, 该表面标记为Ni-Fe(110).
在实验中只有当催化剂中的Ni负载量较低(即原子比例为Ni/(Ni+Fe) = 0.03)时才能够获得最佳C2+烃类选择性.因此, 我们只考虑了Ni含量较低的情况[17].在表面计算中, 最下方两个原子层中的原子都被固定于它们在平衡体结构中的初始位置上, 同时最上面的两个原子层和吸附物均被放开, 进行结构优化.被吸附物在表面上的吸附能(Eads)通过公式Eads = Eadsorbate-catalyst - Ecatalyst- Eadsorbate进行计算, 其中Eadsorbate-catalyst代表催化剂表面和被吸附物种的总能量, Ecatalyst表示催化剂表面的能量, Eadsorbate表示被吸附物在气相中的能量. Eads的值越负, 说明表面与被吸附物之间的相互作用越强.基元反应的活化能(Eact)由Eact = ETS - Ereactant定义, 其中ETS代表过渡态的能量, Ereactant代表相关反应物吸附态的能量.反应热(Erxn)由Erxn = Eproduct- Ereactant定义, 其中Eproduct代表产物吸附于催化剂表面的能量.
2 结果与讨论 2.1 CO2加氢反应中生成C1物种的反应机理 2.1.1 Fe(110)我们之前的工作已考虑了晶面对Fe催化剂上CO2分子吸附和加氢行为的影响, 发现CO2分子在Fe(110)表面上, 易于解离生成CO*+O*, 而不是加氢生成COOH*中间体或HCOO*中间体[26].而且, CO2加氢生成COOH*这一基元反应的能垒约1.2 eV与加氢生成HCOO*的能垒(约0.5 eV)相比[26], 在动力学上是十分困难的.因此, CO*和HCOO*可能是Fe(110)表面上CO2加氢的关键中间体.我们对CO2经由“CO*”和“HCOO*”中间体生成C1物种所有可能路径下的全部基元反应都进行了全面研究, 反应能线图如图 1所示, 其中所涉及基元反应的过渡态构型如图 2所示, 活化能垒与反应热如表 1所示.

|
图 1 Fe(110)表面上, CO2经由“CO*”和“HCOO*”中间体转化为C1物种的反应能线图 Fig.1 Energy profiles of CO2 conversion to C1 species via the "CO*" and "HCOO*" pathways on pure Fe(110) surface |
|
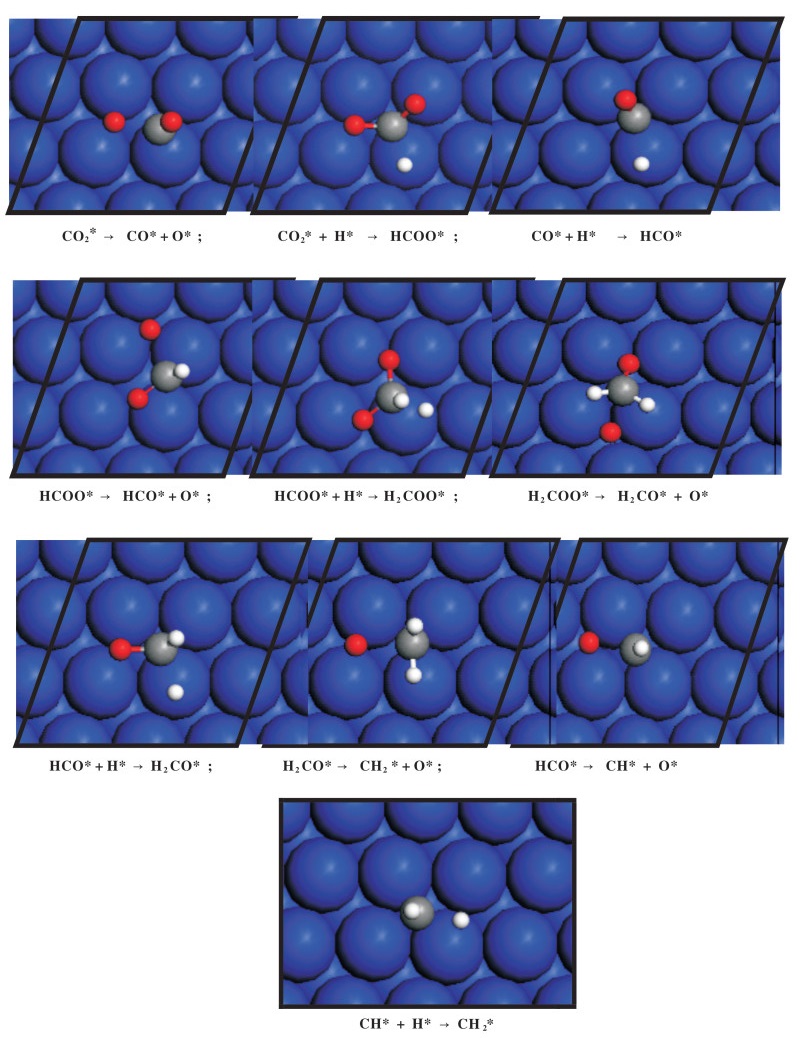
图 2 Fe(110)表面上由CO2转化生成C1物种反应路径上所有可能基元反应的相关过渡态结构 Fig.2 Optimized structures of transition states associated with all possible elementary steps examined in reaction pathways for C1 species formation from CO2 conversion on the Fe(110) surface (蓝色:铁, 灰色:碳, 红色:氧, 白色:氢) (blue = iron, gray = carbon, red = oxygen, white = hydrogen) |
| 表 1 Fe(110)表面上CO2经由“CO*”和“HCOO*”中间体转化为C1物种路径上所考察基元反应的反应能(Erxn)和活化能垒(Eact). Table 1 Reaction energy (Erxn) and activation barrier (Eact) associated with all elementary steps examined of CO2 conversion to C1 species via the "CO*" and "HCOO*" pathways on pure Fe(110) surface |
在“CO*”路径中, CO2解离形成CO*的能垒只有0.28 eV, 且该反应为放热反应, 反应热为-1.42 eV, 这表明该反应极易发生. CO*之后可以克服一个0.73 eV的能垒加氢生成HCO*中间体, 同时该反应为吸热反应, 反应热为0.67 eV. CO*通过加氢生成COH*则极为困难, 因为该反应的能垒为1.95 eV.同时CO*解离为C* + O*也需要克服一个1.74 eV的高能垒.因此, HCO*是CO*加氢的优势中间体.随后HCO*可以解离为CH* + O*, 该反应的能垒只有0.47 eV, 而且这一反应为强放热反应, 反应热为-1.29 eV.接下来, CH*可以克服一个0.74 eV的能垒, 通过继续加氢形成CH2*物种, 同时这一吸热反应的反应热为0.66 eV.在这一路径上, 我们还考察了HCO*加氢生成H2CO*物种, 但该反应具有相对更高的能垒(0.67 eV vs. 0.47 eV), 也是吸热反应, 反应热为0.46 eV. HCO*中的氧原子若要加氢生成HCOH*需克服一个1.66 eV的能垒, 所以不必考虑这一路径.因此, CO2经由“CO*”中间体生成C1物种的一个可能路径为CO2*→CO*→HCO*→CH*→CH2*.
在“HCOO*”路径上, HCOO*可以克服一个0.93 eV的能垒加氢生成H2COO*中间体, 反应热为0.31 eV. HCOO*也可以克服一个1.69 eV的能垒加氢生成HCOOH*物种, 反应热为1.41 eV, 因此难以发生.相比之下, HCOO*解离为HCO*和O*在热力学和动力学上则更为有利, 该反应的能垒和反应热分别为0.75和-0.73 eV.在生成了HCO*中间体之后, “CO*”路径和“HCOO*”路径相重叠, 将会按照同样的路径由HCO*解离生成CH*, 再由CH*加氢生成CH2*物种.因此Fe(110)表面上CO2转化为C1物种的可能路径分别为CO2* → CO* → HCO* → CH* → CH2*和CO2* → HCOO* → HCO* → CH* → CH2*.由于CH2*物种在Fe(110)表面上并不稳定, 其解离为CH*+H*的能垒仅为0.08 eV, 所以CH*物种被认为是最重要的C1单体.
2.1.2 Ni-Fe(110)在Ni-Fe(110)表面上, 通过对相同框架内所有相关基元反应步骤的计算和平行对比, CO2转化为关键C1物种可能经历反应路径如图 3所示, 所涉及基元反应的反应能垒及反应热别和过渡态构型如表 2和图 4所示.为考察镍的影响, 被吸附物均被放置在引入镍原子后稳定的活性位点上.考虑到Fe(110)表面上形成C*, COH*和HCOOH*物种所需克服的能垒过高, 在Ni-Fe(110)表面上, 只计算了主要反应路径上所有可能的基元反应.结果表明, 在将Ni原子引入Fe(110)表面后, 虽然基元反应的能垒有所变化, 但从能量上看, CO2转化中的C1关键物种在Ni-Fe(110)表面上依然由CO2* → CO* → HCO* → CH* → CH2*和CO2* → HCOO* → HCO* → CH* → CH2*两个路径生成.与此同时, CH*物种依旧是有利的C1单体, 尽管在Ni-Fe(110)表面上CH2*物种解离为CH*和H*的能垒从0.08升高至0.15 eV, 但CH2*物种在表面上依旧不稳定, 易于分解成CH*再进行后续转化.从Fe(110)表面和Ni-Fe(110)表面上CO2*转化为CH*的整个过程来看, “HCOO*”路径的有效能垒分别为0.73和0.77 eV, “CO*”路径的有效能垒分别为0.73和1.03 eV.这表明Ni的引入对CO2加氢生成关键C1物种, 即CH*物种, 并无显著影响, 尤其是“HCOO*”路径.同时, 反应的最优能量路径和关键物种表面覆盖度对反应路径和动力学的影响还需在未来的研究中通过微动力学模型计算等来进一步确认.

|
图 3 Ni-Fe(110)表面上, CO2经由“CO*”和“HCOO*”中间体转化为C1物种的能线图 Fig.3 Energy profiles of CO2 conversion to C1 species via the "CO*" and "HCOO*" pathways on the Ni-Fe(110) surface |
| 表 2 Ni-Fe(110)表面上CO2经由“CO*”和“HCOO*”中间体转化为C1物种路径上所考察基元反应的反应能(Erxn)和活化能垒(Eact) Table 2 Reaction energy (Erxn) and activation barrier (Eact) associated with all elementary steps examined of CO2 conversion to C1 species via the "CO*" and "HCOO*" pathways on Ni-Fe(110) surface |

|
图 4 在Ni-Fe(110)表面上由CO2转化生成C1物种反应路径上关键基元反应的相关过渡态结构 Fig.4 Optimized structures of transition states associated with key elementary steps examined in reaction pathways for C1 species formation from CO2 conversion on the Ni-Fe(110) surface (蓝色:铁, 橙色:镍, 灰色:碳, 红色:氧, 白色:氢) (blue = iron, orange = nickel, gray = carbon, red = oxygen, white = hydrogen) |
作为在单一Fe金属催化剂和Ni-Fe双金属催化剂表面上的主要产物之一, 我们对两个表面上CH4的生成进行了研究. CH*和CH2*加氢在Fe(110)表面上的能垒分别为0.74和0.77 eV; 在Ni-Fe(110)表面上两步反应的能垒分别为0.69和0.62 eV, 均较为适中.而CH3*加氢生成CH4在两个表面上需要分别克服一个1.25和1.18 eV的能垒, 表明CH3*加氢生成CH4速率较慢.与Fe(110)表面相比, Ni-Fe(110)表面上由于从CH*到CH4加氢所经历的三步基元反应的能垒都表现出轻微的降低, 这说明在Ni-Fe(110)表面上CH4的生成速率也会有略微升高.此外, CH*物种除了可以通过一系列加氢反应生成CH4外, 还可通过C—C耦合反应形成C—C键, 故也被认为是生成C2烃类的关键C1物种.因此, CH*物种在C—C耦合反应和加氢反应两方面的活性差异即可用来评价催化剂对CH4和C2+烃类两种产物选择性的相对差异.
2.2 C2物种中C—C耦合和C—H键的形成机理根据之前的文献报道[28, 30-33], Fe基催化剂上的碳链增长机理中, CO*物种的双聚反应和插入反应与CHx*物种间的耦合反应相比是不利的, 因此我们只考虑了3种C1单体, 包括CH*, CH2*和CH3*, 这些物种的C—C耦合在Fe(110)表面和Ni-Fe(110)表面上所有基元反应的过渡态结构如图 5所示.

|
图 5 Fe(110)和Ni-Fe(110)表面上形成C2物种的C—C耦合基元反应中过渡态的结构 Fig.5 Optimized structures of transition states associated with individual elementary steps for C—C coupling in the formation of C2 species on Fe(110) and Ni-Fe(110) surface (蓝色:铁, 橙色:镍, 灰色:碳, 白色:氢) (blue = iron, orange = nickel, gray = carbon, red = oxygen, white = hydrogen) |
在Fe(110)表面上, CH*和CH2*物种通常稳定在4-fold hollow位点, CH3*物种从能量上看, 更偏向于吸附在3-fold hollow位点.在CH* + CH*, CH* + CH2*, 和CH2* + CH2* 3个基元反应的初始态中, 所有的单体都分别被放置在相邻的两个4-fold hollow位点上.在CH* + CH*和CH* + CH2*这两个耦合反应的过渡态中, CH*物种会停留在它原来的4-fold hollow位点上, 同时CH2*物种会向bridge位点移动.当CH2*与另一个CH2*反应时, 其中一个也会停留在最初的4-fold hollow位点上, 而另一个移向bridge位点进而形成C—C键.当CH3*与CH*或CH2*反应时, 过渡态结构显示出CH3*物种会向top位点迁移, 与此同时, CH*或CH2*物种停留在4-fold hollow位点上.在CH3*物种相互耦合的反应中, 反应物从最初的3-fold hollow位相互靠近并通过旋转调整出适当的角度进而形成C—C键, 如图 5所示. Fe(110)表面上C2形成涉及的所有可能C—C耦合反应的反应热(Erxn), 能垒(Eact)及C—C原子间距(dC—C)均在表 3中列出.
| 表 3 Fe(110)表面和Ni-Fe(110)表面上C—C耦合反应, CHx*及C2Hx*物种加氢反应的反应热(Erxn), 活化能(Eact)和对应过渡态构型中的碳原子间或碳氢原子间距离(dC—C/dC—H) Table 3 Reaction energies (Erxn), activation barriers (Eact) and C—C distances (dC—C) or C—H distances (dC—H) of the transition states associated with all C—C coupling reactions, CHx* and C2Hx* species hydrogenation reactions on Fe(110) and Ni-Fe(110) surfaces |
在Fe(110)表面上除CH2*物种间的耦合反应外, 所有的耦合反应都是吸热的. CH*物种与CH*、CH2*和CH3*发生耦合反应所需要克服的能垒分别为0.83、0.96和1.57 eV, 同时两个CH*互相耦合的反应热是相对较低的.对于CH2*物种, 它与CH2*和CH3*发生耦合反应的活化能垒分别为0.83和1.38 eV, 反应热分别为-0.01和0.22 eV.这些结果表明CH2*物种之间的耦合反应似乎更容易发生.然而CH2*物种在Fe(110)表面上并不稳定, 倾向于解离为CH* + H*.两个CH3*单体之间的C—C耦合反应的反应能垒是2.73 eV, 说明该反应在动力学上受阻.因此, 不论是热力学上还是动力学上, 通过将所有C—C耦合反应进行对比, 生成C2烃类的关键反应步骤最有可能是CH*物种间的耦合反应生成CH-CH*.因此, 我们继续研究了后续的CH-CH*物种通过两步加氢反应生成乙烯的反应过程(见表 3). CHCH*加氢生成CHCH2*的反应热是1.07 eV, 需要克服的能垒是1.15 eV. CHCH2*进一步加氢的产物即为乙烯, 这一基元反应的反应热为0.17 eV, 需要克服一个0.55 eV的能垒.
2.2.2 Ni-Fe(110)在Ni-Fe(110)表面上, 两个C1单体也同样被放置在了两个相邻的4-fold hollow位点或3-fold hollow位点, 并且其中一个位点中包含一个Ni原子.和Fe(110)表面上的过渡态形成过程类似, 过渡态的结构如图 5所示, 基元反应的反应热(Erxn)、反应能垒(Eact)和过渡态中两个C原子间的距离(dC—C)也在表 3中列出.在Ni-Fe(110)表面上的所有C—C耦合反应中, 除CH*与CH3*耦合是吸热反应以外, 其余均为放热反应, 这表明在Fe(110)表面引入Ni原子后, 使得这些基元反应在热力学上更加有利.与此同时, 大部分的C—C耦合反应能垒以及C2物种进一步加氢形成新的C—H键的反应能垒都有所降低, 这表明在Fe催化剂加入少量Ni原子后在动力学上也是有利的.对于CH*物种而言, 两个CH*单体的耦合反应需克服0.63 eV的能垒, 反应热为-0.18 eV.当CH*与CH2*或CH3*反应时, 所需克服的能垒均有所提高, 分别为0.73和1.39 eV.两个CH2*互相耦合的基元反应, 活化能垒为0.47 eV, 反应热为0.46 eV. CH2*与CH3*发生耦合反应能垒为1.07 eV.两个CH3*单体相互耦合的反应能垒为2.74 eV, 说明其在Ni-Fe(110)表面上也是动力学受阻的.与Fe(110)上的情况类似, Ni-Fe(110)表面上C—C耦合反应的过渡态结构中显示dC—C的范围均在1.9~2.2 Å之间.这些计算结果均显示在Ni-Fe(110)表面通过两个CH*或CH2*单体互相耦合得到CHCH*或CH2CH2*在热力学和动力学两方面都更加有利.然而在反应过程中, 即便是在Ni-Fe(110)上, CH2*物种依然不够稳定, 如图 3所示, 其易于分解生成CH*.这也导致在Ni-Fe(110)表面上最优势的C—C耦合反应依然是CH*单体间直接耦合, 反应所形成的CHCH*在之后的加氢反应中, 先生成CHCH2*, 再生成CH2CH2*(见表 3).其中, CHCH*第一步和第二步加氢的反应热分别为0.69和0.10 eV, 所需克服的能垒分别为0.85和0.62 eV.与这两个基元反应在Fe(110)上的数据相比对, 不难发现在引入Ni原子后, 此类基元反应的能垒和反应热均有所降低, 进一步说明了适量Ni的引入对C2烯烃合成具有促进作用.
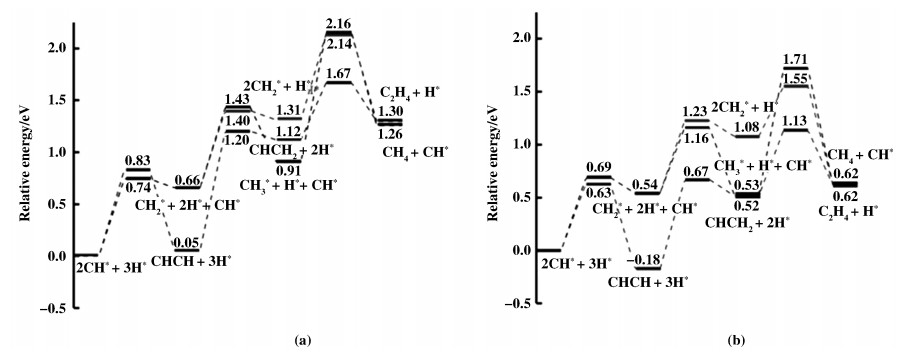
2.3 对CH4和C2H4选择性的比较正如前文所讨论的, CH*物种在表面上是继续加氢还是发生C—C耦合反应直接影响了产物的最终走向是CH4还是C2H4, 这也表明了CH*物种是CO2转化为C1和C2烃类的最关键中间体.为评估CH4和C2H4在Fe(110)表面的相对选择性, CH*物种沿两条路径继续转化的反应能线图如图 6(a)所示.如若要生成CH4, 反应速率最慢的步骤为CH3*加氢生成CH4这一基元反应, 其能垒为1.25 eV.对于C2H4的生成, CHCH*物种加氢生成CHCH2*这一基元反应最为困难, 其能垒为1.15 eV, 反应热为1.07 eV.这两个动力学上最为困难的基元反应在活化能垒上仅有0.10 eV的差异, 因此在Fe(110)上, 甲烷和乙烷的选择性差异并不明显.
|
图 6 (a) Fe(110)表面和(b) Ni-Fe(110)表面上, 关键物种CH*继续转化生成CH4或C2H4的反应能线图 Fig.6 Energy diagrams for CH4 and C2H4 formation on (a) Fe(110) and (b) Ni-Fe(110) surfaces |
当在Fe(110)表面引入Ni原子后, CH*物种通过三步加氢反应生成甲烷的过程中, 3个基元反应中能垒最高的依然是CH3*加氢生成甲烷这一步骤, 为1.18 eV.另一方面, CH*物种经过与另一个CH*单体发生C—C耦合反应, 再通过两步加氢反应合成乙烯的速率控制步骤也是CHCH*加氢生成CHCH2*这一基元反应, 其活化能垒为0.85 eV, 反应热为0.69 eV.这时, 决定Ni-Fe(110)表面上CH4和C2H4选择性的两个速控步骤的反应能垒之间的差值扩大到0.33 eV, 说明铁基催化剂在引入少量镍后, 对C2H4产物的选择性是有所提高的.
与Fe(110)表面上的计算结果相比较, 除CH3*单体间的相互耦合反应以外, Ni的引入在一定程度上降低了C—C耦合反应的能垒(0.2~0.4 eV), 说明C2物种的形成在Ni-Fe(110)表面上更有利.更重要的是, 生成乙烯的速率控制步骤(CHCH* + H* → CHCH2* + *)的反应能垒随Ni原子的引入下降了0.30 eV, 加快了乙烯的生成.这些计算结果表明, C2H4的选择性在引入Ni原子后得到加强, 因此少量Ni的引入对于改善Fe基催化剂活性和乙烯选择性是有利的.
3 结论我们利用DFT计算探索了单一Fe金属催化剂和Ni-Fe双金属催化剂上生成C1和C2烃类的反应机理.在Fe(110)表面和Ni-Fe(110)表面上, 最有利的CHx*单体是由CO2* → CO* → HCO* → CH*和CO2* → HCOO* → HCO* → CH*两条路径得到的CH*物种.从CO2转化为CH*的过程看, Ni的引入对关键物种CH*在表面的形成并没有明显的影响, 尤其是HCOO*路径.
CH2*物种被发现在Fe(110)和Ni-Fe(110)表面上并不稳定, 容易解离为CH*和H*, 能垒分别为0.08和0.15 eV.在CH4的生成路径中, CH3*加氢反应在两个表面上均为速率控制步骤.通过计算所有可能的C—C耦合反应发现, 生成乙烯的关键中间物种CHCH*主要通过CH*-CH*耦合反应得到.在Fe(110)表面, 甲烷生成路径上的速率控制步骤和乙烯生成路径上的速率控制步骤之间的能垒差异仅为0.10 eV.但在引入了一个Ni原子之后, 这一差异被扩大至0.33 eV.这表明在引入少量Ni后, Fe基催化剂对乙烯的选择性有所提高.
这些理论计算结果揭示了Ni-Fe双金属催化剂中适量的镍掺杂有利于CO2加氢反应过程中的C—C耦合反应和C2物种继续加氢, 促进高附加值烃类产物的生成.
| [1] |
Olah G, Goeppert A, Prakash , et al. Chemical recycling of carbon dioxide to methanol and dimethyl ether:From greenhouse gas to renewable, environmentally carbon neutral fuels and synthetic hydrocarbons[J]. J Org Chem, 2008, 74(2): 487–498.
|
| [2] |
Jiang Z, Xiao T, Kuznetsov V, et al. Turning carbon dioxide into fuel[J]. Biotechnol J, 2010, 368(1923): 3343–3364.
|
| [3] |
Rodemerck U, Holeňa M, Wagner E, et al. Catalyst development for CO2 hydrogenation to fuels[J]. ChemCatChem, 2013, 5(7): 1948–1955.
DOI:10.1002/cctc.201200879 |
| [4] |
Song C. Global challenges and strategies for control, conversion and utilization of CO2 for sustainable development involving energy, catalysis, adsorption and chemical processing[J]. Catal Today, 2006, 115(1): 2–32.
|
| [5] |
Centi G, Perathoner S. Opportunities and prospects in the chemical recycling of carbon dioxide to fuels[J]. Catal Today, 2009, 148(3): 191–205.
|
| [6] |
Trainham J, Newman J, Bonino A, et al. Whither solar fuels[J]. Curr Opin Chem Eng, 2012, 1(3): 204–210.
|
| [7] |
Visconti C, Martinelli M, Falbo L, et al. CO2 hydrogenation to lower olefins on a high surface area K-promoted bulk Fe-catalyst[J]. Appl Catal B Environ, 2017, 200: 530–542.
DOI:10.1016/j.apcatb.2016.07.047 |
| [8] |
Al-Dossary M, Ismail A, Fierro J, et al. Effect of Mn loading onto MnFeO nanocomposites for the CO2 hydrogenation reaction[J]. Appl Catal B Environ, 2015, 165: 651–660.
DOI:10.1016/j.apcatb.2014.10.064 |
| [9] |
Pérez-Alonso F, Ojeda M, Herranz T, et al. Carbon dioxide hydrogenation over Fe-Ce catalysts[J]. Catal Commun, 2008, 9(9): 1945–1948.
DOI:10.1016/j.catcom.2008.03.024 |
| [10] |
Dorner R, Hardy D, Williams F, et al. C2-C5+ olefin production from CO2 hydrogenation using ceria modified Fe/Mn/K catalysts[J]. Catal Commun, 2011, 15(1): 88–92.
|
| [11] |
Dorner R, Hardy D, Williams F, et al. Effects of ceria-doping on a CO2 hydrogenation iron-manganese catalyst[J]. Catal Commun, 2010, 11(9): 816–819.
DOI:10.1016/j.catcom.2010.02.024 |
| [12] |
Dorner R, Hardy D, Williams F, et al. K and Mn doped iron-based CO2 hydrogenation catalysts:Detection of KAlH4 as part of the catalyst's active phase[J]. Appl Catal A:Gen, 2010, 373(1): 112–121.
|
| [13] |
Guo L, Sun J, Ge Q, et al. Recent advances in direct catalytic hydrogenation of carbon dioxide to valuable C2+ hydrocarbons[J]. J Mater Chem A, 2018, 6(46): 23244–23262.
DOI:10.1039/C8TA05377D |
| [14] |
Kaiser P, Unde R, Kern C, et al. Production of liquid hydrocarbons with CO2 as carbon source based on reverse water-gas shift and fischer-tropsch synthesis[J]. Chem Ing Technol, 2013, 85(4): 489–499.
DOI:10.1002/cite.201200179 |
| [15] |
Riedel T, Schaub G, Jun K W, et al. Kinetics of CO2 hydrogenation on a K-promoted Fe catalyst[J]. Ind Eng Chem Res, 2001, 40(5): 1355–1363.
DOI:10.1021/ie000084k |
| [16] |
Satthawong R, Koizumi N, Song C, et al. Bimetallic Fe-Co catalysts for CO2 hydrogenation to higher hydrocarbons[J]. J CO2 Util, 2013, 3/4: 102–106.
DOI:10.1016/j.jcou.2013.10.002 |
| [17] |
Satthawong R, Koizumi N, Song C, et al. Comparative study on CO2 hydrogenation to higher hydrocarbons over Fe-based bimetallic catalysts[J]. Top Catal, 2013, 57(6/9): 588–594.
|
| [18] |
Ding F, Zhang A, Liu M, et al. CO2 Hydrogenation to hydrocarbons over iron-based catalyst:Effects of physicochemical properties of Al2O3 supports[J]. Ind Eng Chem Res, 2014, 53(45): 17563–17569.
DOI:10.1021/ie5031166 |
| [19] |
Satthawong R, Koizumi N, Song C, et al. Light olefin synthesis from CO2 hydrogenation over K-promoted Fe-Co bimetallic catalysts[J]. Catal Today, 2015, 251: 34–40.
DOI:10.1016/j.cattod.2015.01.011 |
| [20] |
Boreriboon N, Jiang X, Song C, et al. Higher hydrocarbons synthesis from CO2 hydrogenation over K-and La-promoted Fe-Cu/TiO2 catalysts[J]. Top Catal, 2018, 61(15/17): 1551–1562.
|
| [21] |
Boreriboon N, Jiang X, Song C, et al. Fe-based bimetallic catalysts supported on TiO2 for selective CO2 hydrogenation to hydrocarbons[J]. J CO2 Util, 2018, 25: 330–337.
DOI:10.1016/j.jcou.2018.02.014 |
| [22] |
Rao D, Zhang S, Li C, et al. The reaction mechanism and selectivity of acetylene hydrogenation over Ni-Ga intermetallic compound catalysts:A density functional theory study[J]. Dalton Trans, 2018, 47(12): 4198–4208.
DOI:10.1039/C7DT04726F |
| [23] |
Nie X, Wang H, Liang Z, et al. Comparative computational study of CO2 dissociation and hydrogenation over Fe-M (M=Pd, Ni, Co) bimetallic catalysts:The effect of surface metal content[J]. J CO2 Util, 2019, 29: 179–195.
DOI:10.1016/j.jcou.2018.12.010 |
| [24] |
Blöchl P. Projector augmented-wave method[J]. Phys Rev B, 1994, 50(24): 17953–17979.
DOI:10.1103/PhysRevB.50.17953 |
| [25] |
Perdew J, Burke K, Ernzerhof M. Generalized gradient approximation made simple[J]. Phys Rev Lett, 1996, 77(18): 3865–3868.
DOI:10.1103/PhysRevLett.77.3865 |
| [26] |
Wang H, Nie X, Chen Y, et al. Facet effect on CO2 adsorption, dissociation and hydrogenation over Fe catalysts:Insight from DFT[J]. J CO2 Util, 2018, 26: 160–170.
DOI:10.1016/j.jcou.2018.05.003 |
| [27] |
Wang T, Wang S, Luo Q, et al. Hydrogen adsorption structures and energetics on iron surfaces at high coverage[J]. J Phys Chem C, 2014, 118(8): 4181–4188.
DOI:10.1021/jp410635z |
| [28] |
Nie X, Wang H, Janik M, et al. Mechanistic insight into C-C coupling over Fe-Cu bimetallic catalysts in CO2 hydrogenation[J]. J Phys Chem C, 2017, 121(24): 13164–13174.
DOI:10.1021/acs.jpcc.7b02228 |
| [29] |
Nie X, Luo W, Janik M, et al. Reaction mechanisms of CO2 electrochemical reduction on Cu(111) determined with density functional theory[J]. J Catal, 2014, 312: 108–122.
DOI:10.1016/j.jcat.2014.01.013 |
| [30] |
Peter C, Jennifer W, David W. Effect of Ag and Pd promotion on CH4 selectivity in Fe(100) Fischer-Tröpsch catalysis[J]. Phys Chem Chem Phys, 2017, 19(7): 5495–5503.
DOI:10.1039/C6CP07116C |
| [31] |
John M, Tom Z. A first-principle study of chain propagation steps in the fischer-tropsch synthesis on Fe(100)[J]. J Phys Chem C, 2008, 112(35): 13681–13691.
DOI:10.1021/jp802042s |
| [32] |
Zhao T, Chang J, Yoneyama Y, et al. Selective synthesis of middle isoparaffins via a two-stage Fischer-Tropsch reaction:Activity investigation for a hybrid catalyst[J]. Ind Eng Chem Res, 2005, 44(4): 769–775.
DOI:10.1021/ie040097o |
| [33] |
Li T, Wen X, Li W, et al. Mechanisms of CO activation, surface oxygen removal, surface carbon hydrogenation, and C-C coupling on the stepped Fe(710) surface from computation[J]. J Phys Chem C, 2018, 122(27): 15505–15519.
DOI:10.1021/acs.jpcc.8b04265 |
 2020, Vol. 34
2020, Vol. 34


