2. 中国工程物理研究院 核物理与化学研究所, 四川 绵阳 621900
2. Institute of Nuclear Physics and Chemistry, China Academy of Engineering Physics, Mianyang 621900, China
1987年, Hurata教授发现以沉积沉淀法制备的金催化剂在低温下即可催化CO氧化反应[1].自此以后, 无论是实验研究还是理论计算, 人们在金催化CO氧化反应上做了大量的研究工作, 但是对于活性位点的认识与理解仍然存在着分歧.大多数情况下, 电中性金(Au0)[2-4]和电正性金(Auδ+)[5-6]被视作反应的活性位点.还有的学者认为高的催化活性还来源于Au0和Auδ+的协同作用[7-9].最近有部分研究表明Auδ-是活性位点. 2005年, Yoon等[10]对比缺陷MgO和无缺陷MgO负载金催化剂, 认为缺陷MgO的F中心向Au8转移电子产生的Auδ-是具有催化活性的原因. 2018年, Zhou等[11]制备了单原子Au1/CuO催化剂, 通过Au 4f和O 1s的XPS光谱证实了载体的晶格氧向单原子金的电荷转移产生的Auδ-对于CO氧化至关重要, CO分子和邻近的晶格氧反应后变成Au0后伴随着催化剂的失活. 2019年, Fernández-García等[12]采用原位漫反射傅里叶变换红外光谱(in situ DRIFTS)对Au/CeO2催化CO氧化反应进行了研究, 发现Au-CeO2界面处电子转移产生的Auδ-的催化活性高于Au0.
与CeO2, TiO2这类“活性”载体[13]不同, SiO2是一种不可还原的“惰性”载体, 其表面的氧原子很难参与到催化反应中去.虽然部分研究[14-15]报道Au/SiO2的催化活性并不高, 但是SiO2也有其特有的优势:热稳定性好、表面积大、机械强度大.此外, 以SiO2作为载体, 可以避免载体对金粒子的影响.
由于SiO2的等电点较低, 利用阳离子前驱体[Au(en)2]3+ (en =ethylenediamine)制备较为合适[16-18].考虑到金催化剂对焙烧温度很敏感, 温度太高或太低都会对活性产生很大影响[19]; 结合文献[17, 20]中的结果, 选择在500 ℃, 空气气氛下对催化剂进行预处理以除去催化剂表面的乙二胺配体.我们以[Au(en)2]Cl3为前驱体, 通过离子交换法制备了Au/SBA-15催化剂.采用漫反射傅里叶变换红外光谱(DRIFTS)研究了CO探针分子[21-23]在Au/SBA-15催化剂表面的吸附状态及在不同条件下的演化情况.我们观察到Au/SBA-15表面存在两种Au位点: Au0和Auδ-.
1 实验部分 1.1 催化剂制备 1.1.1 [Au(en)2Cl3]合成将氯金酸和乙二胺分别溶于无水乙醇溶液中, 按3:1的体积比将配制好的氯金酸-乙醇溶液(25.4 mmol/L)缓慢逐滴加入到乙二胺-乙醇溶液(152 mmol/L)中, 于室温下搅拌1.5 h.搅拌过程中逐渐产生黄色沉淀.离心分离固体, 用无水乙醇洗涤3次.然后对所得样品重结晶(加入少量去离子水将其溶解, 再用乙醇使其沉淀并分离), 洗涤1次.将得到的沉淀放置于真空干燥箱内于40 ℃下干燥2 h, 得到[Au(en)2]Cl3[24].
1.1.2 Au/SBA-15制备由于SBA-15的吸水性很强, 在使用之前, 商用的SBA-15(南京先锋纳米科技有限公司, 比表面积: 550~600 m2/g)在500 ℃下热处理3 h, 除去表面的水分及其它杂质.
将500 mg SBA-15分散于20 mL去离子水中, 随后将42 mg[Au(en)2]Cl3溶于10 mL水中并快速加入到SBA-15的分散液中, 边加边搅拌, 补加5 mL水.然后逐滴加入NaOH溶液(1 mol/L)将pH调至10, 滴加过程中颜色逐渐变为淡黄色.继续于45 ℃水浴中搅拌4 h.离心分离固体并用去离子水洗数次至pH=7.将所得的固体于70 ℃下真空干燥3 h, 得到Au/SBA-15-UN样品.
Au/SBA-15-UN一系列热处理步骤.还原: Au/SBA-15-UN在10%H2/He混合气下于150 ℃(升温速率: 2 ℃/min)处理2 h, 记为Au-H; 焙烧:之后在500 ℃(升温速率: 5 ℃/min)的空气中处理2 h(记为Au-H-A); 二次还原:再于150 ℃、10% H2/He混合气下二次还原2 h, 记为Au-H-A-H.
1.2 样品表征透射电镜表征在Tecnai F-30型透射电镜上进行, 加速电压为100 V.样品Au-H, Au-H-A-H在无水乙醇中超声制样后, 将悬浮液滴在喷有碳膜的铜网上, 以备测试.
原位漫反射红外光谱(DRIFTS)光谱是在配有MCT检测器的Perkin Elmer Frontier光谱仪上完成的, 同时在气体出口端连接了四极质谱仪(QMS, Dycor, Ametek)用以检测尾气组分.红外扫描分辨率为4 cm-1, 扫描次数为32次.考虑到金催化剂存放过程中可能发生变化, 所有的红外吸附实验进行前, 样品都预先在150 ℃分别于10%H2/He及He气氛下处理1 h, 并在He气中冷却至室温后取背景光谱.
流动吸附模式:将待测样品填充到原位反应池中, 5%CO/He(或1%CO/He)以50 mL/min的流速通入反应池中, 连续扫描红外光谱.吸附饱和后, 切换为He气吹扫脱附.
脉冲模式吸附: 5%CO/He(脉冲环体积: 0.25 mL, 流速: 20 mL/min)脉冲进样10 s, 然后切换六通阀为He, 10 s后切回至5%CO/He, 开始下一个脉冲, CO脉冲的周期为20 s.脉冲实验中, 扫描次数为8次(约10 s), 每个脉冲周期取两个红外光谱图.
O2共吸附实验: Au-H-A-H吸附1%CO/He至饱和后, 向反应气体中加入O2(气体组分: CO/O2/He=1/20/79;气体流速: 50 mL/min), 到达稳态后, 切断O2待达到稳态.重复切断-通入O2的循环.整个实验过程中连续扫描红外光谱.
2 结果与讨论 2.1 透射电镜表征SBA-15是一种具有规则六方介孔结构的介孔氧化硅, 将Au纳米颗粒沉积在其孔道中会限制其聚集长大[20, 25].从图 1a中可以看到Au纳米颗粒均匀分散在SBA-15的孔道中. Au-H的平均粒径为2.7 nm, 经过500 ℃空气焙烧及二次还原后(Au-H-A-H), 金颗粒并没有出现烧结现象, 仍分散于载体的孔道中(图 1c), 与Au-H相比, Au-H-A-H粒径分布几乎没有变化.表明在高温焙烧过程中, SBA-15载体对金粒子有很强的稳定作用[25-26].

|
图 1 Au-H (a, b)和Au-H-A-H (c, d)的TEM照片及粒径分布图 Fig.1 TEM images and particle size distributions of Au-H (a, b)and Au-H-A-H (c, d) |
CO作为常用的探针分子, 又是反应物之一, 可提供有关金催化剂表面位点有价值的信息[2, 21-23].
向经过H2还原得到的Au-H中通入5%CO/He.如图 2所示, 红外光谱中只有CO气相峰, 没有出现任何吸附CO的特征峰.这可能是由于在制备过程中仅还原无法完全除去前驱体中的乙二胺配体, 残余配体覆盖在催化剂表面阻止了CO在Au上的吸附[20, 24].因此, 高温焙烧除去残余配体对于获得洁净的金表面是必要的[17-18].虽然500 ℃下空气焙烧可以得到金粒子, 再进行二次还原以确保所有的金都处于金属态, 得到Au-H-A-H样品.

|
图 2 CO吸附于Au-H的DRIFT谱图以及气相CO的光谱图 Fig.2 DRIFT spectra of CO adsorption on Au-H in flowing 5% CO/He and spectrum of gaseous CO |
向Au-H-A-H通入1%CO/He后, 如图 3a所示, 1 min内, 2111 cm-1处立即出现吸附峰.该峰被归属于Au0位点上吸附的CO [2, 22, 27], 表明Au-H-A-H表面的配体完全除去.约6 min后, 2076 cm-1处出现了另一峰并不断增强; 该峰可归属于CO在Auδ-上的吸附[21, 23].由于向CO 2π*轨道的电子反馈的增强, 使得Auδ-上吸附CO分子的吸附波数要低于Au0.

|
图 3 Au-H-A-H通入1% CO/He吸附(插图为40 min减去CO气相峰的光谱); b.在He中脱附的DRIFT光谱图 Fig.3 DRIFT spectra of: a. Au-H-A-H in flowing 1% CO/He (The inset is the spectrum of 40 min after subtraction of gaseous CO signal); b. subsequent desorption in flowing He |
在CO吸附饱和后(40 min), 切换为He吹扫脱附.如图 3b所示, 2076 cm-1峰脱附很快且波数红移至2063 cm-1, 在2076 cm-1的峰完全消失后, 2111 cm-1的峰还有相当的强度并逐渐蓝移至2116 cm-1. CO分子吸附峰位(νCO)随覆盖度变化的移动是化学效应(chemical shift)和偶极相互作用(dipole shift)两个因素的综合结果[28-29].化学位移描述的是邻近CO分子引起吸附位点电子性质变化的贡献.对于Au、Ag、Cu, 化学位移通常是红移, 而偶极位移一定是蓝移.在金催化剂上, 相反方向的化学位移可抵消甚至超过偶极位移.因此绝大多数文献报道:与铂催化剂相反, 金催化剂上νCO随覆盖度减小而蓝移[29].从图 3可看出:在Au0上, 脱附过程中νCO蓝移(2111到2116 cm-1), 与文献报道一致.而在Auδ-上, 脱附过程中νCO红移(2076到2063 cm-1).这表明在Auδ-上的化学位移明显弱于Au0, 同时也表明CO-Auδ-的成键性质不同于CO-Au0.从图 3的CO吸附-脱附图中可以看出: Au-H-A-H表面存在两种不同的金位点: Au0和Auδ-. CO在Auδ-上的吸附强度弱于在Au0的吸附, 因为CO在Auδ-上吸附速度慢且更容易脱附.
2.2.2 预吸附CO与O2的反应为了研究Au/SBA-15上两种不同的金位点在反应中的活性, CO饱和吸附后, 向该反应气氛中引入O2, 连续扫描红外光谱观察吸附峰的变化趋势.
向Au-H-A-H样品中通入1%CO/He至吸附饱和(红外谱图如图 3a所示).再通入O2, 2076 cm-1处的峰(CO-Auδ-)在2 min内几乎完全消失, 2111 cm-1的峰(CO-Au0)的消失速度要慢很多, 且波数移动至2116 cm-1, 可能是由于共吸附氧的原因[23, 30].约10 min后, 可以看到少量CO2的峰(2340 cm-1). 20 min后, CO-Au0峰仍有较大程度的剩余.说明Auδ-上的CO(CO-Auδ-)优先和O2发生反应, 对O2的反应活性更高.当切断反应气体中的O2后, CO-Au0峰从2116又回到2112 cm-1处, CO-Auδ-峰重新出现.反应后的催化剂CO吸附谱图和新鲜的样品基本一致(如图 4b所示).表明在O2吸附前后, Au纳米颗粒表面并没有发生大的变化.重复图 4的O2之通入-切断循环, 结果可以可逆重现. Daté等[22]通过在Au/TiO2催化剂上观察到了类似的现象.作者认为负电荷金的产生是由于TiO2表面氧空位向金颗粒的电子转移.
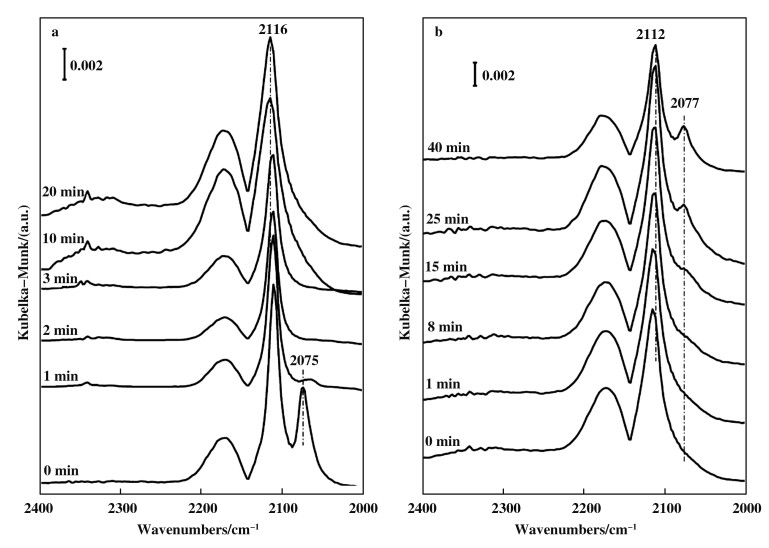
|
图 4 向预先吸附CO的Au-H-A-H中引入O2(气体组分: CO/O2/He=1/20/79); b.切掉O2后在1% CO/He再吸附的DRIFT光谱图 Fig.4 a. DRIFT spectra of Au-H-A-H after introduction of oxygen to pre-adsorbed 1%CO/He (The mixture gas: CO/O2/He=1/20/79); b. cut-off oxygen for re-adsorption of 1%CO/He |
气体脉冲进样可以尽可能避免CO气相峰对红外吸附峰位置的干扰[31].当CO以脉冲的形式向Au-H-A-H进样后(图 5), 由于气体流动的延迟, 第一个CO脉冲没有任何的吸附峰; 从第二个脉冲开始, 2112 cm-1开始出现, 随着脉冲次数的增加, 2112 cm-1逐渐增大, 源于CO在Au0上的吸附[32].与流动模式不同的是, 20次CO气体脉冲后, 仍然没有2076 cm-1的出现.推测原因可能是由于脉冲模式下, 少量的CO气体只能够在吸附能力更强的Au0 位点上吸附.而在流动模式下, 长时间、较大的CO分压(1 kPa)下使在Au0吸附饱和后, 弱吸附能力的Auδ-位点可以逐渐吸附CO; 这又进一步说明了CO在Au0上的吸附强于Auδ-.

|
图 5 Au-H-A-H上5% CO/He多次脉冲进样后的DRIFT谱图 Fig.5 DRIFT spectra of 5% CO/He multiple pulses on Au-H-A-H |
Auδ-通常是通过Au纳米颗粒从载体表面的缺陷位点(例如:还原性氧化物载体的氧空位)获得电子产生的, 例如Au/TiO2[33], Au/ZrO2[34], Au/defect MgO[10, 27]上Auδ-.而对于惰性的SBA-15载体而言, 电荷转移很难发生.
Chakarova等[21]在Au/SiO2上观察到了CO还原Au0产生Auδ-的现象, 并通过向CO气体中加入H2对其进行了验证.我们也做了类似的实验:向1%CO/He气体中加入5%H2.在图 6中, 向1% CO/He中加入H2后, 2111和2076 cm-1处的吸附峰的强度均比无H2时的弱, 且2076 cm-1处的吸附峰减少更明显.这说明Auδ-不是由H2还原Au0产生的.两个峰强度的降低可能源于H2和CO竞争吸附. Au/SBA-15上Auδ-的产生机制还需更深入的研究.
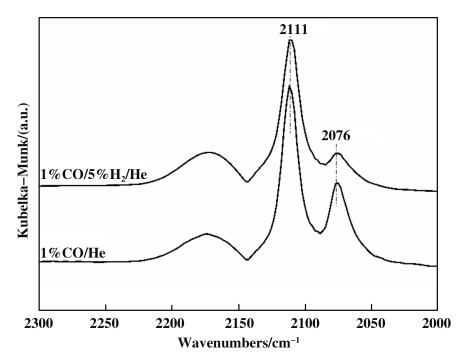
|
图 6 Au-H-A-H上1%CO/He与1%CO/5%H2/He的DRIFT谱图对比 Fig.6 DRIFT spectra of 1%CO/He and 1%CO/5%H2/He adsorption on Au-H-A-H |
关于CO-Auδ-强度弱于CO-Au0的原因可从CO-Au的成键模型去理解. Wörz等[33]发现位于氧空位上的金原子带有负电荷并从理论上进行了解释:当CO分子吸附在Auδ-上时, 扩散的Au 6s轨道和CO 5σ轨道之间Pauli排斥使得CO-Auδ-之间键长变长, 强度减弱.因此, CO-Auδ-键强度弱于CO-Au0.
3 结论经过还原-焙烧-二次还原处理后的Au/SBA-15催化剂上存在着Au0和Auδ-两种位点, 对应于红外光谱上2111 cm-1 (CO-Au0)和2076 cm-1(CO-Auδ-)两个峰. CO-Auδ-成键更弱, 但与O2的反应活性更强.
| [1] |
Haruta M, Kobayashi T, Sano H, et al. Novel gold catalysts for the oxidation of carbon monoxide at a temperature far below 0℃[J]. Chem Lett, 1987, 16(2): 405–408.
|
| [2] |
Wu Zi-li, Zhou Sheng-hu, Zhu Hao-guo, et al. DRIFTS-QMS study of room temperature CO oxidation on Au/SiO2 catalyst:Nature and role of different Au species[J]. J Phys Chem C, 2009, 113(9): 3726–3734.
DOI:10.1021/jp809220z |
| [3] |
Wei Shuai, Fu Xin-pu, Wang Wei-wei, et al. Au/TiO2catalysts for CO oxidation:Effect of gold state to reactivity[J]. J Phys Chem C, 2018, 122(9): 4928–4936.
DOI:10.1021/acs.jpcc.7b12418 |
| [4] |
Zhu Lin-hua(祝琳华), Li Feng-long(李奉隆), Si Tian(司甜), et al. Preparation of layered clay-supported gold catalysts and catalytic activity for CO oxidation at room temperature(层状粘土负载的金催化剂制备及其常温催化氧化活性)[J]. J Mol Catal(China)(分子催化), 2016, 30(1): 46–53.
|
| [5] |
Guzman J, Carrettin S, Corma A. Spectroscopic evidence for the supply of reactive oxygen during CO oxidation catalyzed by gold supported on nanocrystalline CeO2[J]. J Am Chem Soc, 2005, 127(10): 3286–3287.
DOI:10.1021/ja043752s |
| [6] |
Fierro-Gonzalez J C, Gates B C. Mononuclear AuⅢ and AuI complexes bonded to zeolite NaY:Catalysts for CO oxidation at 298 K[J]. J Phys Chem B, 2004, 108(44): 16999–17002.
DOI:10.1021/jp046171y |
| [7] |
Venkov T, Klimev H, Centeno M, et al. State of gold on an Au/Al2O3 catalyst subjected to different pre-treatments:An FTIR study[J]. Catal Commun, 2006, 7(5): 308–313.
DOI:10.1016/j.catcom.2005.11.018 |
| [8] |
Zhang Rui-rui, Ren Li-hui, Lu An-hui, et al. Influence of pretreatment atmospheres on the activity of Au/CeO2 catalyst for low-temperature CO oxidation[J]. Catal Commun, 2011, 13(1): 18–21.
|
| [9] |
Costello C K, Kung M C, Oh H S, et al. Nature of the active site for CO oxidation on highly active Au/γ-Al2O3[J]. Appl Catal A General, 2002, 232(1/2): 159–168.
|
| [10] |
Yoon B, Hakkinen H, Landman U, et al. Charging effects on bonding and catalyzed oxidation of CO on Au8 clusters on MgO[J]. Science, 2005, 307(5708): 403–407.
DOI:10.1126/science.1104168 |
| [11] |
Zhou Xiong, Shen Qian, Yuan Kai-di, et al. Unraveling charge state of supported Au single-atoms during CO Oxidation[J]. J Am Chem Soc, 2018, 140(2): 554–557.
DOI:10.1021/jacs.7b10394 |
| [12] |
Fernández-García S, Collins S E, Tinoco M, et al. Influence of {111} nanofaceting on the dynamics of CO adsorption and oxidation over Au supported on CeO2nanocubes:An operando DRIFT insight[J]. Catal Today, 2019, 336: 90–98.
DOI:10.1016/j.cattod.2019.01.078 |
| [13] |
Huang Wei-xin(黄伟新), Qian Kun(千坤), Wu Zong-fang(邬宗芳), et al. Structure-sensitivity of Au Catalysis(金催化作用的结构敏感性)[J]. Acta Phys -Chim Sin(物理化学学报), 2016, 32(1): 48–60.
|
| [14] |
Martra G, Prati L, Manfredotti C, et al. Nanometer-sized gold particles supported on SiO2 by deposition of gold sols from Au(PPh3)3Cl[J]. J Phys Chem B, 2003, 107(23): 5453–5459.
DOI:10.1021/jp0225166 |
| [15] |
Overbury S H, Ortiz-Soto L, Zhu Hao-guo, et al. Comparison of Au catalysts supported on mesoporous titania and silica:Investigation of Au particle size effects and metal-support interactions[J]. Catal Lett, 2004, 95(3/4): 99–106.
DOI:10.1023/B:CATL.0000027281.96719.42 |
| [16] |
Yin Hong-feng, Ma Zhen, Overbury S H, et al. Promotion of Au(en)2Cl3-derived Au/fumed SiO2 by treatment with KMnO4[J]. J Phys Chem C, 2008, 112(22): 8349–8358.
DOI:10.1021/jp800797t |
| [17] |
Zhu Hao-guo, Ma Zhen, Clark J C, et al. Low-temperature CO oxidation on Au/fumed SiO2-based catalysts prepared from Au(en)2Cl3 precursor[J]. Appl Catal A-Gen, 2007, 326(1): 89–99.
DOI:10.1016/j.apcata.2007.04.004 |
| [18] |
Zhu Hao-guo, Liang Cheng-du, Yan Wen-fu, et al. Preparation of highly active silica-supported Au catalysts for CO oxidation by a solution-based technique[J]. J Phys Chem B, 2006, 110(22): 10842–10848.
DOI:10.1021/jp060637q |
| [19] |
Zou Xu-hua(邹旭华), Qi Shi-xue(齐世学), An Lidun(安立敦), et al. Effects of calcination conditions on structure of supported gold catalysts and catalytic performance for CO oxidation(焙烧条件对金催化剂的结构及其催化CO氧化性能的影响)[J]. J Mol Catal(China)(分子催化), 2001, 15(4): 246–250.
|
| [20] |
Kraszkiewicz P, Mista W. Thermally stable SBA-15 supported sub-2 nm gold clusters, highly active in room temperature CO oxidation:Effect of thermal pretreatment[J]. Catal Commun, 2018, 110: 14–17.
DOI:10.1016/j.catcom.2018.03.004 |
| [21] |
Chakarova K, Mihaylov M, Ivanova S, et al. Well-defined negatively charged gold carbonyls on Au/SiO2[J]. J Phys Chem C, 2011, 115(43): 21273–21282.
DOI:10.1021/jp2070562 |
| [22] |
Daté M, Imai H, Tsubota S, et al. In situ measurements under flow condition of the CO oxidation over supported gold nanoparticles[J]. Catal Today, 2007, 122(3/4): 222–225.
|
| [23] |
Mihaylov M, Knözinger H, Hadjiivanov K, et al. Characterization of the oxidation states of supported gold species by IR spectroscopy of adsorbed CO[J]. Chem Ing Tech, 2007, 79(6): 795–806.
|
| [24] |
Feng Xiao-qing, Meng Dan, Yang Yong, et al. Au/SBA-15 catalyst prepared by ozone treatment and importance of negatively charged gold in CO oxidation by DRIFTS[J]. Chemosphere, 2020, 250: 126274.
DOI:10.1016/j.chemosphere.2020.126274 |
| [25] |
Su Ji-xin(苏继新), Zhang Shen-ping(张慎平), Ma Li-yuan(马丽媛), et al. Preparation of Au/SBA-15 and its catalytic activity for CO oxidation(Au/SBA-15的制备及其催化CO氧化反应性能)[J]. Chin J Catal(催化学报), 2010, 31(7): 839–845.
|
| [26] |
Zhang Yun-lai, Zhang Jun-ying, Zhang Bing-sen, et al. Boosting the catalysis of gold by O2 activation at Au-SiO2 interface[J]. Nat Commun, 2020, 11(1): 558.
|
| [27] |
Sterrer M, Yulikov M, Fischbach E, et al. Interaction of gold clusters with color centers on MgO(001) films[J]. Angew Chem Int Ed, 2006, 45(16): 2630–2632.
DOI:10.1002/anie.200504443 |
| [28] |
Boccuzzi F, Tsubota S, Haruta M. Vibrational investigation of CO adsorbed on gold deposited on TiO2[J]. J Electron Spec Relat, 1993, 64/65: 241–250.
DOI:10.1016/0368-2048(93)80085-Z |
| [29] |
Hollins P. The influence of surface defects on the infrared spectra of adsorbed species[J]. Surf Sci Rep, 1992, 2(16): 51–94.
|
| [30] |
Boccuzzi F, Chiorino A, Manzoli M, et al. Au/TiO2 nanosized samples:A catalytic, TEM, and FTIR study of the effect of calcination temperature on the CO oxidation[J]. J Catal, 2001, 202(2): 256–267.
DOI:10.1006/jcat.2001.3290 |
| [31] |
Luo Liang-feng, Hua Qing, Jiang Zhi-quan, et al. A pulse chemisorption/reaction system for in situ and time-resolved DRIFTS studies of catalytic reactions on solid surfaces[J]. Rev Sci Instrum Rev, 2014, 85(6): 64103.
DOI:10.1063/1.4884795 |
| [32] |
Qian Kun, Luo Liang-feng, Bao Hui-zhi, et al. Catalytically active structures of SiO2-supported Au nanoparticles in low-temperature CO oxidation[J]. Catal Sci Technol, 2013, 3(3): 679–687.
DOI:10.1039/C2CY20481A |
| [33] |
Wörz A S, Heiz U, Cinquini F, et al. Charging of Au atoms on TiO2 thin films from CO vibrational spectroscopy and DFT calculations[J]. J Phys Chem B, 2005, 109(39): 18418–18426.
DOI:10.1021/jp054093o |
| [34] |
Vindigni F, Manzoli M, Chiorino A, et al. Catalytically active gold sites:Nanoparticles, borderline sites, clusters, cations, anions? FTIR spectra analysis of 12CO and of 12CO-13CO isotopic mixtures[J]. Gold Bull, 2009, 42(2): 106–112.
|
 2020, Vol. 34
2020, Vol. 34


