2. 辽宁省化工分离技术重点实验室, 辽宁 沈阳 110142
2. Key Laboratory of Chemical Separation Technology of Liaoning Province, Shenyang 110142, China
随着可再生资源的兴起, 对其进行高效的转化利用越来越受到人们的广泛关注[1-7].目前, 人们将大量精力投入到将可再生原料转化为精细化学品和清洁燃料的绿色催化研究中[8-10].近十年来, 生物柴油作为代表性可再生液体燃料, 无论是全球产量还是需求量都在逐步增加.甘油作为生物柴油生产过程的主要副产物, 其产量也在与日俱增[11-12], 据统计每生产1 t生物柴油大约会产生0.1 t的副产物[13-16].而甘油本身在食品、医学、涂料、纺织、燃料等领域就有重要的应用.生物柴油产业的兴起及扩大在增加甘油产量的同时也对其市场产生了重大影响, 导致其价格持续走低[17].但从另一个角度来看, 这也使甘油成为一种理想的、低成本的原料.将甘油转化成高附加值的化工产品或原料无疑会大大提高其经济价值, 具有十分可观的发展前景和重要的现实意义[3, 18-20].
迄今为止, 已有多种不同的技术应用于甘油的转化.其中, 研究较多的技术是将甘油通过催化选择性氧化的方式转化为丙烯醛[8, 13, 21-25]或丙烯酸[26-31].丙烯酸作为重要的化工原料, 广泛应用于制药、农业、建筑、石油开采等诸多领域[32-33], 目前已成为甘油转化利用中最具经济价值和发展前景的产品, 开发用于该反应的高性能催化剂也成为了研究热点之一.
目前, 可应用于甘油氧化制丙烯酸的催化剂较多, 主要包括金属氧化物、杂多酸、分子筛等[26, 34-41].但通过研究发现, 杂多酸拥有的酸性位点过多, 在催化过程中易促进CO2等过度氧化产物的生成, 大大降低了丙烯酸的选择性和收率.而分子筛催化剂则容易产生积碳而使催化剂失活, 显著降低了催化剂的使用寿命.与杂多酸和分子筛催化剂相比, 由于结构中含有的酸性位适量以及独特的晶格氧氧化优势, 复合金属氧化物催化剂表现出对丙烯酸较高的选择性和使用过程中更高的热稳定性.根据操作过程, 复合金属氧化物催化甘油氧化制丙烯酸可分为直接法和间接法两种.直接法具有设备投资少、操作简单等显著优势, 但对催化剂要求较高, 间接法工艺成熟、产物收率高, 但设备及工艺过程较复杂.我们综述了近年来用于甘油制丙烯酸所涉及的复合金属氧化物催化剂体系、反应机理等研究进展, 其中着重阐述复合金属氧化物催化甘油转化丙烯酸的技术, 分析归纳了该类催化体系现存的问题, 并对未来的优化和发展方向提出了见解与展望.
1 复合金属氧化物催化体系 1.1 直接法直接法是指在同一反应设备中将甘油直接转化为丙烯酸的一种工艺方法.目前直接法所用的复合金属氧化催化体系主要包括Mo-V系、W-V(Nb)系、Mo-W-V系和Fe-V(P)系等.其中Mo-V系复合金属氧化物在甘油氧化脱水反应中表现出了优异的催化活性和丙烯酸选择性, 甘油转化率达100%, 丙烯酸选择性最高可达到57%左右.其优异的催化性能得益于拥有适宜的V4+、V5+、V—O键强度和Brønsted酸, Mo-V-O同时提供了氧化还原位点. W-V(Nb)系催化剂普遍对丙烯酸具有较高的选择性(最高可达到60%), 甘油转化率达100%, 其中WNbO组分主要催化甘油脱水成丙烯醛, V原子几乎不影响丙烯醛的形成, 但能促进丙烯醛氧化成丙烯酸.与前两类不同的是Fe-V(P)系虽然对丙烯酸选择性较低, 但由于FeOx的存在使得该催化剂具有较高的稳定性.
1.1.1 Mo-V系由于Mo-V复合金属氧化物中具有V2O5, MoV2O8, Mo4V6O25, MoO3等多种晶相, 为了明确Mo-V复合金属氧化物中的关键活性相, 科研人员做出大量研究工作. Possato L G等[42]利用XRD对钒和钼前驱体进行热处理时形成的结晶相进行了原位分析.研究表明, Mo和V前驱体混合物在氧气或惰性气氛热处理最终温度500 ℃条件下, 形成的晶相分别为MoV2O8(61%)和Mo4V6O25(29%).在甘油氧化为丙烯酸的过程中, MoV2O8比Mo4V6O25表现出了更好的丙烯酸选择性, 原因是在反应期间MoV2O8中钒的redox循环能够产生明显的动态氧空位, 从而可获得97%甘油转化率以及32%丙烯酸选择性.此外, 作者认为在甘油催化转化为丙烯酸的过程中, 体系中水蒸气会在催化剂表面上发生解离并导致V5+位点减少, 导致MoV2O8向Mo4V6O25转变, 致使催化性能下降.研究表明, 当MoV2O8/Mo4V6O25两种晶相比值为1/1时表现出了最佳的催化性能, 且可以通过向反应器中加入纯O2来保持MoV2O8 / Mo4V6O25活性相的平衡, 从而提高催化剂的稳定性.
Rasteiro等[43]采用水热合成法制备了一系列Mo-V-O催化剂, 并研究了在不同温度和不同气体流量成分下热处理后的催化性能.在320 ℃且100%O2的流量下进行催化氧化脱水可获得最佳性能, 丙烯酸选择性为33.5%, 甘油转化率为100%.此外, 该研究也发现向反应器中加入O2之后能够使得含V4+和V5+的氧化物活性相保持平衡.但由结果可知, 丙烯酸的选择性并不理想, 这可能与催化剂较低的比表面积有关.在此基础上Rasteiro等[44]添加CTAB和SDS表面活性剂合成了纳米棒状MoV2O8晶相.结果表明, 表面活性剂的存在可促进晶相形貌的改变, 从而导致纳米棒状晶体的形成(图 1).该催化剂在一步法催化甘油制丙烯酸反应中, 可将甘油完全转化, 且丙烯酸选择性高达57%.其原因在于纳米棒状结构提高了甘油转化过程中的MoV2O8晶相的稳定性, 避免了钒从晶相迁移到非晶相, 有利于钒的还原/再氧化, 因此有助于提高催化性能和寿命.
Shen等[45]研究了Mo-V和W-V氧化物催化剂在空气中将甘油直接氧化为丙烯酸的过程, 详细探讨了催化剂组分对氧化脱水反应的影响.研究发现, 随着W-V氧化物催化剂中V含量的增加, WO3相从单斜晶变为六方晶和正交晶.同时, W-V氧化物催化剂中WO3的微晶尺寸也随着V含量的变化而明显变化; Mo-V催化剂中的Mo6V9O40晶相具有较高的催化活性, 可将丙烯醛进一步氧化为丙烯酸.分析原因为Mo-V和W-V氧化物催化剂中V组分有利于Mo5+, W5+和V4+离子的产生, 这些阳离子的存在会使反应过程中形成更多的活性氧, 从而表现出较高的催化活性.低V含量的Mo1V0.25和W1V0.25催化剂在300 ℃反应温度下, 丙烯酸产率分别高达20.1%和25.7%.此外, 碳平衡随着反应温度的降低而增加, 表明较低的反应温度可抑制W-V氧化物催化剂在甘油氧化脱水反应中积碳的发生.
1.1.2 W-V(Nb)系研究认为, W-V系催化剂之所以能够将甘油一步法转化为丙烯酸, 是因为催化剂同时具有WO3的酸性和V离子的氧化性.为了明确催化剂最佳的原子配比, Soriano M D等[46]通过水热法制备了W-V混合氧化物催化剂.研究表明, 当W、V原子比为V/(W+V)= 0.12~0.21时, 丙烯酸收率为25%.作者认为该催化剂中由钨氧化物赋予的酸性以及由WO3晶相内结合V离子赋予的氧化性共同提供了两种活性位点.
Omata K等[47]通过水热法添加磷酸制备了W-V-Nb的复合金属氧化物催化剂.研究表明, 添加磷酸后丙烯酸产率从46.2%提升至59.2%, 表明添加磷酸的W-V-Nb的复合金属氧化物催化剂可显著提高甘油直接转化丙烯酸的催化性能.此外, 添加磷酸后催化剂酸性位点数量从129增加到250 g/μmol, 且增加了Brønsted和Lewis酸度的比率, 因此作者推测催化性能的改善可能是由于酸量和Brønsted酸度的增加.通过对比还发现, 未添加磷酸的W-V-Nb-O催化剂在高于308 ℃的反应温度下, 丙烯酸收率急剧下降, 而当采用H3PO4/W-V-Nb-O催化剂时, 该下降明显地被抑制了, 显然添加磷酸可以抑制丙烯酸的深度氧化.
在W-V-O基础上, Chieregato A等[48]研究了掺Nb的W-V复合氧化物的六方钨青铜结构, 进行了甘油一锅法氧化制丙烯酸的催化性能研究.结果表明, 在三组分六方钨青铜结构中掺入Nb元素获得了34%的最佳丙烯酸收率, 远高于未掺杂Nb催化剂的丙烯酸收率(25%), 同时在寿命实验中也表现出更高的稳定性, 证实了Nb5+掺杂可增加六方钨青铜结构的酸性位点.然而, 随着Nb含量的增加, 丙烯酸选择性出现了显著的降低, 从26.5%降到11%, 这表明少量的Nb有利于形成丙烯酸, 但当Nb掺杂量过高时则会促进1, 3-二氧戊环-4-甲醇等大分子物质的形成.此外, 当催化反应连续进行100 h时, 仅观察到对丙烯酸的选择性略有下降(从33%~34%下降至30.5%), 是由于六方钨青铜结构中V4+的逐步氧化所致.作者还发现, 丙烯醛和丙烯酸的选择性受反应条件的影响很大:例如当反应温度高于300 ℃或接触时间超过0.15 s时便容易生成COx和其他大分子物质.
Delgado D等[36]水热合成了一系列具有不同m-WO3和h-WO3相含量的W-V-O催化剂.研究表明, 含V的h-WO3晶相可促进丙烯醛和丙烯酸的形成, 催化剂中h-WO3相含量较低时, 主要形成碳氧化物和大分子物质.含V的h-WO3晶相呈现的V5+位点表现出比m-WO3晶相更高的还原性.甘油氧化脱水反应催化结果表明, m-WO3相中不存在酸性位点且对丙烯酸的形成具有负面影响.产物中丙烯酸/丙烯醛比例随h-WO3比例的增加而增加, 这意味着进入六方钨青铜结构的钒位点对丙烯醛部分氧化为丙烯酸具有选择性, 而m-WO3在甘油部分氧化中选择性较低, 主要生成碳氧化物和甘油低聚产物.
与Mo-V复合金属氧化物相比, W-V(Nb)复合金属氧化物可显著提高丙烯酸产率, 这是由于WO3晶相结合V可将丙烯醛选择性氧化为丙烯酸, 同时也提高了催化剂的热稳定性.尽管W-V(Nb)复合金属氧化物和其它催化剂在选择性生产丙烯酸方面展现了优异的性能, 但需要相对稳定的反应温度, 且对W-V(Nb)复合金属氧化物活性位点仍需进一步深入研究.
1.1.3 Mo-W-V系除了Mo-V、W-V两种催化剂体系外, Liu等[49]采用不同的煅烧温度制备了一系列Al2O3负载Mo-W-V复合金属氧化物催化剂.研究表明, 当煅烧温度为350 ℃时, 丙烯醛选择性为35.2%而丙烯酸选择性为19.8%, 通过以上数据我们发现, 在350 ℃下煅烧的催化剂活性不足以将丙烯醛转化为丙烯酸; 但当煅烧温度提高到450 ℃时, 丙烯酸的选择性达到46.2%, 而丙烯醛仅为3.0%, 同时与350 ℃下煅烧相比, COx的选择性急剧提高, 这说明煅烧温度的提高不仅促进丙烯酸的生成而且增强了氧化程度.当煅烧温度提高到550、650 ℃时, 丙烯酸选择性出现了下降, 丙烯醛选择性则增加了.为了了解煅烧温度对催化剂晶体结构的影响, 作者又做了一组对比实验:合成的催化剂无煅烧和350 ℃煅烧的样品显示出相同的XRD衍射峰(六边形的(V, Mo)O3或钼酸铵), 但450 ℃煅烧的催化剂晶体结构完全不同(类似于正交(V, Mo)O3物种), 与此同时观察到MoO3消失了, 并被许多复杂的团聚体所取代(例如Mo4O11 , V2O5, VO2以及(V, Mo)2O5和(V, Mo)4O11), 将煅烧温度进一步提高到550和650 ℃会使催化剂中Mo3VOx和WOx发生连续的结构变化(图 2).这很好地解释了在550和650 ℃煅烧时, 丙烯醛选择性的增加以及丙烯酸选择性的下降, 这是由于高温煅烧后(V, Mo)5O14活性晶相的消失, 此外催化剂表面积下降和孔结构的损失也可能导致催化性能的变化.

|
图 2 不同煅烧温度下负载物种结构演化方案[49] Fig.2 Scheme of structure evolution of supported species under different calcinations temperature[49] |
此外, Yun等[50]通过密度泛函理论计算(DFT), 将W掺入Mo-V复合氧化物中模拟制备了双功能Mo-V-W复合氧化物催化剂.结果表明, MoV中的Mo或V被掺入的W6+所替代, 催化剂酸强度得到显著提升, 有利于甘油氧化脱水反应.此外, 研究发现, 掺入的元素以W6+为主, W6+可将MoV晶体中的部分Mo6+和V5+分别还原成Mo5+和V4+, 这样便增加了低价态元素的含量, 同时形成了较弱的金属-氧相互作用, 提高了催化剂的氧化活性位比例, 从而有利于丙烯醛进一步氧化为丙烯酸; 随着W含量的增加, Mo5+/(Mo5++Mo6+)和V4+/(V4++V5+)比值以及催化剂的表面积和酸度均增加, 显著抑制了COx的生成(选择性降低30.6%), 丙烯酸的选择性提高了8.8%.此外, V4+/(V4++V5+)之比是决定丙烯酸和COx选择性的关键因素, V4+有利于将丙烯醛转化为丙烯酸而不是深度氧化产物, MoVW-5催化剂在250 ℃下, 丙烯酸选择性达到30.5%.研究认为W的存在不仅起到酸性物质的作用, 而且还具有促进剂的作用.
1.1.4 Fe-V(P)系Fe-V(P)复合金属氧化物也被人们用于甘油催化氧化制丙烯酸的反应中. Wang等[51]通过固态合成法制备了负载Fe2O3的Fe-V复合氧化物催化剂, 并研究了其对甘油脱氧串联反应的催化作用. FeVO4颗粒的表面被V=O和V-OH基团覆盖, 它们分别通过甘油的中碳和末端碳位置处脱水而生成丙烯醛或羟丙酮的活性位点, 生成的丙烯醛被重新吸附到FeOx上, 从而被进一步氧化为丙烯酸.作者认为, 在甘油氧化制丙烯酸的过程中, FeVO4相和FeOx结构分别为甘油脱水以及丙烯醛氧化为丙烯酸提供了相应的活性位点, 且嵌入式结构可稳定纳米尺寸的FeOx结构, 进一步提高了催化剂的稳定性.
1.2 间接法甘油间接法制丙烯酸与直接法的区别在于, 甘油→丙烯醛、丙烯醛→丙烯酸这两个反应过程是分别在两个反应设备中完成的, 首先在催化剂A作用下将甘油催化脱水氧化生成丙烯醛, 然后在催化剂B作用下再将丙烯醛进一步氧化为丙烯酸.与直接法相比, 间接法的两步串联或耦合使得丙烯酸收率可达到80%以上, 从工业应用的角度更具有发展潜力.用于丙烯醛氧化制丙烯酸的催化剂及相关反应工艺都已经实现了工业化.因此, 将甘油高选择性地氧化为丙烯醛是间接法的关键步骤和研究重点.目前, 用于甘油选择性氧化制丙烯醛的复合金属氧化物催化剂主要有Zr-Nb-O、W-Nb-O、Cs-W-O和Fe-P-O体系.
Lauriol-Garbay P等[52]合成的ZrNbO催化剂既能有效地将甘油脱水成丙烯醛, 又具有较高的稳定性, 在运行177 h后仍显示出82%的转化效率以及稳定的丙烯醛选择性.这是由于Nb含量的增加对催化剂的稳定性产生了积极的影响.尽管以往的研究认为Brønsted酸性位点和Lewis酸性位点都对反应起到了积极作用, 但同时两种酸的强度也会对反应产生一定的负面影响, 作者在该研究中就发现, 催化剂的失活与在强Lewis酸性位点上形成焦炭有关.这一问题可通过在反应过程中提高氮气流速来解决, 这是由于流速的增加减少积碳前驱体在反应器中的停留时间从而抑制了积碳的形成.研究认为, ZrNbO的高稳定性不仅与铌掺入氧化锆中以及Lewis和ZrO2载体的碱性位点有关, 同时还与氧化铌固有性质有关.
Omata等[53]利用水热法合成了具有层状结构的W-Nb-O (700 ℃)、W-Nb-O (1000 ℃)、Cs-W-Nb-O系列催化剂, 研究了催化剂晶相结构对甘油脱水制丙烯醛反应选择性的影响.这3种催化剂在c方向上都是八面体层状排列, 但a-b平面结构不同, 其中W-Nb-O (700 ℃)为无序排列, W-Nb-O (1000 ℃)基于Nb8W9O47相有序排列, Cs-W-Nb-O基于正交结构有序排列.研究表明, 虽然W-Nb-O (700 ℃)和Cs-W-Nb-O具有相近的丙烯醛选择性(W-Nb-O (700 ℃)29.7%, Cs-W-Nb-O30.5%), 但是催化活性却显著不同.而W-Nb-O (1000 ℃)和Cs-W-Nb-O相比, 脱水产物(例如羟丙酮)的产率更高, 而丙烯醛的产率较低.研究表明W-Nb-O复合金属氧化物是一种高效且有潜力催化剂, 在甘油制丙烯醛反应中收率高达70%以上.
Wang等[54]通过水热法制备了含有不同晶相(Cs0.12WO3, CsW1.6O6, CsW2O6)的Cs-W-O复合金属氧化物催化剂.研究发现, 纯相Cs-W-O复合金属氧化物对甘油脱水制丙烯醛具有良好的催化效果, 且铯的存在提高了丙烯醛的选择性.当Cs/W摩尔比为0.2/1时, 制备的Cs-W-O具有最好的催化性能, 甘油转化率为81.3%, 丙烯醛的选择性达到92.9%.
Deleplanque等[26]对合成的FePO4催化甘油脱水进行了研究, 发现FePO4对丙烯醛具有较高的选择性.研究通过水热合成、沉淀-浓缩法、氨法以及氨水热法均制备出了FePO4催化剂, 通过对比发现用氨水热法合成的磷酸铁催化剂(FeP-P和FeP-H)呈现出形状相对良好的颗粒, 具有大而平坦的表面(43.6 m2/g).同时水热合成法也能得到晶型结构良好的纯单斜晶FePO4催化剂, 且稳定性更高. FeP-H在280 ℃下催化反应5 h, 甘油可完全转化, 并且对丙烯醛选择性高达92%.
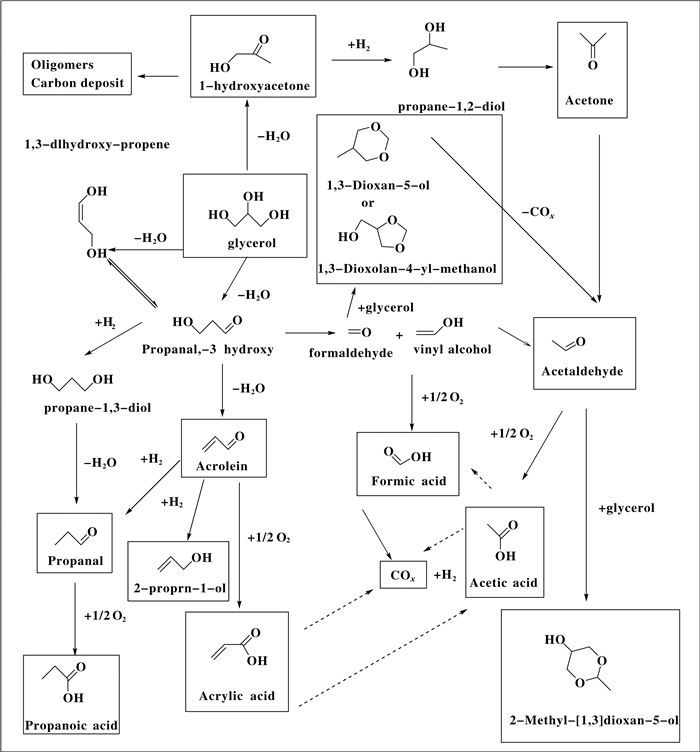
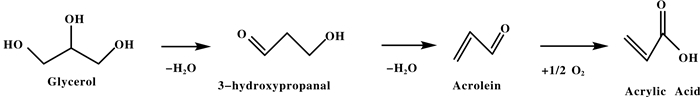
2 催化甘油氧化反应机理研究认为, 甘油脱水氧化生成丙烯酸需要3步反应(路线图 1):第1步, 甘油分子在催化剂的酸性位点(B和L酸)上发生脱水反应生成3-羟基丙醛; 第2步, 3-羟基丙醛再经脱水生成中间产物丙烯醛, 最后丙烯醛发生氧化生成丙烯酸.甘油脱水氧化机理如图 3所示, 由于甘油分子中同时存在端位羟基和仲位羟基, 当在B和L酸位发生脱水时, 会分别生成3-羟基丙醛和羟基丙酮. 3-羟基丙醛再经脱水可形成丙烯醛, 并且通过逆羟醛缩合反应, 3-羟基丙醛还产生乙醛和甲醛.甲醛可与甘油反应形成环醚产物, 或与氧气反应形成甲酸和COx.如果催化剂表面发生积碳, 反应则更倾向于生成羟基丙酮、乙醛和丙醛等产物, 并在有氧条件下继续生成甲酸、乙酸、丙酸和COx.通过反应机理可知, 对于甘油选择性氧化制丙烯酸反应而言, 理想的催化剂不仅应当拥有合适的酸性位点和氧化还原位点, 还应在催化过程中具有抑制积碳发生的结构特点, 这样才能获得高收率的丙烯酸以及持续的稳定性[26, 51].
|
图示1 甘油三步转化为丙烯酸 Scheme 1 The three steps required for glycerol transformation into acrylic acid |
基于对甘油氧化反应的认识, 随后的研究进一步拓展了对机理的认知, 提出了Mo-V-O和W-V-O复合金属氧化物催化甘油氧化的反应机理. Shen等[45]从催化剂活性位点(例如Mo5+、W5+和V4+)的角度出发, 提出了如图 4所示的反应路线.与前述反应路线一致的是, 作者也认为甘油的质子化是发生在伯羟基或仲羟基上, 前者通过裂解可产生乙醛, 而后者通过两步脱水反应可生成丙烯醛.丙烯醛再按照Marsvan-Krevelen机制进一步氧化为丙烯酸. Drochner等[55]通过研究发现,丙烯醛羰基中独立电子对与钼阳离子之间存在相互作用, 这会导致C—H键发生极化并在之后氧化还原反应中形成配位化合物, 紧接着羰基化合物被转化为丙烯酸酯, 形成的丙烯酸酯通过分解进而得到丙烯酸.这一理论很好地解释了丙烯醛和乙醛氧化为丙烯酸和乙酸的原因.此外, 丙烯酸或乙酸可被进一步氧化而形成CO和CO2.

|
图 4 Mo/V和W/V氧化物催化剂甘油氧化脱水反应路线[45] Fig.4 Reaction routes in glycerol oxide hydration over Mo/V and W/V oxide catalysts[45] |
对于一个理想的催化过程而言, 其技术核心是高性能的催化剂, 催化剂的晶相结构、表面酸碱性、氧化还原性以及元素价态等微观结构对催化结果具有决定性的影响.在此基础上, 适宜的工艺条件则可以使催化剂发挥出更佳的催化效果. 表 1、表 2总结了近年来甘油直接法、间接法制丙烯酸反应中, 各复合金属氧化物催化剂在不同条件下(反应温度、接触时间、氧气浓度等)的催化性能结果.
| 表 1 复合金属氧化物在不同反应条件下催化甘油选择性氧化结果 Table 1 Results of selective oxidation of glycerol catalyzed by composite metal oxides under different reaction conditions |
| 表 2 复合金属氧化物在不同反应条件下催化甘油脱水结果 Table 2 Dehydration of glycerol catalyzed by complex metal oxides under different reaction conditions |
在反应过程中, 甘油首先通过预热器气化, 然后进入反应器进行反应.通过表 1可知, 反应温度在290~350 ℃范围内.由于反应要经过脱水和氧化两大过程, 故而温度的控制在整体反应中显得极为重要, 温度过低导致脱水反应不完全, 中间产物丙烯醛产率大大降低; 但温度过高, 则会促使丙烯酸发生C—C键断裂转而生成COx等其他副产物[56]. Miller等[57]通过13C同位素示踪剂对丙烯酸C—C键断裂进行了深入研究, 研究发现键断裂后丙烯酸先生成乙烯, 然后在MoVOx催化剂上乙烯被氧化为乙酸. Rasteiro等[43]在研究Mo-V-O催化甘油转化为丙烯酸性能时得到最有效的温度为320 ℃, 通过对比其他温度发现, 在290 ℃下, 丙烯酸更多地吸附在催化剂表面上, 导致进一步的氧化生成COx, 从而很好的说明丙烯酸产率为何降低; 将温度升高至320 ℃, 有助于丙烯酸从催化剂表面解吸, 故而得到最佳的催化效果; 当温度升高至350 ℃, 在脱水成丙烯醛之前, 甘油的一部分会分解为COx, 所以中间产物丙烯醛产率大大降低.
3.2 接触时间对于连续催化氧化反应而言, 接触时间过长, 虽然促进了甘油在酸性位点转化为丙烯醛, 但却降低了丙烯醛在氧化位点上转化为丙烯酸的选择性; 反之, 如果接触时间过短, 则会降低甘油和丙烯醛与酸性位点以及氧化活性位点接触机会.因此, 反应物(甘油)和中间体(丙烯醛)与催化剂的接触时间都对反应具有重要的影响.为了明晰接触时间对反应的具体影响, Yun等[50]研究发现, 接触时间在0.05 s下检测到的产物有丙烯醛、乙醛、丙烯酸、乙酸以及氧化产物(CO和CO2), 这说明即使在很短的接触时间内甘油也完成了转化.当接触时间增加至0.16 s时, 丙烯酸的选择性从22.2%增加到28.7%, COx的产率从42.5%减少到37.1%, 该数据直观地说明当反应物和中间体缺乏与各个活性位点接触时间时, 会促进副产物生成.另一方面, 当接触时间为0.16 s时, 平衡了脱水和丙烯醛的选择性氧化, 故而提高了丙烯酸收率, 降低了副产物收率.随着接触时间的增加(> 0.2 s), COx的选择性显著增加, 在0.27 s时达到53.1%.检测时未发现丙烯醛、乙醛, 但乙酸的含量增加, 进一步说明接触时间过长, 促进了初级产物向次级产物的转化, 导致了深度氧化的发生.
3.3 氧气浓度丙烯醛首先在酸性位点上形成, 然后通过钒原子迅速氧化为丙烯酸, 但是V5+容易被氧化为V4+, 因此实验室多采用向反应器中通入O2使其得以恢复.通过以往研究发现钒的动态氧化还原(V5+
在当前以及将来很长一段时间内, 生物质资源利用及相关技术的开发都将会是世界各国重点研究及发展的内容之一.而生物柴油则是生物质资源利用领域最具代表性且发展最快的液体燃料之一, 对该生产过程的主要副产物甘油进行高效利用同样是重要且迫切的.复合金属氧化物是催化甘油氧化制备高附加值产品丙烯酸反应中具有发展前景的催化剂, 相对于其他催化剂, 其催化效果好、稳定性更高.然而, 无论是直接法还是间接法, 进一步研发具有高选择性及高稳定性的新型复合金属氧化物催化剂仍是推动生产工艺进步以及该领域发展的关键.
首先需要解决的是催化剂失活问题, 如常用的Mo-V-O催化剂体系中的有效活性组分(MoV2O8)极易被氧化成Mo4V6O25非活性相, 以及W-V-O催化剂体系中V4+的逐步氧化, 这些都能造成催化剂性能的下降, 大大缩短其使用寿命.通过向现有晶相中掺入合适的杂原子进而稳定活性晶相的结构或许是一种值得深入研究的手段.另外, 对于甘油氧化制丙烯酸反应来说, 复合金属氧化物催化剂表面的酸碱特性以及氧化还原性是影响催化性能优劣的重要因素, 开发新的制备技术并通过制备过程对催化剂酸碱性及氧化还原性进行定向调控, 进而实现甘油分子向丙烯酸分子高选择性的转化同样是今后研究的主要方向.
| [1] |
Bechthold I, Bretz K, Kabasci S, et al. Succinic acid: A new platform chemical for biobased polymers from renewable resources[J]. Chem Eng Technol, 2008, 31(5): 647–654.
|
| [2] |
Khanna S, Goyal A, Moholkar V S. Production of n-butanol from biodiesel derived crude glycerol using clostridium pasteurianum immobilized on amberlite[J]. Fuel, 2013, 112: 557–561.
|
| [3] |
Behr A, Eilting J, Irawadi K, et al. Improved utilisation of renewable resources: New important derivatives of glycerol[J]. Green Chem, 2008, 10(1): 13–30.
|
| [4] |
Dimitratos N, Lopez-Sanchez J A, Hutchings G J. Greencatalysis with alternative feedstocks[J]. Top Catal, 2009, 52(3): 258–268.
|
| [5] |
Besson M, Gallezot P, Pinel C. Conversion of biomass into chemicals over metal catalysts[J]. Chem Rev, 2014, 114(3): 1827–1870.
|
| [6] |
Hu L, Zhao G, Hao W, et al. Catalytic conversion of biomass-derived carbohydrates into fuels and chemicals via furanic aldehydes[J]. RSC Adv, 2012, 2(30): 11184–11206.
|
| [7] |
Wang Y, Xiao Y, Xiao G. Sustainable value-added C3 chemicals from glycerol transformations: A mini review for heterogeneous catalytic processes[J]. Chin J Chem Eng, 2019, 27(7): 1536–1542.
|
| [8] |
Katryniok B, Paul S, Capron M, et al. Towards the sustainable production of acrolein by glycerol dehydration[J]. ChemSusChem, 2009, 2(8): 719–730.
|
| [9] |
De Martino M T, Abdelmohsen L, Rutjes F, et al. Nanoreactors for green catalysis[J]. Beilstein J Org Chem, 2018, 14: 716–733.
|
| [10] |
Zhou C H, Xia X, Lin C X, et al. Catalytic conversion of lignocellulosic biomass to fine chemicals and fuels[J]. Chem Soc Rev, 2011, 40(11): 5588–5617.
|
| [11] |
Silitonga A S, Atabani A E, Mahlia T M I, et al. A review on prospect of Jatropha curcas for biodiesel in Indonesia[J]. Renew Sust Energ Rev, 2011, 15(8): 3733–3756.
|
| [12] |
Oh P P, Lau H L N, Chen J, et al. A review on conventional technologies and emerging process intensification (PI) methods for biodiesel production[J]. Renew Sust Energy Rev, 2012, 16(7): 5131–5145.
|
| [13] |
Katryniok B, Paul S, Dumeignil F. Recent developments in the field of catalytic dehydration of glycerol to acrolein[J]. ACS Catal, 2013, 3(8): 1819–1834.
|
| [14] |
Ayoub M, Abdullah A Z, Ahmad M, et al. Performance of lithium modified zeolite Y catalyst in solvent-free conversion of glycerol to polyglycerols[J]. J Taibah Univ Sci, 2018, 8(3): 231–235.
|
| [15] |
Yaakob Z, Mohammad M, Alherbawi M, et al. Overview of the production of biodiesel from waste cooking oil[J]. Renewable & Sustainable Energy Reviews, 2013, 18: 184–193.
|
| [16] |
Jerzykiewicz M, Cwielag I, Jerzykiewicz W. The antioxidant and anticorrosive properties of crude glycerol fraction from biodiesel production[J]. J Chem Technol Biot, 2009, 84(8): 1196–1201.
|
| [17] |
Callam C S, Singer S J, Lowary T L, et al. Computational analysis of the potential energy surfaces of glycerol in the gas and aqueous phases: Effects of level of theory, basis set, and solvation on strongly intramolecularly hydrogen-bonded systems[J]. J Am Chem Soc, 2001, 123(47): 11743–11754.
|
| [18] |
Zhou C H, Beltramini J N, Fan Y X, et al. Chemoselective catalytic conversion of glycerol as a biorenewable source to valuable commodity chemicals[J]. Chem Soc Rev, 2008, 37(3): 527–549.
|
| [19] |
Viswanadham B, Pavankumar V, Chary K V R. Vaporphase dehydration of glycerol to acrolein over phosphotungstic acid catalyst supported on niobia[J]. Catal Lett, 2014, 144(4): 744–755.
|
| [20] |
Sun D, Yamada Y, Sato S, et al. Glycerol as a potential renewable raw material for acrylic acid production[J]. Green Chem, 2017, 19(14): 3186–3213.
|
| [21] |
Foo G S, Wei D, Sholl D S, et al. Role of Lewis and Brønsted acid sites in the dehydration of glycerol over niobia[J]. ACS Catal, 2014, 4(9): 3180–3192.
|
| [22] |
Mahdavi V, Monajemi A. Gas phase dehydration of glycerol catalyzed by gamma Al2O3 supported V2O5: A statistical approach for simultaneous optimization[J]. RSC Adv, 2016, 6(115): 114244–114255.
|
| [23] |
Denkwitz Y, Zhao Z, HRmann U, et al. Stability and deactivation of unconditioned Au/TiO2 catalysts during CO oxidation in a near-stoichiometric and O2-rich reaction atmosphere[J]. J Supercrit Fluid, 2007, 251(2): 363–373.
|
| [24] |
Sung K H, Cheng S. Effect of Nb doping in WO3/ZrO2 catalysts on gas phase dehydration of glycerol to form acrolein[J]. RSC Adv, 2017, 7(66): 41880–41888.
|
| [25] |
Yu W, Wang P, Zhou C, et al. Acid-activated and WO-loaded montmorillonite catalysts and their catalytic behaviors in glycerol dehydration[J]. Chin J Catal, 2017, 38(6): 1087–1100.
|
| [26] |
Deleplanque J, Dubois J L, Devaux J F, et al. Production of acrolein and acrylic acid through dehydration and oxydehydration of glycerol with mixed oxide catalysts[J]. Catal Today, 2010, 157(1/4): 351–358.
|
| [27] |
Thanasilp S, Schwank J W, Meeyoo V, et al. Preparation of supported POM catalysts for liquid phase oxydehydration of glycerol to acrylic acid[J]. J Mol Catal A-Chem, 2013, 380: 49–56.
|
| [28] |
Witsuthammakul A, Sooknoi T. Direct conversion of glycerol to acrylic acid via integrated dehydration-oxidation bed system[J]. Appl Catal A-Gen, 2012, 413/414: 109–116.
|
| [29] |
Sarkar B, Pendem C, Sivakumar Konathala L N, et al. Cu nanoclusters supported on nanocrystalline SiO2-MnO2: A bifunctional catalyst for the one-step conversion of glycerol to acrylic acid[J]. Chem Commun, 2014, 50(68): 9707–9710.
|
| [30] |
Wang F, Dubois J L, Ueda W. Catalytic dehydration of glycerol over vanadium phosphate oxides in the presence of molecular oxygen[J]. J Catal, 2009, 268(2): 260–267.
|
| [31] |
Wu S T, She Q M, Tesser R, et al. Catalytic glycerol dehydration-oxidation to acrylic acid[J]. Catal Rev, 2020.
DOI:10.1080/01614940.2020.1719611 |
| [32] |
Feng X, Sun B, Yao Y, et al. Renewable production of acrylic acid and its derivative: New insights into the aldol condensation route over the vanadium phosphorus oxides[J]. J Catal, 2014, 314: 132–141.
|
| [33] |
Xu X, Lin J, Cen P. Advances in theresearch and development of acrylic acid production from biomass[J]. Chin J Chem Eng, 2006, 14(4): 419–427.
|
| [34] |
Paula A S, Possato L G, Ratero D R, et al. One-step oxide hydration of glycerol to acrylic acid using ETS-10-like vanadosilicates[J]. Micropor Mesopor Mat, 2016, 232: 151–160.
|
| [35] |
Chieregato A, Soriano M D, Garcia-Gonzalez E, et al. Multielement crystalline and pseudocrystalline oxides as efficient catalysts for the direct transformation of glycerol into acrylic acid[J]. ChemSusChem, 2015, 8(2): 398–406.
|
| [36] |
Delgado D, Chieregato A, Soriano M D, et al. Influence of phase composition of bulk tungsten vanadium oxides on the aerobic transformation of methanol and glycerol[J]. Eur J Inorg Chem, 2018, 2018(10): 1204–1211.
|
| [37] |
Possato L G, Diniz R N, Garetto T, et al. A comparative study of glycerol dehydration catalyzed by micro/mesoporous MFI zeolites[J]. J Catal, 2013, 300: 102–112.
|
| [38] |
Liu Rong(刘蓉), Xiao Tian-cun(肖天存), Wang Xiao-long(王晓龙), et al. Preparation of acrylic acid from biomass by-product crude glycerol(生物质副产物粗甘油制备丙烯酸)[J]. Petrkchem Technol(石油化工), 2018, 47(8): 820–826.
|
| [39] |
Chen Xiao-na(陈小娜), He Dan-dan(何丹丹), Chen Zhi-peng(陈志鹏), et al. Preparation of acrylic acid by catalytic oxidative dehydration of crude glycerol by-product of biodiesel(生物柴油副产物粗甘油催化氧化脱水制备丙烯酸)[J]. Chin J Process Eng(过程工程学报), 2019, 2019(S01): 123–128.
|
| [40] |
Possato L G, Acevedo M D, Padró C L, et al. Activation of Mo and V oxides supported on ZSM-5 zeolite catalysts followed by in situ XAS and XRD and their uses in oxydehydration of glycerol[J]. Mol Catal, 2020, 481: 110–158.
|
| [41] |
Dos Santos M B, Andrade H M C, Mascarenhas A J S. Oxidative dehydration of glycerol over alternative H, Fe-MCM-22 catalysts: Sustainable production of acrylic acid[J]. Micropor Mesopor Mat, 2019, 278: 366–377.
|
| [42] |
Possato L G, Cassinelli W H, Meyer C I, et al. Thermal treatments of precursors of molybdenum and vanadium oxides and the formed MoxVyOz phases active in the oxydehydration of glycerol[J]. Appl Catal A-Gen, 2017, 532: 1–11.
|
| [43] |
Rasteiro L F, Vieira L H, Possato L G, et al. Hydrothermal synthesis of Mo-V mixed oxides possessing several crystalline phases and their performance in the catalytic oxydehydration of glycerol to acrylic acid[J]. Catal Today, 2017, 296: 10–18.
|
| [44] |
Rasteiro L F, Vieira L H, Santilli C V, et al. Surfactant-assisted synthesis of Mo-V mixed oxide catalysts for upgraded one-step conversion of glycerol to acrylic acid[J]. RSC Adv, 2018, 8(22): 11975–11982.
|
| [45] |
Shen L, Yin H, Wang A, et al. Gas phase oxidehydration of glycerol to acrylic acid over Mo/V and W/V oxide catalysts[J]. Chem Eng J, 2014, 244: 168–177.
|
| [46] |
Soriano M D, Concepción P, Nieto J M L, et al. Tungsten-Vanadium mixed oxides for the oxidehydration of glycerol into acrylic acid[J]. Green Chemistry, 2011, 13(10): 2954–2962.
|
| [47] |
Omata K, Matsumoto K, Murayama T, et al. Directoxidative transformation of glycerol into acrylic acid over phosphoric acid-added W-V-Nb complex metal oxide catalysts[J]. Chem Lett, 2014, 43(4): 435–437.
|
| [48] |
Chieregato A, Basile F, Concepción P, et al. Glycerol oxidehydration into acrolein and acrylic acid over W-V-Nb-O bronzes with hexagonal structure[J]. Catal Today, 2012, 197(1): 58–65.
|
| [49] |
Liu L, Wang B, Du Y, et al. Bifunctional Mo3VOx/H4-SiW12O40/Al2O3 catalysts for one-step conversion of glycerol to acrylic acid: Catalyst structural evolution and reaction pathways[J]. Appl Catal B-Environ, 2015, 174/175: 1–12.
|
| [50] |
Yun Y S, Lee K R, Park H, et al. Rationaldesign of a bifunctional catalyst for the oxydehydration of glycerol: A combined theoretical and experimental study[J]. ACS Catal, 2014, 5(1): 82–94.
|
| [51] |
Wang F, Xu J, Dubois J L, et al. Catalytic oxidative dehydration of glycerol over a catalyst with iron oxide domains embedded in an iron orthovanadate phase[J]. ChemSusChem, 2010, 3(12): 1383–1389.
|
| [52] |
Lauriol-Garbay P, Millet J M M, Loridant S, et al. New efficient and long-life catalyst for gas-phase glycerol dehydration to acrolein[J]. J Catal, 2011, 280(1): 68–76.
|
| [53] |
Omata K, Izumi S, Murayama T, et al. Hydrothermal synthesis of W-Nb complex metal oxides and their application to catalytic dehydration of glycerol to acrolein[J]. Catal Today, 2013, 201: 7–11.
|
| [54] |
Wang Ting-ting(王婷婷), Song Yu(宋玉), Zhang Min-na(张敏娜), et al. Synthesis of cesium tungsten bronze and its catalytic performance for the dehydration of glycerol to acrolein(铯钨青铜的合成及其对甘油脱水制丙烯醛的催化性能)[J]. Chem(化学通报), 2019, 82(11): 1008–1012.
|
| [55] |
Drochner A, Ohlig D, Knoche S, et al. Mechanisticstudies on the transition metal oxide catalysed partial oxidation of (Meth)acrolein to the corresponding carboxylic acids[J]. Top Catal, 2016, 59(17/18): 1518–1532.
|
| [56] |
Hua Dong-long(花东龙), Zhuang Xiao-yu(庄晓煜), Tong Dong-shen(童东绅), et al. Catalytic dehydration and oxidation of glycerin in series to produce acrylic acid(催化甘油脱水氧化连串反应制丙烯酸)[J]. Prog Chem(化学进展), 2016, 28(Z2): 375–390.
|
| [57] |
Miller J H, Bhan A. Reaction pathways in acrolein oxidation over a mixed-oxide catalyst[J]. ChemCatChem, 2018, 10(22): 5242–5255.
|
| [58] |
Chieregato A, Soriano M D, Basile F, et al. One-pot glycerol oxidehydration to acrylic acid on multifunctional catalysts: Focus on the influence of the reaction parameters in respect to the catalytic performance[J]. Appl Catal B-Environ, 2014, 150/151: 37–46.
|
 2020, Vol. 34
2020, Vol. 34