2. 昆明冶金研究院有限公司, 云南 昆明 650503;
3. 共伴生有色金属资源加压湿法冶金技术国家重点实验室, 云南 昆明 650503
2. Kunming Metallurgical Research Institute, Kunming 650503, China;
3. StateKey Laboratory of Common Associated Non-ferrous Metal Resources Pressure Hydrometallurgy Technology, Kunming 650503, China
铝-空气电池是一种金属燃料电池, 其组成为金属电极、电解液、空气电极. 正极(阴极)消耗氧气, 由防水透气膜、催化剂及导电材料构成. 负极(阳极)消耗金属铝, 由高纯铝、铝合金或工业铝构成. 在铝-空气电池放电的过程中, 空气电极作为电池的阴极, 是制约铝-空气电池产业化应用的关键因素之一[1]. 空气阴极在控制铝空气电池氧还原反应(orr)中起着重要作用. 空气阴极通常加入高活性催化材料, 以降低功率损耗, 改善放电性能. 因此寻求各种新型的具有高催化效能、绿色环保等特点的催化剂已成为空气电池研究热点之一[2].
目前铝-空气电池空气电极大多使用过渡金属氧化物作为催化剂. 贵金属是一种很好的空气电极材料, 但是其价格昂贵, 使其应用受到限制[3]. 金属氧化物二氧化锰因其优越的物理化学性质, 如多价性[4]、多晶性[5]、氧化还原能力[6-7]等, 已成为一个很有吸引力的候选材料, 人们已进行了大量的研究工作, 以提高其催化活性. 除了目前常规的二氧化锰之外[8-9], 单氧化物、复合氧化物也具有催化能力. 它们低价易获取, 对orr过程和H2O2分解过程都起到了一定的催化性能[10-12].
其中, 具有高的比表面积和原子占有率的复合氧化物, 由于其具有的特殊表面位置和相对于单氧化物来说较多的缺陷结构, 从而具备了优异的氧传递和电子转移能力, 比单氧化物凸显出更加优异的理化性质, 这也是复合氧化物的优点之一, 在氧化还原反应方面具有更好的催化性能, 光电反应方面具有较好的电化学性能[13-15]. 钙钛矿是一类定义明确的ABO3复合氧化物材料, 其中A是一个与氧离子大小相似的大阳离子, B是一个较小的阳离子填充八面体孔, 由氧和A离子的封闭填充晶格形成, 这种钙钛矿型氧化物, 导电率很高, 理想的钙钛矿的晶型为立方晶系[16-20]. 例如, 具有类钙钛矿型结构的K2NiF4复合氧化物, 其氧化催化能力有较高的体现. 赵三平等[16]通过计算发现Na2MoO4对催化H2O2氧化的可行性. 另外Huang等[17]制备了La.Mn.Fe复合氧化物催化剂, 对催化CO有良好的催化活性. Beste A[18]制备了Sr掺杂的LaMnO3复合氧化物, 并发现其可催化甲醇还原. 李升宪等[21]制备了尖晶石型复合氧化物ZnMn204, 该材料的初始电容量可达140 mA· h·g-1, 且具有较好的可逆性. 柴应洁等[22]制备了La0.46Sr0.34Ti0.9Ni0.1O3复合氧化物, 发现其对甲烷干重整有较好的催化活性. 秦毅红等[23]制备了LaxSr1-xFeO3复合氧化物, 并发现其对催化SO2还原有良好的性能. 晏耀宗等[24]制备了La1-xCaxMnO3复合氧化物, 并发现其对甲烷催化燃烧有良好性能. 因此, 复合氧化物材料具有广阔的市场发展前景.
我们采用共沉淀法、溶胶凝胶法[25-26]制备了不同形貌的ZnMn复合氧化物, 并将其作为铝空气电池空气电极催化剂, 研究了制备的3种不同形貌ZnMn复合氧化物的催化和电化学性能.
1 实验方法 1.1 材料的制备球形ZnMn复合氧化物的制备(实验所用试剂均为分析级, 未经进一步纯化而使用)采用共沉淀法制备, 按摩尔比为1∶1取Zn(NO3)2·6H2O和Mn(SO4)2·H2O配置成1 L溶液(其中各金属离子浓度为0.1 mol·L-1的均匀混合溶液), 配置1 L浓度为0.2 mol·L-1的无水碳酸钠溶液, 往3 L的三口烧瓶中加入100 mL去离子水, 将0.2 mol·L-1的碳酸钠溶液与Zn(NO3)2·6H2O和Mn(SO4)2·H2O的混合溶液通过蠕动泵以6 mL·min-1同时泵入三口烧瓶中, 并不断搅拌, 通过3 h充分搅拌后, 对悬浊液静置3 h, 并用无水乙醇和去离子水洗涤沉淀数次, 过滤, 获得沉淀在80 ℃恒温干燥箱干燥过夜, 获得ZnMn(CO3)2前驱体, 在马弗炉中经过800 ℃(100 ℃·h-1)煅烧4 h, 获得黑色粉末, 并研磨备用.
刺球形ZnMn复合氧化物的制备采用共沉淀法制备, 将Zn(NO3)2·6H2O和Mn(SO4)2·H2O按摩尔比1∶1配置成1 L溶液(其中各金属离子浓度为0.3 mol·L-1的均匀混合溶液), 并配置1 L浓度为0.1 mol·L-1的NH4HCO3溶液. 将两种溶液同时滴加入3 L的烧杯中, 同时搅拌, 滴加完成后反应3 h, 陈化3 h. 用去离子水和酒精洗涤3次, 过滤获得白色粉末. 将其在80 ℃干燥箱烘干12 h, 获得前驱体粉末. 将粉末于800 ℃(100 ℃·h-1)马弗炉中煅烧4 h, 获得黑色粉末, 并研磨备用.
不规则絮状ZnMn复合氧化物采用溶胶凝胶法制备, 将Zn(NO3)2·6H2O与Mn(SO4)2·H2O按1∶1配置成1 L溶液(其中各金属离子浓度为0.1 mol·L-1的均匀混合溶液), 然后加入乙二胺四乙酸(EDTA)和柠檬酸(CA)作为螯合剂. 总金属离子/EDTA/CA的摩尔比为1∶1∶1.5, 并调节pH值为8. 在80 ℃的恒温水浴锅中搅拌直到得到湿凝胶, 将其在80 ℃干燥箱烘干12 h得到干凝胶, 将干凝胶于800 ℃(100 ℃·h-1)马弗炉中煅烧4 h获得黑色粉末, 并研磨备用.
1.2 空气电极的制备将导电炭黑和草酸铵均匀混合于无水乙醇中, 向混合液中缓慢加入PTFE, 并不断搅拌, 使之充分混合均匀, 获得浆糊状浆料, 再通过辊压机压制成0.5 mm厚的薄膜, 放入干燥箱中干燥, 待干燥后使用辊压机压在处理完成的镍网上, 用作防水透气层, 其组分配比为导电炭黑∶PTFE∶草酸铵=40%∶40%∶20%(质量分数);然后再分别制备不同形貌ZnMn复合氧化催化层, 将4 g催化剂和4 g导电炭黑倒入10 mL无水乙醇中, 充分搅拌, 再加入5 mL 60%(质量分数)PTFE溶液, 并在80 ℃的水浴锅中搅拌蒸发无水乙醇, 最后获得糊状产物, 经辊压机压成0.1 mm厚的薄膜, 并与防水透气层复合成空气电极.
1.3 材料表征及电化学性能测试物相结构使用PANalytical公司的X’Pert Power型X射线粉末衍射仪(XRD)分析, 辐射源为Cu靶发射Kα射线, 管电压40 kV, 管电流100 mA, 扫描速度为2 (°)/min, 测试角度为2θ=10°~80°. 形貌观察使用TESCAN公司的MIRA3型扫描电子显微镜(SEM). 采用三电极体系在Metrohm公司的PGSTAT101型电化学工作站进行电化学性能测试, 工作电极为玻璃碳电极d=3 mm、Ag/AgCl为参比电极、铂片为对电极, 电解液采用0.1 mol/L的KOH溶液. CV扫描电位范围为-1 V~1 V和-0.2 V~0.8 V, 扫描速度为1 mV·s-1, 交流阻抗测试频率范围为: 0.01~10 kHZ. 空气电极作为正极, 其有效工作面积为10 cm2, 用高纯铝板作为负极, 在塑料框架中组成半电池, 用蓝电测试仪检测半电池的放电性能.
2 结果与分析 2.1 结构与形貌图 1是不同形貌的ZnMn复合氧化物的XRD图. 图 1a是球形ZnMn复合氧化物的XRD图, 经与标准PDF卡片对比, 可发现球形ZnMn复合氧化物的衍射峰为18.1°、30.4°、35.2°、37.2°、43.4°、53.5°、57.6°和63.3°, 与ZnMnO3(PDF#19-1461)的衍射峰相符合, XRD显示出现的是ZnMnO3的(1 1 1)、(2 2 0)、(3 1 1)、(2 2 2)、(4 0 0)、(4 0 0)、(5 1 1)和(4 0 0)晶面, 这八个特征晶面可很好的印证合成的复合氧化物为ZnMnO3. 其尖锐的衍射峰, 表明其良好的结晶度, 且属于立方晶系, 该结构与钙钛矿结构ABO3相同, 锰离子与六个氧离子形成八面体配位; 锌离子位于由八面体构成的空穴内, 形成立方钙钛结构.

|
图 1 不同形貌的ZnMn复合氧化物的XRD Fig.1 The X-ray diffraction pattern of ZnMn composite oxides with different morphologies (a. 球形; b. 不规则絮状; c. 刺球) (a. Spherical; b. Irregular flocculent; c. Spiny spherical) |
图 1b为不规则絮状ZnMn复合氧化物的XRD图, 合成的ZnMn复合氧化物主要由ZnO和ZnMn2O4两种物质组成, 在18.2°、29.3°、31.2°、33.0°、36.4°、36.9°、38.9°、44.7°、46.0°、48.7°、50.7°、51.9°、54.4°、56.7°、59.0°、60.8°、61.9°、64.7°、65.1°、66.2°、68.3°、69.2°分别是ZnMn2O4的(1 0 1)、(1 1 2)、(2 0 0)、(1 0 3)、(2 1 1)、(2 0 2)、(0 0 4)、(2 2 0)、(2 1 3)、(3 0 1)、(2 0 4)、(1 0 5)、(3 1 2)、(3 0 3)、(3 2 1)、(2 2 4)、(2 1 5)、(1 1 6)、(4 0 0)、(3 2 3)、(4 1 1)、(2 0 6)晶面特征衍射峰, 32.0°、34.4°、36.5°、47.7°、57.1°、63.1°分别是ZnO的(1 0 0)、(0 0 2)、(1 0 1)、(1 0 2)、(1 1 0)、(1 0 3)晶面的特征衍射峰.
图 1c为刺球形ZnMn复合氧化物的XRD图, 所制备的ZnMn复合氧化物分别在37.6°、34.4°、36.2°、47.5°、56.6°、62.8°、66.3°、67.9°、69.1°、72.5°、73.9°, 出现ZnO的(1 0 0)、(0 0 2)、(1 0 1)、(1 0 2)、(1 1 0)、(1 0 3)、(2 0 0)、(1 1 2)、(2 0 1)、(0 0 4)、(2 0 2)晶面衍射峰, 在18.3°、30.2°、35.6°、37.3°、43.4°、53.8°、57.3°、62.9°出现的ZnMnO3的(1 1 1)、(2 2 0)、(3 1 1)、(2 2 2)、(4 0 0)、(4 2 2)、(5 1 1)、(4 4 0)晶面衍射峰, 可知合成的ZnMn复合氧化物主要是由ZnO和ZnMnO3组成. 由于硝酸锌和硫酸锰总摩尔量与NH4HCO3的摩尔比为6∶1, 故硝酸锌和硫酸锰是过量的. ZnMnO3属于立方晶系, 该结构与钙钛矿结构ABO3相同, 锰离子与六个氧离子形成八面体配位; 锌离子位于由八面体构成的空穴内, 形成立方钙钛结构.
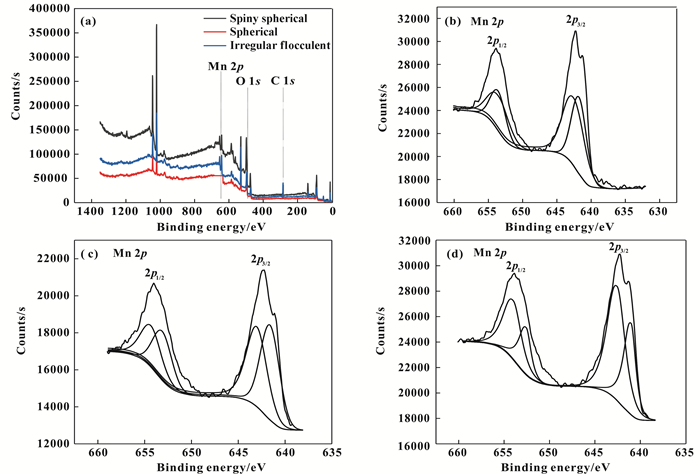
图 2是不同形貌的ZnMn复合氧化物的XPS图谱. 由图 2(a)可清楚的看见锰的峰. 从高分辨率Mn 2p光谱图 2(b)中可以看出, 在641.8和653.8 eV, 它们很好的应对于Mn 2p3/2和Mn 2p1/2. 这两个峰可以进一步反褶积成4个子峰, 641.2和652.4 eV处的两个峰归属于Mn2+的结合能, 643.4和653.8 eV处的两个峰证明了Mn4+的存在. 从高分辨率Mn 2p光谱图 2(c)中可以看出, 在641.5和653.5 eV出现了两个主要峰值, 它们很好的应对于Mn 2p3/2和Mn 2p1/2. 这两个峰可以进一步反褶积成4个子峰, 641.6和652.8 eV处的两个峰归属于Mn2+的结合能, 643.7和654.1 eV处的两个峰证明了Mn4+的存在. 从高分辨率Mn 2p光谱图 2(d)中可以看出, 在641.9和653.9 eV出现了两个主要峰值, 它们很好的应对于Mn 2p3/2和Mn 2p1/2. 这两个峰可以进一步反褶积成4个子峰, 640.9和652.1 eV处的两个峰归属于Mn2+的结合能, 644.1和654.5 eV处的两个峰证明了Mn4+的存在. 由此表明, 我们制备的3种不同形貌的ZnMn复合氧化物中Mn2+和Mn4+共存.
|
图 2 不同形貌的ZnMn复合氧化物的XPS图谱 Fig.2 XPS spectra of ZnMn composite oxides with different morphologies (a.全谱; b. 刺球形精扫谱; c.球形精扫谱; d.不规则絮状精扫谱) (a. Full spectrum; b. Spiny spherical Pure sweep spectrum; c. Spherical Pure sweep spectrum; d. Irregular flocculent Pure sweep spectrum) |
图 3是不同形貌的ZnMn复合氧化物的扫描电镜图. 由图 3(a)可知, ZnMnO3呈现良好的球形, 无团聚现象, 直径在0.3 nm~3 μm, 且具有很好的分散性. ZnMnO3的形貌主要由前驱体决定, 单纯的ZnCO3是没有特定形貌的粉末, MnCO3是具有球形结构的粉末, 由此可知, 前驱体ZnMn(CO3)2的形貌主要由MnCO3起到结构支撑, 而ZnCO3嵌入在MnCO3中, 所以可以通过控制前驱体的形貌获得球形ZnMnO3. 图 3(b)制备的ZnO+ZnMn2O4呈现不规则絮状, 说明混合煅烧后, ZnO+ZnMn2O4主要保持MnO2之前的形貌. 图 3(c)可见制备的ZnO+ZnMnO3形状类似于刺球, 由于团聚的原因, 无法较好的看清其结构. 由于该方法在制备单一前驱体过程中, Mn(CO3)2主要呈现球形, ZnO呈现线状, 在两者混合制备过程中, 就以Mn(CO3)2为骨架, 生长出了刺球形ZnxMn(1-x)(CO3)2前驱体, 说明其生长方式以刺球为圆心, 向四周生长.

|
图 3 不同形貌的ZnMn复合氧化物的扫描电镜图 Fig.3 SEM images of ZnMn composite oxides with different morphology (a. 球形; b.不规则絮状; c.刺球形) (a. Spherical; b. Irregular flocculent; c. Spiny spherical) |
图 4是在-196 ℃下进行N2吸附-脱附实验, 分析样品的结构和孔隙. 所以样品的等温线形状基本相同, 可以根据IUPAC分类将其归为Ⅲ型等温线, 在相对压力P/P0范围为0.8~1时具有回滞环, 表明制备的催化剂具有介孔结构. 得到球形、刺球形、絮状催化剂的比表面积分别为4.64、9.66和9.09 m2·g-1, 孔容分别为0.02、0.03和0.03 cm3/g, 孔径分别为6.580、5.909、6.237 nm.

|
图 4 (a). 不同形貌催化剂的N2吸附/脱附等温曲线; (b) 不同形貌催化剂的孔径分布 Fig.4 (a) N2 adsorption/desorption isothermal curves of catalysts with different morphologies; (b) pore size distributions of catalysts with different morphologies |
图 5是球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO在-1~1 V范围内的循环伏安曲线图. 从图 5可知球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO在-1~1 V范围内具有相似的循环伏安曲线, 均具有3个氧化峰, 说明ZnMn复合氧化物具有很好的氧化还原性能.

|
图 5 3种ZnMn复合氧化物循环伏安图(-1~1 V) Fig.5 Cyclic voltammograms of ZnMn composite oxides with different morphology(-1~1 V) |
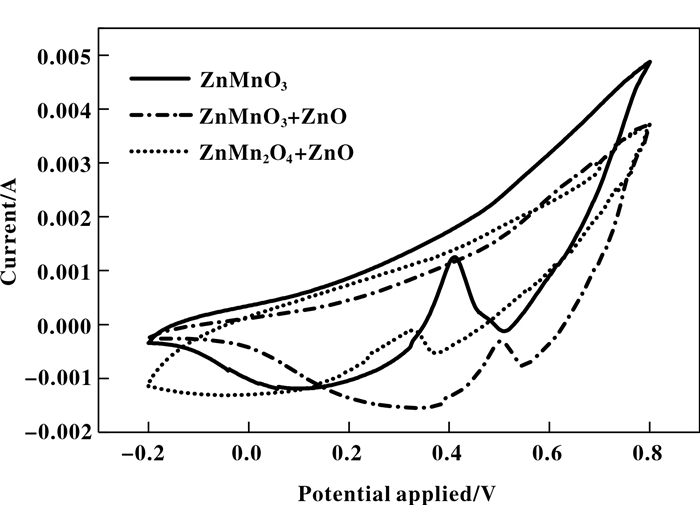
图 6是球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO在-0.2~0.8 V范围内的循环伏安曲线图. 从图中可以看出三者均出现两个还原峰, 与图 5在该处出现的两个还原峰相同. 通过对比3种ZnMn复合氧化物的还原电位发现球形ZnMnO3和ZnMn2O4+ZnO的还原电位较低, 刺球形ZnMnO3+ZnO还原电位较高. 说明刺球形ZnMnO3+ZnO还原性能较好. 这是由于刺球形结构能够赋予催化剂更多的活性位点, 从而提高了催化活性.
|
图 6 3种ZnMn复合氧化物循环伏安图(-0.2~0.8 V) Fig.6 Cyclic voltammograms of ZnMn composite oxides with different morphology(-0.2~0.8 V) |
ZnMnO3为钙钛矿型催化剂, 还原过程为O2的两电子还原生成HO2-, 然后再经过一个两电子还原成H2O. 钙钛矿氧化物的作用则是通过B位离子Mn吸附O2还原生成HO2-, 然后进一步将其催化还原为H2O. 观察ZnMnO3的还原峰可知, 在0.54和0.05 V附近出现的还原峰与这一过程相对应, 说明ZnMnO3催化氧气还原遵循两电子还原过程, ZnMnO3在-0.7 V附近出现还原峰, 这是Mn4+还原为Mn2+的反应, 与之相对应的出现的3个氧化峰是相对应的氧化过程, 循环伏安结果表明: ZnMnO3是一种催化性能优良的催化剂. 两电子反应如下:
| $ {{\rm{O}}_2} + {{\rm{H}}^ + } + 2{{\rm{e}}^ - } \to {\rm{HO}}_2^ - $ | (a) |
| $ {\rm{HO}}_2^ - + 3{{\rm{H}}^ + } + 2{{\rm{e}}^ - } \to 2{{\rm{H}}_2}{\rm{O}} $ | (b) |
ZnMn2O4+ZnO、ZnMnO3+ZnO与ZnMnO3具有相似的循环伏安曲线, 说明其与钙钛矿型催化剂具有相同的催化氧气还原机理, 为两个两电子反应过程.
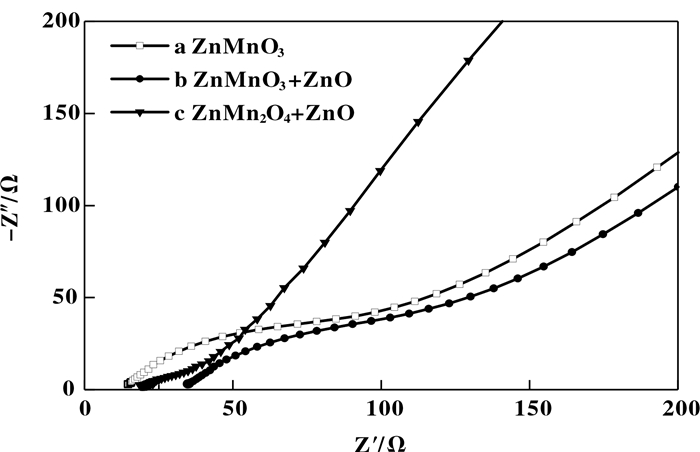
图 7是球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO的交流阻抗曲线. 从图 7可知球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO的交流阻抗曲线相似, 都是高频区的圆弧和低频区的直线组成.
|
图 7 不同形貌的ZnMn复合氧化物交流阻抗曲线 Fig.7 AC impedance curves of ZnMn composite oxides with different morphology |
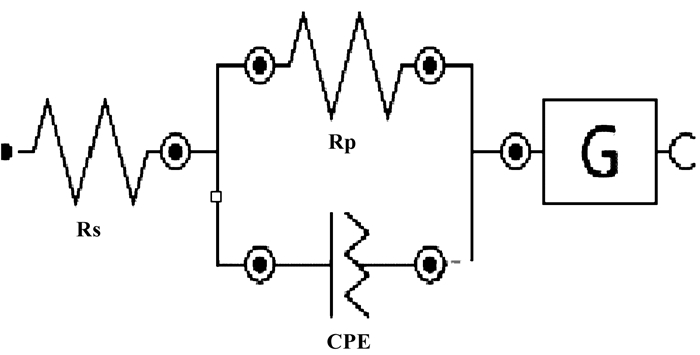
通过对3种不同形貌产物的交流阻抗曲线拟合发现, 3种材料的等效电路图具有相似的电路构成, 如图 8所示. 通过对比阻抗曲线可知, 球形ZnMnO3阻抗曲线所呈现的阻抗Rs最小, 刺球形ZnMnO3+ZnO阻抗Rs次之, 不规则絮状ZnMn2O4+ZnO阻抗Rs最大. 说明球形ZnMnO3的导电性能最好.
|
图 8 不同形貌的ZnMn复合氧化物的等效电路 Fig.8 Equivalent circuit of ZnMn composite oxides with different morphology |
图 9是球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO作为电极催化剂在6 mol·L-1的KOH溶液中的塔菲尔曲线. 从图中可以看出球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO的塔菲尔曲线有大致相同的趋势.
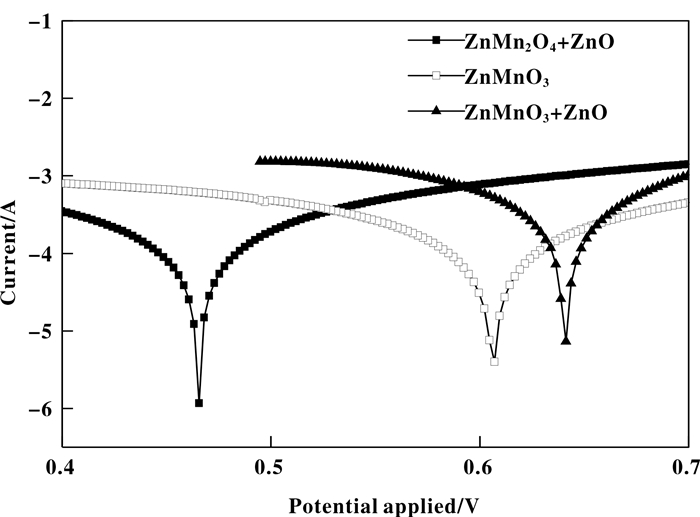
|
图 9 3种ZnMn复合氧化物的塔菲尔曲线图 Fig.9 Tafel curves of ZnMn composite oxides with different morphology |
腐蚀电位和腐蚀电流的大小能够表明材料的耐腐蚀性能的好坏, 将3种形貌复合氧化物作为正极, 研究其耐腐蚀性能, 腐蚀电位越小耐腐蚀性能越好, 腐蚀电流位置越低耐腐蚀性能越好. 根据图 9可知刺球形ZnMnO3+ZnO的腐蚀电位比球形ZnMnO3和不规则絮状ZnMn2O4+ZnO的腐蚀电位更高, 腐蚀电流比球形ZnMnO3和不规则絮状ZnMn2O4+ZnO更高, 这表明刺球形ZnMnO3+ZnO的耐腐蚀性能最差, 相反不规则絮状ZnMn2O4+ZnO具有最低的腐蚀电压与腐蚀电流说明其在施加工作电压后最不容易发生腐蚀反应, 实验结果说明不规则絮状ZnMn2O4+ZnO的耐腐蚀性能最好.
图 10是球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO作为催化剂的铝空气电池放电曲线. 从图 10看出, 3种形貌做催化剂的铝空气电池在同一电流密度下电压平台都随时间而下降, 但球形ZnMnO3的初始电压最高, 在同一电流密度下球形ZnMnO3作催化剂时的电压平台下降速度低于另外两种催化剂的电压平台下降速度, 结合交流阻抗和放电测试与循环伏安曲线的结果分析可以知道, 电压平台随电流密度增加而下降是由于电阻造成的, 由此可知用球形ZnMnO3的电阻和极化电阻明显低于另外两种形貌, 说明球形ZnMnO3作为空气电极催化与不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO相比较时, 球形ZnMnO3的放电性能, 具有更好的氧还原催化性能.
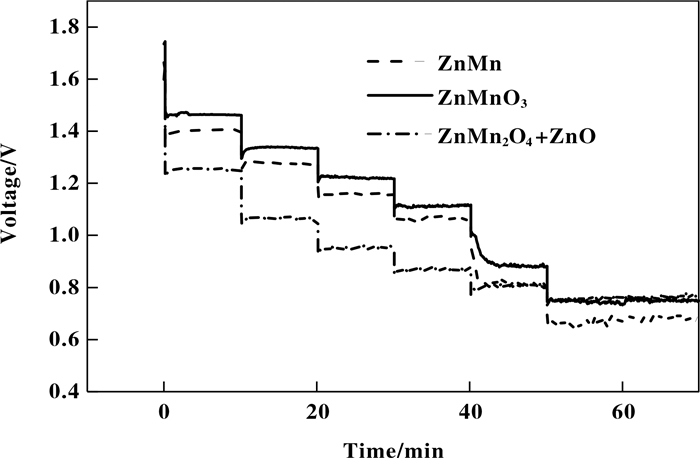
|
图 10 不同形貌的ZnMn复合氧化物的放电曲线 Fig.10 Discharge curve of ZnMn composite oxides with different morphology |
在20、40、60、80、100和120 mA/cm2的电流密度下, 球形ZnMnO3的电压平台为1.46、1.34、1.22、1.11、0.88和0.76 V. 在同等测试条件下, 刺球形ZnMnO3+ZnO的电压平台为1.40、1.27、1.16、1.06、0.81和0.66 V. 不规则絮状ZnMn2O4+ZnO的放电电压达到1.34、1.08、0.91、0.75、0.60和0.56 V.
3 结论通过制备不同形貌的ZnMn复合氧化物前驱体, 经过高温煅烧获得的球形ZnMnO3、不规则絮状ZnMn2O4+ZnO、刺球形ZnMnO3+ZnO, 他们有不同的性能表现. 由XRD分析可知所得样品均具有良好晶型. 由上可知样品的形貌主要由前躯体中Mn的化合物决定, 不同Mn的化合物拥有不同的形貌(球形、不规则絮状等), 这将决定最终产物的形貌. 通过XPS分析, 不同形貌的ZnMn复合氧化物均含有Mn4+和Mn2+. 通过对不同样品的CV曲线进行分析, 刺球形ZnMn复合氧化物拥有较高的还原电位, 其主要原因是刺球形结构能够赋予催化剂更多的活性位点, 提高了ZnMn复合氧化物的催化性能. 通过对不同材料的阻抗曲线研究发现, 球形ZnMnO3阻抗曲线所呈现的阻抗Rs最小, 具有良好的导电性能. 根据塔菲尔曲线获得的不同材料的腐蚀电位和腐蚀电流值可知, 不规则絮状ZnMn复合氧化物具有最低的腐蚀电压与腐蚀电流, 说明其在施加工作电压后最不容易发生腐蚀反应, 具有较好的耐腐蚀性能. 在铝空气电池半电池中, 球形ZnMn复合氧化物的初始电压最高, 决定于其较小的阻抗. 由此可知, 不同形貌的ZnMn复合氧化物拥有不同的性能, 通过改变样品的形貌来获得特定的性能是可以实现的.
| [1] |
Wang Yun-hua(汪云华), Ren Shan-shan(任珊珊). Research status and application prospect of aluminum-air batteries(铝-空气电池的研究现状及应用前景)[J]. Battery(蓄电池), 2019, 56(1): 1–5.
|
| [2] |
Xue Y, Sun S, Wang Q, et al. La0.7(Sr0.3-xPdx)MnO3 as a highly efficient electrocatalyst for oxygen reduction reaction in aluminum air battery[J]. Electrochimica Acta, 2017, 230: 418–427.
DOI:10.1016/j.electacta.2017.01.181 |
| [3] |
Basu S, Basu P K. Nanocrystalline metal oxides for methane sensors: Role of noble metals[J]. Journal of Sensors, 2009, 29: 777–790.
|
| [4] |
Chen D, Mu Y, Shen J, et al. Anchoring α-, β-, or γ-MnO2 into polypyrrole wrapping for modifying graphite felt anodes: The effect of MnO2 type on phenol degradation[J]. Chem Lett, 2017, 46(12): 1769–1772.
DOI:10.1246/cl.170749 |
| [5] |
Chen H, Wang Y, Lv Y. Catalytic oxidation of NO over MnO2 with different crystal structures[J]. RSC Advances, 2016, 6: 54032–54040.
DOI:10.1039/C6RA10103H |
| [6] |
a. Dong J, Lu G, Wu F, et al. Facile synthesis of a nitrogen-doped graphene flower-like MnO2 nanocomposite and its application in supercapacitors[J]. Applied Surface Science, 2017, 427(pt. a): 986-993. b. Tang Nan(唐南), Huang Yan(黄妍), Li Yuan-yuan(李元元), et al. Low temperature selective catalytic reduction of NO with NH3 over Fe-Mn catalysts prepared by hydrothermal method(水热法制备铁锰催化剂脱硝性能及抗水抗硫性能研究)[J]. J Mol Catal(China)(分子催化), 2018, 32(3): 240-248. c. Zhang Yi(张溢), Shi Jin(石琎), Zhang Zhi-xiang(张志翔), et al. Study on simultaneous removal of for- maldehyde and ozone by manganese oxygen octahedral molecular sieve at room temperature (锰氧八面体分子筛室温同时去除甲醛和臭氧的性能研究)[J]. J Mol Catal(China)(分子催化), 2019, 33(3): 201-208. d. Liu Peng(刘鹏), Huang Guan(黄冠), Li Pei-lan(李佩兰), et al. Research on catalytic oxidation of cyclohexane over manganese porphyrin immobilized on mesoporous Ag2S(介孔Ag2S固载锰卟啉催化氧化环己烷性能研究)[J]. J Mol Catal(China)(分子催化), 2019, 33(5): 420-428. |
| [7] |
Li L, Jing F, Yan J, et al. Highly effective self-propagating synthesis of CeO2-doped MnO2 catalysts for toluene catalytic combustion[J]. Catal Today, 2017, 297: 167–172.
DOI:10.1016/j.cattod.2017.04.053 |
| [8] |
Li G, Mezaal M A, Zhang R, et al. Electrochemical performance of MnO2-based air cathodes for zinc-air batteries[J]. Fuel Cells, 2016, 16(3): 395–400.
DOI:10.1002/fuce.201500077 |
| [9] |
Hu Y, Zhang T, Cheng F, et al. Recycling application of Li-MnO2 batteries as rechargeable lithium- air batteries[J]. Angewandte Chemie, 2015, 54(14): 4338–4343.
DOI:10.1002/anie.201411626 |
| [10] |
Song K, Jung J, Heo Y U, et al. α-MnO2 nanowire catalysts with ultra-high capacity and extremely low overpotential in lithium-air batteries through tailored surface arrangement[J]. Physical Chemistry Chemical Physics, 2013, 15(46): 20075–20079.
DOI:10.1039/c3cp53754d |
| [11] |
Huang Y J, Li W S. Preparation of manganese dioxide for oxygen reduction in zinc air battery by hydro thermal method[J]. Journal of Inorganic Materials, 2013, 28(3): 341–346.
DOI:10.3724/SP.J.1077.2012.12474 |
| [12] |
Jiang Hong(江虹), Guo Rui-song(郭瑞松), Sun Dan-dan(孙丹丹), et al. Electrochemical performance of MnO2 modified Li3V2 (PO4) 3/C cathode materials(MnO2改性Li3V2(PO4)3/C正极材料的电化学性能)[J]. Journal of the Chinese Ceramic Society(硅酸盐学报), 2018, 46(8): 1162–1168.
|
| [13] |
Valero-Romero M J, Cabrera-Molina A, Guerrero-Pérez M O, et al. Carbon materials as template for the preparation of mixed oxides with controlled morphology and porous structure[J]. Catalysis Today, 2014, 227: 233–241.
DOI:10.1016/j.cattod.2013.10.093 |
| [14] |
桂斌. 过渡金属复合氧化物的制备及其催化性能研究[D]. 合肥: 合肥工业大学, 2009.
Gui Bing. Synthesis of transition metal composite oxides and their catalytic performance[D]. Hefei: Hefei University of Technology, 2009.
|
| [15] |
Zhang He-feng(张鹤丰), Li Da-guang(李大光), Fu Wei-qin(傅维勤), et al. Some progress of preparation, structure and application research on multiple complex oxides(多元复合氧化物的制备、结构及应用研究进展)[J]. Jiangsu Chemical Industry(江苏化工), 2006, 3(1): 6–10.
|
| [16] |
Zhao San-ping(赵三平), Xi Hai-ling(习海玲), Zuo Yan-jun(左言军), et al. Oxidation kinetics and products of methyl phenyl sulfide, a sulfur mustard simulant by sodium molybda catalyzed hydrogen peroxide solution(Na2MoO4催化H2O2氧化芥子气模拟剂苯甲硫醚的动力学与产物)[J]. Journal of Molecular Catalysis(China)(分子催化), 2015, 29(1): 45–51.
|
| [17] |
Xue-hui Huang, Peng-ju Niu, Hong-yun Pan, et al. Micromorphological control of porous LaMnO3 and LaMn0.8-Fe0.2O3 and its catalytic oxidation performance for CO[J]. Journal of Solid State Chemistry, 2018, 265: 218–226.
DOI:10.1016/j.jssc.2018.06.002 |
| [18] |
Beste A. Methanol adsorption and dissociation on LaMnO3 and Sr doped LaMnO3 (001) surfaces[J]. Surface Science, 2017, 664(10): 155–161.
|
| [19] |
Peña M A, Fierro J L G. Chemical structures and performance of perovskite oxides[J]. Chem Rev, 2001, 101(7): 1981–2017.
DOI:10.1021/cr980129f |
| [20] |
Zhu J, Li H, Zhong L, et al. Perovskite oxides: Preparation, characterizations, and applications in heterogeneous catalysis[J]. ACS Catal, 2014, 4(9): 2917–2940.
DOI:10.1021/cs500606g |
| [21] |
Li Sheng-xian(李升宪), Li Bao-qi(李保旗), Yang Han-xi(杨汉西), et al. Synthesis and electrochemical behaviors of ZnMn2O4(尖晶石型ZnMn2O4的合成及其电化学行为)[J]. Battery Bimonthly(电池), 2002, 32(1): 3–5.
|
| [22] |
Chai Ying-jie(柴应洁), Feng He(冯鹤), Cui Yan-bin(崔艳斌), et al. Structure control of nickel-based perovskite catalyst and its application in methane dry reforming(镍基钙钛矿型催化剂的结构调控及其在甲烷干重整反应中的应用)[J]. Journal of Molecular Catalysis(China)(分子催化), 2018, 32(3): 228–239.
|
| [23] |
Qin Yi-hong(秦毅红), Sun Li-guo(孙立国), Zhang Dang-long(张党龙), et al. Preparation of LaxSr (1-x)-FeO3 catalyst and its performance for catalytic reduction of SO2 with CO(LaxSr (1-x)FeO3催化剂的制备及其催化还原SO2性能的研究)[J]. Journal of Molecular Catalysis(China)(分子催化), 2016, 30(1): 54–61.
|
| [24] |
Yan Yao-zong(晏耀宗), Guo Jin-wei(郭谨玮), Chen Ya-zhong(陈亚中), et al. Preparation of La1-xCax-MnO3+δ perovskite catalyst and its catalytic performance study in methane combustion(钙钛矿型La1-xCax-MnO3+δ催化剂制备及其甲烷催化燃烧性能研究)[J]. Journal of Molecular Catalysis(China)(分子催化), 2015, 29(1): 82–89.
|
| [25] |
Ran Rui, Wu Xiao-dong, Weng Duan. Progress in preparing methods of rare earth perovskite catalysts[J]. Chin Rare Earths, 2004, 25(5): 46–50.
|
| [26] |
Sagar T V, Padmakar D, Lingaiah N, et al. Syngas production by CO2 reforming of methane on LaNixAl1-xO3 perovskite catalysts: Influence of method of preparation[J]. J Chem Sci, 2017, 129(11): 1787–1794.
DOI:10.1007/s12039-017-1359-2 |
 2020, Vol. 34
2020, Vol. 34


