2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049 China
C—N键广泛存在于有机小分子和生物大分子中[1]. 在过去的二十几年中, 通过过渡金属催化构建C—N键的方法得到了迅速的发展, 已成为合成胺和含氮分子的强有力的工具[2-10]. 相反, 由于C—N键的高稳定性和化学惰性[11], 过渡金属催化C—N键断裂转化的研究报道相对较少, 特别是芳香胺电中性芳基C—N键断裂的转化, 仍具有非常大的挑战性.
芳香胺是工业上具有重要商业利用价值的核心结构单元, 广泛存在于染料、农用化学品、活性药物成分(APIS)和功能材料中[12]. 因此, 其C—N键的断裂转化研究受到人们的广泛关注[13], 通过对这类C—N键断裂转化的研究, 可为含有芳香胺结构单元的功能分子或者药物分子的后期修饰提供一种手段[1, 13-14]. 然而, 由于芳香胺氮上的孤对电子与芳环p轨道之间的共轭, 使得芳香胺的C—N键具有非常高的解离能(429.3 + 4.2 kJ/mol), 直接活化芳基C—N键非常困难. 传统方法是将其转化为活性较高的胺类化合物, 如季铵盐、重氮盐、肼、三氮烯或者Katritzky盐等. 最近几年, 一些优秀的国内外文献[1, 13, 15-20]已对C—N键的转化研究进展进行了阐述, 我们这篇综述的重点是阐述过渡金属催化芳香胺中性碳氮键活化与转化反应的新进展.
芳香胺通常是以电中性分子形式存在于自然界中, 与高活性的芳香季铵盐相比, 直接实现芳基C—N键的断裂转化非常困难. 目前的主要策略是在氨基邻位预先安装导向基团实现官能团导向的C—N键断裂, 或者在不预装导向基团的情况下通过调节芳香胺氮上的取代基, 比如引入吸电子基团等来削弱芳基C—N键的键能, 实现其断裂. 一般而言, 过渡金属催化芳香胺芳基C—N键断裂的反应机理与C—X键过程相似, 涉及到金属对C—N键的氧化加成形成C—M—N物种, 这是非常关键的一步, 因为这一步可以使惰性的C—N键转化为高活性的C—M—N物种. 从原理上讲, 在合适的反应条件下, 利用这种亲核性的中间体与其他相应的金属试剂发生转金属反应, 随后还原消除则可构建新的化学键(图 1).
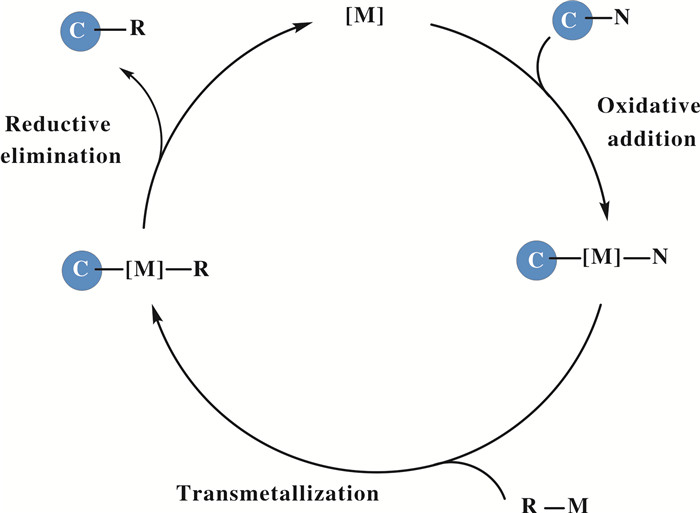
|
图 1 过渡金属介导C—N键断裂的机理 Fig.1 Mechanism of transition-metal-mediated cleavage of C—N bonds |
在含导向基团的芳香胺底物中, 主要以酮、亚胺、酰胺、吡啶作为导向基团, 以贵金属钌和非贵金属铬作为催化剂. 贵金属钌催化剂和非贵金属铬催化剂在导向策略中有着不同的特点: 就催化剂用量而言, 贵金属钌催化剂在反应中使用量较低, 一般为2%~5%(摩尔分数), 而非贵金属铬催化剂使用量较高, 一般为10%(摩尔分数); 就反应条件而言, 使用非贵金属铬催化剂的反应较为温和, 而使用贵金属钌催化剂的反应条件一般比较苛刻, 需要较高的反应温度.
1.1 铬催化的Kumada偶联反应Cong等[21]用N-叔丁基亚胺作为导向基团, 首次以廉价的非贵金属铬作催化剂, 在温和条件下实现了邻氨基苯甲酮亚胺与格氏试剂的Kumada偶联反应, 得到2-芳基苯甲醛化合物(图 2). 该反应条

|
图 2 铬催化的芳香胺的Kumada偶联反应 Fig.2 Chromium-catalyzed Kumada coupling of aromatic amines |
件温和, 对各种官能团都能兼容, 如F, Cl, OH, OMe, NHBoc, CONMe2等. 然而, 烷基的格氏试剂在反应中显示出了低的反应活性. 通过对反应机理的研究, 他们认为Cr(Ⅱ)被格氏试剂还原成Cr(0)活性物种1, 在导向基团亚胺的配位下与芳胺上氮孤对电子进行配位, 使得芳香胺氮上的孤对电子与芳环的共轭程度降低, 从而削弱了C—N键的键能. 进一步的实验和理论计算研究表明, 首先是格氏试剂与氯化铬催化剂发生反应得到高活性的零价铬物种1, 接着与底物中亚胺氮及芳基胺上的氨基氮配位得到物种2, 然后发生氧化加成得到物种3, 随后与格氏试剂发生转金属反应得到中间体4, 最后还原消除及水解得到相应的2-芳基醛化合物.
1.2 铬催化的还原偶联反应最近, 曾小明课题组[22]发展了以N-叔丁基亚胺作为导向基团, 实现了铬催化的芳基C—N键与芳基C—O键断裂的还原偶联反应(图 3). 以氯化铬为催化剂, 4, 4′-二叔丁基-2, 2′-联吡啶(dtbpy)为配体, 镁作还原剂, 芳香胺与芳基酯在THF溶剂中40 ℃反应, 酸化后得到2-芳基苯甲醛化合物. 此反应具有良好的官能团兼容性, 如F, Cl, OH, OMe和SiMe3等官能团. 尽管该反应有良好的底物耐受性, 但是非π-共轭的芳基酯展示了低的反应活性. 机理研究表明, 与C—O键相比, 铬催化剂更易活化C—N键, 铬催化剂与配体4, 4′-二叔丁基-2, 2′-联吡啶的配比为1 ∶1.

|
图 3 铬催化的C—N键和C—O键断裂的还原偶联反应 Fig.3 Chromium-catalyzed reductive coupling via C—N bond and C—O bond cleavage |
以贵金属RuH2(CO)(PPh3)3作催化剂, Kakiuchi课题组[23-24]首次实现了用叔丁酰基作导向基, 发展了2-氨基-苯基叔丁基酮与有机硼酸酯的Suzuki偶联反应(图 4). 由于叔丁酰基的导向作用, Ru催化剂能选择性地对邻位的C—N键进行活化. 此反应具有广泛的底物普适性, 无论是NH2, NMe2, 还是N(Me)Ac的芳香胺, 都能得到中等到优秀的反应收率, 且反应体系能兼容芳基硼酸酯和烷基硼酸酯.

|
图 4 钌催化的酮导向的芳基C—N键断裂 Fig.4 Ruthenium-catalyzed aryl C—N cleavage with ketone as an ortho-directing group |
Kakiuchi课题组随后在研究2-氨基-苯基叔丁基酮与有机硼酸酯的Suzuki偶联反应机理中发现, RuH2(CO)(PPh3)3与2-氨基-苯基叔丁基酮反应得到金属Ru配合物5和6[25]. 金属Ru配合物5是Ru催化剂对芳基C—N键氧化加成后形成的中间体. 金属Ru配合物5与苯基硼酸酯可得到偶联产物进一步验证了Ru配合物5在叔丁酰基导向芳基C—N键断裂转化中是重要的反应中间体. 在这些实验结果的基础上, Ru催化芳基C—N键断裂的可能反应机制如下: 首先是叔丁酰基的羰基与Ru催化剂配位, 然后金属Ru对芳基C—N键进行氧化加成形成环钌中间体, 接着与有机硼酸酯发生转金属反应, 最后还原消除得到相应的偶联产物(图 5).
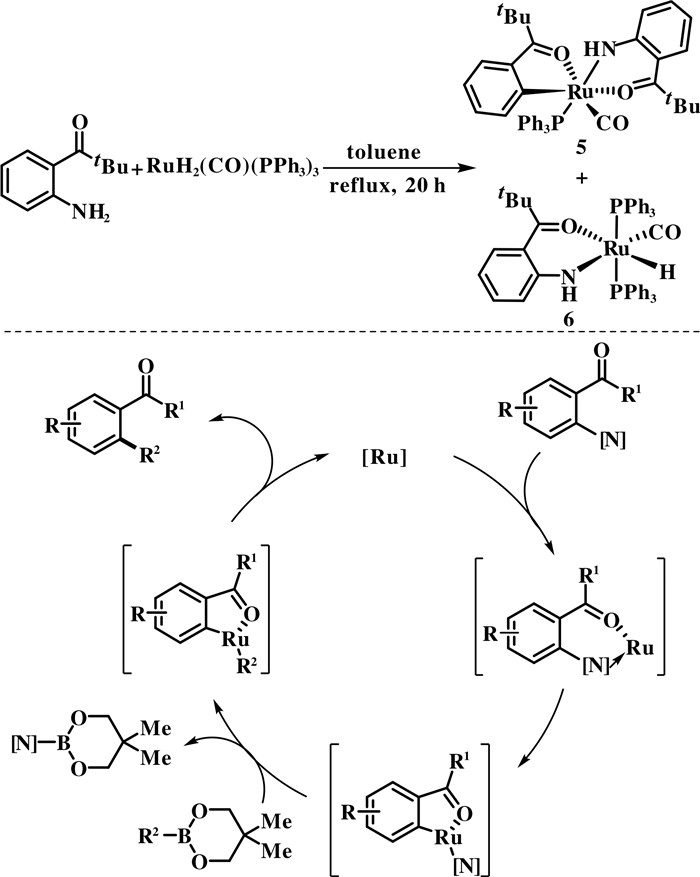
|
图 5 钌催化芳香胺的C—N键断裂的机理 Fig.5 Mechanism of ruthenium-catalyzed C—N bond cleavage of aromatic amines |
利用类似策略, Kondo等[26]用甲基酮作导向基团, 在钌催化下与烯基硼酸酯反应, 实现了C—O键和C—N键的选择性活化断裂(图 6). 以RuH- (OAc)(CO)(PPh3)2作催化剂, CsF作添加剂, 在对二甲苯溶剂中140 ℃反应得到含有醚和酮等官能团的芳基烯烃化合物. 当甲基酮导向基团的邻位同时存在OMe和NMe2官能团时, 反应能在催化剂的作用下选择性地实现芳基C—N键的断裂转化, 几乎没有观察到C—O键断裂转化的产物.
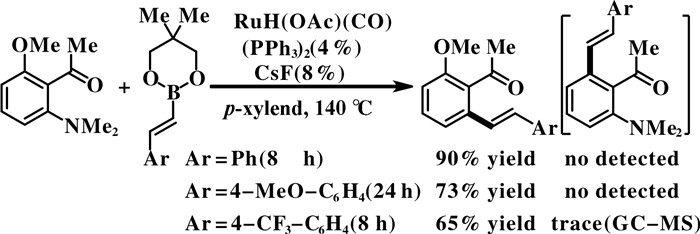
|
图 6 钌催化的酮导向的选择性C—N烯基化 Fig.6 Selective ruthenium-catalyzed C—N alkenylation with ketone as an ortho-directing group |
在Kakiuchi课题组的工作中, 尽管反应的底物普适性好, 但是合成叔丁基酮的底物相对比较困难. 因此, Zhao等[27]发展了酰胺导向的2-氨基-苯甲酰胺与有机硼酸酯的Suzuki偶联反应(图 7). 该反应与Kakiuchi的工作相比, 以酰胺基团作导向基, 酰胺底物比2-氨基-苯基叔丁基酮底物更容易合成. 机理研究表明, 该反应中包括了两个关键的步骤: 一步是过渡金属对芳基C—N键的氧化加成形成Ar-Ru-NR2物种; 另一步是Ar-Ru-NR2物种与有机硼试剂的转金属反应.

|
图 7 钌催化的酰胺导向的芳基C—N键断裂 Fig.7 Ruthenium-catalyzed aryl C—N bond cleavage with amide as an ortho-directing group |
最近, Szostak课题组[28]用N-苯基亚胺作导向基, 以Ru3(CO)12作催化剂, 实现了邻氨基苯甲酮亚胺与芳基硼酸酯的Suzuki偶联反应, 酸性条件下水解得到2-芳基苯甲酮化合物(图 8). 此反应的催化剂Ru3(CO)12在亚胺的导向下可以高选择性地断裂芳基C—N键, 反应展现了优秀的官能团兼容性. 在芳基C—H键, C—O键, 或者芳基C—Br键的存在下, 此催化体系都能选择性地对芳基C—N键进行活化.

|
图 8 钌催化的亚胺导向的芳基C—N键断裂 Fig.8 Ruthenium-catalyzed aryl C—N bond cleavage with imine as an ortho-directing group |
最近, Xu等[29]用吡啶作为导向基团, 以Ru3- (CO)12为催化剂, 实现了N, N-二甲基-2-(2-吡啶基)苯胺与烯基硼酸酯的Suzuki偶联反应(图 9). 此反应能很好地兼容OMe, CF3, Cl, SiEt3, F和呋喃基等官能团, 且反应得到的烯烃产物具有优秀的立体选择性(E∶Z> 20∶1).
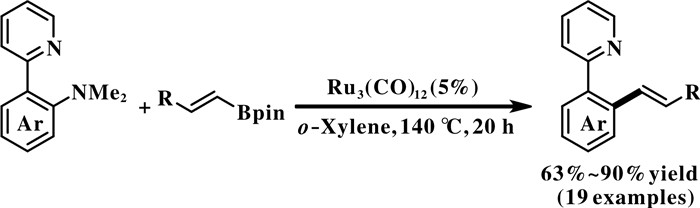
|
图 9 钌催化的吡啶导向的芳基C—N键断裂 Fig.9 Ruthenium-catalyzed aryl C—N bond cleavage with pyridine as an ortho-directing group |
以叔丁酰基作导向基团, Kakiuchi团队[30]实现了芳香胺的脱氨化和烷基化反应(图 10). 以RuH2(CO)(PPh3)3作催化剂, 对二甲苯作溶剂, 2-氨基-苯基叔丁基酮在140 ℃条件下发生脱氨化反应, 得到叔丁酰基苯化合物; 当额外加入烯烃时, 可得到芳基C—N键断裂的烷基化产物. 机理研究表明, 在不加入烯烃时, 2-氨基-苯基叔丁基酮在叔丁酰基的配体导向下实现钌催化剂对芳基C—N键的氧化加成, 得到物种7, 然后氨基上的烷基发生β-氢消除得到钌氢物种8, 最后还原消除和金属催化剂的解离得到脱氨化产物; 加入烯烃以后, 钌催化剂与2-氨基-苯基叔丁基酮的叔丁酰基以及烯烃配位, 并实现对芳基C—N键的氧化加成, 得到物种9, 然后氨基上的烷基发生β-氢消除, 得到钌氢物种10, 随后烯烃的迁移插入得到中间体11, 最后还原消除得到烷基化产物.

|
图 10 钌催化的还原脱氨化和烷基化反应 Fig.10 Ruthenium-catalyzed reductive deamination and alkylation reaction |
最近, Xu等[31]用吡啶作为导向基团, 以Ru3- (CO)12作催化剂, 首次实现了N, N-二甲基-2-(2-吡啶基)苯胺与一氧化碳和有机硼酸酯的羰基化反应, 得到二芳基酮化合物(图 11). 此反应具有优秀的底物普适性, 无论是富电子的底物还是缺电子的底物, 都能得到中等至良好收率的二芳基酮产物. 然而, 反应对大空间位阻的底物较为敏感. 同时, 他们考察了芳香胺氮上的取代基, 发现只有N, N-二烷基的芳香胺能实现芳基C—N键断裂, 一级芳香胺和N-单烷基的芳香胺不能发生羰基化反应. 以Ru3(CO)12作催化剂, 反应底物中的吡啶导向基团对C—N键活化展现了独特的选择性, 叔丁基酰基、乙酰基、吡唑、2-羟基吡啶等导向基团在此催化体系中都没有反应活性. 机理研究表明, 首先钌催化剂与底物配位形成物种12, 物种12通过氧化加成生成中间体13. 同时, NMe2基团与有机硼配位可能进一步活化了芳基C—N键. 中间体13与有机硼发生转金属反应和一氧化碳的插入以后, 形成中间体15或者15′, 最后在一氧化碳氛围下发生还原消除得到羰基化产物, 并生成钌催化剂实现催化循环.
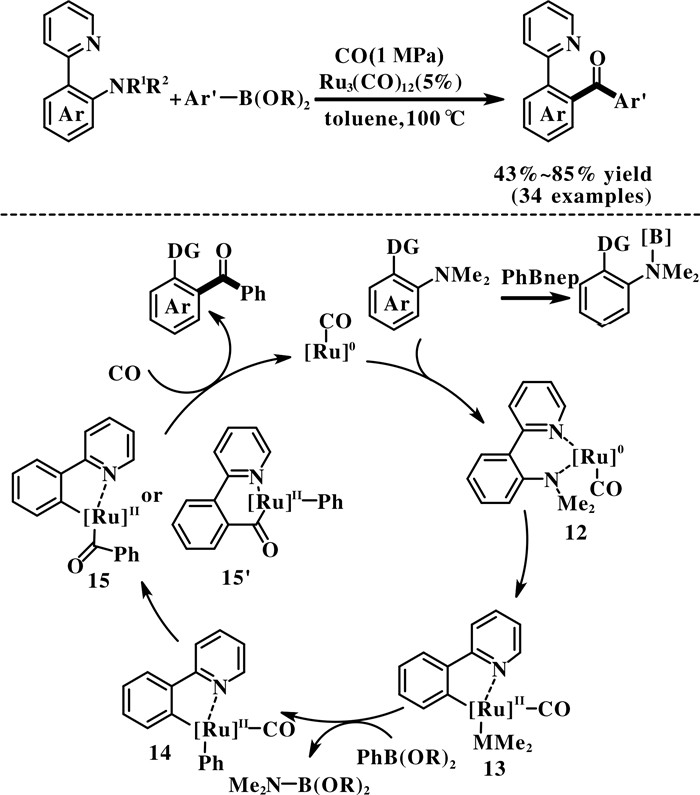
|
图 11 钌催化的芳香胺的羰化反应 Fig.11 Ruthenium-catalyzed carbonylation of aromatic amines |
在非导向的芳香胺芳基C—N键断裂反应中, 主要是以非贵金属镍作为催化剂, 也有少量早期的文献使用钯、铑等贵金属作为催化剂.
2.1 一级芳香胺的C—N键断裂转化由于伯胺的氨基C—N键断裂离去能力弱和N—H键官能团的兼容性差, 因此一级芳香胺的芳基C—N键断裂是一个非常困难的过程. 然而, 伯胺被质子化生成铵盐后能降低C—N键的键能, 使得氨基变成了一个容易离去的官能团. Akiyama等[32-33]首次实现了非导向的一级芳香胺的C—N键断裂转化. 在Pd(OAc)2的作用下, 醋酸作为添加剂, 芳香胺与烯烃发生Heck反应, 得到相应的芳基烯烃化合物(图 12). 机理研究表明, 芳香胺首先在醋酸的作用下生成芳基铵盐化合物, 然后Pd(OAc)2对芳基铵盐的C—N键进行氧化加成得到芳基钯物种, 随后烯烃的迁移插入后经历β-H消除得到相应的芳基烯烃化合物. 此反应中使用了适量的Pd(OAc)2, 使得芳香胺与醋酸发生乙酰化反应产生大量的芳基乙酰化产物16, 导致偶联产物的收率较低. 可以预见, 如果能抑制芳香胺在醋酸中的乙酰化, 同时实现中间体Pd—H物种17重新转化为Pd(0), 那么该反应就能实现催化的Heck反应. 该反应首次实现了非导向芳香胺的芳基C—N键断裂转化, 为芳基C—N键断裂转化提供了一种新策略.
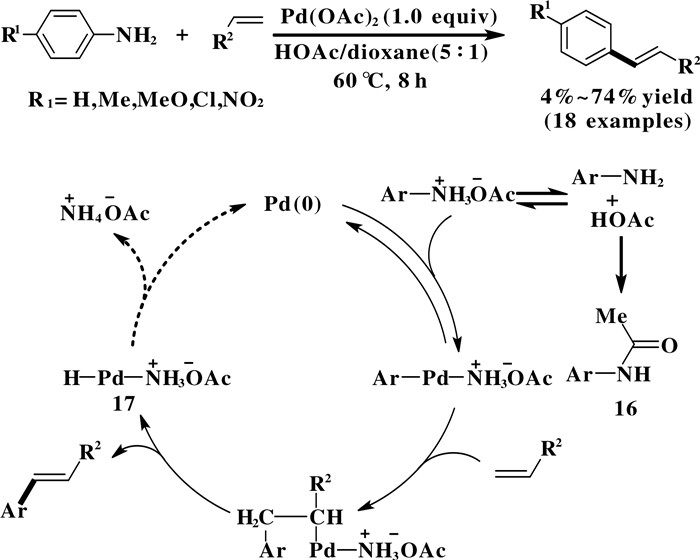
|
图 12 钯促进的芳香胺的Heck偶联反应 Fig.12 Palladium promoted Heck coupling of aromatic amines |
随后, Bonanno等[34]报道了用化学当量的铊配合物对芳香胺的芳基C—N键进行氧化加成, 得到一种Ar-Ta(tBu3SiO)3-NH2金属配合物(图 13). 然而, 此方法仅使用4-三氟甲基苯胺才能实现芳基C—N键的氧化加成, 其他芳香胺只得到N-H氧化加成的产物ArNH-Ta(tBu3SiO)3-H. 尽管该方法的芳基C—N键活化策略存在很大的局限性, 但它是第一例金属配合物直接对电中性芳基C—N键的断裂反应.

|
图 13 铊配合物对芳香胺的C—N键的氧化加成 Fig.13 Thallium-mediated oxidative addition of C—N bond of aromatic amine |
在过渡金属催化非导向芳香胺的芳基C—N键断裂反应中, 在芳香胺上引入吸电子基团可以一定程度上活化芳基C—N键. Tobisu和Chatani等[35]在芳香胺的氮上引入了吸电子的氨基甲酸酯基团或者Boc基团, 可实现π-共轭萘胺衍生物的芳基C—N键断裂转化(图 14). 以Ni(cod)2作催化剂, PCy3作配体, N, N-二取代的萘基酰胺与HB(pin)反应以中等到良好的收率得到脱氨化产物. 此方法对含有手性的底物没有影响, 可实现含手性的底物的C—N键活化转化. 以Ni(cod)2/IMes作催化剂时, N, N-二取代的萘胺与B2(nep)2在160 ℃反应得到了萘硼酸酯化合物. 尽管该方法的官能团兼容性好, 但是底物局限于π-共轭的萘胺化合物, 简单的芳香胺不适用.

|
图 14 镍催化芳香胺的的硼化及脱氨化反应 Fig.14 Nickel-catalyzed borylation and deamination of aromatic amines |
最近, 我们课题组[36]报道了一个阶段性的工作, 实现了镍催化的N-Boc保护的三级芳香胺芳基C—N键断裂的Kumada偶联反应(图 15). 以NiCl2- (PCy3)2作催化剂, 甲苯作溶剂, N-Boc芳香胺与芳基格氏试剂在25 ℃条件下反应, 得到非对称的二芳基化合物. 该反应条件温和, 反应底物中不需要导向基团, 且具有良好的官能团兼容性, 如F, OTBS, OH, N(Bn)2和TMS等, 但是反应底物局限于π-共轭的芳香胺化合物, NiCl2(PCy3)2催化剂对简单的芳香胺底物不适用. 当使用NHC-Ni复合物作催化剂时, 简单芳香胺底物可得到中等收率的偶联产物. 洪鑫课题组通过理论计算对机理进行了研究, 芳香胺氮上的Boc基团对C—N键的活化起到了至关重要的作用, Boc基团可以很大程度上削弱芳基C—N键的键能并促进其断裂.
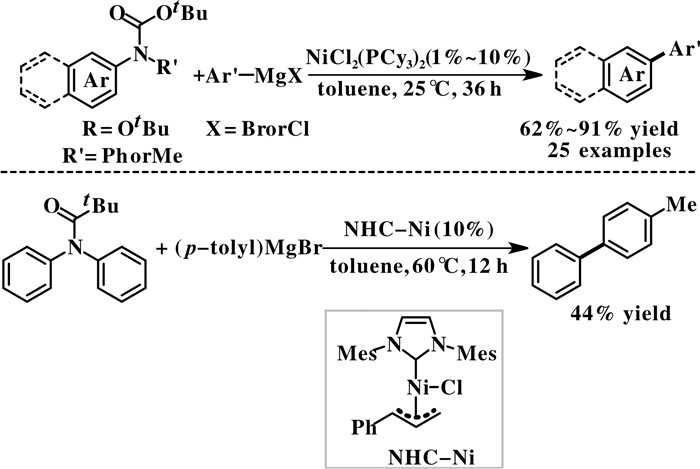
|
图 15 镍催化芳香胺C—N键选择性断裂的Kumada偶联反应 Fig.15 Nickel-catalyzed C—N bond cleavage of aromatic amines for Kumada coupling |
与N-酰基三级芳香胺相比, N, N-二烷基三级芳香胺的芳基C—N键的反应活性更低. Cao等[37]以Ni(cod)2作催化剂, 使用富电子卡宾IMesMe作配体, 实现了N, N-二烷基三级芳香胺与B2(nep)2的硼化反应, 得到相应的芳基硼酸酯化合物(图 16). 该反应具有良好的底物耐受性, 但是简单的芳香胺在高催化剂使用量和高温条件下只展现出了中等的反应活性.

|
图 16 镍催化的芳香胺的硼化反应 Fig.16 Nickel-catalyzed borylation of aromatic amines |
随后, Cao等[38]在还原条件下实现了N, N-二甲基芳香胺的芳基C—N键断裂构建C—C键. 以NiBr2作催化剂, IMesMe作配体, Mg作为金属还原剂, N, N-二甲基芳香胺与芳基硼酸酯偶联生成二芳基化合物(图 17). 此反应的活性催化物种是Ni(Ⅰ)金属物种. 溴化镍和NHC卡宾配体在镁粉存在下被还原成NHC-Ni(Ⅰ)活性物种18, 在芳香胺与卡宾配体进行配体交换后对芳基C—N键进行氧化加成得到Ni(Ⅲ)物种20, 随后与芳基硼酸酯发生转金属反应得到Ni(Ⅲ)物种21, 最后C—C键的还原消除得到二芳基化合物和NHC-Ni(Ⅰ)物种18. 此方法的芳香胺不需要引入吸电子基团预活化C—N键, 然而, 反应的底物主要适用于富电子的芳香萘胺化合物, 催化体系对于简单的苯胺不能实现芳基C—N键的活化转化.

|
图 17 镍催化的芳香胺的Suzuki类型偶联反应 Fig.17 Nickel-catalyzed Suzuki-type coupling of aromatic amines |
Robins课题组[39]报道了镍催化的三唑/咪唑衍生物与芳基硼酸的Suzuki偶联反应, 得到6-芳基嘌呤-2′-脱氧核苷(图 18). 此方法以三氮唑作一个活化的离去基团, 镍催化剂可以有效地对芳基C—N键进行氧化加成.
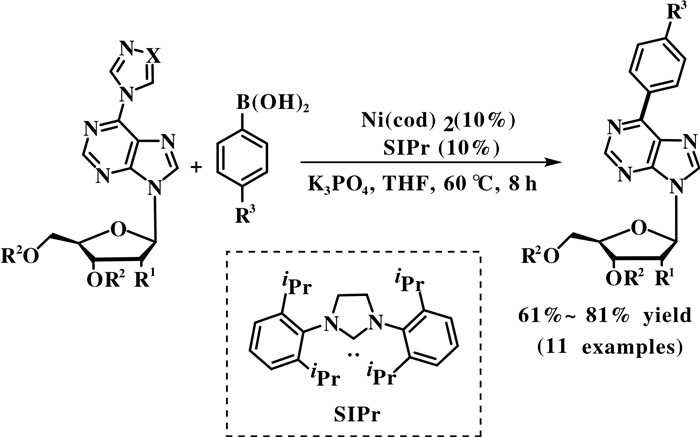
|
图 18 镍催化三唑/咪唑衍生物的Suzuki偶联反应 Fig.18 Nickel-catalyzed Suzuki coupling of triazole/imidazole derivatives |
Li等[40]报道了一种Rh二聚体催化剂催化的1-(2-吡啶基)-1H-吲哚与1-芳基炔乙醇的偶联反应, 得到吡啶并[2, 1-a]吲哚化合物(图 19). 该反应用化学计量的醋酸铜活化C—C键, Rh催化剂活化C—H键, 同时实现了C—H、C—C和C—N键的活化, 但C—N键断裂的机理还不清楚. 此反应底物普适性广, 各种官能团在反应中都能兼容.

|
图 19 铑催化吲哚衍生物的C—N键断裂环化串联反应 Fig.19 Rhodium-catalyzed C—N bond cleavage of indole derivatives for a cascade cyclization reaction |
在过去十几年中, 芳香胺的电中性芳基C—N键断裂催化转化反应已经取得了显著的进展, 主要集中于金属催化的偶联反应. 而与其他C—H、C—O、和C—C键等惰性化学键的断裂转化反应相比, 芳基C—N键断裂催化转化反应仍处于发展阶段. 尽管过渡金属催化芳基C—N键的断裂转化在有机合成中已成为比较有用的反应之一, 但是通过芳基C—N键活化开发新的、实用的偶联反应仍然面临着巨大的挑战. 未来, 高原子经济性的C—N键断裂转化反应具有非常大的吸引力. 再者, 温和条件下通过C—N键断裂实现天然产物和药物分子的后期修饰是未来的一个发展方向. 此外, 通过芳基C—N键活化, 发展高效的对映选择性反应也是该领域的一个前沿方向. 这些反应的成功主要依赖于高效配体的设计和开发, 以及对反应机理的深刻理解.
| [1] |
Ouyang K, Hao W, Zhang W X, et al. Transition-metal-catalyzed cleavage of C-N single bonds[J]. Chem Rev, 2015, 115(21): 12045–12090.
DOI:10.1021/acs.chemrev.5b00386 |
| [2] |
a. Schlummer B, Scholz U. Palladium-catalyzed C-N and C-O coupling a practical guide from an industrial vantage point[J]. Adv Synth Catal, 2004, 346(13/15): 1599-1626. b. Wang Yu (王宇), Xu Xiao-liang (徐小亮), Wang Yi-ren (汪义忍), et al. Catalytic performance of three kinds of zeolites in aniline condensation to diphenylamine (三种分子筛催化苯胺缩合制二苯胺性能研究)[J]. J Mol Catal (China)(分子催化), 2018, 32(6): 540-545. c. Li Di (李迪), Du Min-chen (杜旻辰), Bu Chao (卜超), et al. Three-component reactions of propargyl alcohols, secondary amines and CO2 catalyzed by CuCl2/ionic liquids (CuCl2/离子液体催化炔丙醇、仲胺与CO2的三组分反应)[J]. J Mol Catal (China)(分子催化), 2019, 33(6): 542-550. |
| [3] |
a. Heravi M M, Kheilkordi Z, Zadsirjan V, et al. Buchwald-Hartwig reaction: An overview[J]. J Organomet Chem, 2018, 861: 17-104. b. Wang Fei-fei (王菲菲), Ma Xiao-ming (马晓明), Guo Yu-ming (郭玉明), et al. Influence of non-noble transition metals on Pd-based catalysts based on band theory (基于能带理论研究非贵过渡金属对Pd基催化剂的影响)[J]. J Mol Catal (China)(分子催化), 2019, 33(1): 41-49. . c. Zhang Xie-yi (张燮义), Xie Guang-you (谢光友), Li Heng-feng (李衡峰). Quasi-homogeneous PtPd alloy nanocatalyst and its catalytic performance in the dehalogenation of aromatic compounds (准均相的铂钯合金纳米催化剂用于芳香族化合物脱卤反应)[J]. J Mol Catal (China)(分子催化), 2018, 32(1): 46-53. |
| [4] |
Ley S V, Thomas A W. Modern synthetic methods for copper-mediated C (aryl)-O, C (aryl)-N, and C (aryl)-S bond formation[J]. Angew Chem Int Ed, 2003, 42(44): 5400–5449.
DOI:10.1002/anie.200300594 |
| [5] |
Forero-Cortés P A, Haydl A M. The 25th anniversary of the Buchwald-Hartwigamination: Development, applications, and outlook[J]. Org Process Res Dev, 2019, 23(8): 1478–1483.
DOI:10.1021/acs.oprd.9b00161 |
| [6] |
Vaibhav M, Tejpal Singh C. Pd-catalyzed N1/N4 arylation of piperazine for synthesis of drugs, biological and pharmaceutical targets: An overview of buchwald hartwigamination reaction of piperazine in drug synthesis[J]. Curr Org Synth, 2018, 15(2): 208–220.
DOI:10.2174/1570179415666171206151603 |
| [7] |
Ruiz-Castillo P, Buchwald S L. Applications of palladium-catalyzed C-N cross-coupling reactions[J]. Chem Rev, 2016, 116(19): 12564–12649.
DOI:10.1021/acs.chemrev.6b00512 |
| [8] |
Fischer C, Koenig B. Palladium-and copper-mediated N-Aryl bond formation reactions for the synthesis of biological active compounds[J]. Beilstein J Org Chem, 2011, 7: 59–74.
DOI:10.3762/bjoc.7.10 |
| [9] |
Louillat M L, Patureau F W. Oxidative C-H amination reactions[J]. Chem Soc Rev, 2014, 43(3): 901–910.
DOI:10.1039/C3CS60318K |
| [10] |
Reddy C V, Kingston J V, Verkade J G. (t-Bu)2PNdP (i-BuNCH2CH2)3N: New efficient ligand for palladium-catalyzed C-N couplings of aryl and heteroaryl bromides and chlorides and for vinyl bromides at room temperature[J]. J Org Chem, 2008, 73(8): 3047–3062.
DOI:10.1021/jo702367k |
| [11] |
Blanksby S J, Ellison G B. Bond dissociation energies of organic molecules[J]. Acc Chem Res, 2003, 36(4): 255–263.
DOI:10.1021/ar020230d |
| [12] |
Wang Q, Su Y, Li L, et al. Transition-metal catalysed C-N bond activation[J]. Chem Soc Rev, 2016, 45(5): 1257–1272.
DOI:10.1039/C5CS00534E |
| [13] |
Desnoyer A N, Love J A. Recent advances in well-defined, late transition metal complexes that make and/or break C-N, C-O and C-S bonds[J]. Chem Soc Rev, 2017, 46(1): 197–238.
DOI:10.1039/C6CS00150E |
| [14] |
Pound S M, Watson M P. Asymmetric synthesis via stereospecific C-N and C-O bond activation of alkyl amine and alcohol derivatives[J]. Chem Commun, 2018, 54(87): 12286–12301.
DOI:10.1039/C8CC07093H |
| [15] |
Balgotra S, Verma P K, Vishwakarma R A, et al. Catalytic advances in direct functionalizations using arylatedhydrazines as the building blocks[J]. Catal Rev Sci Eng, 2019, 62(3): 1–74.
|
| [16] |
Wang Z X, Yang B. Chemical transformations of quaternary ammonium salts via C-N bond cleavage[J]. Org Biomol Chem, 2020, 18(6): 1057–1072.
DOI:10.1039/C9OB02667C |
| [17] |
Li G, Chen Y, Xia J. Progress on transition-metal-catalyzed cross-coupling reactions of ammonium salts via C-N bond cleavage[J]. Chin J Org Chem, 2018, 38(8): 1949–1962.
DOI:10.6023/cjoc201803013 |
| [18] |
Zhai Guo-qing(翟国庆), Yu Zong-jiang(于宗江), Jiang Tao(江涛), et al. Research progress in cleavage of C-N bond(碳氮键断裂的研究进展)[J]. Chem(化学通报), 2018, 81(7): 579–586.
|
| [19] |
Zhang Yong-gang (张永刚). Oxidantive cleavage of C-N bond sand alkenes synthesis (碳氮键的氧化断裂与烯烃合成)[D]. Hefei (合肥): University of Science and Technology of China (中国科学技术大学), 2014.
|
| [20] |
Xu Ya-nan (许亚楠). Studies on the activation and carbon-nitrogen bond cleavage reaction of alkylamines (烷基胺的活化及碳-氮键断裂反应研究)[D]. Hefei (合肥): University of Science and Technology of China (中国科学技术大学), 2019.
|
| [21] |
Cong X, Fan F, Ma P, et al. Low-valent, high-spin chromium-catalyzed cleavage of aromatic carbon nitrogen bonds at room temperature: A combined experimental and theoretical study[J]. J Am Chem Soc, 2017, 139(42): 15182–15190.
DOI:10.1021/jacs.7b08579 |
| [22] |
Tang J, Fan F, Cong X, et al. Reductive cross-coupling between unactivated C (aryl)-N and C (aryl)-O bonds by chromium catalysis using a bipyridyl ligand[J]. J Am Chem Soc, 2020, 142(29): 12834–12840.
DOI:10.1021/jacs.0c05730 |
| [23] |
Ueno S, Chatani N, Kakiuchi F. Ruthenium-catalyzed carbon-carbon bond formation via the cleavage of an unreactive aryl carbon-nitrogen bond in aniline derivatives with organoboronates[J]. J Am Chem Soc, 2007, 129(19): 6098–6099.
DOI:10.1021/ja0713431 |
| [24] |
Koreeda T, Kochi T, Kakiuchi F. Substituent effects on stoichiometric and catalytic cleavage of carbon-nitrogen bonds in aniline derivatives by ruthenium-phosphine complexes[J]. Organometallics, 2013, 32(2): 682–690.
DOI:10.1021/om3011855 |
| [25] |
Koreeda T, Kochi T, Kakiuchi F. Cleavage of C-N bonds in aniline derivatives on a ruthenium center and its relevance to catalytic C-C bond formation[J]. J Am Chem Soc, 2009, 131(21): 7238–7239.
DOI:10.1021/ja902829p |
| [26] |
Kondo H, Akiba N, Kochi T, et al. Ruthenium-catalyzed monoalkenylation of aromatic ketones by cleavage of carbon-heteroatom bonds with unconventional chemoselectivity[J]. Angew Chem Int Ed, 2015, 54(32): 9293–9297.
DOI:10.1002/anie.201503641 |
| [27] |
Zhao Y, Snieckus V. Beyond directed orthometalation: Ruthenium-catalyzed amide-directed CAr-N activation/C-C coupling reaction of anthranilamides with organoboronates[J]. Org Lett, 2014, 16(12): 3200–3203.
DOI:10.1021/ol501180q |
| [28] |
Zhao Q, Zhang J, Szostak M. Ruthenium (0)-catalyzed cross-coupling of anilines with organoboranes by selective carbon-nitrogen cleavage[J]. ACS Catal, 2019, 9(9): 8171–8177.
DOI:10.1021/acscatal.9b02440 |
| [29] |
Xu J X, Zhao F, Franke R, et al. Ruthenium-catalyzed suzuki coupling of anilines with alkenyl borates via selective aryl C-N bond cleavage[J]. Catal Commun, 2020, 140: 106009.
DOI:10.1016/j.catcom.2020.106009 |
| [30] |
Koreeda T, Kochi T, Kakiuchi F. Ruthenium-catalyzed reductive deamination and tandem alkylation of aniline derivatives[J]. J Organomet Chem, 2013, 741: 148–152.
|
| [31] |
Xu J X, Zhao F, Yuan Y, et al. Ruthenium-catalyzed carbonylative coupling of anilines with organoboranes by the cleavage of neutral aryl C-N bond[J]. Org Lett, 2020, 22(7): 2756–2760.
DOI:10.1021/acs.orglett.0c00736 |
| [32] |
Akiyama F, Miyazaki H, Kaneda K, et al. Arylation and alkylation of olefins by arylamines or hydrazines via carbon-nitrogen bond cleavage in the presence of palladium (I1) salts[J]. J Org Chem, 1980, 45(12): 2359–2361.
DOI:10.1021/jo01300a018 |
| [33] |
Akiyama F, Teranishi S, Fujiwara Y, et al. Aromatic substitution of olefins.arylation with anilines via the C-N bond cleavage in the presence of palladium (Ⅱ) acetate[J]. J Organomet Chem, 1977, 140: C7–C9.
DOI:10.1016/S0022-328X(00)84403-4 |
| [34] |
Bonanno J B, Henry T P, Neithamer D R, et al. Arylamine C-N bond oxidative addition to (silox)3Ta (silox=tBu3SiO)[J]. J Am Chem Soc, 1996, 118(21): 5132–5133.
DOI:10.1021/ja960092l |
| [35] |
Tobisu M, Nakamura K, Chatani N. Nickel-Catalyzed reductive and borylative cleavage of aromatic carbon-nitrogen bonds in N-aryl amides and carbamates[J]. J Am Chem Soc, 2014, 136(15): 5587–5590.
DOI:10.1021/ja501649a |
| [36] |
Zhang Z B, Ji C L, Yang C, et al. Nickel-catalyzed kumada coupling of boc-activated aromatic amines via nondirected selective aryl C-N bond cleavage[J]. Org Lett, 2019, 21(4): 1226–1231.
DOI:10.1021/acs.orglett.9b00242 |
| [37] |
Cao Z C, Li X L, Luo Q Y, et al. Direct borylation of tertiary anilines via C-N bond activation[J]. Org Lett, 2018, 20(7): 1995–1998.
DOI:10.1021/acs.orglett.8b00545 |
| [38] |
Cao Z C, Xie S J, Fang H, et al. Ni-catalyzed cross-coupling of dimethyl aryl amines with arylboronic esters under reductive conditions[J]. J Am Chem Soc, 2018, 140(42): 13575–13579.
DOI:10.1021/jacs.8b08779 |
| [39] |
Liu J Q, Robins M J. Azoles as suzuki cross-coupling leaving groups: Syntheses of 6-arylpurine 2'-deoxynucleosides and nucleosides from 6-(imidazol-1-yl)-and 6-(1, 2, 4-triazol-4-yl) purine derivatives[J]. Org Lett, 2004, 6(19): 3421–3423.
DOI:10.1021/ol048490d |
| [40] |
Li T, Wang Z, Zhang M, et al. Rh/Cu-catalyzed multiple C-H, C-C, and C-N bond cleavage: Facile synthesis of pyrido[2, 1-a]-indoles from 1-(pyridin-2-yl)-1H-indoles and γ-substituted propargyl alcohols[J]. Chem Commun, 2015, 51(31): 6777–6780.
DOI:10.1039/C5CC01412C |
 2020, Vol. 34
2020, Vol. 34


