CH3OH裂解反应在直接甲醇燃料电池(DMFCs)[1]和甲醇蒸汽重整反应(MSR)[2]中起重要作用, 裂解过程中产生的中间体还可应用于医药和染料行业. 近年来, CH3OH裂解反应已被广泛研究, 但对于CH3OH初步裂解路径还存在一些争议[3-6]. CH3OH初步裂解可以通过C-H、C-O、O-H键的断裂进行, 生成的第一个中间体再继续裂解. 目前大部分的实验和理论结果表明CH3OH首先通过O-H键断裂生成CH3O[3-4, 7], 而Levis等[8]通过二次离子质谱和程序升温脱附法发现CH3OH在Pt(111)表面初步裂解是通过C-O键的断裂形成CH3物种, Lin等[5]通过理论计算指出CH3OH在Pd(100)表面初步裂解是通过C-H键的断裂生成CH2OH. 而且, 在Pd(211)[5]、Pt3Ni[9]等催化剂表面, CH3OH初步裂解是速控步骤, 在整个裂解过程中起关键作用.
CH3OH裂解常用的催化剂是Cu[4]、Ru[10]、Rh[11]、Ni[12]、Pd[5]等过渡金属. 根据研究者提出的金属热稳定性顺序: Ag < Cu < Au < Pd < Fe < Ni < Co < Pt < Rh < Ru < Ir < Os < Re[13], 发现CH3OH裂解常用的金属催化剂的耐热性不是很高. 过渡金属在高温下催化CH3OH裂解的过程中, 既可能发生金属烧结, 也会引发副反应导致积碳[13-14]. CH3OH在裸露的金属表面裂解有着较高的活性, 但表面碳沉积和热力学烧结是过渡金属催化剂失活的主要原因[15]. 耐久性和催化活性兼备的CH3OH裂解催化剂的设计与制备受到越来越多研究者的关注[15].
有研究表明相对于纯CNTs, 沉积在CNT外壁上的金属颗粒的稳定性和活性有所提高[16], 但对于将金属封装在碳纳米管内部(M@CNTs)的催化体系研究尚浅. M@CNTs理论上的催化原理是金属纳米颗粒通过向外层电子转移参与催化反应[17]. 研究表明Fe@CNTs、Co@CNTs、Ni@CNTs等结构中金属纳米颗粒会改变体系的物化性质[18-20], 碳纳米管封装纳米金属粒子通过纳米管壁将金属与反应环境隔离有效保护了金属, 但封装对金属粒子催化活性的影响并没有形成共识. Chen等[21]发现Fe@CNTs在费托合成反应中使得催化活性提高, 而Guo等[22]使用Ru@CNTs催化氨合成反应发现纳米管壁会阻碍Ru电子转移并削弱催化活性. 然而, CH3OH在M@CNTs表面初步裂解路径及其催化作用机理尚不清楚.
我们以直径为1 nm两端封口的CNTs内部封装过渡金属为催化剂模型, 以CH3OH初步裂解反应为探针. 通过运用DFT和VASP软件计算CH3OH在M@CNTs(M= Fe、Co、Ni、Cu、Fe2、Co2、FeCo)表面相应的反应热和活化能, 并探索其吸附和初步裂解机理.
1 计算方法及模型 1.1 计算方法所有的DFT计算均使用Vienna Ab initio模拟软件包(VASP)进行[23]. 离子核与电子之间的相互作用由投影仪增强波(PAW)描述[24]. 交换相关函数通过广义梯度近似(GGA)进行处理[25]. 平面波基的动态截止能量设定为270 eV, 使用1×1×1 k点采样网格, 涂抹宽度为0.2 eV的Monkhorst-Paxton进行计算. 过渡态(TS)通过CI-NEB方法确定. 通过振动分析, 有且仅有一个虚频证实过渡态.
吸附能(Eads)定义如下:
| $ {\mathrm{E}}_{\mathrm{a}\mathrm{d}\mathrm{s}}={\mathrm{E}}_{\mathrm{a}\mathrm{d}\mathrm{s}\mathrm{o}\mathrm{r}\mathrm{b}\mathrm{a}\mathrm{t}\mathrm{e}/\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)}-{\mathrm{E}}_{\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)}-{\mathrm{E}}_{\mathrm{a}\mathrm{d}\mathrm{s}\mathrm{o}\mathrm{r}\mathrm{b}\mathrm{a}\mathrm{t}\mathrm{e}} $ | (1) |
其中Eadsorbate/(catalyst)、Ecatalyst、Eadsorbate分别是催化剂以及吸附介质的总能量、催化剂、吸附介质的能量. 根据定义, Eads值为负表示在催化剂表面是放热吸附, 且吸附的物质是稳定的.
对于在金属和表面上的AB→A + B之类的反应, 根据以下方程式计算反应能(ΔH)和能垒(Ea):
| $ △\mathrm{H}={\mathrm{E}}_{\left(\mathrm{A}+\mathrm{B}\right)/\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)}-{\mathrm{E}}_{\mathrm{A}\mathrm{B}/\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)} $ | (2) |
| $ {\mathrm{E}}_{\mathrm{a}}={\mathrm{E}}_{\mathrm{T}\mathrm{S}/\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)}-{\mathrm{E}}_{\mathrm{A}\mathrm{B}/\left(\mathrm{c}\mathrm{a}\mathrm{t}\mathrm{a}\mathrm{l}\mathrm{y}\mathrm{s}\mathrm{t}\right)} $ | (3) |
其中, E(A+B)/(catalyst)是催化剂表面共吸附的A和B的总能量, EAB/(catalyst)是被吸附的AB的能量, ETS/(catalyst)是过渡态的能量.)
d带中心的公式为:
| $ \mathrm{\varepsilon }\mathrm{d}=\frac{{\int }_{-\mathrm{\infty }}^{+\mathrm{\infty }}\mathrm{n}\left(\mathrm{\epsilon }\right)\mathrm{\epsilon }\mathrm{d}\mathrm{\epsilon }}{{\int }_{-\mathrm{\infty }}^{+\mathrm{\infty }}\mathrm{n}\left(\mathrm{\epsilon }\right)\mathrm{d}\mathrm{\epsilon }} $ | (4) |
其中, 𝛆为能量, n(𝛆)为d电子密度.
1.2 计算模型计算模型是直径为0.94 nm的两端封口的单壁碳纳米管, 在其内部顶端锚定过渡金属. 以FeCo@CNTs为例, 模型的主视图和俯视图如图 1所示.

|
图 1 FeCo@CNTs催化剂模型的主视图和俯视图 Fig.1 Front view and top view of FeCo@CNTs catalyst model |
CNTs帽状结构的五元环与六元环连接处附近为活性位点, 这是由于CNTs的封口处出现了五元环结构使其表面更具活性. 过渡金属在活性位点附近有5个吸附位点, 如图 1所示为site1~5. 通过计算金属的吸附, 发现单个金属在site1位点的吸附最稳定, 双金属分别吸附在两个五元环的穴位. 然后确定了CH3OH及其中间体的吸附态, 包括CH3OH、CH2OH、CH3O、CH3. FeCo@CNTs表面各物种的最稳定结构如图 2所示, CNTs表面和其它M@CNTs表面各物种的最稳定结构与FeCo@CNTs表面类似, 不再赘述, 相应的吸附能如表 1所示.
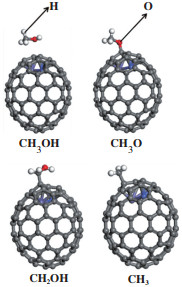
|
图 2 FeCo@CNTs表面CH3OH及相关物种的最稳定构型 Fig.2 The most stable configuration of CH3OH and related species on FeCo@CNTs surface |
| 表 1 CNTs、M@CNTs表面CH3OH及相关物种的吸附能(eV) Table 1 Adsorption energy (eV) of CH3OH and related species on the surfaceof CNTs and M@CNTs |
CHxOH(x=2~3)的吸附. CH3OH吸附在site1位点的上方与管内的金属相互作用. CH3OH在M@CNTs表面吸附的最稳定结构是C-O键几乎与催化剂表面平行, 是较弱的物理吸附. CH2OH通过CH3OH的C-H键断裂生成, 它的最优位点是通过C吸附在催化剂表面, CH2OH在催化剂表面是较强的化学吸附.
CH3O的吸附. CH3OH通过O-H键断裂生成CH3O, 中间体CH3O通过O吸附在M@CNTs表面. 通过表 1可以看出, 由于失去一个H, CH3O的吸附能比CH3OH大得多.
CH3的吸附. CH3是CH3OH通过C-O键断裂形成, CH3与CH2OH类似, 是通过C与催化剂表面相互作用, 都是较强的化学吸附.
2.2 CH3OH在M@CNTs表面的初步裂解分别计算了CNTs表面和M@CNTs表面CH3OH初步裂解的反应能和活化能, 确定了CH3OH初步裂解的最有利路径. 以FeCo@CNTs为例, 催化剂表面CH3OH初步裂解的初态(IS)、TS、终态(FS)的构型如图 3所示. 所有的反应能和活化能的计算结果汇于表 2中.
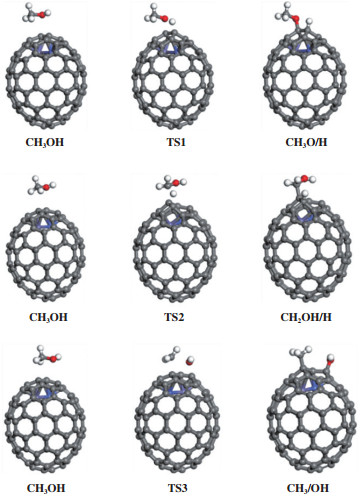
|
图 3 FeCo@CNTs表面CH3OH初步裂解反应的IS、TS、FS的最稳定构型 Fig.3 The most stable configuration of IS, TS and FS in the initial cleavage reaction of CH3OH on the FeCo@CNTs surface |
| 表 2 CNTs、M@CNTs表面CH3OH裂解的相关反应能和活化能 Table 2 Related reaction and activation energy of CH3OH crackingon the surfaceof CNTs and M@CNTs |
R1: CH3OH→CH3O + H. CH3OH分子吸附在CNTs表面, C-O键与表面平行, 作为反应物的初始构型. CH3OH的初始裂解有3条路径, 分别是C-O、C-H和O-H键断裂路径. 该反应表示吸附的CH3OH开始初步裂解, 经O-H键断裂生成CH3O和H. CH3O通过O与催化剂表面成键, 游离的H吸附于邻位的碳原子上. 该反应吸热0.35 eV, 活化能为1.60 eV, 与Pd(100)[26]催化剂表面的活化能数据相差不大(1.71 eV).
R2: CH3OH→CH2OH + H. CH3OH中的C-H键裂解也可能发生, 反应吸热0.17 eV, 需跨越1.97 eV的能垒. C-H键断裂的活化能略高于O-H键断裂的活化能, 两者之间存在比较激烈的竞争(1.97 vs. 1.60 eV), 但后者更容易.
R3: CH3OH→CH3 + OH. 另一种可能的反应路径是CH3OH通过C-O键裂解生成CH3和OH, 该反应吸热0.28 eV, 活化能为3.84 eV. 经过TS3生成CH3和OH的活化能相对较高, 说明C–O键几乎很难发生断裂, 这与之前的研究结果一致[27]. 在CNTs表面, CH3OH最可能通过O-H键裂解生成CH3O, 而C-O键断裂最难发生.
2.2.2 CH3OH在M@CNTs表面的初步裂解以FeCo@CNTs表面CH3OH初步裂解为例进行说明, CH3OH的IS、TS、FS的构型如图 3所示. 其它M@CNTs表面与FeCo@CNTs的IS、TS、FS的构型类似, 相应的反应能和活化能的值如表 2所示.
R1: CH3OH→CH3O + H.与CNTs表面类似, CH3OH在FeCo@CNTs表面的初始裂解始于CH3OH的吸附. CH3OH通过O-H键断裂经TS1形成CH3O和H的活化能为0.76 eV, 该反应放热-0.58eV. 根据表 2的活化能数据, 可以发现在FeCo@CNTs表面, CH3OH通过O-H键裂解的活化能低于Fe@CNTs、Co@CNTs表面.
R2: CH3OH→CH2OH + H. CH3OH中的C-H键裂解也可能发生, 该反应放热-0.44eV, 活化能为2.18 eV. 生成CH2OH和H的活化能高于生成CH3O和H的活化能, 说明O-H键断裂更有利.
R3: CH3OH→CH3 + OH. CH3OH还可以经TS3跨越3.11 eV的高能垒, 通过断裂C-O键生成CH3物种, 该反应放热-1.05 eV. 在FeCo@CNTs表面, CH3OH也是通过O-H键裂解生成CH3O, C-H键和C-O键断裂都较难发生.
2.3 讨论 2.3.1 DOS分析和d带中心计算了M@CNTs催化O-H键断裂步骤中封装的金属和裸露的单金属d轨道的局域态密度(PDOS)及其d带中心, 图 4中设置0点为费米能级, 曲线和垂直实线分别表示PDOS和d带中心. M@CNTs(M=Fe、Co、Ni、Cu)中金属的d轨道的DOS是一个很大的峰, 说明d电子相对比较局域; M@CNTs(M=Fe2、Co2、FeCo)中两个金属的d轨道存在非常明显的重叠, 表明双金属之间有强烈的相互作用. 通过图 4可以发现M@CNTs中金属的d带中心比单金属更加靠近费米能级, 说明封装后金属有着更高的活性. 当费米能级为0 eV时, 对-2到0 eV范围内的态密度积分为可激发电子数. M@CNTs(M= Fe、Co、Ni、Cu)中金属的可激发电子数分别为5.20、5.55、5.57、1.17, 而Fe和Co的d带中心更加靠近费米能级, 增大Fe和Co数量或组合两者会在d带中心变化不大的前提下有更多的可激发电子数. M@CNTs(M=Fe2、Co2、FeCo)中金属的可激发电子数分别为7.90、8.39、8.47, 其中FeCo@CNTs中FeCo的可激发电子数最多, d带中心最靠近费米能级, 说明FeCo可能参与催化反应的电子最多, 致使催化剂对O-H键的活化作用更强, 即反应活化能更低.

|
图 4 M@CNTs中金属原子d轨道的PDOS和d带中心 Fig.4 PDOS and d-band center of d orbital of metal atom on the M@CNTs |
通过图 5可以发现, CH3OH在CNTs表面裂解的活化能较高, 封装金属后催化剂的活性都高于CNTs表面, 说明过渡金属向碳层的电子转移使得表面碳原子的活化程度提高. M@CNTs(M=Fe、Co、Ni、Cu)催化CH3OH中O-H键断裂的活化能逐渐增大, 这可能与Fe(4s23d6)、Co(4s23d7)、Ni(4s23d8)、Cu(4s13d10)的外层电子数逐渐增大有关. 增加活化能相对较低的Fe和Co的数量后, 发现与Fe@CNTs (1.10 eV)和Co@CNTs (1.11 eV)的活化能相比, Fe2@CNTs (1.06 eV)和Co2@CNTs (1.00 eV)稍有降低, 说明金属的数量对催化活性有一定的影响. 而将活化能相对较低的Fe和Co组合后, 发现FeCo@CNTs (0.76 eV)的活化能有较大幅度下降, 说明Fe和Co组合后向CNTs的电子转移量增大, 使得催化剂发挥出了更高的活性, 对催化活性的影响很大. CH3OH在M@CNTs表面O-H键断裂的活化能既与金属转移电子量有关, 还与金属颗粒活化了多少碳表面有关. FeCo@CNTs (0.76 eV) 表面O-H键断裂的活化能与Ru(0001)[10]表面(0.74 eV)相差不大, 说明FeCo@CNTs可以有效活化O-H键.
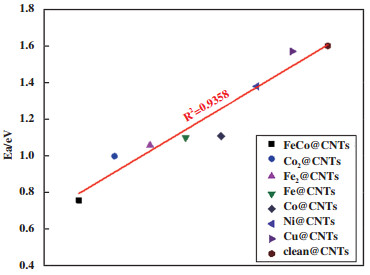
|
图 5 CH3OH在CNTs、M@CNTs表面O-H键断裂的活化能关系图 Fig.5 The relationship between the activation energy of CH3OH on the surface of CNTs and M@CNTs for O-H bond breakage |
通过运用DFT计算了在催化剂表面CH3OH初步裂解过程中3条路径下的反应能和活化能, 研究了CH3OH在CNTs表面、M@CNTs表面吸附和初步裂解机理. 依据计算结果可以发现: (1)CH3OH在CNTs和M@CNTs表面是物理吸附, O-H键断裂是最有利的路径, 其在不同催化剂表面的活化能顺序是CNTs(1.60 eV)、Cu@CNTs(1.57 eV)、Ni@CNTs(1.38 eV)、Co@CNTs(1.11 eV)、Fe@CNTs(1.10 eV)、Fe2@CNTs(1.06 eV)、Co2@CNTs(1.00 eV)、FeCo@CNTs(0.76 eV), 即FeCo@CNTs可作为CH3OH初步裂解的有效催化剂; (2)CNTs封装金属粒子的数量对其催化活性有一定的影响; (3)双金属封装催化剂可能有更高的催化活性. 该研究结果为设计和发展新的CH3OH裂解催化剂体系提供理论支撑.
| [1] |
Liu Z, Shi Q, Peng F, et al. Pt supported on phosphorus-doped carbon nanotube as an anode catalyst for direct methanol fuel cells[J]. Electrochem Commun, 2012, 16(1): 73–76.
DOI:10.1016/j.elecom.2011.11.033 |
| [2] |
a. Gu X K, Li W X. First-principles study on the origin of the different selectivities for methanol steam reforming on Cu(111) and Pd(111)[J]. J Phys Chem C, 2010, 114(49): 21539-21547. b. Lian Chen-shuai(连晨帅), Dai Rong(代蓉), Tian Ren(田韧), et al. The effect of preparation method on catalytic properties over Ni-Cu bimetallic catalysts for steam Re forming of ethanol (Ni-Cu双金属催化剂上乙醇水蒸气重整制氢研究—制备方法对催化性能的影响)[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 297-308. c. Guo Dan-yu(郭丹瑜), Fan Ling-na(范玲娜), An Xia(安霞), et al. The effect of metal modified mesoporous molecular sieve SBA-15 on hydrogen production by steam reforming of ethanol(金属改性SBA-15应用于乙醇水蒸气重整制氢的研究)[J]. J Mol Catal (China)(分子催化), 2019, 33(1): 66-74. |
| [3] |
Zhang Y C, Ren R P, Liu S Z, et al. Theoretical study on the influence of a secondary metal on the Cu(110) surface in the presence of H2O for methanol decomposition[J]. RSC Adv, 2016, 6(18): 15127–15136.
DOI:10.1039/C5RA18226C |
| [4] |
Greeley J, Mavrikakis M. Methanol Decomposition on Cu(111): A DFT Study[J]. J Catal, 2002, 208(2): 291–300.
DOI:10.1006/jcat.2002.3586 |
| [5] |
Lin S, Ma J, Zhou L, et al. Influence of step defects on methanol decomposition: periodic density functional studies on Pd(211) and kinetic monte carlo simulations[J]. J Phys Chem C, 2013, 117(1): 451–459.
DOI:10.1021/jp310600q |
| [6] |
Miller A V, Kaichev V V, Prosvirin I P, et al. Mechanistic study of methanol decomposition and oxidation on Pt(111)[J]. J Phys Chem C, 2013, 117(16): 8189–8197.
DOI:10.1021/jp3122177 |
| [7] |
Cao D, Lu G Q, Wieckowski A, et al. Mechanisms of methanol decomposition on platinum: A combined experimental and ab initio approach[J]. J Phys Chem B, 2005, 109(23): 11622–11633.
DOI:10.1021/jp0501188 |
| [8] |
Levis R J, Jiang Z C, Winograd N. Evidence for activation of the carbon-oxygen bond of methanol on the palladium(111) surface after low temperature adsorption[J]. J Am Chem Soc, 1988, 110(13): 4431–4432.
DOI:10.1021/ja00221a063 |
| [9] |
Du P, Wu P, Cai C. Mechanism of methanol decomposition on the Pt3Ni(111) surface: DFT study[J]. J Phys Chem C, 2017, 121(17): 9348–9360.
DOI:10.1021/acs.jpcc.7b01114 |
| [10] |
Liu J H, Lue C Q, Jin C, et al. Density functional theoretical studies on the methanol adsorption and decomposition on Ru(0001) surfaces[J]. Chem Res Chin Univ, 2016, 32(2): 234–241.
DOI:10.1007/s40242-016-5416-z |
| [11] |
Hung T C, Liao T W, Liao Z, et al. Dependence on size of supported Rh nanoclusters in the decomposition of methanol[J]. ACS Catal, 2015, 5(7): 4276–4287.
DOI:10.1021/acscatal.5b00579 |
| [12] |
Wang G C, Zhou Y H, Morikawa Y, et al. Kinetic mechanism of methanol decomposition on Ni(111) surface: A theoretical study[J]. J Phys Chem B, 2005, 109(25): 12431–12442.
DOI:10.1021/jp0463969 |
| [13] |
Lindstrom B, Pettersson L J. Hydrogen generation by steam reforming of methanol over copper-based catalysts for fuel cell applications[J]. Int J Hydrog Energy, 2001, 26(9): 923–933.
DOI:10.1016/S0360-3199(01)00034-9 |
| [14] |
Twigg M V, Spencer M S. Deactivation of copper metal catalysts for methanol decomposition, methanol steam reforming and methanol synthesis[J]. Top Catal, 2003, 22(3/4): 191–203.
DOI:10.1023/A:1023567718303 |
| [15] |
Xu Y, Jin H X, Zhang J X, et al. Carbon deposition–resistant Ni3Sn nanoparticles with highly stable catalytic activity for methanol decomposition[J]. Appl Catal A: Gen, 2020, 608: 117872–107884.
DOI:10.1016/j.apcata.2020.117872 |
| [16] |
Huang K, Li Y F, Yan L T, et al. Nanoscale conductive niobium oxides made through low temperature phase transformation for electrocatalyst support[J]. RSC Adv, 2014, 4(19): 9701–9708.
DOI:10.1039/c3ra47091a |
| [17] |
Yu L, Deng D, Bao X. Chainmail for catalysts[J]. Angew Chem Int Edit, 2020, 59(36): 15294–15297.
DOI:10.1002/anie.202007604 |
| [18] |
Oluigbo C J, Ullah N, Xie M, et al. Incorporation of pyridinic and graphitic N to Ni@CNTs: As a competent electrocatalyst for hydrogen evolution reaction[J]. Int J Energ Res, 2020, 44(11): 9157–9165.
DOI:10.1002/er.5536 |
| [19] |
Javan M B, TajaborN , BehdaniM , et al. Influence of 3d transition metals (Fe, Co) on the structural, electrical and magnetic properties of C60 nano-cage[J]. Physica: B, 2010, 405(24): 4937–4942.
DOI:10.1016/j.physb.2010.09.035 |
| [20] |
Garg I, Sharma H, Kapila N, et al. Transition metal induced magnetism in smaller fullerenes (C-n for n≤36)[J]. Nanoscale, 2011, 3(1): 217–224.
DOI:10.1039/C0NR00475H |
| [21] |
Chen X Q, Deng D H, Pan X L, et al. Iron catalyst encapsulated in carbon nanotubes for CO hydrogenation to light olefins[J]. Chin J Catal, 2015, 36(9): 1631–1637.
DOI:10.1016/S1872-2067(15)60882-8 |
| [22] |
Guo S, Pan X L, Gao H L, et al. Probing the electronic effect of carbon nanotubes in catalysis: NH3 synthesis with Ru nanoparticles[J]. Chem Eur J, 2010, 16(18): 5379–5384.
DOI:10.1002/chem.200902371 |
| [23] |
Kresse G, Hafner J. Ab initio molecular-dynamics simulation of the liquid-metal-amorphous-semiconductor transition in germanium[J]. Phys Rev B: Condens Matter, 1994, 49(20): 14251–14269.
DOI:10.1103/PhysRevB.49.14251 |
| [24] |
Kresse G, Joubert D. From ultrasoft pseudopotentials to the projector augmented-wave method[J]. Phys Rev B, 1999, 59(3): 1758–1775.
DOI:10.1103/PhysRevB.59.1758 |
| [25] |
Perdew J P, Burke K, Ernzerhof M. Generalized gradient approximation made simple[J]. Phys Rev Lett, 1998, 77(18): 3865–3868.
|
| [26] |
Jiang Z, Wang B, Fang T. A theoretical study on the complete dehydrogenation of methanol on Pd(100) surface[J]. Appl Surf Sci, 2016, 364(Feb.28): 613–619.
|
| [27] |
Zhang D D, Feng W, Liu H L, et al. Dissociation and oxidation mechanism of methanol on Al12N12 cage: A DFT study[J]. Theor Chem Acc, 2018, 137(8): 1–12.
|
 2021, Vol. 35
2021, Vol. 35


