2. 江苏大学 化学化工学院, 江苏 镇江 212013;
3. 华东理工大学 化工学院, 上海 200237
2. School of Chemistry and Chemical Engineering, Jiangsu University, Zhenjiang 212013, China;
3. School of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China
苯是石油工业的重要有机溶剂和基础原料, 在化工产品, 农药和医药领域有很大的需求. 早在1940年代, Reppe等[1]即报道了Ni催化剂可以催化乙炔环三聚反应生成苯. 虽然采用乙炔环三聚合成苯仍没有工业化报道, 但对于乙炔环三聚反应的研究至今仍是化学工作者感兴趣的科学问题之一.
随着计算化学及计算机硬件的发展, 分子模拟越来越引起学术界的兴趣[2-9]. 有研究报道, Fe[2]和Ni[3]均可以催化乙炔发生环三聚反应生成苯. Liu等[4-5]利用DFT方法研究了Cr系催化剂催化乙炔/丙炔环三聚的反应机理, 并提出铬中心自旋翻转对乙炔/丙炔环三聚反应机理及反应活性的影响机制, 确定了最佳反应路径. 类似地, 钴及其他金属体系催化乙炔环三聚反应路径中也存在电子自旋翻转的报道[6-9]. 以上研究为理解不同过渡金属催化乙炔/丙炔环三聚机理奠定了良好的理论基础.
我们旨在应用DFT方法研究Cr、Fe和Ni过渡金属催化乙炔环三聚的反应机理, 通过解析乙炔环三聚反应中的关键中间体和过渡态, 最终阐明过渡金属单原子Cr、Fe和Ni对乙炔环三聚反应的催化性能, 并确定各催化体系下的最优反应路径.
1 计算模型与方法结构优化和频率分析在Gaussian 09软件包中完成, 对H和O原子使用全电子6-311G(d, p)基组, 对金属原子采用赝势LanL2TZ(f)基组. Liu等[4]将完全活性空间二阶微扰理论(CASPT2)的计算值作为基准, 测试了Gaussian 09软件包中的30种杂化泛函和180种非杂化泛函. 测试结果表明含有28% Hartree-Fock交换能的杂化泛函B3PW91*最适用于过渡金属催化乙炔环三聚反应体系的计算. 我们在B3PW91* 水平下进行乙炔环三聚的反应机理研究.
过渡金属催化乙炔环三聚反应遵循金属环机理. 以铬金属为例, 金属环反应路径如图 1所示. 两分子乙炔连续与铬中心配位得到双乙炔配合物2, 或吸附第三分子乙炔形成三乙炔络合物3; 若双乙炔配合物发生氧化耦合, 则可以得到金属五元环中间体4; 若三乙炔配合物中两分子乙炔发生氧化耦合, 则可以形成金属乙炔-铬五元环配合物6; 金属五元环4发生还原消去反应就可以得到乙炔二聚产物5; 第三分子乙炔配位则形成乙炔-铬五元环配合物6, 进一步环增长得到铬七元环7, 最终发生还原消去反应得到产物8; 乙炔-铬五元环配合物6, 也可能发生还原消去反应, 生成带有一分子乙炔配位的二聚产物配合物9.

|
图 1 Cr催化乙炔环三聚生成苯的反应机理图 Fig.1 Schematic representation of acetylene cyclotrimerization to benzene catalyzed by Cr catalyst |
铬原子最外层电子排布为3d54s1, 因此铬配合物存在七重态、五重态、三重态和一重态等多种可能的电子自旋态, 其中铬原子处于七重态基态势能面. 图 2中展示了多乙炔-铬配合物在不同自旋态条件下的几何结构、相对能量(kJ/mol)和铬活性中心的自旋密度及电荷. 乙炔分子与铬中心形成稳定的乙炔铬配合物主要存在两种轨道作用方式: i)乙炔分子的两个π轨道分别与铬中心的3d轨道通过π, σ方式发生重叠; ii)铬中心的3d轨道同时又通过π, σ反馈的方式与乙炔分子的两个π轨道发生重叠, 从而活化了乙炔分子. 乙炔分子也因此失去了其原有的线性分子结构. 从几何构型看, 乙炔-铬配合物基本处于空间对称状态. 一重态下, 乙炔分子和Cr中心的相互作用较强, Cr-C间的距离为0.183 nm. 在三重态、五重态和七重态条件下, 单分子乙炔与Cr中心的作用逐渐变弱, Cr-C间的距离也逐渐增大, 直至达到0.372 nm(71). 类似地, 两分子乙炔与Cr中心发生配位作用形成具有空间对称性的双乙炔-铬配合物. 其中, 在五重态条件下, 两分子乙炔相互垂直, 使得配合物能量降至-51.2 kJ/mol. 当第三分子乙炔尝试配位时, 在一重态条件下可以形成稳定的三乙炔-铬配合物, 进而在第三分子乙炔配位状态下发生氧化耦合反应得到乙炔-铬五元环. 与一重态条件下反应路径不同之处: 在三重态和五重态条件下, 两分子乙炔会发生耦合成环反应, 无法通过配位第三分子乙炔, 经三乙炔-铬中间体形成乙炔-铬五元环的配合物. 在七重态条件下, 第三分子乙炔与Cr中心的相互作用很弱, 难以发生后续的氧化耦合成环反应.

|
图 2 不同自旋多重度条件下乙炔-铬配合物的几何结构及铬中心的自旋密度(MSD)和电荷(MC) Fig.2 Geometrical features, Mulliken spin densities, and Mulliken charges of Cr·(C2H2)n (n=1, 2, 3) complexes |
图 2中给出了铬中心的电子自旋密度及电荷. 乙炔铬配合物的自旋多重态为一重态、三重态、五重态及七重态时, 其铬中心理论未成对电子数目分别为0, 2, 4, 6. 自旋一重态条件下, 乙炔铬配合物体系不存在单电子, 因此, 铬中心的自旋密度为零. 自旋三重态、五重态条件下, 铬中心理论上分别存在2、4个单电子, 计算得到的铬中心自旋密度和理论值比较接近. 但在自旋七重态条件下, 对于单乙炔铬配合物, 乙炔和铬中心几乎不存在明显的相互作用, 铬中心的自旋密度计算值为5.996, 十分接近理论值6. 对于双乙炔和三乙炔铬配合物, 由于乙炔分子的配位作用, 铬中心的电子发生了离域, 七重态条件下计算得到的铬中心自旋密度则明显低于理论值6. 电荷分析则表明, 铬中心的3d轨道通过π, σ反馈的方式与乙炔分子的两个π*反键轨道发生重叠, 其3d电子进入乙炔的π*反键轨道, 从而表现出一定的正电性. 在七重态条件下, 单乙炔铬配合物铬中心与乙炔的距离较远, 铬中心的电荷几近为零.
基于乙炔环三聚生成苯的反应机理路径(图 1), 优化了在一重态、三重态、五重态及七重态条件下各反应中间体的几何结构. 图 3给出了自旋七重态和五重态条件下铬催化乙炔环三聚反应的吉布斯自由能图. 从基态七重态出发(70), 第一分子乙炔与Cr原子配位时, 反应随即翻转至五重态势能面(51). 第二分子乙炔与Cr原子配位放出56.0 kJ/mol能量, 克服32.3 kJ/mol的能垒得到铬五元环(54). 类似地, 第三分子乙炔配位会使体系能量进一步降低. 铬五元环增长形成铬七元环需要克服55.5 kJ/mol的能垒. 铬七元环发生还原消去反应, 克服48.3 kJ/mol的能垒, 经过自旋翻转至七重态势能面, 得到铬-苯配合物(78). 随后, 在铬中心配位的苯分子进一步解吸附, 完成一次完整的催化循环. 铬五元环中间体直接发生还原消去反应形成乙炔二聚产物, 需要克服205.2 kJ/mol的能垒, 这远高于其他C-C耦合反应的能垒, 以及铬七元环发生还原消除反应的能垒. 因此, 在自旋七重态和五重态势能面上发生乙炔环三聚反应的速率控制步骤为第三分子乙炔的插入反应, 也是铬七元环中间体的形成过程.
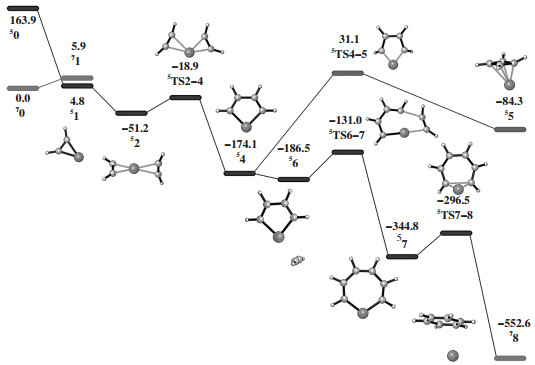
|
图 3 自旋七重态和五重态条件下Cr催化乙炔环三聚的反应路径 Fig.3 Gibbs free energy profiles (kJ/mol) for Cr-catalyzed septet/quintet pathways for acetylene cyclotrimerization |
自旋三重态和一重态条件下, Cr催化乙炔环三聚反应的自由能图如图 4所示. 与图 3中反应路径的不同之处在于: 一重态下, 更容易形成三乙炔-铬配合物(13), 其中两个配位的乙炔分子发生氧化耦合反应形成乙炔-铬五元环中间体(16), 第三分子乙炔插入铬五元环形成铬七元环, 该步骤的能垒升高至106.0 kJ/mol. 随后, 铬七元环发生还原消除过程的能垒较低, 为21.3 kJ/mol. 类似地, 三重态条件下, 第二分子配位的乙炔发生氧化耦合成铬五元环以及第三分子乙炔插入形成铬七元环步骤的能垒均有一定程度的升高, 分别为118.6和77.4 kJ/mol. 因此, 在一重态和三重态条件下的速率控制步骤的能垒均远高于五重态条件下速率控制步骤的反应能垒.

|
图 4 自旋一重态和三重态条件下Cr催化乙炔环三聚的反应路径 Fig.4 Gibbs free energy profiles (kJ/mol) for Cr-catalyzed singlet/triplet pathways for acetylene cyclotrimerization |
自旋五重态和三重态条件下Cr催化乙炔环三聚反应路径中关键过渡态的几何结构如图 5所示. 由于不同自旋多重态下Cr中心的电子排布发生了变化, 因此在乙炔配位、耦合成环过程中各中间体的几何结构有较大差异. 比如, 在五重态条件下, 两分子乙炔耦合成环的碳碳键长为0.301 nm. 而在三重态条件下, 两分子乙炔耦合成环的碳碳键长缩短至0.224 nm. 在铬五元环增长为铬七元环的过程中, 五重态下TS6-7中碳碳键长为0.222 nm, 而三重态下TS6-7中碳碳键长仅为0.201 nm. 这表明, 铬五元环增长为铬七元环的过程中, 其过渡态在五重态条件下比三重态下结构更为松散.

|
图 5 自旋五、三重态势能面上Cr催化乙炔环三聚关键过渡态的结构参数 Fig.5 Optimized geometries of key transition states on the quintet-/triplet surfaces for Cr-catalyzed acetylene cyclotrimerization |
乙炔耦合成环过程的差异也可以从过渡态的前线轨道进行对比分析(图 6). 在三重态条件下, 碳碳耦合反应过渡态TS2-4的成键轨道为HOMO-1, 这也极大地提高了耦合过程所需要克服的能垒(118.6 kJ/mol). 第三分子乙炔插入过渡态TS6-7的HOMO轨道中, 第三分子乙炔与铬金属五元环的轨道相互重叠部分较多, 也使得这一过程相较于三重态下碳碳耦合反应更容易进行. 在五重态条件下, 碳碳耦合反应过渡态TS2-4和第三分子乙炔插入铬五元环反应过渡态TS6-7的成键轨道均为HOMO轨道, 并且碳碳耦合反应过渡态TS2-4的HOMO轨道重叠部分较第三分子乙炔插入过渡态TS6-7更为显著, 这说明在五重态条件下, 碳碳耦合反应更容易发生. 因此, 三重态条件下的速率控制步骤为碳碳耦合步骤, 而五重态条件下, 则速控步骤为第三分子乙炔插入过程.

|
图 6 自旋五重态、三重态势能面上Cr催化乙炔环三聚关键过渡态的前线分子轨道 Fig.6 Frontier orbital analysis of key transition states on the quintet-/triplet surface for Cr-catalyzed acetylene cyclotrimerization catalyzed |
总体而言, 铬催化乙炔环三聚过程在自旋七重态、五重态势能面上进行, 主要经过两次碳碳耦合过程和一次金属七元环消除闭环过程, 速率控制步骤为第三分子乙炔插入形成铬七元环过程, 能垒为55.5 kJ/mol.
2.2 镍、铁催化乙炔环三聚的反应机理我们探究Ni及Fe金属单原子对乙炔环三聚的催化性能. 图 7中展示了Ni系及Fe系多乙炔配合物的几何结构、相对能量和金属中心自旋密度及电荷. 从几何构型看, Ni系和Fe系乙炔-金属配合物与Cr系配合物基本类似. 一重态下, 单分子乙炔与Ni中心相互作用较强, Ni-C距离为0.182 nm, 双乙炔-Ni配合物中Ni-C距离为0.188 nm, 而三乙炔-Ni配合物的Ni-C距离增加至0.199 nm; 随着Ni中心吸附乙炔数量的增加, Ni中心的正电荷也从0.306增加到0.619, 表明更多的镍中心3d电子进入乙炔分子的π*反键轨道, 活化了配位的乙炔分子. 三重态条件下, 单乙炔-铁配合物和双乙炔-铁配合物中乙炔与铁中心的配位距离几乎相等, 分别为0.191和0.192 nm, 这与铁中心正电荷从单乙炔铁配合物的0.307增加到双乙炔铁配合物的0.706的趋势一致, 表明双乙炔铁配合物中铁中心对两个乙炔分子的活化程度与单乙炔铁配合物中的活化程度相当. 针对Fe和Ni金属中心在一重态、三重态和五重态下催化乙炔环三聚生成苯的计算结果, 如图 8所示.

|
图 7 乙炔-镍、乙炔-铁配合物的几何结构、自旋密度(MSD)和电荷(MC) Fig.7 Geometrical features, Mulliken spin densities, and Mulliken charges of Ni·(C2H2)n, Fe·(C2H2)n (n=1, 2, 3) complexes |
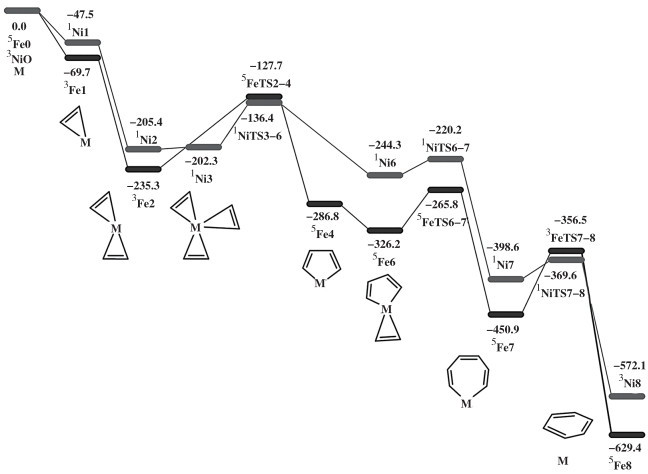
|
图 8 Fe和Ni金属中心催化乙炔环三聚反应的自由能图 Fig.8 Gibbs free energy profile (kJ/mol) for the Fe-/Ni-catalyzed acetylene cyclotrimerization |
类似地, Ni金属催化乙炔环三聚过程也存在自旋翻转. 在每一个催化循环中, 反应首先从反应物基态翻转至邻近势能面上进行反应, 最终释放产物回到基态势能面, 完成一个催化循环. Ni金属中心首先处于三重态基态, 吸附一分子乙炔后反应翻转至一重态势能面, 随后倾向于直接吸附三分子乙炔, 形成三乙炔-镍配合物(1Ni3). 其中两分子乙炔克服69.0 kJ/mol的能垒形成乙炔-镍五元环配合物, 随后发生第三分子乙炔插入(能垒为24.1 kJ/mol), 形成镍七元环(1Ni7). 最终镍七元环克服29.0 kJ/mol的能垒完成还原消除, 反应回到三重态势能面, 得到苯-镍配合物(3Ni8). 由此可知, 镍金属催化乙炔环三聚过程的速率控制步骤为乙炔-镍五元环的形成, 速率控制步骤的能垒为69.0 kJ/mol.
由于铁金属中心电子活泼, 铁的催化反应中常常伴随着自旋翻转[10]. 反应开始时, Fe处于五重态基态, 随后在三重态势能面吸附两分子乙炔后, 体系能量降低至-235.3 kJ/mol. 双乙炔-铁配合物克服107.6 kJ/mol能垒, 在五重态势能面发生氧化耦合得到铁五元环(5Fe4). 双乙炔-铁配合物发生乙炔分子插入铁五元环进行环增长反应需要克服60.4 kJ/mol的能垒, 最终铁七元环经过94.4 kJ/mol的能垒发生消除反应得到苯-铁配合物.
催化反应的转化频率(TOF)是衡量反应活性的一个重要指标. TOF的计算依据Uhe等[11]开发的能量跨度模型, 依据最优反应路径中各物种的吉布斯自由能, 由以下公式计算出Cr、Fe和Ni催化体系的TOF值(表 1). 其中, ΔGr是反应吉布斯自由能, Ti和Ij是每个过渡态和中间体的吉布斯自由能,
| ${\rm{TOF}} = \frac{{{K_B}T}}{h} \cdot \frac{{{e^{ - \Delta Gr/RT}} - 1}}{{\sum\limits_{i,j}^N {{e^{\left( {{T_i} - {I_j} - \delta {{\dot G}_{ij}}} \right)}}} /RT}}$ |
| 表 1 Cr、Fe和Ni催化体系最优路径结构能量及TOF值(s-1) Table 1 Relative Gibbs free energies (kJ/mol) of optimized geometries of Cr, Fe and Ni catalytic systems and TOF(s-1) |
结果表明, Cr催化体系计算所得TOF值为5.5×102 s-1, 其速率决定中间体(TDI)为乙炔-铬五元环(5Cr6), 速控决定过渡态(TDTS)为铬七元环形成的过渡态(5CrTS6-7). Ni催化体系计算所得TOF值为6.6 s-1, Fe催化体系的TOF值为8.1×10-7 s-1, TDTS均为两分子乙炔氧化耦合过程(1NiTS3-6和5FeTS2-4). 由此可见, 在Cr、Fe和Ni催化体系中, Cr催化体系对乙炔环三聚表现出的活性最强, Fe催化体系的活性最低.
3 结论主要考察了Cr、Fe和Ni 3种金属中心催化乙炔环三聚反应机理, 主要结果如下: Cr、Fe和Ni中心催化乙炔环三聚过程均存在自旋翻转, 其中Cr催化乙炔环三聚生成苯在七重态、五重态势能面上进行, 而Ni中心催化过程则在一重态、三重态势能面上进行, Fe中心则在三、五重态势能面上交叉进行. Cr催化循环的速率控制步骤为第三分子乙炔插入形成金属七元环, 而Fe和Ni催化循环的速率控制步骤则为形成金属五元环中间体. TOF计算结果表明, Cr催化体系的TOF为5.5×102 s-1, 其反应活性远高于Fe和Ni催化体系, 是乙炔环三聚的优选催化体系.
| [1] |
Reppe W, Sweckendiek W J. Cyclizing polymerization of acetylene. Ⅲ. Benzene, benzene derivatives, and hydroaromatic compounds[J]. Liebigs Ann Chem, 1948, 560: 104–116.
DOI:10.1002/jlac.19485600104 |
| [2] |
Chen Shu(陈曙), Ju Ting-yong(鞠廷勇), Yang Hua-qing(杨华清). A DFT study of the acetylene cyclotrimerization catalyzed by FeO in the gas phase FeO(催化乙炔三聚环化气相反应机理的理论研究)[J]. Chem Res Appl(化学研究与应用), 2014, 26(6): 928–932.
DOI:10.3969/j.issn.1004-1656.2014.06.030 |
| [3] |
Ju Ting-yong(鞠廷勇), Chen Shu(陈曙), Yang Hua-qing(杨华清). Theoretical study on the reaction mechanism of acetylene cyclotrimetization catalyzed by Ni atom(Ni原子催化乙炔三聚环化反应机理的理论研究)[J]. Chem Res Appl(化学研究与应用), 25(6): 824–828.
|
| [4] |
Liu Z, Cheng R H, He X L, et al. DFT functional benchmarking on the energy splitting of chromium spin states and mechanistic study of acetylene cyclotrimerization over the Phillips Cr(Ⅱ)/silica catalyst[J]. J Phys Chem A, 2012, 116(28): 7538–7549.
DOI:10.1021/jp302529q |
| [5] |
Liu Z, Cheng R H, He X L, et al. Reactivity and regioselectivity of methylacetylene cyclotrimerization over the Phillips Cr/silica catalyst: A DFT study[J]. ACS Catal, 2013, 3(6): 1172–1183.
DOI:10.1021/cs400129g |
| [6] |
Martinez M, Michelini M D C, Rivalta I, et al. Acetylene cyclotrimerization by early second-row transition metals in the gas phase: a theoretical study[J]. Inorg Chem, 2005, 44(26): 9807–9816.
DOI:10.1021/ic051281k |
| [7] |
Gandon V, Agenet N, Vollhardt K P C, et al. Cobalt-mediated cyclic and linear 2:1 cooligomerization of alkynes with alkenes: A DFT study[J]. J Am Chem Soc, 2006, 128(26): 8509–8520.
DOI:10.1021/ja060756j |
| [8] |
Agenet N, Gandon V, Vollhardt K P C, et al. Cobalt-catalyzed cyclotrimerization of alkynes: The answer to the puzzle of parallel reaction pathways[J]. J Am Chem Soc, 2007, 129(28): 8860–8871.
DOI:10.1021/ja072208r |
| [9] |
Xu R, Inget P, Clark T. The cyclooligomerisation of acetylene at metal centres[J]. Eur J Inorg Chem, 2008, 18: 2874–2883.
|
| [10] |
Sergi V, Maria F, Jordi C, et al. Thermal spin crossover in Fe(Ⅱ) and Fe(Ⅲ). Accurate spin state energetics at the solid state[J]. Phys Chem Chem Phys, 2020, 22(6): 4938–4945.
|
| [11] |
Uhe A, Kozuch S, Shaik S. Automatic analysis of computed catalytic cycles[J]. J Comput Chem, 2011, 32(5): 978–985.
|
 2021, Vol. 35
2021, Vol. 35


