2. 河北农业大学 机电学院, 河北 保定 071001;
3. 石家庄龙泽制药股份有限公司, 河北 石家庄 052560
2. College of Mechanical and Electrical Engineering, Hebei Agricultural University, Baoding 071001, China;
3. Shijiazhuang Longze Pharmaceutical Co., Ltd. Shijiazhuang, 052560, China
化石能源不断枯竭和过度CO2排放引起的温室效应是地球可持续发展所面临的主要问题. 一条有效的解决途径是利用催化剂将可再生生物质能源转化为燃料或化学品[1], 这一方面可以实现生物质原料替代石油基原料, 解决能源短缺问题; 另一方面可以控制CO2排放, 减缓温室效应.
γ-和δ-酮酸衍生物是重要的双官能团生物质平台化合物, 分子内含有羰基和羧酸基两种活性反应位点. 通过催化加氢可以选择性制备γ-和δ-羟基酸、酯、内酯、环醚等精细化学品(图 1)[2]. 与α-和β-酮酸酯类化合物的氢化反应研究相比[3], γ-和δ-酮酸酯类化合物研究较少, 且尚没有一种通用催化剂可通过调控反应条件和选择性, 高效地催化γ-和δ-烷基取代酮酸衍生物转化成相应的单一化学品. γ-内酯作为重要的产物之一, 又为丁位内酯, 是香料、香精、化妆品、添加剂等日用化学品[4]; 也是有效抑制埃博拉等病毒药物的重要医药中间体[5]. 如何催化氢化γ-和δ-酮酸酯制备单一的内酯具有巨大需求.
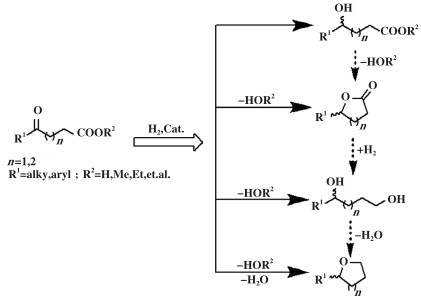
|
图 1 γ- 和δ酮酸衍生物催化加氢制备精细化学品 Fig.1 Catalytic hydrogenation of γ- and δ-keto acid derivatives to produce fine chemicals |
乙酰丙酸(LA)是γ-酮酸中研究最广泛的生物质平台化合物, 是替代石油基化学品制备添加剂、增塑剂和调味剂等化学品的重要原料[6]. LA可通过石油基原料、生物质纤维素或C6/C5糖酸水解得到, 其来源广泛[7]. LA能参与酯化、氧化还原、卤化、缩合等多种反应; 可转化为高附加值的化学产品, 如γ-戊内酯(GVL)、1, 4-戊二醇(1, 4-PDO)、2-甲基四氢呋喃(2-MeTHF)、N-取代吡咯烷酮、N-取代吡咯烷以及戊酸等[6c](图 2). 如何高选择性和高效地催化LA转化成相应的单一化学品是当今研究的热点; 也是解决目前化石资源日渐枯竭和维持CO2平衡、控制温室效应的有效途径, 更是实施绿色生物质化学品可持续发展战略的突破口[2].
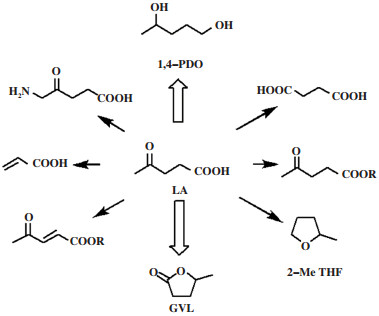
|
图 2 基于乙酰丙酸的平台分子 Fig.2 Levulinic acid based platform molecules |
GVL是LA重要的氢化下游产品. 丁位内脂的结构使它既稳定又不失活泼, 可合成1, 4-PDO、2-MeTHF、丁烯、戊酸、二丁基酮等关键中间体[6]. 以LA制备GVL的催化反应为例阐释γ-酮酸衍生物制备γ-内酯的催化机制, 其转化方式分为以下3种(图 3): 第一, LA高温脱水生成当归内酯, 随后当归内酯加氢生成GVL; 第二, LA中的羰基先被加氢生成4-羟基戊酸, 之后在酸催化下, 分子内脱水关环形成热力学稳定的GVL; 第三, LA与醇类反应生成乙酰丙酸酯, 之后加氢生成4-羟基戊酸酯, 进行酯交换反应生成GVL[6a, 8]. 分析反应途径可知, 第二条路径最容易, 能耗低, 易于操作.

|
图 3 LA加氢成GVL的反应途径 Fig.3 Reaction pathway for the hydrogenation of LA to GVL |
目前, 关于还原法制备GVL的方法, 因氢源不同, 可分为H2, HCOOH[8b]和醇[9]. 其中H2作为绿色可再生能源、副产物少、原子利用率高是绿色合成反应中具有代表性的一类还原反应. 就催化氢化反应体系而言, 可分为均相催化体系和非均相体系. 对于非均相催化体系[8c, 10], 一般以Ru/C、Ru/Al2O3、Pt/TiO2、Au/ZrO2等金属氧化物为催化剂, 其中以钌负载的活性最高. 但都存在反应条件苛刻(高温、高压、高负载量)、污染重、催化剂难再生等问题, 不利于进一步工业化生产. 而对于均相催化体系[11], 其出色的催化性能和选择性以及配体可设计性, 吸引了国内外学者的关注.
以金属配合物为催化剂的催化氢化反应在现代有机合成中占有重要地位. 针对C=C, C=O和C=N等不饱和键的还原, 以H2作为氢源, 开发了多种高化学选择性和立体选择性的催化剂, 在实验室和工业生产中有着广泛应用[12]. 根据配体中供体数目的不同, 乙酰丙酸催化体系可分为单齿、二齿和三齿金属配合物催化体系.
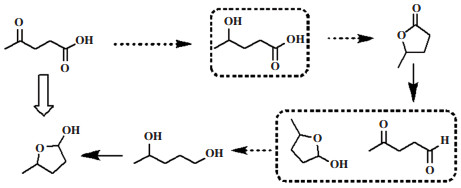
单齿金属配合物催化体系主要集中在对单齿膦配体的修饰与改进[2, 13]. 主要催化剂有RuCl2(PPh3)3 (TON = 200)[13a]、Ru(acac)3/PBu3 (TON = 1559)、TPPTS (TON = 600)、TPPTS =三(3-磺酰基苯基)膦)[13b]、Ru(acac)3/ P(Oct)3 (TON = 1000)等体系(图 4). 这些催化剂在一定条件下可高选择性地制备GVL. 其中Leiner等[2]以三辛基膦钌为催化剂, 在160 ℃, 10 MPa H2、无溶剂, 以NH4PF6为助剂, 催化氢化乙酰丙酸制备GVL具有很好的效果, GVL的收率达99%, TON为1000. 此外, 作者发现配体对体系的选择性有很大影响(图 5): 使用Dppb, 选择性降低, 有11%的1.4-PDO生成, GVL的产率降为89%; 而使用Triphos, 选择性更差, 仅有8%的GVL生成, 还生成35%的1, 4-PDO和53%的2-MeTHF[2].

|
图 4 单齿膦钌催化剂制备GVL Fig.4 Monodentate phosphine ruthenium catalyst for the preparation of GVL |

|
图 5 配体与产物之间的关系 Fig.5 Relationship between ligand and product |
二齿金属催化剂体系分为二齿膦钌催化剂[14]和二齿氮铱催化剂[15]. 其中Mika等[14a]为了提高催化剂的活性, 对不同二齿膦配体(如DPPE、DPPP、DPPB、DPPe、BINAP等)进行了测试, 发现两个磷原子之间的碳链长度对催化活性影响很大(图 6). 结果显示Ru(acac)3和DPPB组合时, 催化性能最佳. 在140 ℃, 10 MPa H2, 无助剂存在下, GVL的产率达99%, TON达12 740. 且催化剂循环使用10次后, 活性不失活(图 6). Mika等[14b]选用手性配体Sgphos制备了系列二齿膦钌催化剂用于催化氢化制备手性GVL(图 6). 从D-果糖出发, 经酸化水解得到乙酰丙酸, 以(S)-[(RuCl(SEGPHOS))2 (μ-Cl)3][NH2Me2]为催化剂, 在140 ℃、6.0 MPa H2, 甲醇为溶剂, 反应20 h, 转化率可达100%, ee值最高达78%, TON为800. 此外, 溶剂的种类和催化剂的用量对GVL的选择性和乙酰丙酸的转化率有很大影响.
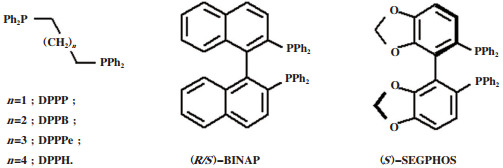
|
图 6 Mikea等使用的双膦配体 Fig.6 Bisphosphine ligands used by Mikea |
与二齿膦钌催化剂相比, 二齿氮铱催化剂(图 7)的活性更高[15]. Deng等[15a]报道了一类稳定性高、水溶性好的催化体系: Cp-Ir的联吡啶铱催化剂. 以H2或HCOOH为氢供体, 该体系都可高效、高选择性的转化LA制备GVL. 特别是在120 ℃, 1.01 MPa H2, 铱负载量仅为0.001%(摩尔分数)时, 反应36 h, GVL收率达78%, TON高达78 000. 另外该催化剂可直接将C6糖转化为GVL(综合收率34%).

|
图 7 二齿铱催化剂 Fig.7 Bidentate iridium catalysts |
三齿螯型金属配合物中金属与配体的供体杂原子形成稳定五元或六元环结构, 使其耐受性和活性进一步提高[16]. 此外, 通过修饰配体的取代基, 调控金属中心电子和位阻效应[17], 使催化剂的催化活性和立体选择性进一步提高, 对多官能团底物显示出强大的选择性和耐受性. 金属配体协同催化理念的深化使得三齿金属配合物催化反应成为关注的热点[18].
三齿金属催化剂(图 8)在催化LA氢化成GVL中显出极高的催化活性和选择性[19]. 2012年, Li等[19a]发展一类高效的PNP或NNN型铱催化体系, 在100 ℃、10 MPa H2条件下, GVL收率大于96%. 其中PNP-tBu与铱金属结合的催化效果最好, TON达71 000. 2018年, Stadler等[19c]将NNS型钌催化剂用于不饱和羧酸酯的氢化. 其中以乙酰丙酸甲酯为底物时, GVL收率达77%, TON为308. 同年, Yi等[19d]以PNP铁配合物为催化剂, 在10 MPa H2、100 ℃, 铁负载量为0.002%(摩尔分数), 反应12 h, 转化率达46%, TON达23 000. 2019年, Padilla等[19e]以HN(CH2CH2PR2)2为配体制备了螯型钌、铱催化剂. 在2.0 MPa H2, 60 ℃下, 可以高效催化乙酰丙酸乙酯成GVL. 其中钌催化剂的TON达7400; 铱催化剂的TON高达9300.
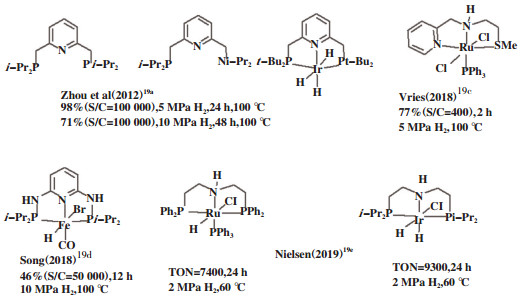
|
图 8 三齿金属配合物催化剂 Fig.8 Tridentate metal complex catalysts |
1, 4-PDO是LA加氢反应的另一重要产物, 可用作聚酯单体、润滑剂和药物中间体等[2]. 1947年, Christian等[20]首次报道以铜铬氧化物为催化剂实现将LA转化为1, 4-PDO. 与制备2-MeTHF相比, 该反应没有分子内环醚化过程(图 9). GVL作为LA及衍生酯还原生成1, 4-PDO的上游原料, 也被作为底物的研究对象.
|
图 9 LA转化成1, 4-PDO或2-MeTHF Fig.9 Conversion of LA to 1, 4-PDO or 2-MeTHF |
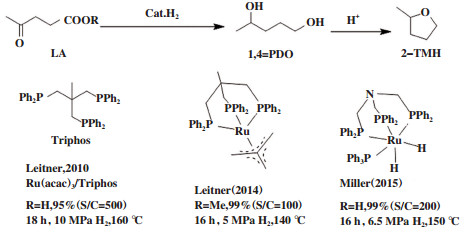
2010年, Geilen等[2]以Ru(acac)3/triphos为催化剂(图 10), 成功地将LA转化为1, 4-PDO. 随后, 该组将钌催化剂[Ru(triphos)(TMM)]用于该反应[21]. 在140 ℃, 5.0 MPa H2, 1, 4-PDO的收率可达99%. 该催化体系对羧酸、羧酸酯、酰胺、脲等在内羧酸衍生物都有很好的反应活性. Phanopoulos等[22]开发了一种N-triphos配体的催化剂[RuH2(PPh3)[N-(CH2PPh2)3]用以催化LA制备1, 4-PDO.
|
图 10 三齿膦钌催化剂催化制备1, 4-PDO或2-MeTHF Fig.10 Synthesis of 1, 4-PDO or 2-MeTHF via tridentate phosphine ruthenium catalysts |
2014年, Li等[23]发展了一类联吡啶四齿钌催化体系(图 11)用于制备1, 4-PDO. 在25 ℃, 5.0 MPa H2, 甲醇钠为助剂, 以乙酰丙酸甲酯或GVL为底物, 反应16 h, 产物收率达95%. 该体系是目前报道氢化条件最温和的实例.

|
图 11 四齿钌催化剂制备1, 4-PDO Fig.11 Synthesis of 1, 4-PDO by tetradentate ruthenium catalyst |
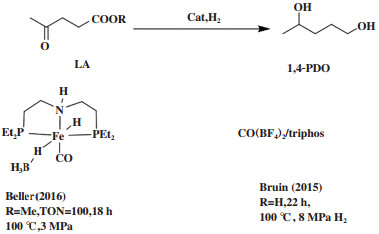
2016年, Elangovan等[24]报道了三齿铁配合物催化体系(图 12). 在100 ℃、3.0 MPa H2, 该体系有效催化氢化乙酰丙酸甲酯成1, 4-PDO, TON可达100. Bruin等[25]开发了四硼酸钴和三齿膦配体原位形成钴催化剂用于羧酸的氢化反应. 当LA为底物时, 实现了100%转化, 1, 4-PDO的产率为47%, 2-MeTHF的收率为14%.
|
图 12 铁、钴催化剂制备1, 4-PDO Fig.12 Synthesis of 1, 4-PDO with iron or cobalt catalysts |
2-MeTHF不仅是重要的有机溶剂, 还是一种新兴的生物燃料[26]. 以LA及其酯为原料合成2-MeTHF主要基于以下反应途径(图 9): 首先LA及其酯通过还原、分子内脱水关环生成GVL; 然后GVL被进一步还原、开环生成1, 4-PDO; 最后1, 4-PDO通过催化脱水醚化生成2-MeTHF.
均相催化体系制备2-MeTHF的报道仅有3例. Geilen等[2]在Ru(acac)3/triphos与NH4PF6和酸性离子液体体系中, 有效地将LA转化为2-MeTHF. 在160 ℃, 10 MPa H2, 2-MeTHF收率达92%. 无酸性添加剂时, 脱水醚化无法进行, 反应将止步于1, 4-PDO(图 6). Phanopoulos等[22]以N-triphos钌催化体系制备2-MeTHF. 作者认为配体中的碱与酸性添加剂形成的离子对对体系的活性有很大的影响. 在150 ℃, 6.5 MPa H2, 以HNTf2为酸助剂, 2-MeTHF的产率达到87%(图 10).
4 γ-和δ-酮酸衍生物的氢化与乙酰丙酸及衍生物制备γ-内脂相比, 国内外学者对γ-酮酸衍生物的氢化研究较少(图 13)[27]. Lipshutz等[27a]选用[{(R)-(-)-DTBM-Segphos}CuH]作催化剂, 以聚甲基氢硅氧烷(PMHS)作氢源, 可高效地催化γ-苯基-γ-羰基丁酸甲酯氢化成γ-苯基-γ-丁内酯, TON达890; Yang等[27b]开发了手性螺环膦氮铱配合物(Ir-SpiroPAP)用于δ-芳基-δ-酮酸乙酯的氢化. 该体系可同时对羰基和酯基进行氢化获得δ-芳基-1, 6-己二醇, TON达100 000. 该体系对苯基、吡啶基、呋喃基的芳香族底物都具有催化活性, 有较广泛的适用性. 此外, 该体系对远程的δ-烷基-δ-羟基戊酸酯或δ-烷基-δ-内酯进行手性识别和动力学拆分, 可高选择地制备手性δ-烷基-1, 5-戊二醇[27c]. Arai等[27d]报道了钌催化剂(DIPSkewphos/3-AMIQ-Ru)用于γ-芳基酮酸酯的氢化. 通过调控碱助剂的用量可以选择性的制备γ-芳基-γ-内酯或γ-芳基-1, 4-丁二醇. 2020年初, Hua等[27e]将Ir-SpiroPAP用于δ-/γ-芳基-δ-/γ-酮酸的不对称氢化, 获得手性δ-/γ-芳基-δ-/γ-羟基酸, 再以三氟乙酸作酸催化剂, 二步法制备手性δ-/γ-芳基-δ-/γ-内酯. 产物收率在92%以上, ee大于96%, TON最高达10 000. 最近, Li等[27f]对手性螺环膦氮配体进行修饰, 发展了手性螺环膦-噁唑啉的铱配合物催化剂, 实现了脂肪族γ-酮酸的高对映选择性氢化反应. 氢化产物经过酸化处理, 可高收率、高选择性得到一系列手性γ-内酯, 进而用于多种手性药物和生物活性分子的合成.

|
图 13 氢化γ-和δ-芳基酮酸酯类的催化剂 Fig.13 Hydrogenation of γ- and δ-aryl ketoester via catalysts |
我们综述了金属配合物均相催化氢化γ-和δ-酮酸的研究进展, 重点介绍了以γ-和δ-酮酸为原料制备内酯、二醇、环醚及γ-/δ-羟基酸所用的金属催化剂以及涉及催化机理. 其中针对γ-酮酸衍生物的氢化反应研究进展, γ-取代基主要是芳基类, 长碳链烷基的脂肪族酮酸报道很少. 主要原因是现有催化剂对烷基链识别能力和瞄定能力不足, 长羰链γ-和δ-酮酸酯的羰基极性小, 不如强供电子的芳基可以很好与金属配合物进行配合和脱去. 此外, 所报道的催化剂的效率尚不能满足工业应用的需要. 随着贵金属价格不断上涨和环境保护意识逐渐加强, 国内外科研人员纷纷将目光转向廉价金属, 并将其与现有的经典配体进行配位反应, 合成新的金属催化剂, 以期望获得与贵金属相媲美的催化效果. 我们应抓住这一契机, 深耕配体与金属协同双功能化理念, 设计新型配体, 从而合成高效、高选择性的新型催化剂, 革新工艺技术满足实际应用. 一方面可以促进能源体系中可再生生物质能源向化学产品的转化, 另一方面也减少了当今石油化工工业中的化学生产对环境的影响. 最终通过化学家跨学科的研究与开发为能源利用和精细化学品生产的可持续发展做出重要贡献.
| [1] |
a. Wang S, Dorcet V, Roisnel T, et al. Ruthenium and irid-ium dipyridylamine catalysts for the efficient synthesis of γ-valerolactone by transfer hydrogenation of levulinic acid[J]. Organometallics, 2017, 36(3): 708-713. b. Lu Zi-xuan(卢自轩), Li Shuang-ming(李双明), Yu San-san(于三三). Research progress of composite met-al oxide catalysts for the oxidation of glycerol to acrylic acid(复合金属氧化物催化剂用于甘油氧化制丙烯酸的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 484-494. c. Feng Chen-chen(冯晨晨), Zhang Ya-jun(张亚军), Bi Ying-pu(毕迎普). Research progress and challenges of α-Fe2O3 photoanode for photoelectrochemical water splitting(α-Fe2O3光阳极光电化学分解水的研究进展与挑战[J]. J Mol Catal(China)(分子催化), 2020, 34(3): 227-241. |
| [2] |
a. Geilen F M, Engendahl B, Harwardt A, et al. Selective and flexible transformation of biomass-derived platform chemicals by a multifunctional catalytic system[J]. Angew Chem Int Ed, 2010, 49(32): 5510-5514. b. ZhengWan-bin(郑万彬), YeYan-wen(叶艳文), HuYiming(胡一鸣), et al. High performance Ir/TiH2 catalysts for liquid phase selective hydrogenation of crotonaldehyde(用于巴豆醛液相选择性加氢的高性能Ir/TiH2催化剂)[J]. J Mol Catal (China)(分子催化), 2021, 35(1): 31-39. c. HuYi-ming(胡一鸣), ZhengWan-bin(郑万彬), Tang Cen(汤岑), et al. Recent advances in selective hydrogenation of crotonaldehyde over noble metal catalysts(贵金属催化剂上巴豆醛选择性加氢的研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(4): 366-377. d. GuTing-ting(谷婷婷), SongHuan-ling(宋焕玲), Chou Ling-jun(丑凌军). Research progress of vegetable oil hydrogenation catalyst(油脂加氢催化剂研究进展)[J]. J Mol Catal (China)(分子催化), 2020, 34(3): 242-251. |
| [3] |
Geilen F M A, Engendahl B, H-lscher M, et al. Selective homogeneous hydrogenation of biogenic carboxylic acids with[Ru(TriPhos)H]+: A mechanistic study[J]. J Am Chem Soc, 2011, 133(36): 14349–14358.
DOI:10.1021/ja2034377 |
| [4] |
Domínguez de María P. John, In industrial biorenewables[M]. Wiley & Sons, Inc.Hoboken: New Jersey, 2016.
|
| [5] |
a. Cooke Née Brown R C, van Leeuwen K A, Capone D L, et al. Odor detection thresholds and enantiomeric distributions of several 4-alkyl substituted gamma -lactones in Australian red wine[J]. J Agric Food Chem, 2009, 57(6): 2462-2467. b. Wang M, Cao R, Zhang L, et al. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro[J]. Cell Res, 2020, 30(3): 269-271. c. Warren T K, Jordan R, Lo M K, et al. Therapeutic efficacy of the small molecule GS-5734 against Ebola virus in rhesus monkeys[J]. Nature, 2016, 531(7594): 381-385. |
| [6] |
a. Deng Li, Li Jiang, Lai Da-ming, et al. Catalytic conversion of biomass-derived carbohydrates into gamma-valerolactone without using an external H2 supply[J]. Angew Chem Int Ed, 2009, 48(35): 6529-6532. b. Li J, Jiang Z, Hu L, et al. Selective conversion of cellulose in corncob residue to levulinic acid in an aluminum trichloride-sodium chloride system[J]. ChemSusChem, 2014, 7(9): 2482-2488. c. Szabolcs Á, Molnár M, Dibó G, et al. Microwave-assisted conversion of carbohydrates to levulinic acid: an essential step in biomass conversion[J]. Green Chem, 2013, 15(2): 439-445. |
| [7] |
Sordakis K, Tang C, Vogt L K, et al. Homogeneous catalysis for sustainable hydrogen storage in formic acid and alcohols[J]. Chem Rev, 2018, 118(2): 372–433.
DOI:10.1021/acs.chemrev.7b00182 |
| [8] |
a. Abdelrahman O A, Heyden A, Bond J Q. Analysis of kinetics and reaction pathways in the aqueous-phase hydrogenation of levulinic acid to form γ-valerolactone over Ru/C[J]. ACS Catal, 2014, 4(4): 1171-1181. b. Ortiz-Cervantes C, Flores-Alamo M, García J J. Hydrogenation of biomass-derived levulinic acid into γ-valerolactone catalyzed by palladium complexes[J]. ACS Catal, 2015, 5(3): 1424-1431. c. Ruppert A M, Jędrzejczyk M, Sneka-Płatek O, et al. Ru catalysts for levulinic acid hydrogenation with formic acid as a hydrogen source[J]. Green Chem, 2016, 18(7): 2014-2028. |
| [9] |
a. Yang Zhen, Huang Yao-bing, Guo Qing-xiang, et al. RANEY(R) Ni catalyzed transfer hydrogenation of levulinate esters to γ-valerolactone at room temperature[J]. Chem Commun, 2013, 49(46): 5328-5330. b. Tang X, Li Z, Zeng X, et al. In situ catalytic hydrogenation of biomass-derived methyl levulinate to γ-valerolactone in methanol[J]. ChemSusChem, 2015, 8(9): 1601-1607. |
| [10] |
a. Heeres H, Handana R, Chunai D, et al. Combined dehydration/(transfer)-hydrogenation of C6-sugars (D-glucose and D-fructose) to γ-valerolactone using ruthenium catalysts[J]. Green Chem, 2009, 11(8): 1247-1255. b. Lange J P, Price R, Ayoub P M, et al. Valeric biofuels: A platform of cellulosic transportation fuels[J]. Angew Chem Int Ed, 2010, 49(26): 4479-4483. c. Liguori F, Moreno-Marrodan C, Barbaro P. Environmentally friendly synthesis of γ-valerolactone by direct catalytic conversion of renewable sources[J]. ACS Catal, 2015, 5(3): 1882-1894. |
| [11] |
Vries J G, Elsevier C J. The handbook of homogeneous hydrogenation[M]. Wiley-VCH: Weinheim, 2007.
|
| [12] |
Ager D J, de Vries A H, de Vries J G. Asymmetric homogeneous hydrogenations at scale[J]. Chem Soc Rev, 2012, 41(8): 3340–3380.
DOI:10.1039/c2cs15312b |
| [13] |
a. Osakada K, Ikariya T, Yoshikawa S. Preparation and properties of hydride triphenyl-phosphine ruthenium complexes with 3-formyl (or acyl) propionate[RuH (OCOCHRCHRCOR')(PPh3)3] (R=H, CH3, C2H5; R=H, CH3, C6H5) and with 2-formyl (or acyl) benzoate[RuH(o-OCCOC6H4COR')(PPh3)3] (R'=H, CH3)[J]. J Org Chem, 1982, 231(1): 79-90. b. Mehdi H, Fábos V, Tuba R, et al. Integration of homogeneous and heterogeneous catalytic processes for a multi-step conversion of biomass: from sucrose to levulinic acid, γ-valerolactone, 1, 4-pentanedio l, 2-methyl-tetrahydrofuran, and alkanes[J]. Top Catal, 2008, 48(1/4): 49-54. |
| [14] |
a. Tukacs J M, Novák M, Dibób G, et al. An improved catalytic system for the reduction of levulinic acid to γ-valerolactone[J]. Catal Sci Technol, 2014, 4(9): 2908-2912. b. Tukacs J M, Fridrich B, Dibó G, et al. Direct asymmetric reduction of levulinic acid to γ-valerolactone: Synthesis of a chiral platform molecule[J]. Green Chem, 2015, 17(12): 5189-5195. |
| [15] |
a. Deng J, Wang Y, Pan T, et al. Conversion of carbohydrate biomass to γ-valerolactone by using water-soluble and reusable iridium complexes in acidic aqueous media[J]. ChemSusChem, 2013, 6(7): 1163-1167. b. Wang S D, Huang H, Bruneau C, et al. Selective and efficient iridium catalyst for the reductive amination of levulinic acid into pyrrolidones[J]. ChemSusChem, 2017, 10(21): 4150-4154. |
| [16] |
a. Younus H A, Su W, Ahmad N, et al. Ruthenium pincer complexes: synthesis and catalytic applications[J]. Adv Synth Catal, 2015, 357(2/3): 283-330. b. Gunanathan C, Milstein D. Bond activation and catalysis by ruthenium pincer complexes[J]. Chem Rev, 2014, 114(24): 12024-12087. |
| [17] |
a. Wang Z, Liu Q, Solan G A, et al. Recent advances in Ni-mediated ethylene chain growth: Nimine-donor ligand effects on catalytic activity, thermal stability and oligo-/polymer structure[J]. Coord Chem Rev, 2017, 350: 68-83. b. Wang Z, Solan G A, Zhang W, et al. Carbocyclic-fused N, N, N-pincer ligands as ring-strain adjustable supports for iron and cobalt catalysts in ethylene oligo-/polymerization[J]. Coord Chem Rev, 2018, 363: 92-108. c. Peris E, Crabtree R H. Key factors in pincer ligand design[J]. Chem Soc Rev, 2018, 47(6): 1959-1968. |
| [18] |
a. Zell T, Milstein D. Hydrogenation and dehydrogenation iron pincer catalysts capable of metal-ligand cooperation by aromatization/dearomatization[J]. Acc Chem Res, 2015, 48(7): 1979-1994. b. Khusnutdinova J R, Milstein D. Metal-ligand cooperation[J]. Angew Chem Int Ed, 2015, 54(42): 12236-12273. |
| [19] |
a. Li W, Xie J H, Lin H, et al. Highly efficient hydrogenation of biomass-derived levulinic acid to γ-valerolactone catalyzed by iridium pincer complexes[J]. Green Chem, 2012, 14(9): 2388-2390. b. Chowdhury A, Jackstell R, Beller M. Towards the efficient development of homogeneous catalytic transformation to γ-valerolactone from biomass-derived platform chemicals[J]. ChemCatChem, 2014, 6(12): 3360-3365. c. Stadler B M, Puylaert P, Diekamp J, et al. Inexpensive ruthenium NNS-complexes as efficient ester hydrogenation catalysts with high C=O vs. C=C selectivities[J]. Adv Synth Catal, 2018, 360(6): 1151-1158. d. Yi Y, Liu H, Xiao L P, et al. Highly efficient hydrogenation of levulinic acid into γ-valerolactone using an iron pincer complex[J]. ChemSusChem, 2018, 11(9): 1474-1478. e. Padilla R, Jørgensen M S B, Paix-o M W, et al. Efficient catalytic hydrogenation of alkyl levulinates to γ-valerolactone[J]. Green Chem, 2019, 21(19): 5195-5200. |
| [20] |
Christian R V, Brown H D, Hixon R M. Derivatives of γ-valerolactone, 1, 4-pentanediol and 1, 4-di-(β-cyanoethoxy)-pentane[J]. J Am Chem Soc, 1947, 69(8): 1961–1963.
DOI:10.1021/ja01200a036 |
| [21] |
Stein T, Meuresch M, Leitner W, et al. Highly versatile catalytic hydrogenation of carboxylic and carbonic acid derivatives using a Ru-triphos complex: Molecular control over selectivity and substrate scope[J]. J Am Chem Soc, 2014, 136(38): 13217–13225.
DOI:10.1021/ja506023f |
| [22] |
Phanopoulos A, White A J P, Long N J, et al. Catalytic transformation of levulinic acid to 2-methyltetrahydrofuran using ruthenium–N-triphos complexes[J]. ACS Catal, 2015, 5(4): 2500–2512.
DOI:10.1021/cs502025t |
| [23] |
Li W, Xie J H, Yuan M L, et al. Ruthenium complexes of tetradentate bipyridine ligands: Highly efficient catalysts for the hydrogenation of carboxylic esters and lactones[J]. Green Chem, 2014, 16(9): 4081–4085.
DOI:10.1039/C4GC00835A |
| [24] |
Elangovan S, Wendt B, Topf C, et al. Improved second generation iron pincer complexes for effective ester hydrogenation[J]. Adv Synth Catal, 2016, 358(5): 820–825.
DOI:10.1002/adsc.201500930 |
| [25] |
Korstanje T J, van der Vlugt J I, Elsevier C J, et al. Hydrogenation of carboxylic acids with a homogeneous cobalt catalyst[J]. Science, 2015, 350(6258): 298–302.
DOI:10.1126/science.aaa8938 |
| [26] |
Climent M J, Corma A, Iborra S. Conversion of biomass platform molecules into fuel additives and liquid hydrocarbon fuels[J]. Green Chem, 2014, 16(2): 516–547.
|
| [27] |
a. Lipshutz B H, Frieman B A, Tomaso A E, et al. Copper-in-charcoal (Cu/C): Heterogeneous, copper-catalyzed asymmetric hydrosilylations[J]. Angew Chem Int Ed, 2006, 45(8): 1259-1264. b. Yang X H, Xie J H, Liu W P, et al. Catalytic asymmetric hydrogenation of δ-ketoesters: Highly efficient approach to chiral 1, 5-diols[J]. Angew Chem Int Ed, 2013, 52(30): 7833-7836. c. Yang X H, Wang K, Zhu S F, et al. Remote ester group leads to efficient kinetic resolution of racemic aliphatic alcohols via asymmetric hydrogenation[J]. J Am Chem Soc, 2014, 136(50): 17426-17429. d. Arai N, Namba T, Kawaguchi K, et al. Chemoselectivity control in the asymmetric hydrogenation of γ- and δ-keto esters into hydroxy esters or diols[J]. Angew Chem Int Ed, 2018, 57(5): 1386-1389. e. Hua Y Y, Bin H Y, Wei T, et al. Iridium-catalyzed asymmetric hydrogenation of γ- and δ-ketoacids for enantioselective synthesis of γ- and δ-lactones[J]. Org Lett, 2020, 22(3): 818-822. f. Li M L, Li Y, Pan J B, et al. Carboxyl group-directed iridium-catalyzed enantioselective hydrogenation of aliphatic γ-ketoacids[J]. ACS Catal, 2020, 10(17): 10032-10039. |
 2021, Vol. 35
2021, Vol. 35


