2. 河南农业大学 生命科学学院, 河南 郑州 450002
2. School of Life Sciences, Henan Agricultural University, Zhengzhou 450002, China
D-脯氨酸是抗偏头痛药物依来曲普坦(Elet-riptan)的关键手性中间体. D-脯氨酸的制备方法主要包括: 1)化学不对称转换法. 该法以L-脯氨酸为原料, 正丁醛为催化剂, 正丁酸为溶剂, 与L-酒石酸反应制备D-脯氨酸·L-酒石酸盐, 然后在甲醇中用氨水处理得到D-脯氨酸[1]. 该法是目前D-脯氨酸的工业生产方法, 但存在生产成本高, 环境污染大的缺点; 2)生物法. Bernegger-Egli等以L-精氨酸为原料通过重氮化合成L-2-氯精氨酸, 利用Pseudomonas aeruginosa自动突变体中的L-2-氯脒基水解酶将L-2-氯精氨酸水解为(S)-2-氯鸟氨酸, 然后自动反转、关环为D-脯氨酸[2]. 该法的总收率为13%, ee > 98%. 日本协和发酵采用生物降解法制备D-脯氨酸. 利用假丝酵母PRD-234菌株同化L-脯氨酸, 发酵液中D-脯氨酸浓度达到50 g/L, ee 99.5%, 收率47%[3].
脯氨酸脱氢酶是一种黄素酶, 广泛存在于人体、植物和微生物中[4]. 脯氨酸脱氢酶在L-脯氨酸的代谢途径中, 以黄素腺嘌呤二核苷酸(FAD)为辅酶催化L-脯氨酸脱氢为Δ1-吡咯啉-5-羧酸(P5C). 目前对微生物脯氨酸脱氢酶的研究主要侧重于酶的分离纯化、结构表征和功能研究[5-11], 脯氨酸脱氢酶的生物技术应用局限于构建生物传感器[12-13]和生物燃料电池[14], 用于D-脯氨酸的制备尚未见报道.
我们以DL-脯氨酸为发酵前体, 类产碱假单胞菌XW-40在发酵过程中利用其中的L-脯氨酸诱导产生胞内脯氨酸脱氢酶, D-脯氨酸完全保留. 发酵产生的细胞不经分离, 发酵液直接作为生物转化反应介质. 生物转化阶段, 采用分批补料策略, 利用细胞中的脯氨酸脱氢酶催化DL-脯氨酸中的L-对映体转化. 通过发酵和生物转化的级联实现D-脯氨酸的高效产生.
1 实验部分 1.1 实验材料类产碱假单胞菌XW-40系本实验室从土壤中筛选, 保藏于中国典型培养物保藏中心, 保藏号为CCTCC NO: M2015521. D-脯氨酸、L-脯氨酸、DL-脯氨酸为南京红杉生物科技有限公司馈赠, 乙酰葡萄糖异硫氰酸酯(GITC)购自梯希爱(上海)化成工业发展有限公司, 其余试剂均为市售分析纯或化学纯.
1.2 实验方法 1.2.1 培养基培养基1(g/L): 蛋白胨5, 酵母膏5, 氯化钠1, pH 6.5; 培养基2(g/L): 蛋白胨3, 酵母膏3, 氯化钠5, 牛肉膏1, DL-脯氨酸20, pH 7. 培养基3(g/L): 蛋白胨3, 酵母膏3, 氯化钠5, 牛肉膏1, L-脯氨酸10, pH 7.
1.2.2 种子培养取斜面保存的类产碱假单胞菌XW-40菌种接种于5 mL培养基1中, 30 ℃、180 r/min下恒温摇床振荡培养48 h.
1.2.3 摇瓶发酵将培养基1中培养液作为种子, 按10%接种量接种于50 mL培养基2中, 30 ℃、180 r/min下恒温摇床振荡培养48 h.
1.2.4 生物转化50 mL发酵液, 用2 mol/L盐酸溶液调整pH至7.5, 加入0.5 g DL-Pro, 30 ℃、180 r/min下反应, HPLC检测反应过程.
1.2.5 L-脯氨酸转化产物的鉴定将培养基1中培养液作为种子, 按10%接种量接种于100 mL培养基3中, 30 ℃、180 r/min下恒温摇床振荡培养48 h. 将发酵液离心, 弃上清, 保留细菌细胞. 将细菌细胞悬浮于4 mL 100 mmol/L磷酸盐(pH 7.5)中备用. 8 mL 100 mmol/L磷酸盐(pH 7.5)中加入2 mL细胞悬浮液(130 mg干重细胞)和0.1 g L-脯氨酸, 30 ℃、180 r/min下反应60 h, HPLC检测是否反应完全. 反应液留存备用.
2, 4-二硝基苯肼显色法. 取上述反应液, 离心留上清. 取1 mL上清液与1 mL 1 mmol/L 2, 4-二硝基苯肼混合, 37 ℃下水浴加热20 min, 冷却至室温. 加入5 mL 1.5 mmol/L NaOH溶液混匀并静置5 min, 观察颜色变化.
薄层色谱法. 取上述反应液, 离心留上清. 加入0.5 mL 30%高氯酸, 离心, 去除上清液中的蛋白质. 上清液中加入0.5 mL 30%双氧水, 混合均匀. 用2 mol/L K2CO3溶液中和至pH 7左右. 在硅胶板上用苯酚∶水(75∶25, v/v)展开, 茚三酮溶液显色. L-谷氨酸钠溶液作对照.
1.2.6 L-谷氨酸生物转化8 mL 100 mmol/L磷酸盐缓冲液(pH 7.5)中加入2 mL细胞悬浮液(130 mg干重细胞)和0.1 g L-谷氨酸钠, 30 ℃、180 r/min下反应60 h, HPLC检测.
1.2.7 分析方法发酵液中的生物质浓度采用分光光度法在600 nm处测量. 1个OD600相当于0.43 mg干重细胞.
发酵和生物转化过程中L-Pro、D-Pro和转化产物, L-Pro转化率采用柱前手性衍生-HPLC分离和测定. 取1 mL发酵液或转化液, 12 000 r/min离心1 min弃细胞. 取100 μL上清液, 加入150 μL水, 250 μL三乙胺乙腈溶液(4 g/L)和500 μL乙酰葡萄糖异硫氰酸酯(GITC)乙腈溶液(2 g/L), 30 ℃下衍生30 min, 离心. 上清液采用HPLC法在Alltech高效液相色谱仪上测定. 色谱柱: Sepax MAH-C18(250×4.6 mm, 5 μm), 流动相: 0.1%三氟乙酸水溶液/甲醇(49/51, v/v), 流速: 1 mL/min, 检测波长: 254 nm, 柱温: 25 ℃. L-Pro·GITC、D-Pro·GITC的保留时间分别为14.9、17.8 min. L-脯氨酸转化率=(1-AL/AD×1.5)×100%, D-脯氨酸的对映体过量(ee)=(AD-AL)/(AD+AL)×100%. 其中AL、AD分别为L-Pro·GITC和D-Pro·GITC的峰面积. DL-Pro中L-Pro·GITC和D-Pro·GITC的峰面积比为1∶1.5.
2 结果与讨论 2.1 类产碱假单胞菌XW-40发酵采用单因素法对类产碱假单胞菌XW-40的培养基组分进行优化. 考察了蛋白胨、牛肉膏、酵母膏和NaCl对细胞生长和DL-脯氨酸中L-对映体转化率的影响. 结果如图 1. 结果表明, 各个组分的最适浓度分别为: 蛋白胨3 g/L, 牛肉膏1 g/L, 氯化钠5 g/L, 酵母膏3 g/L.

|
图 1
培养基组分对细胞生长和转化率的影响
Fig.1
Effect of medium component on cell growth and conversion
Except for variables, other conditions are the same as the experimental section a. peptone; b. beef extract; c. NaCl; d. yeast extract |
考察了培养基初始pH对类产碱假单胞菌XW-40细胞生长和DL-脯氨酸中L-对映体转化率的影响. 由图 2a可知, 当pH过高或是过低都不利于类产碱假单胞菌XW-40细胞的生长和L-脯氨酸的转化. 当初始pH值为7时, 细胞生长最好, L-脯氨酸转化率最高. 考察了培养温度对类产碱假单胞菌XW-40的生长以及L-脯氨酸转化率的影响(图 2b). 由图 2b可知, 从20 ℃开始, 细胞生物量和转化率随温度的升高而升高, 在30 ℃达到最大值; 超过30 ℃, 细胞生物量和转化率迅速降低. 为此选择30 ℃作为类产碱假单胞菌XW-40的发酵温度.

|
图 2 初始pH和温度对转化率和细胞生长的影响 Fig.2 Effect of initial pH (a) and temperature (b) on conversion and cell growth a. Fermentation broth(50 mL) contained 3 g/L yeast extract, 1 g/L beef extract, 3 g/L peptone, 5 g/L NaCl, 20 g/L DL-Pro. pH 5.0~7.5, 30 ℃, 48 h, 180 r/min; b. Fermentation broth(50 mL) contained 3 g/L yeast extract, 1 g/L beef extract, 3 g/L peptone, 5 g/L NaCl, 20 g/L DL-Pro. pH 7.0, 20~40 ℃, 48 h, 180 r/min |
对菌体生长及L-脯氨酸转化曲线的测定有利于确定最佳发酵时间. 由图 3可知发酵时间为48 h时, 细胞生长基本停止, 但L-脯氨酸的转化率仍在上升. 当发酵时间为72 h时, 转化率接近100%. 提示细胞在生长过程中产生胞内脯氨酸脱氢酶. 细胞停止生长后, 胞内脯氨酸脱氢酶继续催化L-脯氨酸降解.

|
图 3 发酵过程中细胞生长和DL-脯氨酸转化的时间进程 Fig.3 Time course of cell growth and conversion of DL-Pro in fermentation Fermentation broth(50 mL) contained 3 g/L yeast extract, 1 g/L beef extract, 3 g/L peptone, 5 g/L NaCl, 20 g/L DL-Pro. pH 7.0, 30 ℃, 180 r/min |
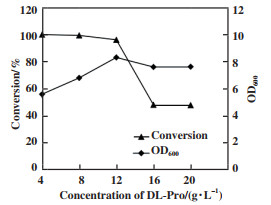
在发酵过程中, 当发酵前体DL-脯氨酸浓度小于12 g/L时, L-脯氨酸的转化率没有明显下降, 可见在此发酵前体浓度下, 细胞生长和脯氨酸脱氢酶的产生不受D-脯氨酸的抑制. 当发酵前体浓度大于12 g/L时, 细胞生长受到抑制, L-脯氨酸转化率随发酵前体浓度增大逐渐下降(图 4). 为此, 选择12 g/L为发酵前体DL-脯氨酸浓度.
|
图 4 DL-脯氨酸浓度对转化率和细胞生长的影响 Fig.4 Effect of DL-proline concentration onconversion and cell growth Fermentation broth(50 mL) contained 3 g/L yeast extract, 1 g/L beef extract, 3 g/L peptone, 5 g/L NaCl, 4~20 g/L DL-Pro. pH 7.0, 30 ℃, 48 h, 180 r/min |
类产碱假单胞菌XW-40在发酵过程中产氨, 发酵液pH上升至9.0, 该pH非生物转化的最适pH. 为此, 我们考察了发酵液pH对生物转化的影响(图 5). 从图 5可知, 生物转化的最适pH为7.5.

|
图 5 生物转化阶段pH对转化率的影响 Fig.5 Effect of pH on conversion in biotransformation Fermentation broth (10 mL), pH 7.0~9.5, 10 g/L DL-Pro, 30 ℃, 48 h, 180 r/min |
为提高类产碱假单胞菌XW-40细胞的利用率和D-脯氨酸的产生效率, 采用分批补料的策略产生D-脯氨酸(图 6). 以12 g/L DL-脯氨酸为发酵前体, 类产碱假单胞菌XW-40发酵48 h后, 调整发酵液的pH为7.5, 补料10 g/L DL-脯氨酸. 每批补料的L-脯氨酸转化完全后, 继续补料. 分批补料5批, 累计加入DL-脯氨酸50 g/L. L-脯氨酸转化完全, 累积的D-脯氨酸浓度达到31 g/L, ee大于99%. 类产碱假单胞菌XW-40细胞在长达384 h的操作时间里表现出高的脯氨酸脱氢酶活性, 有待进一步深入研究.

|
图 6 分批补料产生D-Pro Fig.6 Fed-batch production of D-Pro from DL-Pro in fermentati-on-biotransformation cascade Fermentation broth (10 mL), 12 g/L DL-Pro, pH 7.5, 30 ℃, 180 r/min. 10 g/L DL-Pro was fed at the indicated time intervals |
采用柱前手性衍生HPLC对类产碱假单胞菌XW-40细胞催化L-脯氨酸的转化产物和L-4-氨基丁酸、L-谷氨酸进行了对照. 转化产物既不是L-4-氨基丁酸, 也不是L-谷氨酸, 证明L-脯氨酸的转化途径中没有脯氨酸氧化酶参与.
采用2, 4-二硝基苯肼显色法对转化产物进行鉴定, 发现显色液呈红棕色, 表明L-脯氨酸的转化产物含有醛基或酮基(图 7a). 进一步地, 转化产物采用双氧水氧化, 经TLC分析, 证实其氧化产物为L-谷氨酸(图 7b). 因此, 推断L-脯氨酸在类产碱假单胞菌XW-40细胞中的脯氨酸脱氢酶(ProDH)作用下转化为γ-谷氨酸半醛(γ- glutamic semialdehyde, GSA).

|
图 7 L-脯氨酸转化产物的2, 4-二硝基苯肼显色和双氧水氧化产物的薄层色谱 Fig.7 Chromogenic reaction of GSA with DNP and TLC of oxidizing product of GSA by H2O2 a. GSA-DNP (left), control (right); b. L-Glu(left), oxidizing product of GSA by H2O2 (right) |
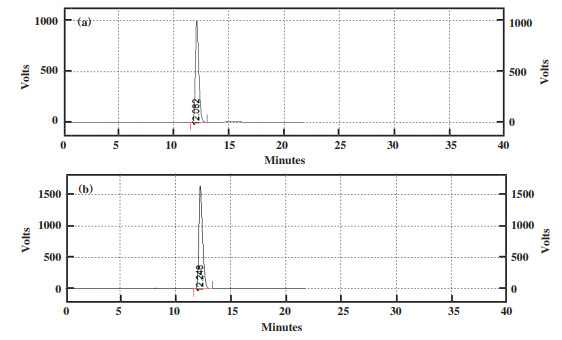
以L-谷氨酸为底物, 采用类产碱假单胞菌XW-40细胞转化时, 转化产物与L-脯氨酸的转化产物相同, 均为GSA, 但未观察到L-脯氨酸的形成(图 8). 说明L-谷氨酸在γ-谷氨酸半醛合成酶(亦称为吡咯啉-5-羧酸合成酶, P5CS)作用下转化为GSA. 转化产物中没有L-脯氨酸存在, 一个可能的原因是ProDH活性远高于吡咯啉-5-羧酸还原酶(P5CR)活性.
|
图 8 L-脯氨酸(a)和L-谷氨酸(b)转化产物的HPLC图谱 Fig.8 HPLC profile of GSA from L-Pro (a) and L-Glu(b) |
类产碱假单胞菌XW-40细胞中存在L-脯氨酸合成和降解酶系. L-脯氨酸在ProDH作用下转化为Δ1-吡咯啉-5-羧酸(P5C), P5C与GSA处于平衡中. P5C在P5CR作用下还原为L-脯氨酸. 相对于L-脯氨酸脱氢途径, 还原途径的反应是限速步骤; P5C在吡咯啉-5-羧酸脱氢酶(P5CDH)作用下, 转化为L-谷氨酸. L-谷氨酸在P5CS作用下转化为P5C. 相对于P5C合成途径, 其脱氢途径的反应是限速步骤. 结合L-脯氨酸在植物和微生物中的合成和代谢途径[15-16], 推测其反应机理如下(Scheme 1).

|
图示1 类产碱假单胞菌XW-40催化DL-脯氨酸产生D-脯氨酸的反应机理推测 Scheme 1 Postulated mechanism for the production of D-proline from DL-Proline by Pseudomonas pseudoalcaligenes XW-40 |
以DL-脯氨酸为发酵前体, 类产碱假单胞菌XW-40细胞在发酵过程中利用L-脯氨酸诱导产生胞内脯氨酸脱氢酶, D-脯氨酸完全保留. 类产碱假单胞菌XW-40发酵的最适培养基成分为: 蛋白胨3 g/L, 牛肉膏1 g/L, 氯化钠5 g/L, 酵母膏3 g/L, DL-脯氨酸(发酵前体)12 g/L. 最适培养条件为: 初始pH 7.0, 温度30 ℃, 发酵时间48 h. 发酵液中的细胞不经分离, 直接用于生物转化. 生物转化阶段的最适pH值为7.5, DL-脯氨酸的单批补料浓度为10 g/L, 分批补料批次达到5批. 采用发酵-生物转化级联方式和转化阶段分批补料策略, D-脯氨酸累积量达到31 g/L, ee值大于99%. 类产碱假单胞菌XW-40细胞中存在同时L-脯氨酸合成酶系和降解酶系, 其中脯氨酸脱氢酶和P5C合成酶占主导地位. 我们建立的方法为D-脯氨酸的生物法工业化制备提供了一条新颖的途径.
| [1] |
a. Hong Yong-yu(洪镛裕), Liao Ben-ren(廖本仁), Liu Si-bing(刘思斌), et al. Facile production of D-proline by asymmetric transformation of L-proline(不对称转换法合成D-脯氨酸)[J]. Chin J Pharm (中国医药工业杂志), 2001, 32(11): 515-516. b. Cheng Rui-chen(程瑞琛), Liu Yan-li(刘艳丽), Dai Da-zhang(戴大章). Recent progress in computer-aided design and engineering of glycosidases(计算机辅助糖苷酶分子设计与改造研究进)[J]. J Mol Catal (China) (分子催化), 2020, 34(5): 475-483. c. Zhang Can(张灿), Jiang Guo-fang(姜国芳), Yang Jiang-nan(杨江楠), et al. Research progress of immobilized lipase on porous materials(多孔材料固定化脂肪酶的研究进展)[J]. J Mol Catal (China) (分子催化), 2020, 34(4): 378-396. d. Liu Qing-yun(刘青云), Xin Jia-ying(辛嘉英), Sun Li-rui(孙立瑞), et al. Research progress of nanogold particles-enzyme biohybrid(纳米金杂化酶研究进展)[J]. J Mol Catal (China) (分子催化), 2020, 34(3): 252-260. |
| [2] |
Bernegger-Egli C, Etter K S, Studer F, et al. Production of D-proline from L-arginine using Pseudomonas aeruginosa[J]. J Mol Catal B: Enzym, 1999, 6(3): 359–367.
DOI:10.1016/S1381-1177(98)00124-6 |
| [3] |
Yagasaki M, Ozaki A. Industrial biotransformations for the production of D-amino acids[J]. J Mol Catal B: Enzym, 1998, 5(4): 1–11.
|
| [4] |
Liu L K, Becker D F, Tanner J J. Structure, function, and mechanism of proline utilization A (PutA)[J]. Arch Biochem Biophys, 2017, 632: 142–157.
DOI:10.1016/j.abb.2017.07.005 |
| [5] |
Meile L, Leisinger T. Purification and properties of the bifunctional proline dehydrogenase/l-pyrroline-5-carboxylate dehydrogenase from Pseudomonas aeruginosa[J]. Eur J Biochem, 1982, 129: 67–75.
DOI:10.1111/j.1432-1033.1982.tb07021.x |
| [6] |
Kawakami R, Sakuraba H, Tsuge H, et al. A second novel dye-linked L-proline dehydrogenase complex is present in the hyperthermophilic archaeon Pyrococcus horikoshii OT-3[J]. FEBS J, 2005, 272: 4044–4054.
DOI:10.1111/j.1742-4658.2005.04810.x |
| [7] |
Mohammadi H S, Omidinia E. Isolation, purification and characterization of proline dehydrogenase from a Pseudomonas putida POS-F84 isolate[J]. Iran J Biotechnol, 2012, 10(2): 111–119.
|
| [8] |
Satomura T, Zhang X D, Hara Y. Characterization of a novel dye-linked L-proline dehydrogenase from an aerobic hyperthermophilic archaeon, Pyrobaculum calidifontis[J]. Appl Microbiol Biotechnol, 2011, 89: 1075–1082.
DOI:10.1007/s00253-010-2914-7 |
| [9] |
Sakuraba H, Satomura T, Kawakami R, et al. Crystal structure of novel dye-linked L-proline dehydrogenase from Hyperthermophilic Archaeon Aeropyrum pernix[J]. J Biol Chem, 2012, 287(24): 20070–20080.
DOI:10.1074/jbc.M111.319038 |
| [10] |
Sakuraba H, Takamatsu Y, Satomura T, et al. Purification, characterization, and application of a novel dye-linked L-proline Dehydrogenase from a Hyperthermophilic Archaeon, Thermococcus profundus[J]. Appl Environ Microbiol, 2001, 67(4): 1470–1475.
DOI:10.1128/AEM.67.4.1470-1475.2001 |
| [11] |
Deutch C E. L-Proline catabolism by the high G + C Gram-positive bacterium Paenarthrobacter aurescens strain TC1[J]. Antonie van Leeuwenhoek, 2019, 112: 237–251.
DOI:10.1007/s10482-018-1148-z |
| [12] |
Hasanzadeh M, Hassanpour S, Nahar A S, et al. Proline dehydrogenase-entrapped mesoporous magnetic silica nanomaterial for electrochemical biosensing of L-proline in biological fluids[J]. Enzyme Microb Tech, 2017, 105: 64–76.
DOI:10.1016/j.enzmictec.2017.05.007 |
| [13] |
Hasanzadeh M, Nahar A S, Hassanpour S, et al. Immobilization of proline dehydrogenase on functionalized silica mesoporous nanomaterial towards preparation of a novel thermostable enzyme biosensor[J]. J Nanosci Nanotech, 2018, 18(1): 7786–7796.
|
| [14] |
Tonooka A, Komatsu T, Tanaka S, et al. A L-proline/O2 biofuel cell using L-proline dehydrogenase (LPDH) from Aeropyrum pernix[J]. Mol Biol Rep, 2018, 45: 1821–1825.
DOI:10.1007/s11033-018-4328-z |
| [15] |
Campbell A C, Bogner A N, Mao Y, et al. Structural analysis of prolines and hydroxyprolines binding to the l-glutamate-γ-semialdehyde dehydrogenase active site of bifunctional proline utilization A[J]. Arch Biochem Biophys, 2021, 698: 108727.
DOI:10.1016/j.abb.2020.108727 |
| [16] |
Xu Xiang-ming(许祥明), Ye He-chun(叶和春), Li Guofeng(李国凤). Progress in synthesis and metabolism of proline and its relationship with osmotolerance of plants(脯氨酸代谢与植物抗渗透胁迫的研究进展)[J]. Chin Bull Botany(植物学通报), 2000, 17(6): 536–542.
DOI:10.3969/j.issn.1674-3466.2000.06.007 |
 2021, Vol. 35
2021, Vol. 35


