天然气不合理利用会导致化石燃料的浪费并加剧温室效应[1]. 甲烷氧化产物尤其是羟基衍生物, 不仅是可储存和运输的液体燃料, 还是通用的化学品原料[2]. 因此, 将甲烷部分氧化转化为甲醇对天然气资源的有效利用具有重要意义. 在以往的研究中, 甲烷单加氧酶(Methane Monooxygenase, MMO)可以在温和条件的氧气气氛中实现甲烷部分氧化为甲醇. 基于这一启示, 研究发现了金属交换分子筛作为甲烷部分氧化反应的催化体系. 其中分子筛与金属阳离子进行离子交换, 形成的金属活性中心被限域在分子筛骨架结构的Al位点上[3], Groothaert等[4]首次将金属交换分子筛催化剂应用于甲烷部分氧化反应. 随后的研究主要涉及如小孔的CHA、AFX、AEI[5-9], 中孔的MFI[10-18]、TON[6]分子筛以及大孔的MOR[19]、MAZ[20]分子筛等. 涉及活性金属种类有Cu、Fe[21-22]、Co[23]、Ni[23]、Pt[24]和Pd[23], 其中Cu和Fe被广泛研究. 关于含掺杂金属的活性位点催化甲烷部分氧化的报道中, 通过理论计算研究得到ZSM-5中[Cu-O-M]2+-ZSM-5(M= Cu, Zn, Au, Ag)催化甲烷C-H键活化的反应性顺序为[Cu-O-Ag]2+-ZSM-5 > [Cu-O-Au]2+-ZSM-5 > [Cu-O-Cu]2+-ZSM-5 > [Cu-O-Zn]2+-ZSM-5[25].
Grundner等[26]通过实验研究提出在450 ℃的O2条件下活化Cu-MOR可以得到三核Cu活性结构. 该体系中被Cu2+取代的H-MOR中的Bronsted酸位点交换化学计量比为2/3, 表明两个晶格Al负载了3个Cu原子. Mahyuddin等[27]通过理论计算研究提出O2活化Cu-MOR生成[Cu3(μ-O)3]2+活性结构的可能前体为[Cu(I)2Cu(II)O]2+结构. Palagin等[28]研究报道了Cu-MOR分子筛中活性位点铜簇的尺寸和稳定性的关系: Cu活性位点簇的稳定性会随着铜簇储存的增大而提高, 因此不同数量Cu-oxo作为活性位点时甲烷C-H键活化的反应性排序为[CuOH]+ < [CuO2Cu]2+ < [CuOCu]2+ < [Cu3O3]2+≈ [Cu4Ox]2+≈ [Cu5Ox]2+.
在得出Cu-分子筛催化甲烷部分氧化反应的计算及实验结果的基础上, 研究者们开始探索催化性能与催化剂体系固有性质之间的规律. Wang等[25]通过分析在双金属活性结构催化的ZSM-5分子筛中活性结构的∠Cu-O-M和活性氧自旋密度与甲烷C-H键活化的能量变化, 定性地得出在[Cu-O-M]2+-ZSM-5中μ-O自旋密度越大负电荷越少, 甲烷C-H键的活化具有越高的反应性. Liu等[29]在Cu-ZSM-5的三核铜活性结构中掺杂过渡金属Fe、Co、Ni, 分析讨论甲烷活化步骤的描述符, 表明甲烷C-H键裂解的活性与活性位点的质子亲和能相关, 但由于质子亲和能并不能解释甲基自由基的稳定性, 因此具有一定的偏差.
为进一步提升部分氧化反应活性, 我们以MAZ分子筛作为金属活性位点负载体系, 在三核[Cu3(μ-O)3]2+活性结构中分别掺杂Pd、Pt、Fe、Co、Ni、Au和Ag 7种过渡金属, 构建[Cu2MO3]2+异金属活性位点. 通过密度泛函理论(Density Functional Theory)研究活性位中的异金属对Cu-分子筛催化甲烷部分氧化反应过程的能量变化的影响, 并通过分析活性位和反应中间体、过渡态等结构的几何、电子结构性质, 讨论并得出适用于Cu-MAZ分子筛催化甲烷部分氧化反应的描述符.
1 计算方法及模型 1.1 计算方法所有计算结果均通过VASP[30-33]计算方法得到, 其中VASP计算方法基于赝势平面波基组. 电子交换关联势采用广义梯度近似法(Generalized gradient approximation, GGA)中的Perdew-Burke-Ernzerhof(PBE)泛函[34]. 布里渊区采用Gamma方法选取k点, 且k点的网格大小为1×1×1. 结构优化中的能量收敛判据设置为10-5 eV, 原子力收敛判据设置为0.005 eV/nm, 平面波展开的截断能为500 eV. 过渡态搜索过程运用CI-NEB方法, 当原子受力小于0.01 eV/nm即认为收敛, 通过有且唯一一个虚频来确定过渡态. 所有原子弛豫. 对所有结构优化和过渡态搜索过程设置van der Waals相互作用校正[35-36], 采用半经验Grimme’s D3校正方法. 原子自旋密度通过Bader分析算法得出[37-38], 用于分析电子转移情况[39].
参考Wang等[25]和Latimer等[40]的计算方法, 三核[Cu2MO3]2+(M=Pd, Pt, Fe, Co, Ni, Au, Ag)活性位形成能Ef的计算公式如下:
| $ \mathrm{E}_{\mathrm{f}}=\mathrm{E}_{\left(\mathrm{Cu}_{2} \mathrm{MO}_{3} \mathrm{MAZ}\right)}-\mathrm{E}_{\left(\mathrm{Cu}_{2} \mathrm{MO}_{2} \mathrm{MAZ}\right)}-\frac{1}{2} \mathrm{E}_{\left(\mathrm{O}_{2}\right)} $ | (1) |
其中E(Cu2 MO3 /MAZ)、(Cu2MO2/MAZ)和E(O2)分别表示[Cu2MO3]2+-MAZ和[Cu2MO2]2+-MAZ的能量以及O2分子在气相中的能量.
参考Latimer等[40]的计算方法, 三核[Cu-O-M]2+活性位质子亲和能EH的计算公式如下:
| $ \mathrm{E}_{\mathrm{H}}=\mathrm{E}_{\left(\mathrm{Cu}_{2} \mathrm{MO}_{3} \mathrm{HMAZ}\right)}-\mathrm{E}_{\left(\mathrm{Cu}_{2} \mathrm{MO}_{2} \mathrm{MAZ}\right)}-\frac{1}{4} \mathrm{E}_{\left(\mathrm{H}_{2} \mathrm{O}\right)}+\frac{1}{8} \mathrm{E}_{\left(\rm O_{2}\right)} $ | (2) |
其中E(Cu2MO3H/MAZ)和E(H2O)分别表示H迁移的[Cu2MO3H]-MAZ和H2分子在气相中的能量.
1.2 计算模型MAZ分子筛结构从分子筛结构类型数据库获取[41-42]. MAZ分子筛的晶格参数为a=1.821 nm, b=1.821 nm, c=1.532 nm. [Cu2MO3]2+活性位的结构构建在MAZ分子筛gme笼8元环的T1/T1位点上, 其中两个T1位点由3个Si原子间隔. 在T1/T1位点上用Al原子替代Si原子, 以平衡分子筛骨架外活性位点的正电荷. 该模型Si/Al比为35.
2 结果与讨论 2.1 异金属三核活性位几何结构性质与稳定性根据Mahyuddin等[43]和Grundner等[26]报道的MAZ和MOR中负载三核铜-氧活性位结构模型, 构建含7种掺杂过渡元素的负载三核铜-氧活性位的结构模型, 如图 1(a)所示. 三核铜活性位分别负载在MAZ分子筛gme笼8元环的两个相对T1位点上, 形成相对稳定的限域结构. 将三核活性位的3个金属位点和3个桥氧位点标号, 如图 1(b)和(c)所示. 结果表明, 三核活性位中的掺杂金属Pd、Pt、Au、Ag在M2位点上能量更低, 而三核活性位中的掺杂金属Fe、Co、Ni位于M3位点能量更低.
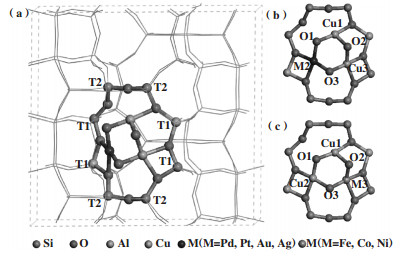
|
图 1 (a)负载三核活性位的MAZ分子筛结构模型; (b)含Pd、Pt、Au、Ag异金属的三核铜活性位结构模型; (c)含Fe、Co、Ni异金属的三核铜活性位结构模型 Fig.1 (a) MAZ Structure model loading with tri-nuclear active sites; (b) Active site structure model of trinuclear copper containing Pd, Pt, Au or Ag; (c) Active site structure model of trinuclear copper containing Fe, Co or Ni |
如表 1所示, 对比每个活性位的两个d(M-O)的平均值, 可以得出[Cu2AuO3]2+和[Cu2AgO3]2+活性位的M-O键长值(0.194到0.198 nm)大于[Cu2PdO3]2+和[Cu2PtO3]2+的键长值(0.187到0.189 nm). 各活性位的活性氧的位点, 即[Cu2MO3]2+(M=Pd, Pt, Ni, Au, Ag)的活性氧为O2, 而[Cu2MO3]2+(M=Fe, Co)的活性氧为O1.比较活性氧及其相连两金属组成的键角大小, [Cu2CoO3]2+和[Cu2FeO3]2+对应的活性氧M-O2-M键角最大(分别为109.1°和108.4°), 而[Cu2MO3]2+(M=Pd, Pt, Ni, Au, Ag)的活性氧键角较小. 除Fe、Co掺杂活性位(分别为0.190和0.195 nm)外, 各Cu-O键长较相近(在0.180 nm左右), 与Mahyuddin等[43]的结果一致.
| 表 1 [Cu2MO3]2+(M= Pd, Pt, Fe, Co, Ni, Au, Ag)活性位优化结构的关键结构参数 Table 1 The key structural parameters of [Cu2MO3]2+(M=Pd, Pt, Fe, Co, Ni, Au, Ag) |
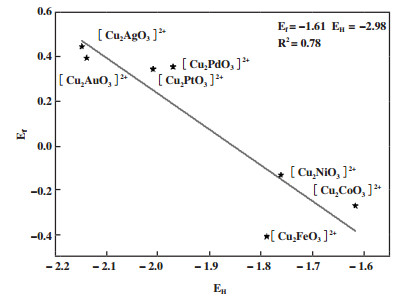
如图 2所示, 对比7种活性位点的形成能Ef来讨论其稳定性, 以Ag为异金属的活性位形成能相对最高(为0.44 eV), 其次为含Au结构(0.39 eV). 而[Cu3O3]2+的形成能为0.50 eV, 均高于研究中涉及的7种异金属活性位, 说明这些掺杂的过渡金属在三核活性位中有利于提升三核铜活性结构的热力学稳定性.
|
图 2 [Cu2MO3]2+(M= Pd, Pt, Fe, Co, Ni, Au, Ag)的质子亲和能EH和形成能Ef的线性拟合曲线 Fig.2 The linear relationship between proton affinity (EH) and formation energy (Ef) of [Cu2MO3]2+ (M= Pd, Pt, Fe, Co, Ni, Au, Ag) |
另外, 分别计算了每个异金属活性位的质子亲和能. 如图 2所示, 质子亲和能与形成能呈现出较明显的线性拟合关系, 即更低的热力学稳定性的[Cu2MO3]2+具有更高的质子亲和性.
2.2 异金属三核活性位电子结构性质为研究活性位点的电子结构性质, 分别计算了7种三核异金属活性位的原子自旋密度, 用VESTA可视化[44]. 如图 3所示, 考察了每个活性结构活性氧的原子自旋密度, 其中[Cu2AgO3]2+的活性氧自旋密度最高(0.32), Au掺杂结构与Ag掺杂结构的活性氧自旋密度相近且略低, 二者均高于未掺杂的三核Cu活性位的活性氧自旋密度(0.06).

|
图 3 [Cu2MO3]2+的原子自旋密度图 Fig.3 The atomic spin density of [Cu2MO3]2+ (蓝色和黄色区域分别代表正自旋密度和负自旋密度, 等值面的值为2.7×105 eV/nm3) (The blue and yellow region represent positive and negative spin densities, respectively, and the isosurface value is 2.7×105 eV/nm3) |
为讨论掺杂金属对三核铜-氧活性结构中金属和氧原子的电荷得失情况, 比较了每个活性位中活性氧的Bader电荷值. 如表 2所示, [Cu2FeO3]2+和[Cu2CoO3]2+中的O1具有较高Bader电荷(分别为0.76 |e|和0.78 |e|), 即其活性氧从与之成键的两个Cu原子得到更多负电荷; 其次为[Cu2PtO3]2+的O2活性氧(为0.73 |e|). 含Pd和Au的三核铜-氧活性位O2的Bader电荷值相近, 约为0.70 |e|. 活性氧Bader电荷相对较低的Ag掺杂结构, 其活性氧Bader电荷与Pd、Au掺杂结构的结果相差较少, 为0.69 |e|. Ni掺杂结构例外, 其活性氧O2的Bader电荷结果最低, 为0.66 |e|. 同时我们对比了三核金属活性O位点的Bader电荷值与金属氧化物体相O的Bader电荷值, 发现活性O位点的Bader电荷值, 即[Cu2MO3]2+(M=Pd, Pt, Ni, Au, Ag)的活性氧为O2, 而[Cu2MO3]2+(M=Fe, Co)的活性氧为O1, 均小于金属氧化物体相O的Bader电荷值, 证明活性O具有离子自由基性质.
| 表 2 [Cu2MO3]2+(M= Pd, Pt, Fe, Co, Ni, Au, Ag)活性位的Bader电荷值 Table 2 Bader charges of [Cu2MO3]2+ (M= Pd, Pt, Fe, Co, Ni, Au, Ag) active sites |
参考Mahyuddin等[43]和Grundner等[26]对MAZ负载的三核铜-氧活性位催化甲烷部分氧化反应机理, 以如图 4所示的催化循环反应机理来讨论异金属三核活性位对该反应的理论催化性能. 反应物甲烷吸附在MAZ分子筛的gme笼中, 与[Cu2MO3]2+活性位点形成反应物复合物(Reactant complex, RC). 随后的甲烷C-H键裂解遵循氢原子转移(Hydrogen-atom Transfer, HAT)机理, 生成自由基中间体[Cu2MO3H…CH3·], 并通过自由基重组机理进一步转化为产物复合物(Product complex, PC), 甲醇在无溶剂条件下脱附, 使得异金属三核铜-氧活性位[Cu2MO3]2+转化为[Cu2MO2]2+, 还原活性结构通过N2O的氧化作用重新转化为原活性结构.

|
图 4 含异金属的三核铜-氧活性位[Cu2MO3]2+-MAZ催化甲烷部分氧化循环过程的反应路径 Fig.4 The reaction path of hetero-metallic tri-nuclear Cu-oxo-MAZ catalyzed methane partial oxidation to methanol |
根据图 4的反应循环机理, 分别优化了反应中间体RC、RI和PC的结构, 并通过过渡态搜索得到甲烷活化过渡态TS1和PC生成过渡态TS2. 得到由图 5所示的[Cu2MO3]2+-MAZ(M=Pd, Pt, Fe, Co, Ni, Au, Ag)催化甲烷部分氧化反应势能曲线.
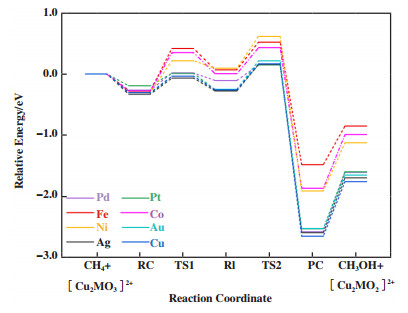
|
图 5 [Cu2MO3]2+-MAZ(M= Pd, Pt, Fe, Co, Ni, Au, Ag)催化甲烷部分氧化反应势能曲线 Fig.5 The potential energy diagrams of [Cu2MO3]2+-MAZ (M= Pd, Pt, Fe, Co, Ni, Au, Ag) catalyzed methane partial oxidation to methanol |
在第一步的甲烷吸附过程中, 各活性位的吸附能有一定的差异. 其中, [Cu2PtO3]2+-MAZ的吸附能呈现出最大值, 为-0.19 eV. 而[Cu2AuO3]2+-和[Cu2AgO3]2+-MAZ的吸附放热值最高, 两者约为-0.33 eV. 作为对比, 不含掺杂过渡金属的[Cu3O3]2+-MAZ的吸附热为-0.30 eV, 放热值高于Pd、Pt、Fe、Co、Ni掺杂结构而略低于Au、Ag掺杂结构.
在甲烷活化步骤中, 通过分别优化各活性位中以不同氧原子作为活性氧的RI结构, 得出能量相对更低的活性氧位点, 其中Pd、Pt、Ni、Au和Ag掺杂结构的活性氧位点为O2, 而Fe和Co掺杂结构的活性氧位点为O1. 如图 6所示, Ni、Fe和Co掺杂结构对应的RI相对能量更高, 分别为0.095、0.069和0.004 eV; Au和Pt掺杂结构的RI相对能量相近, 分别为-0.25和-0.26 eV, 该结果与[Cu3O3]2+相应的RI相对能量(-0.26 eV)相近, 其中Au掺杂结构相对能量略高而Pt掺杂结构相对能量略低. 7种掺杂金属对应RI中相对能量最低的为Ag掺杂结构, 为-0.28 eV. 从动力学角度对甲烷活化步骤的活化能进行比较, Fe、Co、Ni掺杂结构的活化能垒相对较高, 分别为0.69、0.63和0.51 eV. 此外, Au和Pd掺杂结构的活化能垒(分别为0.30和0.28 eV)也高于[Cu3O3]2+-MAZ中的活化能垒(0.27 eV), 相比之下, Ag掺杂结构的能垒(0.26 eV)略低于[Cu3O3]2+-MAZ的参照能垒, 而最低能垒对应Pt掺杂结构, 其值为0.20 eV. 根据该步骤的能量计算结果可以得出, 从热力学角度讨论得到的反应性排序为[Cu2PtO3]2+ > [Cu3O3]2+ > [Cu2AgO3]2+ > [Cu2AuO3]2+ > [Cu2PdO3]2+ > [Cu2CoO3]2+ > [Cu2FeO3]2+ > [Cu2NiO3]2+; 从动力学角度讨论得到的反应性排序为[Cu2PtO3]2+ > [Cu2AgO3]2+ > [Cu3O3]2+ > [Cu2PdO3]2+ > [Cu2AuO3]2+ > [Cu2NiO3]2+ > [Cu2CoO3]2+ > [Cu2FeO3]2+. 同样考察了甲烷活化过程中反应能量与活化能垒之间是否存在明显BEP关系, 据此得出图 6. 可以发现, 异金属三核铜-氧活性位催化的甲烷活化步骤的反应能量和活化能垒呈现正线性相关, 而其相关系数的平方为0.73.

|
图 6 [Cu2MO3]2+-MAZ(M= Pd, Pt, Fe, Co, Ni, Au, Ag)催化甲烷活化步骤的BEP关系 Fig.6 BEP relationship in methane activation catalyzed by [Cu2MO3]2+-MAZ (M= Pd, Pt, Fe, Co, Ni, Au, Ag) |
在甲醇前体生成步骤中, 计算得出该步骤反应能量也呈现出明显的放热特征. 如图 6所示, 从热力学角度讨论得到的反应性排序为[Cu2PdO3]2+ > [Cu2AgO3]2+ > [Cu2PtO3]2+ > [Cu2AuO3]2+ > [Cu2NiO3]2+ > [Cu2CoO3]2+ > [Cu2FeO3]2+; 而从动力学角度讨论得到的反应性排序为[Cu2PdO3]2+ > [Cu2PtO3]2+ > [Cu2CoO3]2+ > [Cu2AgO3]2+ > [Cu2FeO3]2+ > [Cu2AuO3]2+ > [Cu2NiO3]2+. 7种掺杂金属结构中, Ag和Pd掺杂结构的PC相对能量最低且相近但略高于不含掺杂金属的结构, 而Pd和Pt掺杂结构的TS2相对能量低于不含掺杂金属结构, Ag的掺杂结构接近且略小于三核铜结构. 同样验证了甲醇前体生成步骤中反应能量与能垒的关系, 比较三核活性位中甲烷活化和甲醇前体生成步骤得出, 三核活性位中的甲烷活化是关键步骤.
在甲醇脱附过程中, 较大甲醇脱附能对应Pd和Pt掺杂结构, 分别为0.97和0.93 eV. Ag、Co、Au掺杂结构的甲醇脱附能相近, 分别为0.89、0.88和0.87 eV. Ni、Fe掺杂结构的甲醇脱附能分别为0.78和0.63 eV. 还原态三核活性位由N2O氧化再生的反应能量如表 3所示. 从热力学角度考虑, 三核活性位的氧化再生与二核活性位相比更困难.
| 表 3 N2O氧化再生三核活性位[Cu2MO3]2+(M= Pd, Pt, Fe, Co, Ni, Au, Ag)的反应能量 Table 3 The reaction energies of tri-nuclear [Cu2MO3]2+ (M= Pd, Pt, Fe, Co, Ni, Au, Ag) oxidation by N2O |
对异金属三核铜-氧活性位讨论了电子结构对活性位催化性能的影响. 从电子结构角度讨论, 如图 7所示为活性位活性氧自旋密度与TS1能垒之间的线性拟合关系图. 三核活性位中活性氧自旋密度与甲烷活化能垒未呈现期望的拟合结果, 该结论与Liu等[29]报道的MAZ分子筛中三核铜活性位中O自旋密度与甲烷活化能垒的拟合结果相一致.

|
图 7 异金属三核活性位活性氧自旋密度OSD与甲烷活化TS1能垒 Fig.7 The relationship between OSD and of hetero-metallic tri-nuclear active energy |
图 8所示为质子亲和能与甲烷活化能垒的关系. 三核活性位的质子亲和能与甲烷活化能垒的线性拟合相关性较弱且总体呈现正相关, 高质子亲和能的Fe、Co、Ni掺杂结构对应更高的甲烷活化能垒, 而Pd、Pt、Au和Ag掺杂结构的较低质子亲和能对应甲烷活化能垒则相对较低.
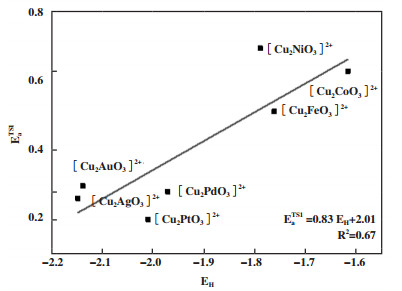
|
图 8 异金属活性位质子亲和能EH与甲烷活化能垒的线性拟合关系 Fig.8 The linear relationship between proton affinity energy EH and methane activation energy barrier |
三核铜-氧活性位中异金属Ag的存在对甲烷部分氧化反应性也起到提升作用, 因此通过讨论Ag掺杂结构与不含异金属的三核铜-氧活性位及反应中间体的电子结构差异, 从而探究三核活性位中异金属Ag的存在对反应性的影响机制.
为讨论[Cu2AgO3]2+与[Cu3O3]2+活性位及反应中间体的电荷转移情况, 分别计算得到[Cu2AgO3]2+与[Cu3O3]2+相应的RC、RI的Bader电荷值, 如表 4所示. Ag原子对μ-O的给电子贡献较Cu更弱, 且[Cu2AgO3]2+的μ-O在RC结构中得电子水平低于[Cu3O3]2+的μ-O, 三核活性位中Ag的存在对应较低的μ-O bader电荷, 也更有利于甲烷H转移过程的发生.
| 表 4 [Cu2AgO3]2+与[Cu3O3]2+相应的RC、RI的Bader电荷 Table 4 Bader charges of [Cu2AgO3]2+ and [Cu3O3]2+ related RC and RI |
通过对[Cu2AgO3]2+-MAZ和[Cu3O3]2+-MAZ催化过程中各活性位和反应中间复合物的分波态密度分析MAZ负载的三核活性位中Ag的存在对各结构具体分子轨道的影响因素. 其中在RC到RI的反应过程中的分子轨道能级变化遵循Mahyuddin等[45]报道中的三核铜-氧活性位HAT机理. [Cu2AgO3]2+与[Cu3O3] 2+相应的RC、RI的pDOS图如图 9所示.

|
图 9 (a)[Cu3O3]2+的RC(b)[Cu2AgO3]2+的RC(c)[Cu3O3]2+的RI(d)[Cu2AgO3]2+的RI的pDOS图 Fig.9 The pDOS curve (a) RC of [Cu3O3]2+, (b) RC of [Cu2AgO3]2+, (c) RI of [Cu3O3]2+, (d) RI of [Cu2AgO3]2+ |
对[Cu2AgO3]2+和[Cu3O3]2+对应的RC和RI结构的pDOS图进行分析, 基于三核活性位的甲烷活化的HAT机理, 对图 9中C-H σ轨道的β自旋电子到O的β自旋最低未占据轨道的转化难易度进行分析. 由图 9的pDOS图可知, 对含Ag活性位的吸附态甲烷来说, C-H σ轨道β自旋电子与O2 β自旋电子的最高占据轨道能级差约为1.16 eV, 作为对比的不含异金属的活性位中该值为1.30 eV. 可以发现, 含Ag三核活性位的C-H σ轨道α自旋电子的最高占据轨道与RI的CH3 α自旋最高占据轨道的能级差约为2.52 eV, 作为对比的不含异金属的活性位中该值为2.55 eV. 这两组能级差的对比证明了三核活性位中Ag的存在使得甲烷C-H σ轨道的β电子更易跃迁至活性氧的β最低未占据轨道从而形成β最高占据轨道, 甲烷中α自旋的C-H σ轨道更易转化为甲基自由基的α自旋最高占据轨道, 而这两个过程能级差的降低对于甲烷C-H键的裂解和自由基中间体RI的生成都更有利. 此外, 含Ag三核活性位和不含异金属的活性位对应的RI中O2 β自旋电子最高占据轨道能量分别为-1.43和-1.21 eV, 说明Ag的存在能够降低三核活性位中活性氧的占据轨道能量, 从而使对应的反应中间体更加稳定. 上述结果与异金属三核活性位的甲烷活化过程能量计算结果得出的结论是一致的.
3 结论采用DFT研究方法, 以构建三核[Cu2MO3]2+-MAZ(M=Pd, Pt, Fe, Co, Ni, Au, Ag)活性位为前提, 优化并得出分别含7种异金属的三核铜-氧MAZ分子筛的结构性质, 通过对其形成能的计算结果比较了稳定性. 异金属三核活性位的形成能Ef与质子亲和能EH之间呈负线性拟合关系. 甲烷活化步骤的活化能垒和反应能量之间呈较弱的BEP关系. 在反应物及催化体系中不含萃取剂的情况下, 产物甲醇的脱附较困难. [Cu2MO3]2+中异金属Ag的存在有利于甲烷C-H键裂解和甲醇前体生成. 含异金属Au的三核活性位结构催化甲烷部分氧化的能量结果与不含异金属的活性位较为相近. 含异金属的三核活性位中, 质子亲和能与甲烷活化能垒的线性拟合结果较弱; 异金属三核活性氧的自旋密度与甲烷活化能垒之间几乎没有线性拟合关系, 该结果与Liu等[29]报道的MFI分子筛中的三核活性位的结果相近. 同时发现异金属Ag有利于降低活性位的活性氧负电荷, 这有利于甲烷H的转移; 从轨道能级差角度考虑, 异金属Ag有利于甲烷吸附态中甲烷C-H σ轨道β电子向活性位最低未占据轨道的跃迁, 从而有利于甲烷C-H键的裂解. 这两方面都能够进一步解释异金属Ag提高甲烷部分氧化反应性的影响机理.
| [1] |
Knorpp A J, Pinar A B, Newton M, et al. Copper-exchanged omega (MAZ) zeolite: Copper-concentration dependent active sites and its unprecedented methane to methanol conversion[J]. ChemCatChem, 2018, 10: 5593–5596.
DOI:10.1002/cctc.201801809 |
| [2] |
a. Zhou Y Y, Ling Z, Wang W Z. Direct functionalization of methane into ethanol over copper modified polymeric carbon nitride via photocatalysis[J]. Nat Commun, 2019, 10(1): 1-8. b. Wang Xin-yao(王馨瑶), Xu Lu-lu(徐禄禄), Zhang Wei-ping(张维萍). Catalytic performances of Mo/HZSM-5 zeolites in methane and methanol Co-aromatization after modification by tetrapropylammonium hydroxide(四丙基氢氧化铵改性Mo/HZSM-5催化甲烷甲醇共芳构化反应性能)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 425-435. |
| [3] |
Mahyuddin M H, Shiota Y, Yoshizawa K. Methane selective oxidation to methanol catalyzed by metal-exchanged zeolites: A review of active sites and their reactivity[J]. Catal Sci Technol, 2019, 9: 1744–1768.
DOI:10.1039/C8CY02414F |
| [4] |
Groothaert M H, Smeets P J, Sels B F, et al. Selective oxidation of methane by the bis(μ-oxo) dicopper core stabilized on ZSM-5 and mordenite zeolites[J]. J Am Chem Soc, 2005, 127: 1394–1395.
DOI:10.1021/ja047158u |
| [5] |
Wulfers M J, Teketel S, Ipek B, et al. Conversion of methane to methanol on copper-containing small-pore zeolites and zeotypes[J]. Chem Commun, 2015, 51: 4447–4450.
DOI:10.1039/C4CC09645B |
| [6] |
Park M B, Ahn S H, Mansouri A, et al. Comparative study of diverse copper zeolites for the conversion of methane into methanol[J]. ChemCatChem, 2017, 9: 3705–3713.
DOI:10.1002/cctc.201700768 |
| [7] |
Pappas D K, Borfecchia E, Dyballa M, et al. Methane to methanol: Structure-activity relationships for Cu-CHA[J]. J Am Chem Soc, 2017, 139: 14961–14975.
DOI:10.1021/jacs.7b06472 |
| [8] |
Ipek B, LoboR F. Catalytic conversion of methane to methanol on Cu-SSZ-13 using N2O as oxidant[J]. Chem Commun, 2016, 52(91): 13401–13404.
DOI:10.1039/C6CC07893A |
| [9] |
Mahyuddin M H, Staykov A, Shiota Y, et al. Roles of zeolite confinement and Cu-O-Cu angle on the direct conversion of methane to methanol by[Cu2(μ-O)]2+exchanged AEI, CHA, AFX, and MFI zeolites[J]. ACS Catal, 2017, 7(6): 3741–3751.
DOI:10.1021/acscatal.7b00588 |
| [10] |
Szécsényi A, Khramenkova E, Chernyshov I Y, et al. Breaking linear scaling relationships with secondary interactions in confined space: A case study of methane oxidation by Fe/ZSM-5 zeolite[J]. ACS Catal, 2019, 9: 9276–9284.
DOI:10.1021/acscatal.9b01914 |
| [11] |
Narsimhan K, Iyoki K, Dinh K T, et al. Catalytic oxidation of methane into methanol over copper-exchanged zeolites with oxygen at low temperature[J]. ACS Cent Sci, 2016, 2(6): 424–429.
DOI:10.1021/acscentsci.6b00139 |
| [12] |
Knorpp A J, Newton M A, Pinar A B, et al. Conversion of methane to methanol on copper mordenite: Redox mechanism of isothermal and high temperature activation procedures[J]. Ind Eng Chem Res, 2018, 57: 12036–12039.
DOI:10.1021/acs.iecr.8b01183 |
| [13] |
Wang X, Martin N, Nilsson J, et al. Copper-modified zeolites and silica for conversion of methane to methanol[J]. Catalysts, 2018, 8(11): 545–554.
DOI:10.3390/catal8110545 |
| [14] |
Mahyuddin M H, Yoshizawa K. DFT exploration of active site motifs in methane hydroxylation by Ni-ZSM-5 zeolite[J]. Catal Sci Technol, 2018, 8(22): 5875–5885.
DOI:10.1039/C8CY01441H |
| [15] |
Markovits M A C, Jentys A, Tromp M, et al. Effect of location and distribution of Al sites in ZSM-5 on the formation of Cu-oxo clusters active for direct conversion of methane to methanol[J]. Top Catal, 2016, 59: 1554–1563.
DOI:10.1007/s11244-016-0676-x |
| [16] |
Al-Shihri S, Richard C J, Al-Megren H, et al. Insights into the direct selective oxidation of methane to methanol over ZSM-5 zeolytes in aqueous hydrogen peroxide[J]. Catal Today, 2020, 353: 269–278.
DOI:10.1016/j.cattod.2018.03.031 |
| [17] |
Tomkins P, Mansouri A, Bozbag S E, et al. Isothermal cyclic conversion of methane into methanol over copper-exchanged zeolite at low temperature[J]. Angew Chem Int Ed, 2016, 55(18): 5467–5471.
DOI:10.1002/anie.201511065 |
| [18] |
Szécsényi Agnes, Li G, Jorge G, et al. The mechanistic complexity of methane oxidation with H2O2 by "single-site" Fe/ZSM-5 catalyst[J]. ACS Catal, 2018, 8: 7961–7972.
DOI:10.1021/acscatal.8b01672 |
| [19] |
Kim Y, Kim T Y, Lee H, et al. Distinct activation of Cu-MOR for direct oxidation of methane to methanol[J]. Chem Commun, 2017, 53(29): 4116–4119.
DOI:10.1039/C7CC00467B |
| [20] |
Knorpp A J, Newton M A, Sushkevich V L, et al. The influence of zeolite morphology on the conversion of methane to methanol on copper-exchanged omega zeolite (MAZ)[J]. Catal Sci Technol, 2019, 9: 2806–2811.
DOI:10.1039/C9CY00013E |
| [21] |
Rosa A, Ricciardi G, Baerends E J. Is[FeO]2+ the active center also in iron containing zeolites? A density functional theory study of methane hydroxylation catalysis by Fe-ZSM-5 zeolite[J]. Inorg Chem, 2010, 49(8): 3866–3880.
DOI:10.1021/ic1000073 |
| [22] |
Jísa K, Nováková J, Schwarze M, et al. Role of the Fe-zeolite structure and iron state in the N2O decomposition: Comparison of Fe-FER, Fe-BEA, and Fe-MFI catalysts[J]. J Catal, 2009, 262(1): 27–34.
DOI:10.1016/j.jcat.2008.11.025 |
| [23] |
Mahyuddin M H, Staykov A, Shiota Y, et al. Direct conversion of methane to methanol by metal-exchanged ZSM-5 zeolite (Metal=Fe, Co, Ni, and Cu)[J]. ACS Catal, 2016, 6: 8321–8331.
DOI:10.1021/acscatal.6b01721 |
| [24] |
Tomkins P, Mansouri A, Sushkevich V L, et al. Increasing the activity of copper exchanged mordenite in the direct isothermal conversion of methane to methanol by Pt and Pd doping[J]. Chem Sci, 2019, 10: 167–171.
DOI:10.1039/C8SC02795A |
| [25] |
Wang G, Huang L, Chen W, et al. Rationally designing mixed Cu-(μ-O)-M (M=Cu, Ag, Zn, Au) centers over zeolite materials with high catalytic activity towards methane activation[J]. Phys Chem Chem Phys, 2018, 20: 26522–26531.
DOI:10.1039/C8CP04872J |
| [26] |
Grundner S, Markovits M A C, Li G, et al. Single-site trinuclear copper oxygen clusters in mordenite for selective conversion of methane to methanol[J]. Nat Commun, 2015, 6: 7546.
DOI:10.1038/ncomms8546 |
| [27] |
Mahyuddin M H, Tanaka T, Staykov A, et al. Dioxygen activation on Cu-MOR zeolite: Theoretical insights into the formation of Cu2O and Cu3O3 active species[J]. Inorg Chem, 2018, 57(16): 10146–10152.
DOI:10.1021/acs.inorgchem.8b01329 |
| [28] |
Palagin D, Knorpp A J, Pinar A B, et al. Assessing the relative stability of copper oxide clusters as active sites of a CuMOR zeolite for methane to methanol conversion: Size matters[J]. Nanoscale, 2017, 9: 1144–1153.
DOI:10.1039/C6NR07723D |
| [29] |
Liu C, Li G, Pidko E A. Property-activity relations for methane activation by dual-metal Cu-oxo trimers in ZSM-5 zeolite[J]. Small Methods, 2018, 2: 1800266.
DOI:10.1002/smtd.201800266 |
| [30] |
Kresse G, Hafner J. Ab initio molecular dynamics for open-shell transition metals[J]. Phys Rev B, 1993, 48(17): 13115–13118.
DOI:10.1103/PhysRevB.48.13115 |
| [31] |
Kresse G, Furthmüller J. Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J]. Comput Mater Sci, 1996, 6(1): 15–50.
DOI:10.1016/0927-0256(96)00008-0 |
| [32] |
Kresse G, Furthmüller J. Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set[J]. Phys Rev B, 1996, 54: 11169–11186.
DOI:10.1103/PhysRevB.54.11169 |
| [33] |
Kresse G, Joubert D. From ultrasoft pseudopotentials to the projector augmented-wave method[J]. Phys Rev B, 1999, 59(3): 1758–1775.
DOI:10.1103/PhysRevB.59.1758 |
| [34] |
Perdew J P, Burke K, Ernzerhof M. Generalized gradient approximation made simple[J]. Phys Rev Lett, 1998, 77(18): 3865–3868.
|
| [35] |
Grimme S, Antony J, Ehrlich S, et al. A consistent and accurate ab initio parametrization of density functional dispersion correction (DFT-D) for the 94 elements H-Pu[J]. J Chem Phys, 2010, 132(15): 154104.
DOI:10.1063/1.3382344 |
| [36] |
Grimme S, Ehrlich S, Goerigk L. Effect of the damping function in dispersion corrected density functional theory[J]. J Comput Chem, 2011, 32(7): 1456–1465.
DOI:10.1002/jcc.21759 |
| [37] |
Henkelman G, Arnaldsson A, Jónsson H. A fast and robust algorithm for Bader decomposition of charge density[J]. Comput Mater Sci, 2006, 36(3): 354–360.
DOI:10.1016/j.commatsci.2005.04.010 |
| [38] |
Sanville E, Kenny S D, Smith R, et al. Improved grid-based algorithm for Bader charge allocation[J]. J Comput Chem, 2010, 28(5): 899–908.
|
| [39] |
Bader R. Atoms in molecules: A quantum theory[J]. J Mol Struct, 1994, 360(1/3): 175–175.
|
| [40] |
Latimer A A, Kulkarni A R, Aljama H, et al. Understanding trends in C-H bond activation in heterogeneous catalysis[J]. Nat Mater, 2017, 16(2): 225–229.
DOI:10.1038/nmat4760 |
| [41] |
Brouwer D H, Brouwer C C, Mesa S, et al. Solid-state 29Si NMR spectra of pure silica zeolites for the International Zeolite Association Database of Zeolite Structures[J]. Micro Mes Mater, 2020, 297: 110000.
DOI:10.1016/j.micromeso.2020.110000 |
| [42] |
Breck D W. Zeolite Molecular Sieves: Structure, Chemistry, And Use[M]. New York: John Wiley & Sons, 1974.
|
| [43] |
Mahyuddin M H, Tanaka T, Shiota Y, et al. Methane partial oxidation over[Cu2(μ-O)]2+ and[Cu3(μ-O) 3] 2+ active species in large-pore zeolites[J]. ACS Catal, 2018, 8(2): 1500–1509.
DOI:10.1021/acscatal.7b03389 |
| [44] |
Momma K, Izumi F. VESTA3 for three-dimensional visualization of crystal, volumetric and morphology data[J]. J Appl Crystallogr, 2011, 44(6): 1272–1276.
DOI:10.1107/S0021889811038970 |
| [45] |
Mahyuddin M H, Staykov A T, Saputro A G, et al. Novel mechanistic insights into methane activation over Fe and Cu active sites in zeolites: A comparative DFT study using meta-GGA functionals[J]. J Phys Chem C, 2020, 124(33): 18112–18125.
DOI:10.1021/acs.jpcc.0c04991 |
 2021, Vol. 35
2021, Vol. 35


