2. 瑞科稀土冶金及功能材料国家工程研究中心, 内蒙古 包头 014030
2. National Engineering Research of Rare Earth Metallurgy and Functional Materials, Baotou 014030, China
柴油车排放的污染物主要包括一氧化碳(CO)、碳氢化合物(HC)、一氧化氮(NO)和颗粒物. 随着排放法规不断加严, 我国已开始实施重型柴油车污染物排放第六阶段(国六)法规. 为了降低污染物排放, 国六阶段主要采用的柴油车尾气后处理技术路线由几个部分组成, 包括柴油车氧化催化剂(diesel oxidation catalyst, DOC), 颗粒捕集器(diesel particulate filter, DPF)和选择性催化还原系统(selective catalytic reduction, SCR)[1-2]. 其中, DOC对常规气态物有非常明显的减排效果, 可氧化CO、HC、可溶性有机物(SOF)等, 还可将NO氧化为NO2, 有利于快速SCR反应和DPF被动再生[3-4].
目前, 商用DOC催化剂主要由贵金属活性组分、氧化铝(Al2O3)载体, 以及具有良好储氧能力的铈锆复合氧化物助剂组成[5-7]. 常见的DOC催化剂为负载铂(Pt)、钯(Pd)的双金属催化剂体系, Pd的添加可以有效抑制Pt颗粒的烧结[8-9]. 然而, 在真实工况下, 反复的高温还是容易导致贵金属逐渐烧结失活, 因此仍需要提高催化剂的热稳定性和低温活性. 研究表明, 氧化锆(ZrO2)用作催化剂载体可以提高催化剂的活性和稳定性. 例如, ZrO2改性SiO2负载Pt催化剂提高了Pt颗粒的分散性和热稳定性, Pt和ZrO2之间存在较强的相互作用, 从而提高Pt对CO的催化氧化活性. 同样, 对于ZrO2负载Pd催化剂, ZrO2的添加也可以提高Pd的分散度, 从而提高CO、C3H6的低温氧化活性以及催化剂的水热稳定性[10-12].
基于此, 我们制备了氧化铝、铈锆复合氧化物(Ce0.3Zr0.7O2)负载Pt、Pd的双金属催化剂用于柴油车尾气CO、HC、NO的氧化, 其中贵金属负载量仅为0.68%(质量分数). 通过添加氧化锆助剂优化催化剂性能, 并进一步研究了制备过程中焙烧温度对催化剂性能的影响. 得到添加氧化锆可以提高催化剂的低温氧化活性和热稳定性, 同时焙烧温度对催化剂活性和物理化学性质均有较大影响, 进而可以通过改变焙烧温度优化催化剂的性能, 为柴油车氧化催化剂的产业化应用提供理论依据.
1 实验部分 1.1 催化剂的制备以商用DOC催化剂为基础, 采用浸渍法制备负载Pt、Pd的双金属DOC催化剂, 其中贵金属总负载量为0.68%(质量分数), Pt∶Pd质量比例为2∶1. 将一定量的氧化铝(γ-Al2O3)和铈锆固溶体(Ce0.3Zr0.7O2)粉末(γ-Al2O3和Ce0.3Zr0.7O2的质量比为9∶1)加入去离子水中搅拌混合均匀, 依次向其中滴加硝酸铂(Pt(NO3)2)和硝酸钯(Pd(NO3)2)溶液, 室温搅拌浸渍1 h, 之后加入一定量的乙酸锆溶液(22%(质量分数))继续搅拌1 h. 于80 ℃恒温磁力搅拌至水分蒸干, 所得固体样品在110 ℃烘箱中干燥2 h, 放入马弗炉中一定温度下焙烧3 h. 得到的催化剂Pt-Pd-(x)ZrO2/ Ce0.3Zr0.7O2-Al2O3(x=0, 3%(质量分数))依次记作Pt-Pd/CZA, Pt-Pd-3Zr/CZA. 改变上述焙烧温度分别为550、600、700、800 ℃, 所得催化剂分别记作Pt-Pd/CZA-550、Pt-Pd/CZA-600、Pt-Pd/CZA-700、Pt-Pd/CZA-800, 依次类推.
1.2 催化剂的表征X射线粉末衍射(XRD)分析在Bruker D8 advance型X射线粉末衍射分析仪上进行测定, 辐射源为Cu Kα靶(λ=0.154 06 nm)射线, 扫描范围2θ=10°~90°, 步长为0.03°. 催化剂的比表面积、孔径分布和孔体积采用Micromeritics 2020 HD88型物理吸附仪进行测试, 测试前在200 ℃下真空脱气3 h进行预处理. 催化剂中贵金属的负载量由Aglient 5110型电感耦合等离子体发射光谱仪(ICP-OES)测定. X射线光电子能谱(XPS)分析通过Thermo Scientific K-Alpha进行测试, 测试在高真空条件下进行, Al Kα作为电子发射源, 各元素的结合能谱按C ls标准谱(284.6 eV)进行校正.
CO化学吸附在AutoChem II 2920通过脉冲法测定, 催化剂在450 ℃条件下3%(体积分数)H2/He气流中预处理30 min, 冷却至50 ℃, He气流吹扫10 min, 通入3%(体积分数)CO/He(60 mL/min)持续20 min测定吸附的CO. 随后He气流持续500 s吹扫物理吸附的CO, 再次通入3%(体积分数)CO/He进行第二次脉冲, 直至吸附饱和, 得到金属分散度. 金属分散度(D)是指催化剂表面金属原子与催化剂总金属原子数的比值, 计算公式如下:
| $ {\left. {D = \frac{{m \times {Q_{{\rm{总 }}}}}}{{1000 \times (W \times P/M}}} \right)} $ | (1) |
| $ \begin{array}{*{20}{l}} {}\\ {{Q_i} = \left( {{V_{loop{\rm{ }}}} - \frac{{{V_{loop{\rm{ }}}}}}{{{S_{loop{\rm{ }}}} \times {S_i}}}} \right)/22.4} \end{array} $ | (2) |
| $ Q_{\text {总 }}=\sum\limits_{1}^{n} Q_{i} $ | (3) |
上式中D为金属分散度, Qi为单次脉冲对CO的吸附量, 单位为mmol; Vloop为定量环标况下的体积, 单位为mL; Sloop为一次脉冲滴定(定量环气体没有被吸附)产生的峰面积, 其数值等于完整的脉冲滴定测试过程中最后两次脉冲滴定的峰面积的平均值; Q总为吸附的CO的总量, 单位为mmol; m为金属原子与吸附质气体(CO)的计量系数, 表示一个CO分子被m个金属原子吸附; W为催化剂的总质量, 单位为g; P为催化剂中所有金属的质量分数或负载量(%); M为金属的摩尔质量, 单位为g/mol.
活性金属的平均粒径计算公式如下:
| $ d=\frac{f \times 10^{4}}{\rho \times S_{M}} $ | (4) |
上式中d为活性金属平均粒径, 单位为nm; f为金属的形状系数(f=6); ρ为金属密度, 单位为g/m3; SM为活性金属比表面积, 单位m2/g, 计算公式如(5)所示.
| $ \mathrm{S}_{M}=\left[m \times \frac{Q_{总}}{1000} \times N_{0} \times S_{0} \times 10^{-18}\right] /(W P) $ | (5) |
其中m为金属原子与吸附质气体(CO)的计量系数; N0为阿伏伽德罗常数; S0为金属横截面积, 单位为nm2; W为催化剂的总质量, 单位为g; P为催化剂中所有金属的质量分数或负载量(%).
氢气程序升温还原(H2-TPR)测试在AutoChem1 II 2920分析仪上进行, 催化剂用量为50 mg, 以10 ℃/min从室温程序升温至300 ℃干燥预处理, He气流(50 mL/min)吹扫2 h, 冷却至50 ℃; 通入5%(体积分数)H2/Ar混合气(50 mL/min)30 min待基线稳定后, 样品在5%(体积分数)H2/Ar气流中以10 ℃/min的升温速率升至900 ℃脱附, 用TCD检测脱出气体.
1.3 催化剂活性评价催化剂的氧化性能评价在固定床反应器中进行, 催化剂评价装置具体如图 1所示. 将催化剂压片在0.450~0.280 mm过筛, 称取0.05 g装填于石英反应管中. 反应气体模拟柴油车尾气组成, 为0.05%(体积分数)NO, 0.018%(体积分数)C3H6, 0.02%(体积分数)CO, 10%(体积分数)O2, 8%(体积分数)CO2, 7%(体积分数)H2O, N2为平衡气. 混合气体流速为500 mL/min, 空速为300 000 h-1. 出口气体(CO、C3H6、NO、NO2)浓度通过Nicolet Antaris IGS50(Thermo Fisher Scientific, USA)红外气体分析仪检测得到. CO、C3H6与NO转化为NO2的转化率定义如下:

|
图 1 催化剂评价装置示意图 Fig.1 Schematic of catalyst activity evaluation device |
| $ \text { CO转化率 }=\left([\mathrm{CO}]_{\text {intlet }}-[\mathrm{CO}]_{\text {outlet }}\right) /[\mathrm{CO}]_{\text {intlet }} \times 100 \% $ | (6) |
| $ \mathrm{C}_{3} \mathrm{H}_{6} \text { 转化率 }=\left(\left[\mathrm{C}_{3} \mathrm{H}_{6}\right]_{\text {intlet }}-\left[\mathrm{C}_{3} \mathrm{H}_{6}\right]_{\text {outlet }}\right) /\left[\mathrm{C}_{3} \mathrm{H}_{6}\right]_{\text {intlet }} \times100\% $ | (7) |
| $ \text { NO转化率 }=\left[\mathrm{NO}_{2}\right]_{\text {outlet }} /[\mathrm{NO}]_{\text {intlet }} \times 100 \% $ | (8) |
其中, [CO]intlet、[C3H6]intlet、[NO]intlet为入口浓度; [CO]outlet、[C3H6]outlet、[NO2]outlet为出口浓度; NO转化率指NO转化为NO2的转化率.
2 结果与讨论 2.1 CO\HC\NO的氧化性能图 2为各催化剂对应的CO、C3H6和NO的转化率曲线, 由此得到的CO、C3H6的起燃温度(T50, 转化率为50%时的反应温度)、NO的最大转化率见表 1. 可以看到, 对于Pt-Pd/CZA催化剂, 焙烧温度从550提高至700 ℃, 催化剂对CO、C3H6和NO的氧化性能呈下降趋势, CO和C3H6的起燃温度分别从194和219 ℃升高至210和243 ℃, NO最大转化率从28%降至23%. 当焙烧温度升高至800 ℃, 催化剂对CO和C3H6的氧化活性有所恢复, T50(CO)和T50(C3H6)分别为195和215 ℃, 而NO的最大转化率继续降低至18%.
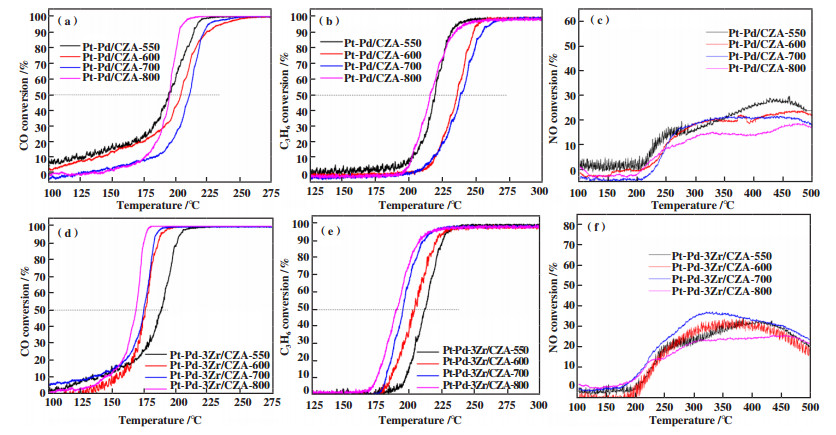
|
图 2 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA对CO、C3H6和NO的氧化性能 Fig.2 CO, C3H6 and NO oxidation activities of Pt-Pd/CZA and Pt-Pd-3Zr/CZA catalyst (a) CO conversion; (b) HC conversion; (c) NO conversion; (d) CO conversion; (e) HC conversion; (f) NO conversion to NO2 |
| 表 1 不同焙烧温度制备的Pt-Pd/CZA、Pt-Pd-3Zr/CZA的催化活性 Table 1 Activities of Pt-Pd/CZA and Pt-Pd-3Zr/CZA prepared at different calcination temperature |
与Pt-Pd/CZA相比, 添加3%(质量分数)ZrO2助剂后得到催化剂Pt-Pd-3Zr/CZA, 经过各个温度焙烧后对CO、C3H6和NO的氧化性能均有明显提高. 随着焙烧温度从550升高至800 ℃, 催化剂对CO、C3H6的氧化性能逐渐提高, T50(CO)和T50(C3H6)分别从187和211 ℃降低至168和189 ℃, 表现出优异的热稳定性. 催化剂对NO的氧化性能呈现先升高后降低的趋势, 当焙烧温度为700 ℃时, 催化剂对NO的氧化性能最佳, NO的最大转化率为36%. 同时也说明焙烧温度对催化剂性能有显著影响, 可以通过提高焙烧温度优化催化剂性能.
2.2 XRD分析图 3为催化剂Pt-Pd-3Zr/CZA的XRD谱图. 对比Al2O3的特征衍射峰(PDF# 10-0425), Pt-Pd-3Zr/CZA在29°、34°、49°和58°处的衍射峰归属于CeZrO2(PDF# 54-0017)[10]. 39.8°(111)、46.5°(200)、67.4°(220)和81.3°(311)处的衍射峰归属于Pt、Pd金属(PDF# 04-0802)[13]. 550 ℃焙烧处理后, 催化剂在39.8°处Pt和Pd(111)相的衍射峰很小, 提高焙烧温度, 衍射峰强度略有增加, 表明贵金属颗粒逐渐长大, 但是增长幅度很小, 可能是由于ZrO2的存在可以抑制贵金属颗粒烧结. 同时也说明焙烧温度不影响催化剂的晶体结构.
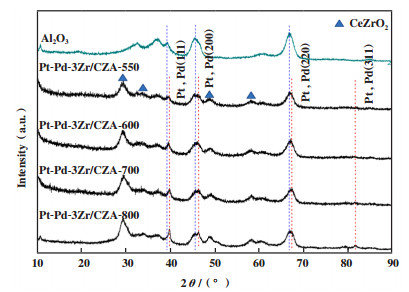
|
图 3 不同焙烧温度制备的Pt-Pd-3Zr/CZA的XRD谱图 Fig.3 XRD patterns of Pt-Pd-3Zr/CZA calcined at different temperatures |
催化剂的比表面积和孔结构通过N2吸附-脱附法测定得到, 结果列于表 2. 原料γ-Al2O3和Ce0.3Zr0.7O2的BET比表面积(SBET)分别为154.0和100.5 m2/g. 催化剂样品均为平均孔径13.9~14.9 nm的介孔结构. 经过550 ℃焙烧后, 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA的比表面积接近, 分别为153.8和151.7 m2/g. 提高焙烧温度, 催化剂的孔径变化较小, 二者的比表面积和孔体积均略有下降. 700 ℃焙烧后二者的比表面积降至最低, 分别为140.5和132.7 m2/g, 催化剂Pt-Pd-3Zr/CZA较Pt-Pd/CZA的比表面积更小, 可能是由于ZrO2的添加导致催化剂孔道在一定程度上堵塞. 继续提高焙烧温度至800 ℃, 比表面积稳定在140 m2/g左右, 整体上具有较好的热稳定性. 经过800 ℃高温处理后, 原料Ce0.3Zr0.7O2的比表面积降至85.6 m2/g, 而γ-Al2O3的比表面积变化很小, 高温焙烧后稳定性良好. 因此, 推测提高焙烧温度催化剂的比表面积减少主要是Ce0.3Zr0.7O2(载体中占比10%(质量分数))比表面积下降导致, 又因为催化剂中主要成分为稳定性良好的γ-Al2O3(载体中占比90%(质量分数)), 因而高温焙烧后催化剂整体的比表面积变化幅度较小并趋于稳定.
| 表 2 催化剂的比表面积、孔径、孔体积、贵金属分散度和平均颗粒粒径 Table 2 SBET, pore volume, pore diameter, metal dispersion and average particle size of catalysts |
催化剂表面的贵金属分散度通过CO化学吸附法测得[14-17], 结果见表 2. 可以看出, Pt-Pd/CZA和Pt-Pd-3Zr/CZA的贵金属分散度接近, 分别为39.9%和39.4%. 当焙烧温度从550提高至700 ℃, 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA的贵金属分散度逐渐降低, 700 ℃焙烧后贵金属分散度最低, 分别降至23.6%和29.5%. 二者的贵金属的分散度随焙烧温度的变化趋势均与比表面积的变化趋势一致, 推测分散度降低可能与比表面积下降有关[18]. 同时结合XRD表征结果, 提高焙烧温度, 贵金属颗粒有所长大, 导致分散度降低. 然而, 800 ℃焙烧后, Pt-Pd/CZA的分散度提高至38.4%, 而Pt-Pd-3Zr/CZA的分散度提高至52.2%. 根据文献[19-20], 经过高温(800 ℃)处理后, 催化剂中的部分贵金属颗粒由于团聚而长大, 此时催化剂中金属颗粒的粒径分布通常呈现“双峰”的分布情况, 即粒径较大的金属颗粒与粒径更小的颗粒共存. 这些独立的、粒径更小的Pt、Pd颗粒, 由于具有更大的比表面积, 有利于在催化剂表面提供原子级分散的贵金属粒子(Pt4+/ Pt2+), 从而易于被还原形成具有更高活性的金属态的活性物种, 提高氧化活性. 此外, 提高焙烧温度后Pt-Pd-3Zr/CZA的贵金属分散度较Pt-Pd/CZA有所提高, 可能是由于ZrO2的添加减弱了贵金属和氧化铈物种之间的相互作用(PM-O-Ce), 从而促进了金属态的Pt、Pd的形成, 提高了分散度. 对应得到贵金属颗粒的平均粒径同样列于表 2, 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA的贵金属颗粒的平均粒径均较小, 分别为2.3~2.7和1.9~2.2 nm, 后者的粒径更小.
2.4 XPS分析XPS分析了催化剂中Pt、Pd、O元素的化学价态和含量. 催化剂Pt-Pd-3Zr/CZA的Pt 4f谱图如图 4(a)所示. 根据文献[21-24]报道, Pt 4f轨道峰裂变为4f7/2和4f5/2. 其中, 71.2~74.3、72.4~75.3和74.9~77.8 eV分别归属于Pt0、Pt2+和Pt4+; Al 2p轨道峰的结合能为74.3~75.5 eV. 由此可见, Al 2p和Pt 4f轨道峰相互重叠. 通过分峰拟合, 得到结合能74.4 eV的峰归属于Al2O3, 74.9和77.8 eV处的两个峰归属于Pt4+, 表明表面Pt主要以PtO2物种形式存在. 据此拟合得到不同焙烧温度制备的Pt-Pd-3Zr/CZA的Pt 4f价态峰如图 4(b)所示. 图 4(c)为轨道峰相互重叠的Pd 3d和Zr 3p谱图. 拟合后, 结合能336.8~342.1 eV的轨道峰分别归属于Pd2+的3d5/2和3d3/2, 表明催化剂表面的Pd物种主要为PdO. 图 4(d)为O 1s轨道峰的谱图. 根据文献[25-26], 531.0~531.6 eV和532.8~533.0 eV分别归属于表面化学吸附氧(或者表面羟基氧, 记作Oα)和吸附水等氧物种(记作Oα′), 529.5~530.0 eV归属于催化剂中的晶格氧物种(记作Oβ). 表面化学吸附氧由于具有较高的氧迁移率, 从而具有较高的活性, 有利于氧化反应的进行.
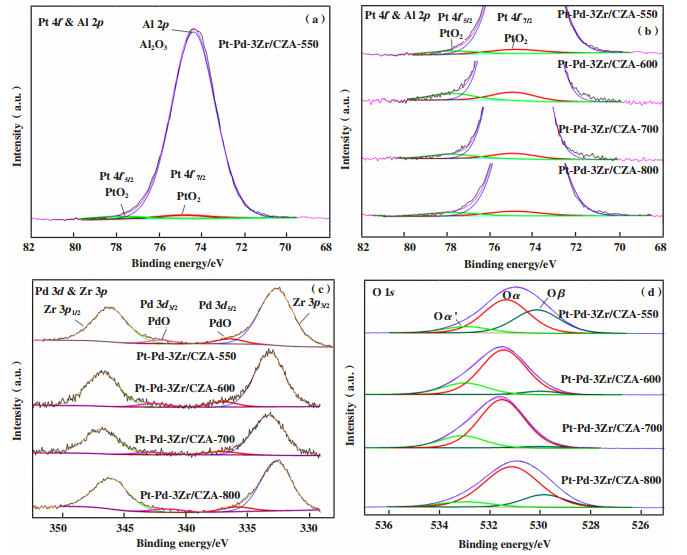
|
图 4 不同焙烧温度制备的Pt-Pd-3Zr/CZA的XPS谱图 Fig.4 XPS spectra of Pt-Pd-3Zr/CZA calcined at different temperature |
拟合定量得到各元素不同价态的含量, 结果列于表 3. 与金属分散度类似, 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA表面的Pt、Pd物种的含量同样呈现先降低后增加的趋势. 当焙烧温度从550升高至800 ℃, Pt和Pd物种的含量分别从0.10%和0.12%下降至0.06%和0.07%, 之后逐渐增加至0.08%和0.14%. ICP-OES表征得到两种催化剂中贵金属粒子的本体含量, 为了分析不同焙烧温度得到的各催化剂表面金属粒子的分布情况, 计算得到金属粒子表面与本体含量的比值见表 3. 可以看到, 同Pt、Pd物种表面浓度的变化趋势类似, 焙烧温度从550升高至700 ℃, 金属粒子的表面含量与本体含量的比值逐渐降低, 800 ℃焙烧后又有所提高. 而表面化学吸附氧含量呈现先增加后降低的趋势. 对于Pt-Pd/CZA, 焙烧温度从550升高至600 ℃, 表面化学吸附氧含量从51.7%增加至84.8%, 之后随焙烧温度升高逐渐降低至52.4%(800 ℃). 对于Pt-Pd-3Zr/CZA, 焙烧温度从550升高至700 ℃, 表面化学吸附氧含量从53.0%增加至78.1%, 之后继续升高至800 ℃时降低至73.5%. 根据上述分析, 高温800 ℃处理诱导催化剂中金属氧化物颗粒的还原, 产生更多金属态的Pt、Pd, 同时金属和氧化铈载体之间的相互作用减弱, 导致表面活性氧含量有所降低.
| 表 3 XPS和H2-TPR结果 Table 3 XPS and H2-TPR results |
催化剂的还原性质通过H2-TPR表征得到, 如图 5所示. 催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA经过550 ℃焙烧后产生3个还原峰, 161~172 ℃归属于表面Pd、Pt物种以及表面有相互作用的Pt-O-Ce的还原; 360~378 ℃归属于与CeO2相互作用的体相PdO、PtO2金属氧化物的还原以及表面CeO2的还原峰, 697~719 ℃归属于体相CeO2的还原峰[27-28]. 提高焙烧温度至600和700 ℃, 催化剂Pt-Pd/CZA在378 ℃较宽的还原峰变为两个小峰, 可能是由于PdO、PtO2与CeO2的相互作用增强导致归属于此的还原峰增强. 继续提高焙烧温度至800 ℃, 有利于还原形成金属态的Pd、Pt物种, 减弱了PM-O-Ce相互作用, 因此催化剂又呈现3个还原峰.

|
图 5 不同焙烧温度制备的催化剂Pt-Pd/CZA和Pt-Pd-3Zr/CZA的H2-TPR曲线 Fig.5 H2-TPR profiles of Pt-Pd/CZA and Pt-Pd-3Zr/CZA calcined at different temperature |
定量得到各催化剂的耗氢量同样见表 3. 耗氢量与催化剂的活性氧物种有关, 增加活性氧物种有利于提高催化剂的氧化性能[29]. 焙烧温度从550升高至800 ℃, Pt-Pd/CZA的耗氢量从32.6逐渐减小至22.6 cm3/gcat. Pt-Pd-3Zr/CZA的耗氢量随焙烧温度的变化很小, 呈现先增加后减少的趋势, 700 ℃焙烧时耗氢量最大, 为22.0 cm3/gcat. 结合催化剂的氧化活性评价结果, 耗氢量的变化趋势与NO的最大转化率的变化趋势一致, 表明催化剂的还原性能一定程度上对活性有影响, 但是总体上Pt-Pd-3Zr/CZA较Pt-Pd/CZA耗氢量有所下降, 说明还原性能不是影响催化剂活性的唯一或主要因素.
2.6 焙烧温度的影响上述结果表明, 制备过程中焙烧温度对得到的催化剂氧化活性和物理化学性质均产生较大影响. 根据文献[30-32], 贵金属分散度、表面活性氧, 贵金属的还原能力等都是影响贵金属催化剂氧化性能的主要因素. 因此, 图 6关联了催化剂对C3H6、NO的氧化性能与贵金属分散度、表面化学吸附氧含量、催化剂还原能力等物理化学性质的关系. 为了方便说明, 以C3H6的T50值和NO的最大转化率作为催化剂对C3H6和NO的氧化性能评价指标, 同时由于代表CO和C3H6转化性能的T50值随焙烧温度的变化趋势一致, 此处仅以C3H6为例进行阐述.
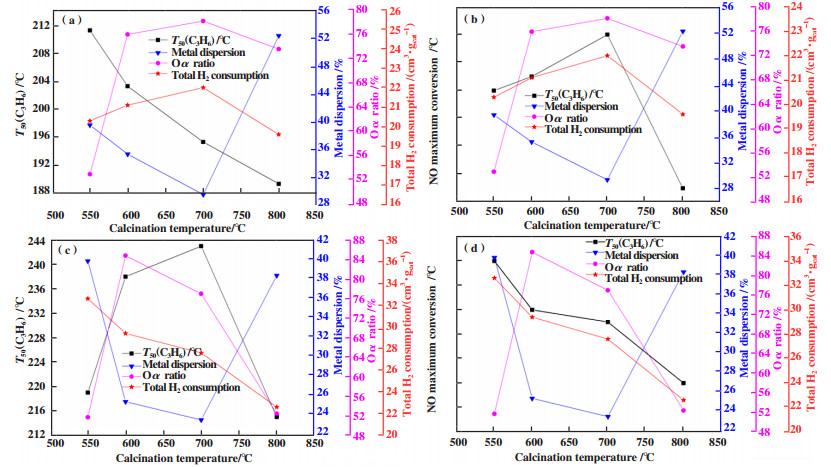
|
图 6 催化剂Pt-Pd-3Zr/CZA(a, b)、Pt-Pd/CZA(c, d)对C3H6、NO的氧化性能以及物理化学性质随焙烧温度的变化关系 Fig.6 T50 (C3H6), maximum NO conversion, and physical-chemistry properties of Pt-Pd-3Zr/CZA (a, b) and Pt-Pd/CZA (c, d) as a function of calcination temperature |
催化剂Pt-Pd-3Zr/CZA对C3H6的氧化活性与物理化学性质随焙烧温度的变化如图 6(a)所示. 可以看到, 焙烧温度从550升高至800 ℃, C3H6转化的T50值逐渐降低, 催化剂对C3H6的氧化性能逐渐提高; 表面化学吸附氧含量、耗氢量均呈现先增加后略减少的趋势(700 ℃最高), 当焙烧温度≤700 ℃时, 与C3H6的转化性能变化趋势一致, 表明表面活性氧、催化剂的还原能力对C3H6的氧化性能有一定影响; 贵金属分散度呈现先减小后增大的趋势(700 ℃最低), 当焙烧温度≤700 ℃时, 分散度与C3H6的转化性能变化趋势相反, 焙烧温度升高至800 ℃, C3H6转化性能最佳, 此时贵金属分散度最大, 表明贵金属分散度也在一定程度上影响着催化剂对C3H6的氧化性能.
结合文献进一步分析上述物理化学性质如何影响催化剂对C3H6的氧化性能. 根据报道[7, 15, 33], 催化剂表面的活性氧有利于对反应物种及中间产物的吸附, 从而促进反应中间产物的形成, 而表面分散的贵金属物种通过氧化作用消耗中间产物, 最终催化剂表现的氧化性能是由表面羟基氧控制的中间产物生成速率和由表面贵金属物种控制的中间产物消耗速率协同竞争的结果. 在图 6(a)中, 催化剂Pt-Pd-3Zr/CZA的贵金属分散度和表面活性氧含量随焙烧温度的变化整体上呈现镜面对称. 焙烧温度≤700 ℃时, 贵金属分散度逐渐降低、表面化学吸附氧含量逐渐增加, 此时C3H6的转化性能逐渐提高的原因可能是, 中间产物的生成速率低于消耗速率, 反应以表面活性氧控制的中间产物生成为主导, 因此催化剂对C3H6的氧化性能随表面活性氧含量增加而提高; 焙烧温度升高至800 ℃时, 转化率进一步提高是由于此时活性氧物种减少, 中间产物生成速率降低, 而贵金属分散度明显提高, 加快了中间产物的消耗, 促进了C3H6的转化.
类似地, 催化剂Pt-Pd/CZA对C3H6的氧化活性随焙烧温度的变化如图 6(c)所示. 当焙烧温度从550升高至800 ℃, 催化剂对C3H6的氧化性能先降低后提高(550和800 ℃相当), 贵金属分散度先减小后增大(700 ℃最低), 与C3H6的转化性能变化趋势一致, 进一步说明C3H6的转化很可能受到贵金属分散度的影响; 表面化学吸附氧含量先增加后减少, 整体与贵金属分散度变化趋势相反, 与C3H6的转化性能相反. 总耗氢量逐渐减少, 当焙烧温度≤ 700 ℃时, 耗氢量与C3H6的转化性能一致. 根据上述分析, 当焙烧温度从550升高至700 ℃, 催化剂中表面化学吸附氧含量提高, 而贵金属分散度明显降低. C3H6的转化性能逐渐下降的原因可能是, 此时表面化学吸附氧主导的中间产物的生成速率高于由表面贵金属物种控制的中间产物消耗速率, 导致中间物种的累积, 而且此时由于反应以中间产物的消耗为主导, 因此C3H6的转化性能随贵金属分散度逐渐降低而下降; 当焙烧温度继续升高至800 ℃, 贵金属分散度提高, 而表面活性氧含量降低, 均与550 ℃焙烧时相当, 此时由贵金属物种控制的中间产物的消耗速率提高, 同时由表面活性氧控制的中间产物的生成速率下降, 因此C3H6转化性能明显提升并接近550 ℃焙烧后样品的性能.
催化剂Pt-Pd-3Zr/CZA对NO的氧化性能与物理化学性质随焙烧温度的变化分别如图 6(b)所示. 当焙烧温度从550升高至800 ℃, 催化剂Pt-Pd-3Zr/CZA对NO的最大转化率先增大后降低(700 ℃最佳), 与贵金属分散度的变化趋势相反, 与表面化学吸附氧含量、耗氢量的变化趋势一致, 表明NO的转化可能主要受到表面活性氧、催化剂还原能力的影响. 同时根据文献报道[1-2], C3H6的存在也会抑制NO的氧化, 这是由于二者在活性位上存在吸附竞争. 因此, 当焙烧温度≤ 700 ℃时, 一方面由于表面化学吸附氧含量、还原性能提高, 另一方面, C3H6的转化性能逐渐提高, 对NO氧化的抑制减弱, 从而NO的转化性能逐渐提高; 当焙烧温度升高至800 ℃, 虽然C3H6的转化性能进一步提高, 但此时表面化学吸附氧含量、还原性能均降低, 影响了NO的转化.
类似地, 对于催化剂Pt-Pd/CZA, 由图 6(d)可得, 焙烧温度从550升高至800 ℃, NO的最大转化率逐渐降低, 与焙烧温度≤700 ℃时贵金属分散度的变化趋势一致, 表明NO的转化可能也受到贵金属分散度的影响. 与焙烧温度≤700 ℃时表面化学吸附氧含量的变化趋势相反; 与总耗氢量变化一致. 因此, 当焙烧温度≤ 700 ℃时, 虽然表面化学吸附氧含量增加, 但因为此时C3H6的转化性能下降, 抑制了NO的氧化, 同时催化剂的还原性能也有所下降, 导致了NO的氧化性能逐渐降低; 当焙烧温度升高至800 ℃, 虽然C3H6的转化性能有所提高, 但表面化学吸附氧含量、还原性能下降明显, 导致NO的转化性能进一步降低.
综上, 催化剂对C3H6、NO氧化性能受到贵金属分散度、表面活性氧物种, 以及催化剂还原性能共同作用的影响, 而制备过程中焙烧温度会影响上述物理化学性质, 从而影响催化剂的氧化性能.
3 结论研究了添加3%ZrO2助剂对DOC催化剂性能的影响, 并进一步考察焙烧温度的影响, 优化催化剂性能, 分析后得到如下结论:
(1)催化剂活性评价结果表明, 添加ZrO2助剂可以提高催化剂的氧化性能, 并且焙烧温度对催化剂的氧化性能有较大的影响. 提高焙烧温度, 催化剂Pt-Pd-3Zr/CZA对CO、C3H6的转化性能逐渐提高, 焙烧温度为800 ℃时性能最佳, 此时T50(CO)和T50(C3H6)值分别为174和195 ℃; 对NO的氧化性能呈现先升高后降低的趋势, 焙烧温度为700 ℃时NO转化率达到最大值, 此时最大转化率为36%, 催化剂表现出较好的热稳定性.
(2)催化剂的表征分析结果表明, 焙烧温度对催化剂的比表面积、表面Pt、Pd物种含量和表面化学吸附氧含量、贵金属分散度、还原能力等物理化学性质均有不同程度的影响, 而且催化剂对CO、C3H6、NO的氧化性能主要受到贵金属分散度、表面化学吸附氧含量、催化剂还原性质等共同作用的影响, 因此可以通过优化焙烧温度提高催化剂的氧化性能.
| [1] |
a. AL-Harbi M, Hayes R, Votsmeier M, et al. Competitive NO, CO and hydrocarbon oxidation reactions over a diesel oxidation catalyst[J]. Can J Chem Eng, 2012, 90(6): 1527-1538. b. Xie Wang-wang(谢旺旺), Zhou Guang-he(周广贺), Zhang Xiao-hong(张晓虹), et al. Research progress of attapulgite application in flue gas SCR denitration catalytic reaction(凹凸棒石在烟气SCR脱硝催化反应中的应用研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(6): 546-558. c. Li Ke-zhi(李柯志), Luo He(罗河), Zhao Ran(赵冉), et al. Research on the influence of calcined titanium dioxide to the newly-produced selective catalytic reduction catalyst and the mechanism(具焙烧服役史钛白粉对新制脱硝催化剂活性影响机制研究)[J]. J Mol Catal(China)(分子催化), 2020, 34(5): 415-424. |
| [2] |
a. Ding Xin-mei(丁心湄), Liang Yan-li(梁艳丽), Zhang Hai-long(张海龙), et al. Preparation of reduced Pt based catalysts with high dispersion and their catalytic performances for NO oxidation(高分散还原态Pt基催化剂的制备及其NO氧化的催化性能)[J]. Acta Phys-Chim Sin(物理化学学报), 2022, 38(4): 2005009. b. Qiao Ming(乔明), Zhang Ji-yi(张继义), Zong Lu-yao(宗路遥), et al. Research progress in catalytic denitrification performance: The catalyst type, preparation methods and activity(催化脱硝技术研究进展-催化剂的种类、制备方法及催化活性)[J]. J Mol Catal(China)(分子催化), 2020, 34(2): 165-181. |
| [3] |
Liang Yan-li, Huang Yu-fen, Zhang Hai-long, et al. Interactional effect of cerium and manganese on NO catalytic oxidation[J]. Environ Sci Pollut Res, 2017, 24(10): 9314–9324.
DOI:10.1007/s11356-017-8645-x |
| [4] |
Arvajová A B, Boutikos P, Pecinka R, et al. Global kinetic model of NO oxidation on Pd/γ-Al2O3 catalyst including PdOx formation and reduction by CO and C3H6[J]. Appl Catal B, 2020, 260: 118141.
DOI:10.1016/j.apcatb.2019.118141 |
| [5] |
Liang Yan-li, Ding Xin-mei, Zhao Ming, et al. Effect of valence state and particle size on NO oxidation in fresh and aged Pt-based diesel oxidation catalysts[J]. Appl Surf Sci, 2018, 443: 336–344.
DOI:10.1016/j.apsusc.2018.03.032 |
| [6] |
Atribak I, Guillén-Hurtado N, Bueno-López A, et al. Influence of the physico-chemical properties of CeO2-ZrO2 mixed oxides on the catalytic oxidation of NO to NO2[J]. Appl Surf Sci, 2010, 256(24): 7706–7712.
DOI:10.1016/j.apsusc.2010.06.042 |
| [7] |
Russell A, Epling W S. Diesel oxidation catalysts[J]. Catal Rev, 2011, 53(4): 337–423.
DOI:10.1080/01614940.2011.596429 |
| [8] |
Herreros J M, Gill S S, Lefort I, et al. Enhancing the low temperature oxidation performance over a Pt and a Pt-Pd diesel oxidation catalyst[J]. Appl Catal B, 2014, 147: 835–841.
DOI:10.1016/j.apcatb.2013.10.013 |
| [9] |
Kaneeda M, Iizuka H, Hiratsuka T, et al. Improvement of thermal stability of NO oxidation Pt/Al2O3 catalyst by addition of Pd[J]. Appl Catal B, 2009, 90(3/4): 564–569.
|
| [10] |
Kim M Y, Choi J S, Toops T J, et al. Coating SiO2 support with TiO2 or ZrO2 and effects on structure and CO oxidation performance of Pt catalysts[J]. Catalysts, 2013, 3(1): 88–103.
DOI:10.3390/catal3010088 |
| [11] |
Kim M Y, Kyriakidou E A, Choi J S, et al. Enhancing lowtemperature activity and durability of Pd-based diesel oxidation catalysts using ZrO2 supports[J]. Appl Catal B, 2016, 187: 181–194.
DOI:10.1016/j.apcatb.2016.01.023 |
| [12] |
Zhou Ying, Xu Chen-jun, Sheng Ye-qing, et al. Thermal stability of MnOxCeO2 mixed oxide for soot combustion: Influence of Al2O3, TiO2, and ZrO2 carriers[J]. RSC Adv, 2015, 5(111): 91734–91741.
DOI:10.1039/C5RA17328K |
| [13] |
Morlang A, Neuhausen U, Klementiev K V, et al. Bimetallic Pt/Pd diesel oxidation catalysts: Structural characterization and catalytic behavior[J]. Appl Catal B, 2005, 60(3/4): 191–199.
|
| [14] |
Zotin F M Z, Gomes O D F M, de Oliveira C H, et al. Auto-motive catalyst deactivation: Case studies[J]. Catal Today, 2005, 107: 157–167.
|
| [15] |
Feng Quan-chen, Zhao Shu, Xu Qi, et al. Mesoporous nitrogen-doped carbon-nanosphere-supported isolated single-atom Pd catalyst for highly efficient semihydrogenation of acetylene[J]. Adv Mater, 2019, 31(36): 1901024.
DOI:10.1002/adma.201901024 |
| [16] |
Kang S B, Hazlett M, Balakotaiah V, et al. Effect of Pt: Pd ratio on CO and hydrocarbon oxidation[J]. Appl Catal B, 2018, 223: 67–75.
DOI:10.1016/j.apcatb.2017.05.057 |
| [17] |
Auvray X, Olsson L. Stability and activity of Pd-, Pt-and Pd-Pt catalysts supported on alumina for NO oxidation[J]. Appl Catal B, 2015, 168: 342–352.
|
| [18] |
Wang Feng, Qi Guo-qin, Zhang Chuan-qi, et al. Na-promoted Pt/Al2O3 activity stability for the complete oxidation of HCHO at room temperature[J]. Catal Commun, 2020, 139: 105713.
DOI:10.1016/j.catcom.2019.105713 |
| [19] |
Kunwar D, Carrillo C, Xiong H, et al. Investigating anomalous growth of platinum particles during accelerated aging of diesel oxidation catalysts[J]. Appl Catal B, 2020, 266: 118598.
DOI:10.1016/j.apcatb.2020.118598 |
| [20] |
Yang Zheng-zheng, Li Jun, Zhang Hai-long, et al. Size-dependent CO and propylene oxidation activities of platinum nanoparticles on the monolithic Pt/TiO2-YOx diesel oxidation catalyst under simulative diesel exhaust conditions[J]. Catal Sci Technol, 2015, 5(4): 2358–2365.
DOI:10.1039/C4CY01384K |
| [21] |
Sun Meng-meng, Wang Su-ning, Li Yuan-shan, et al. Promotion of catalytic performance by adding W into Pt/ZrO2 catalyst for selective catalytic oxidation of ammonia[J]. Appl Surf Sci, 2017, 402: 323–329.
DOI:10.1016/j.apsusc.2016.12.241 |
| [22] |
LiangYan-li , Zhao Ming, Wang Jian-li, et al. Enhanced activity and stability of the monolithic Pt/SiO2-Al2O3 diesel oxidation catalyst promoted by suitable tungsten additive amount[J]. J Ind Eng Chem, 2017, 54: 359–368.
DOI:10.1016/j.jiec.2017.06.016 |
| [23] |
Hatanaka M, Takahashi N, Takahashi N, et al. Reversible changes in the Pt oxidation state and nanostructure on a ceria-based supported Pt[J]. J Catal, 2009, 266(2): 182–190.
DOI:10.1016/j.jcat.2009.06.005 |
| [24] |
Galisteo F C, Mariscal R, Granados M L, et al. Reactivation of sintered Pt/Al2O3 oxidation catalysts[J]. Appl Catal B, 2005, 59(3/4): 227–233.
|
| [25] |
Fang Jun, Bi Xin-zhen, Si De-jun, et al. Spectroscopic studies of interfacial structures of CeO2-TiO2 mixed oxides[J]. Appl Surf Sci, 2007, 253(22): 8952–8961.
DOI:10.1016/j.apsusc.2007.05.013 |
| [26] |
Wu Zhong-biao, Jin Rui-ben, Liu Yue, et al. Ceria modified MnOx/TiO2 as a superior catalyst for NO reduction with NH3at low-temperature[J]. Catal Commun, 2008, 9(13): 2217–2220.
DOI:10.1016/j.catcom.2008.05.001 |
| [27] |
Huang Yu-fen(黄于芬), Zhang Hai-long(张海龙), Yang Zheng(杨铮), et al. Effects of CeO2 addition on improved NO oxidation activities of Pt/SiO2-Al2O3 diesel oxidation catalysts(CeO2的添加对柴油车氧化催化剂Pt/SiO2-Al2O3的NO氧化性能提高的影响)[J]. Acta Phys-Chim Sin(物理化学学报), 2017, 33(6): 1242–1252.
|
| [28] |
Ding Xin-mei, Qiu Jing, Liang Yan-li, et al. New insights into excellent catalytic performance of the Ce-modified catalyst for NO oxidation[J]. Ind Eng Chem Res, 2019, 58(19): 7876–7885.
DOI:10.1021/acs.iecr.9b00415 |
| [29] |
Wang Yan(王艳), Li Zhao-qiang(李兆强), Zhang Cheng(张丞), et al. Influence of CeO2 contents on the SCR performance of commercial rare earth catalysts(CeO2含量对柴油机商用稀土SCR催化剂脱硝性能的影响)[J]. Chem Ind Eng Prog(化工进展), 2020, 39(7): 2662–2669.
|
| [30] |
Li Yao-bin, Zhang Chang-bin, He Hong. Significant enhancement in activity of Pd/TiO2 catalyst for formaldehyde oxidation by Na addition[J]. Catal Today, 2017, 281: 412–417.
DOI:10.1016/j.cattod.2016.05.037 |
| [31] |
Zhang Chang-bin, Li Yao-bin, Wang Ya-fei, et al. Sodium-promoted Pd/TiO2 for catalytic oxidation of formaldehyde at ambient temperature[J]. Environ Sci Technol, 2014, 48(10): 5816–5822.
DOI:10.1021/es4056627 |
| [32] |
Wang Lei, Yue Hai-qing, Hua Ze-lin, et al. Highly active Pt/NaxTiO2 catalyst for low temperature formaldehyde decomposition[J]. Appl Catal B, 2017, 219: 301–313.
DOI:10.1016/j.apcatb.2017.07.073 |
| [33] |
Chen Fei, Wang Feng, Li Qing, et al. Effect of support (Degussa P25 TiO2, anatase TiO2, γ-Al2O3, and AlOOH) of Pt-based catalysts on the formaldehyde oxidation at room temperature[J]. Catal Commun, 2017, 99: 39–42.
DOI:10.1016/j.catcom.2017.05.019 |
 2021, Vol. 35
2021, Vol. 35


