2. 中国科学院大学, 北京 100049;
3. 中国科学院兰州化学物理研究所 苏州研究院, 江苏 苏州 215123
2. University of Chinese Academy of Sciences, Beijing 100049, China;
3. Suzhou Research Institute of LICP, Chinese Academy of Sciences, Suzhou 215123, China
乙酸(或醋酸)是一种重要的有机化工产品, 主要用于合成醋酸乙烯(EVA)、对苯二甲酸(PTA)、醋酸酐、醋酸酯以及氯乙酸等产品. 此外, 在纺织、医药、橡胶、印染、农药、电子以及食品等领域也具有广泛的用途. 据统计, 2018年全球醋酸的消费量为1.4373×107 t, 其中我国消费量为6.593×106 t, 约占总消费量的45.9%, 预计到2023年全球醋酸消费量将达到约1.6890×107 t [1].
目前, 醋酸的生产技术主要有以下几种方法:乙醛氧化法、甲醇羰化法、乙烯氧化法以及乙烷直接氧化法等[2-3]. 其中, 甲醇羰化法生产的醋酸占醋酸总产能的90%以上, 但是该工艺繁琐、投资成本高, 并且所使用的催化剂中含有碘化物具有毒性和腐蚀性[4]. 因此, 需要寻找新的工艺技术. 日本Showa Denko公司采用负载型钯、杂多酸催化剂, 开发出乙烯直接氧化制醋酸新工艺, 并于1997年建成一套产能为1×105 t/a的工业生产装置[5]. Mo、V是低碳烷烃选择氧化制含氧化合物工业催化剂中常用的组分, 如正丁烷制顺酐、丙烷氧化制丙烯酸、丙烷氨氧化制丙烯腈等, 因而在乙烷选择氧化反应中被广泛研究. 1978年Thorsteinson等[6]报道了Mo-V催化剂、在加压条件下将乙烷直接氧化生成乙酸, 由此开启了乙烷选择氧化制备乙酸的研究. 几种典型的乙酸合成工艺列于表 1, 除乙烷氧化路线外, 其余均已工业化应用.
| 表 1 乙酸生产工艺的对比 Table 1 Comparison of acetic acid production technology |
乙烷大量存在于天然气和页岩气中, 随着页岩气革命开始以及天然气开采速度增加, 乙烷资源越来越丰富, 因此乙烷选择氧化反应成为高效利用这些资源的有效途径. 这一过程减少了对传统能源的依赖, 成为缓解资源短缺、实现低碳烷烃高附加值利用的重要技术. 尽管近几十年, 人们一直不断努力改进乙烷氧化制乙酸催化体系, 但到目前为止, 乙酸单程收率依然很低, 尚未实现工业应用. 我们主要针对乙烷选择氧化制乙酸反应, 介绍了催化剂、反应动力学以及反应机理的研究进展, 并对未来发展进行了展望. 希望能对进一步开发高效催化剂、缩短工业化差距提供一些参考.
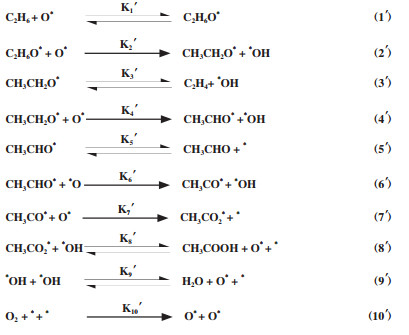
1 乙烷选择氧化制乙酸反应概述乙烷选择氧化制乙酸是利用乙烷和氧气(或空气), 在200~300 ℃、加压条件下直接生成乙酸, 反应体系中通常加入水蒸气来提高乙酸的选择性. 一般地, 乙烷先发生脱氢反应生成乙烯, 乙烯再氧化生成乙酸, 如式(2-3). 并且反应过程常常伴随一些副反应发生, 如式(4-10)所示. 乙烷没有孤对电子、对称性高、分子极性小, 在高温下才能有效活化, 而中间产物乙烯活性较高, 在反应中容易发生深度氧化(COx), 从而降低目标产物乙酸的选择性. 从热力学上来看, 乙烷C-H键的键能为419.5 kJ/mol, 而C-C键的键能为345.6 kJ/mol[7], 说明高温下乙烷更容易与氧气发生裂解反应. 为了提高乙酸的收率, 研究者对催化剂的组成、结构进行不断优化. 此外, 通过控制反应条件, 如温度、压力及原料组成等, 也可以不同程度改善产物的选择性. 然而, 要想获得满意的乙酸收率, 依然具有很大的挑战.
| $ {{{\rm{C}}_2}{{\rm{H}}_6} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{H}}_3}{\rm{COOH}}} $ | (1) |
| $ {{{\rm{C}}_2}{{\rm{H}}_6} \to {{\rm{C}}_2}{{\rm{H}}_4} + {{\rm{O}}_2}} $ | (2) |
| $ {{{\rm{C}}_2}{{\rm{H}}_4} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{H}}_3}{\rm{COOH}}} $ | (3) |
| $ {{{\rm{C}}_2}{{\rm{H}}_6} + {{\rm{O}}_2} \to {\rm{CO}} + {{\rm{H}}_2}{\rm{O}}} $ | (4) |
| $ {{{\rm{C}}_2}{{\rm{H}}_6} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}}} $ | (5) |
| $ {{{\rm{C}}_2}{{\rm{H}}_4} + {{\rm{O}}_2} \to {\rm{CO}} + {{\rm{H}}_2}{\rm{O}}} $ | (6) |
| $ {{{\rm{C}}_2}{{\rm{H}}_4} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}}} $ | (7) |
| $ {{\rm{C}}{{\rm{H}}_3}{\rm{COOH}} + {{\rm{O}}_2} \to {\rm{CO}} + {{\rm{H}}_2}{\rm{O}}} $ | (8) |
| $ {{\rm{C}}{{\rm{H}}_3}{\rm{COOH}} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{O}}_2} + {{\rm{H}}_2}{\rm{O}}} $ | (9) |
| $ {{\rm{CO}} + {{\rm{O}}_2} \to {\rm{C}}{{\rm{O}}_2}} $ | (10) |
Union Carbide于20世纪80年代开发了以乙烷和乙烯为原料的乙烷氧化制乙酸工艺(Ethoxene工艺), 其缺点是产物中存在大量乙烯. 2001年, Sabic曾计划在沙特阿拉伯建一套3×104 t/a的乙烷直接氧化制乙酸装置. 根据他们专利报道, 使用Mo-V-Ln-Nb-Pd-X(X=Al、Ga、Ge或Si)作为催化剂, 在280 ℃、1.38 MPa、C2H6∶O2∶N2∶H2O=40∶8∶32∶20反应条件下, 乙烷转化率为10%, 乙酸选择性可以达到85%[8]. 此外, 他们还通过掺杂不同元素对催化剂进行改性, 但是催化活性没有获得明显提高[9-12]. 虽然乙烷直接氧化制乙酸技术路线很吸引人, 但是目前开发的催化剂对乙烷的活化能力有限, 并且乙酸的选择性达不到生产要求, 因此没有得到工业化应用. 针对乙烷直接氧化制乙酸技术, Smejkal等[13]利用Aspen软件模拟整个工艺流程, 并将其与已工业化的技术相比, 发现新技术具有工艺简单、产热量高、投资成本低等优势. 如果能将该过程中乙酸的选择性提高到90%, 乙烷直接氧化制乙酸技术将具有更大的工业应用前景.
2 催化剂乙烷选择氧化反应一般遵循Mars-Van-Krevelen机理, 乙烷氧化过程涉及反应物分子吸附、活化、脱H、插氧等步骤, 需要催化剂具有酸性、氧化还原等性质协同配合完成氧化反应, 因此明确催化剂中每种元素的作用对理解反应机理和指导催化剂设计具有重要的作用. 目前, 乙烷选择氧化常用的催化剂有杂多酸、钒磷氧化物以及多金属氧化物, 不难发现这些催化剂中都含有相同的元素(V). 这是由于V的电子结构中含有部分可填充的d轨道, 存在多种氧化态(V2+-V5+)具有较强的氧化还原能力, 且其d轨道可与相邻氧原子的p轨道发生重叠, 有利于活化氧分子[14]. 催化剂失去晶格氧产生氧空位, 会引起氧多面体重排从而占据更多的空间, 有利于活性氧插入烯烃分子[15]. 此外, 助剂掺杂会对催化剂的结构、酸碱性、氧化还原等性质产生影响, 所以助剂的选择对提高反应性能具有重要的作用. 多金属氧化物经历高温焙烧处理, 在反应过程中表现出很好的热稳定性. 因此, Mo-V催化体系逐渐成为乙烷氧化制乙酸反应的研究热点.
2.1 杂多化合物催化剂(HPC)杂多酸是由杂原子(如P、Si、Fe、Co等)和多原子(如Mo、W、V、Nb、Ta等)按照特定的结构通过氧原子配位桥联形成的含氧多酸. 由于具有酸性和氧化还原双功能性质, 其在烷烃选择氧化反应中受到了广泛的关注. 但是, 这类催化剂最大的缺点是热稳定性差, 在高温下往往会逐渐分解造成催化剂活性下降[16]. 近年来, 研究人员经过大量研究发现, 对杂多酸进行改性不仅能提高催化剂的热稳定性, 同时可以改善催化剂的活性、提高产物的选择性[17]. Hong等[18]首次报道了杂多酸催化剂用于乙烷选择氧化反应, 结果表明使用不同氧化剂都可以生成乙烯和乙醛. Kirillova等[19]对比含V和不含V的HPC催化剂, 发现在进行乙烷氧化时都会有乙酸生成.
Sopa等[20]将HPMoV杂多酸分别负载于SiO2、TiO2和Al2O3载体, 考察载体对乙烷选择氧化性能的影响. 结果表明, 在相对温和的反应条件下(250~300 ℃), 以TiO2作为载体的HPMoV/TiO2催化剂具有最好的催化活性和乙酸收率, 这是由于TiO2能够从表面释放氧形成氧空位从而提高活性. 并且通过FT-IR发现, 除了HPMoV/Al2O3, HPMoV/SiO2和HPMoV/TiO2催化剂都可以保持HPA的Keggin结构, 这是由于酸性载体表面存在OH可以与杂多酸表面的酸质子相互作用提高催化剂的稳定性, 而碱性载体表面的碱中心会破坏Keggin结构. 除此之外, 还发现Keggin结构中引入V可以提高活性和催化剂的稳定性. Tungatarova等[21]也发现载体的加入不会改变H4SiMo12O40催化剂的Keggin结构, 同时可以提高催化剂的稳定性.
Galownia等[22]采用Nb、吡啶修饰的NbPMo12Pyr和NbPMo11VPyr杂多酸催化剂, 可实现常压下乙烷向乙烯和乙酸的转化. 并且只有Nb和吡啶同时存在才能提高反应活性和选择性. 催化剂中的Nb可以通过改变催化剂的酸度、改善位点的分散性以及氧化还原中心的分布、提高活性位点的稳定性, 从而提高乙烷的氧化能力[23-24]. 除此之外, 反应过程中加入水, 有助于乙酸的解吸从而提高选择性.
2.2 钒磷氧催化剂(VPO)VPO催化剂作为一种复合氧化物催化剂, 被广泛应用于烷烃的选择性氧化反应, 特别是C2-C4烷烃的选择性氧化. 到目前为止, VPO催化剂是正丁烷选择氧化制顺酐工业上最有效的催化剂[25]. 此外, VPO在丙烷氧化生成丙烯酸的反应中也有广泛的研究[26]. 随着低碳烷烃(C4-C2)中碳数的减少, VPO催化剂的活性降低. 因此只有少数关于VPO催化剂用于乙烷选择氧化制乙酸的研究报道.
Merzouki等[27]使用(VO)2P2O4催化剂可在常压下将乙烷直接氧化生成乙酸. 实验证实:低温时(270 ℃), 乙烷转化率小于1%, 而乙酸和乙酸酐的总选择性可以达到100%; 升高反应温度, 产物中除了乙酸还有乙烯生成. 此外, 在催化剂中掺杂Pd元素不仅提高了乙烷的转化率, 还促进了低温下乙烯生成. 这是由于Pd增进了V4+/V5+之间的氧化循环, 同时作为活性位(H受体)生成乙烯. 但是, 催化剂中Te元素的掺杂会使反应活性降低, 这是由于催化剂中的O-V4+用于活化乙烷分子[28], Te掺杂降低催化剂中V4+的含量.
Tessier等[29]探究了VPO催化剂中生成乙酸的活性位. 他们认为, VPO催化剂中的聚钒酸盐是生成乙酸的活性相, 并且磷酸盐对活性V位点有分散作用, 使得这类催化剂具有较高的乙酸选择性. 此外, Mo掺杂可以有效提高乙烷氧化制乙酸的催化性能[30]. 根据XPS表征发现, 催化剂表面富集Mo、P原子, 但是V含量很少, 这就增加了孤立V位点的数量. 并且Mo与V之间存在相互作用, Mo改变了V周围的电子密度, 从而有利于乙酸的生成.
此外, VPO在乙烷选择氧化反应中的机理和动力学也是研究的重点. Fakeeha等[31]基于Redox和Eley-Rideal机理提出Mo-VPO催化剂上乙烷选择氧化生成乙酸的动力学模型. 作者认为吸附的氧与乙烷反应可生成乙烯、乙酸和COx, 然后生成的乙烯进一步被氧化生成乙酸和COx. 在反应中催化剂表面存在不同氧化态的活性位, 其中V4+用于乙烷分子的活化和生成乙烯, V5+用于生成COx, 而乙酸的形成主要通过V4+位生成的乙氧基和V5+位吸附的乙醛氧化得到.
2.3 多金属氧化物催化剂(MMO)1978年, Thorsteinson等[6]使用Mo0.61V0.31Nb0.08Ox催化剂在乙烷脱氢制乙烯过程中发现:常压时乙烯是反应主产物, 当压力升高到2.03 MPa, 有选择性为19.1%的乙酸生成. 并且乙酸的生成速率与乙烯和氧气的浓度有关, 而与乙烷浓度无关, 说明乙烷首先脱氢生成乙烯中间产物, 乙烯再氧化生成乙酸. 另外, 催化剂中的Nb可以有效提高活性和稳定催化剂的结构. 其他研究人员通过对比MoV和MoVNb催化剂, 也证实催化剂中的Nb可用于形成和稳定活性相[32-35]、提高催化剂的本征活性、抑制COx的选择性[36]. 自此, 研究者们致力于研制高效的多金属氧化物催化剂用于乙烷氧化制乙酸反应.
Thorsteinson等[6]和Burch等[37-38]经过测定发现Mo-V-Nb催化剂中主要由Mo4V6O25、Mo6V9O40和MoO3相组成. 为了确定生成乙酸的活性相, Burch等[39]分别制备了纯相的Mo6V9O40、Mo3Nb2O11、NbVO4和MoO3催化剂用于乙烷选择氧化反应, 其中只有Mo6V9O40可以催化乙烷生成乙酸. 通过H2-TPR表征可以说明Mo6V9O40和Mo-V-Nb催化剂具有较好的还原性, 都可在低温下被还原, 这有利于催化剂中晶格氧的释放、促进乙酸的形成[37]. 即便如此, Mo6V9O40催化活性依然低于混合催化剂. Merzouki等[27]通过系统实验发现, 在Mo-V-Nb催化剂合成过程中增加偏钒酸铵和氧化铌的溶解可以避免生成Mo6V9O40结构, 但反应过程中依然有乙酸生成, 说明Mo6V9O40并不是多金属氧化物生成乙酸的活性相. 随后, 大量文献证实具有优异催化性能的Mo-V-Nb多金属氧化物中普遍含有θ-Mo5O14结构, 并且θ-Mo5O14结构中的部分Mo可以被V和Nb取代[27, 32, 40-42]. 因此, θ-Mo5O14结构作为多金属氧化物的活性相被大多数学者认可.
日本三菱化学公司发现Mo-V-Nb-Te-O催化剂在丙烷氨氧化生成丙烯腈和丙烷氧化生成丙烯酸的反应中都具有很好的催化活性[43], 说明Mo-V体系中掺杂一种或多种助剂可以改变催化剂的性质[44]. 为了探究助剂对乙烷选择性能的影响, Ueda等[45-46]使用溶剂热法制备Mo-V-M-O(M=Al、Cr、Fe、Ga、Bi、Sb和Te)多组分金属氧化物催化剂. 结果表明, 所有催化剂都可以催化乙烷生成乙烯和乙酸, 但是催化活性有明显的差异, 特别是V含量对活性的影响. 随后, 在Mo-V-Al催化剂中添加Ti可提高乙烷选择氧化能力, 但是产物选择性没有发生变化[47]. 这是由于Ti的加入只改变了催化剂颗粒的形貌, 增加了比表面积. 与Mo-V-Nb催化剂相比, Mo-V-M催化剂表现出较低的反应活性和乙酸选择性. Bergh等[48]将高通量初步合成和筛选的方法应用于多金属氧化物催化剂的合成, 他们发现Mo-V双组份催化剂具有最好的催化活性和产物选择性. 通过向Mo-V催化剂中分别掺杂主族元素、过渡金属以及稀土元素得到三组分催化剂, 其中Mo-V-Nb催化剂的活性最高. 因此, 研究人员还是将研究重点放在Mo-V-Nb催化剂上.
Li等[49]用共沉淀法制备了Mo-V-Nb/TiO2催化剂, 实验证实, 载体的加入使得乙烯和乙酸的生成速率增加了10倍, 但选择性没有发生变化. 这是由于载体TiO2只是对活性氧化物起到分散作用, 并没有改变反应的本征活性和选择性. 目前, 大多数研究者认为乙烷氧化生成乙酸是通过乙烯发生连续氧化得到, 所以可以考虑通过加快乙烯氧化速率来提高乙酸的选择性. 之前有文献报道称具有氧化还原性质的催化剂, 例如V2O5或杂多酸, 掺杂Pd可以发生“Wacker-like”反应加速乙烯向乙酸的转化[50]. Holger等[51]将这想法用于多金属氧化物催化体系发现, Mo-V-Nb催化剂中掺杂Pd元素可以使乙酸的选择性从32%提高到78%, 乙烯的选择性降低而乙烷的转化率没有变化. 这也证明Pd在多金属氧化物中可以作为“Wacker-like”反应的催化活性中心, 通过消耗生成的乙烯来增加乙酸的选择性[52-53]. 对于Mo-V-Nb/TiO2负载型催化剂[49], Pd的存在对乙烷氧化速率没有影响, 但乙酸生成速率从3.1×10-3提高到6.5×10-3 mol·g-atom-V-1·s-1, 而乙烯生成速率从4.7×10-3降低到0.07×10-3 mol·g-atom-V-1·s-1, 表明Pd只加速乙烯向乙酸的转化. 除此之外, 还可以通过优化反应条件, 如压力、烷氧比等提高乙酸收率[54].
近些年, Mo-V-Nb催化剂主要用于乙烷氧化脱氢以及丙烷选择氧化制丙烯酸反应[55-59], 对于乙烷氧化制乙酸的研究报道很少. 对于乙烷氧化制乙酸反应, 我们尝试使用Ce掺杂的MoVNbO催化剂, 考察Ce含量对催化剂性能和乙烷氧化活性的影响. 从实验结果可以看出, Ce掺杂量对催化剂的物相结构以及氧化还原性质有很大的影响, 从而使催化活性产生差异. 当Ce/V摩尔比为0.1时, 催化剂表现出较好的催化活性, 乙烷的转化率为31%, 乙烯和乙酸的总选择性达到72%.
3 反应机理和动力学目前, 大部分的研究主要考察催化剂的组成、结构对催化性能的影响, 关于反应动力学和机理研究的报道很少, 并且主要针对Mo-V催化剂. 早期, Thorsteinson等[6]提出Mo作为活性位, 在反应中发生氧化还原过程, 反应机理如图 1所示. 在脱氢过程中, 乙烷吸附在Mo活性位形成乙氧基中间体, 然后通过消除β-H形成乙烯, 这时催化剂表面的Mo6+被还原为Mo4+; 生成的乙烯再与活性氧反应生成乙酸[60], 随后Mo4+被O2氧化形成Mo6+. 在这过程中催化剂中的V对Mo4+氧化为Mo6+起到催化作用.
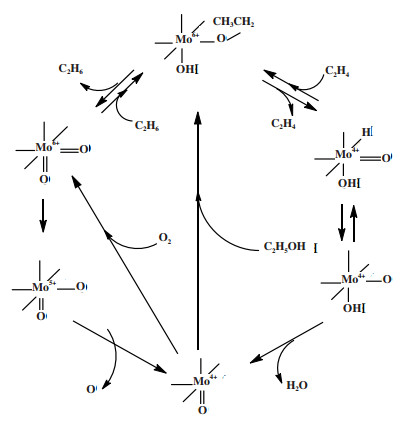
|
图 1 乙烷氧化脱氢在Mo中心发生氧化还原机理 Fig.1 The redox mechanism of C2H6 oxidation dehydrogenation reaction on Mo center[6] |
后来, Ruth等[61]将催化剂的结构性质与催化活性相结合, 通过改变反应条件发现, 乙烯是乙烷氧化生成乙酸的中间产物. 在乙酸的形成过程中, 乙烷分子C-H键的断裂和氧插入与催化剂的晶格氧有关. 结合Mars-Van-Krevelen机理, 作者提出了如图 2所示的反应机理. 在反应过程中, 乙烷分子以乙氧基的形式吸附在催化剂表面[6, 62], 吸附的乙氧基通过β-H消除形成乙烯, 乙烯再吸附在催化剂的阳离子上进一步被氧化生成乙醛和乙酸, 乙醛还可以继续氧化生成乙酸(路径1); 或者乙醇盐被夺取两个α-H, 直接氧化生成乙醛和乙酸(路径2); 再或者先消除一个α-H形成乙醛, 乙醛再氧化生成乙酸(路径3). 对于该反应, α-H和β-H消除可能发生在不同的活性位点[27].
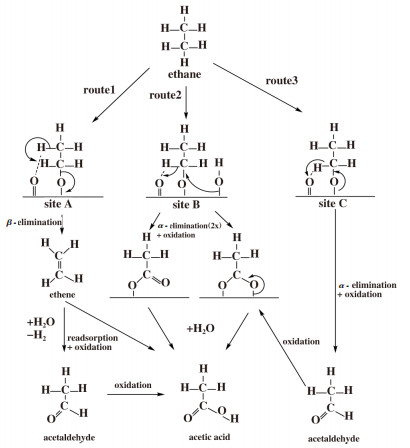
|
图 2 乙烷选择氧化可能机理 Fig.2 Possible mechanism for selectivity oxidation of ethane[61] |
Li等[63]通过改变原料气中O2的分压发现, 在Mo-V-Nb催化剂上, 乙烷氧化速率和产物选择性没有发生变化, 表明催化剂中的晶格氧参与了氧化反应, 并且催化剂表面氧饱和. 因此, 作者基于Mars-Van-Krevelen机理提出图 3所示的反应过程. 首先, 乙烷分子可逆的吸附在晶格氧(O*)表面, 随后被晶格氧夺取H原子形成吸附态的乙氧基(CH3CH2O*)和羟基(*OH); 乙氧基通过β-H消除形成C2H4和*OH, 或者通过O*夺取α-H进一步被氧化形成CH3COOH; 最后, *OH经过重组生成H2O, O2通过不可逆解离形成O*. 除此之外, 作者还通过动力学和同位素标记研究发现, TiO2载体对一级和二级反应速率常数Pd位点选择性地增加乙烯的氧化速率, 提高乙酸的选择性. 在乙烷氧化过程中, 催化剂表面乙烷C-H键活化是反应的决速步骤, 作为中间体的氧空位可以通过体相晶格氧或O2不可逆解离进行快速补充.
|
图 3 Mo-V-Nb催化剂乙烷氧化生成乙烯和乙酸的Mars van Krevelen氧化还原循环 Fig.3 Mars van Krevelen redox cycle for ethane oxidation to ethene and acetic acid on Mo-V-Nb oxide catalysts[63] |
大量实验表明催化剂中掺杂Pd和向反应体系加水, 都可以提高乙酸的选择性. Linke等[64]使用Mo1V0.25Nb0.12Pd0.0005Ox催化剂、探究加水的反应体系对乙烷选择氧化制乙酸反应机理的影响. 他们通过一系列实验证实催化剂表面存在两种活性中心:一种用于乙烷脱氢制乙烯、乙烯连续氧化制乙酸以及完全氧化生成CO2(Mz); 另一种活性位表面通过吸附H2O形成OH, 然后在Pd的催化作用下发生“Wacker-like”反应(Mx). 根据之前的实验结果[40], 他们认为V作为反应活性中心且反应遵循Mars-Van-Krevelen机理, 提出如图 4所示的反应路径. 在反应过程中, [OMzO]在活化乙烷的同时被还原为[OMz], 此时[OMz]不具有活性, 但是可以吸附生成的乙烯和水, 阻碍[OMz]活性位的再生, 降低[OMzO]活性位的数量. 因此, 可以通过改变体系中乙烯和水的浓度来改变乙烷的氧化速率. 并且[OMxO]只有吸附水形成[(HOMxO)(OH)]活性相上才能发生“Wacker-like”反应, 促进乙烯向乙酸的转化. 此外, 还发现反应路径随温度发生变化:低温时, 乙烯作为中间产物可以连续氧化生成乙酸, 乙酸主要通过步骤(3)在Mx活性位上形成; 高温时, 乙烷发生平行反应生成乙烯和乙酸, 通过步骤(2)在Mz位点形成[65]. 除此之外, 他们通过动力学计算发现乙烷分子活化是乙烷氧化反应的决速步, 而H2O在[OMxO]活性位的吸附是乙烯发生Wacker-Like反应生成乙酸的决速步.

|
图 4 Mo1V0.25Nb0.12Pd0.0005Ox乙烷选择氧化反应机理 Fig.4 Reaction mechanistic for selectivity oxidation of ethane on Mo1V0.25Nb0.12Pd0.0005Ox[64] |
同样地, Rahman等[66]通过同位素实验证实了乙酸的生成存在两种途径:一种通过乙烯连续氧化得到; 另一种是水中的OH与乙烯发生羟基化反应. 根据动力学数据以及反应结果发现, 在该反应中使用Eley-Rideal-Redox(ERR)机理更合适(图 5). 催化剂中存在X和Z两种活性位, 与Ueda等[46]提出的双位点模型不同的是, 作者认为Z活性位只发生乙烷脱氢反应生成乙烯, 而在X活性位乙烯可以通过氧化或羟基化生成乙酸. Mo-V氧化物的酸性可以促进水吸附形成表面OH[67], 如果水浓度过高, 也会阻碍催化活性. 此外, 他们认为反应过程中乙烷氧化主要生成乙烯, 而乙烯是乙酸和COx的主要来源.

|
图 5 ERR反应机理 Fig.5 Eley-Rideal-Redox mechanistic[66] |
总而言之, 在Mo-V-Nb催化剂中, V作为活性中心得到多数学者的认可. 乙烷选择氧化反应主要遵循Mars-Van-Krevelen机理, 反应物分子被催化剂中的晶格氧直接氧化, 而O2主要用于补充晶格氧, 并且乙烷分子中C-H键断裂是反应的决速步. 向反应体系中加入H2O, 主要可以通过增加乙酸的形成路径来提高选择性. 而催化剂中Pd的掺杂只是加快促进了乙烯向乙酸转化的速率.
4 结论与展望乙烷直接氧化制乙酸是低碳烷烃转化利用的重要研究方向. 该技术与甲醇羰化法相比具有工艺简单、投资低、催化剂对环境友好等优点, 因此实现其工业化生产具有重要的意义. 乙烷直接氧化制乙酸研究已取得丰富的成果, Mo-V多金属氧化物展现了一定的潜力, 但在乙酸选择性或收率方面仍然不能满足工业化要求. 因此, 了解催化剂结构与催化性能之间的构效关系, 制备新型、高效催化剂成为今后乙烷氧化制乙酸研究的方向. 目前, 还存在一些有待解决的问题:(1)在低温下如何进一步提高乙烷分子的活化能力; (2)提高乙烷活化能力的同时, 如何选择性控制生成乙酸, 提高乙酸收率; (3)Mo-V多金属氧化物的组成较为复杂、形成多种结构物相, 各物相的形成过程及其催化作用本质尚不明确. 针对上述问题, 在催化剂改进方面还应开展:(1)深入对反应机理的研究, 明确活性中心和反应路径, 尤其是确定乙烯到乙酸反应过渡态物质; (2)提高催化剂中用于活化乙烷的晶格氧浓度; (3)明确助剂类型、加入方式以及加入量对催化剂结构和性能的具体影响. 在反应工艺方面:(1)优化反应条件, 使转化率和选择性到达最优结果; (2)控制反应体系的水浓度, 使其更有效地促进乙酸生成.(3)寻找合适的稀释气替代水蒸气, 以达到相同的反应活性.
| [1] |
Xiao Ming(肖铭). Supply and demand situation and development prospect of acetic acid at home and abroad(国内外醋酸的供需现状及发展前景)[J]. Fine Chem(精细与专用化学品), 2019, 27(10): 21–24.
|
| [2] |
Liu Cun-kun(刘存锟). Acetic acid production process and its comparison(醋酸生产工艺及其对比)[J]. Chem Eng Equip(化学工程与装备), 2013, 2013(6): 169–171.
|
| [3] |
Li Ying-cheng(李应成), Xie Zai-ku(谢在库), Lu Wen-kui(卢文奎). Advances in preparation of acetic acid from ethylene via one-step vapor phase catalytic oxidation(乙烯气相直接氧化制乙酸研究进展)[J]. Ind Catal(工业催化), 2001, 9(2): 17–23.
DOI:10.3969/j.issn.1008-1143.2001.02.003 |
| [4] |
Zhang Li-ping(张丽平). Acetate production technology progress and market analysis(乙酸生产技术研究进展及市场分析)[J]. Technol Economics Petrochem(石油化工技术与经济), 2016, 32(1): 23–28.
DOI:10.3969/j.issn.1674-1099.2016.01.005 |
| [5] |
a. Yan Wei-hua(闫伟华), Yao Bin(姚彬). Development and research of coal chemical technology for acetic acid production(煤化工制醋酸技术的工艺发展概况及研究)[J]. Guangdong Chem Ind(广东化工), 2019, 46(6): 137-138. b. Xue Yun(薛云), Yan Mi(晏秘), Shen Yan-ming(申妍铭), et al. Functional nitroxide radicals and MIL-101(Fe) co-catalysts: Cooperative catalytic oxidation of alcohols(功能化氮氧自由基与MIL-101(Fe) 协同催化醇氧化性能)[J]. J Mol Catal(China) (分子催化), 2021, 35(3): 243-251. c. Zhang Qi(张琦), Tong Jin-hui(童金辉), Chou Ling-jun(丑凌军), et al. h-BN-Doped Na2WO4-Mn/SiO2 catalysts for oxidative dehydrogenation of ethane to ethylene(h-BN掺杂Na2WO4-Mn/SiO2催化剂用于乙烷氧化脱氢制乙烯)[J]. J Mol Catal(China)(分子催化), 2020, 34(6): 495-504. |
| [6] |
a. Thorsteinson E M, Wilson T P, Young F G, et al. Oxidative dehydrogenation of ethane over catalysts containing mixed oxides of molybdenum and vanadium[J]. J Catal, 1978, 52(1): 116-132. b. Gao Xiao-xia(高晓霞), Wang Jiang(王奖), Xu Ai-ju(徐爱菊), et al. Preparation of Ni-Co-Al mixed oxides and their catalytic performance for oxidative dehydrogenation of propane(Ni-Co-Al混合氧化物的制备及其丙烷氧化脱氢催化性能)[J]. J Mol Catal(China) (分子催化), 2019, 33(6): 531-541. c. Liu Meng-yang(刘梦洋), Rong Xin(荣欣), Gu Bin(顾彬), et al. Propane dehydrogenation of Pt-Sn metal loaded on aluminum-boron composite oxide(铝硼复合氧化物负载Pt-Sn催化剂的丙烷脱氢性能研究)[J]. J Mol Catal(China)(分子催化), 2019, 33(5): 412-419. |
| [7] |
Batiot C, Hodnett B K. The role of reactant and product bond energies in determining limitations to selective catalytic oxidations[J]. Appl Catal A: Gen, 1996, 137(1): 179–191.
DOI:10.1016/0926-860X(95)00322-3 |
| [8] |
Karim K, Al-Hazmi M, Khan A. Catalysts for the oxidation of ethane to acetic acid, methods of making and using the same[P]. US: 006130356A, 2000.
|
| [9] |
Karim K, Al-Hazmi M, Khan A, et al. Oxidation of ethane to acetic acid and ethylene using molybdenum and vanadium based catalysts[P]. US: 006531631B1, 2003.
|
| [10] |
Karim K, Mamedov E, Al-Hazmi M, et al. Catalysts for producing acetic acid from ethane oxidation, processes of making same and method of using same[P]. US: 006030920A, 2000.
|
| [11] |
Karim K, Al-Hazmi M, Mamedov E, et al. Catalysts for the oxidation of ethane to acetic acid, processes of making same and processes of using same[P]. US: 005907056A, 1999.
|
| [12] |
Karim K, Al-Hazmi M, Khan A. Method for gas phase production of acetic acid from ethane[P]. US: 006156928A, 2000.
|
| [13] |
Smejkal Q, Linke D, Baerns M. Energetic and economic evaluation of the production of acetic acid via ethane oxidation[J]. Chem Eng Process, 2005, 44(4): 421–428.
DOI:10.1016/j.cep.2004.06.004 |
| [14] |
Zhang Tie-zhen(张铁珍). Studies on complex metal-oxide for catalytic selective oxidation of propane(复合金属氧化物对丙烷选择氧化的研究)[D]. Qaqing(大庆): Daqing Petroleum Institute(大庆石油学院), 2005.
|
| [15] |
Zhu Bao-dong(祝宝东). Study on preparing and performance of complex metal-oxide catalysts(复合金属氧化物中催化剂的制备和性能研究)[D]. Qading(大庆): Daqing Petroleum Institute(大庆石油学院). 2007.
|
| [16] |
Moffat J B. Conversion of C2-C5 alkanes on heteropoly oxometalates[J]. Appl Catal A: Gen, 1996, 146(1): 65–86.
DOI:10.1016/0926-860X(96)00169-X |
| [17] |
Ermolenko L, Giannotti C. Aerobic photocatalytic oxidation of adamantane with heteropolyoxometalates[Xn+W12O40] 8-n where X=Si, Co2+, Co3+[J]. J Mol Catal A: Chem, 1996, 114(1/3): 87–91.
|
| [18] |
Hong S S, Moffat J B. The oxidative dehydrogenation of ethane on silica-supported metal-oxygen cluster compounds[J]. Appl Catal A: Gen, 1994, 109(1): 117–134.
DOI:10.1016/0926-860X(94)85006-2 |
| [19] |
Kirillova M V, da Silva J A L, da Silva J J R F, et al. Direct and efficient transformation of gaseous alkanes into carboxylic acids catalyzed by vanadium containing heteropolyacids[J]. Appl Catal A: Gen, 2007, 332(1): 159–165.
DOI:10.1016/j.apcata.2007.08.018 |
| [20] |
Sopa A, Waclaw-Held A, Grossy M, et al. Ethane to acetic acid oxidation over supported heteropoly acids[J]. Appl Catal A: Gen, 2005, 285(1/2): 119–125.
|
| [21] |
Tungatarova S A, Abdukhalykov D B, Baizhumanova T S, et al. Oxidation of alkanes into olefins on the polyoxide catalysts[J]. Catal Today, 2015, 256: 276–286.
DOI:10.1016/j.cattod.2015.03.004 |
| [22] |
Galownia J M, Wight A P, Blanc A, et al. Partially reduced heteropolyanions for the oxidative dehydrogenation of ethane to ethylene and acetic acid at atmospheric pressure[J]. J Catal, 2005, 236(2): 356–365.
DOI:10.1016/j.jcat.2005.10.010 |
| [23] |
Kilos B, Aouine M, Nowak I, et al. The role of niobium in the gasand liquid-phase oxidation on metallosilicate MCM-41-type materials[J]. J Catal, 2004, 224(2): 314–325.
DOI:10.1016/j.jcat.2004.03.002 |
| [24] |
de Farias A M D, Gonzalez W D, de Oliveira P G P, et al. Vanadium phosphorus oxide catalyst modified by niobium doping for mild oxidation of n-butane to maleic anhydride[J]. J Catal, 2002, 208(1): 238–246.
DOI:10.1006/jcat.2002.3562 |
| [25] |
Feng R M, Yang X J, Ji W J, et al. VPO catalysts supported on H3PO4-treated ZrO2 highly active for n-butane oxidation[J]. J Catal, 2007, 246(1): 166–176.
DOI:10.1016/j.jcat.2006.11.027 |
| [26] |
Landi G, Lisi L, Russo G. Oxidation of propane and propylene to acrylic acid over vanadyl pyrophosphate[J]. J Mol Catal A: Chem, 2005, 239(1/2): 172–179.
|
| [27] |
Merzouki M, Taouk B, Monceaux L, et al. Catalytic properties of promoted vanadium-oxide in the oxidation of ethane in acetic-acid[J]. Stud Surf Sci Catal, 1992, 72: 165–179.
|
| [28] |
Merzouki M, Taouk B, Tessier L, et al. Correlation between catalytic and structural-properties of modified molybdenum and vanadium-oxides in the oxidation of ethane in acetic-acid or ethylene[J]. Stud Surf Sci Catal, 1993, 75: 753–764.
|
| [29] |
Tessier L, Bordes E, Gubelmann-Bonneau M. Active specie on vanadium-containing catalysts for the selective oxidation of ethane to acetic-acid[J]. Catal Today, 1995, 24(3): 335–340.
DOI:10.1016/0920-5861(95)00055-K |
| [30] |
Roy M, Gubelmann-Bonneau M, Ponceblanc H, et al. Vanadium-molybdenum phosphates supported by TiO2-anatase as new catalysts for selective oxidation of ethane to acetic acid[J]. Catal Lett, 1996, 42(1/2): 93–97.
DOI:10.1007/BF00814472 |
| [31] |
Fakeeha A H, Fahmy Y M, Soliman M A, et al. A kinetic model for partial oxidation of ethane to acetic acid on promoted VPO catalyst[J]. J Chem Technol Biotechnol, 2000, 75(12): 1160–1168.
DOI:10.1002/1097-4660(200012)75:12<1160::AID-JCTB330>3.0.CO;2-# |
| [32] |
Roussela M, Boucharda M, Bordes-Richarda E, et al. Oxidation of ethane to ethylene and acetic acid by MoVNbO catalysts[J]. Catal Today, 2005, 99(1/2): 77–87.
|
| [33] |
Roussel M, Bouchard M, Karim K, et al. MoVO-based catalysts for the oxidation of ethane to ethylene and acetic acid influence of niobium and/or palladium on physicochemical and catalytic properties[J]. Appl Catal A: Gen, 2006, 308: 62–74.
DOI:10.1016/j.apcata.2006.04.017 |
| [34] |
Roussel M, Barama S, Lofberg A, et al. MoV-based catalysts in ethane oxidation to acetic acid: Influence of additives on redox chemistry[J]. Catal Today, 2009, 141(3/4): 288–293.
|
| [35] |
Kardash T Y, Plyasova L M, Kochubey D I, et al. Development of the local and average structure of a V-Mo-Nb oxide catalyst with Mo5O14-like structure during synthesis from nanostructured precursors[J]. Z Krist-cryst Mater, 2012, 227(5): 288–298.
|
| [36] |
Desponds O, Keiski R L, Somorjai G A. The oxidative dehydrogenation of ethane over molybdenum vanadium niobium oxide catalysts: The role of catalyst composition[J]. Catal Lett, 1993, 19(1): 17–32.
DOI:10.1007/BF00765198 |
| [37] |
Burch R, Swarnakar R. Oxidative dehydrogenation of ethane on vanadium molybdenum oxide and vanadium niobium molybdenum oxide catalysts[J]. Appl Catal, 1991, 70(1): 129–148.
DOI:10.1016/S0166-9834(00)84159-7 |
| [38] |
Ruth K, Kieffer R, Burch R. Mo-V-Nb oxide catalysts for the partial oxidation of ethane I. Preparation and structural characterisation[J]. J Catal, 1998, 175(1): 16–26.
DOI:10.1006/jcat.1998.1975 |
| [39] |
Burch R, Kieffer R, Ruth K. Investigation of the molybdenum-vanadium-niobium (oxidic) system and its phases for their catalytic effects[J]. Top Catal, 1996, 3(3/4): 355–364.
|
| [40] |
Linke D, Wolf D, Baerns M, et al. Catalytic partial oxidation of ethane to acetic acid over Mo1V0.25Nb0.12-Pd0.0005Ox I. Catalyst performance and reaction mechanism[J]. J Catal, 2002, 205(1): 16–31.
DOI:10.1006/jcat.2001.3367 |
| [41] |
Kardash T Y, Kochubei D I, Plyasova L M, et al. EXAFS study of the local structure and distribution in V-Mo-Nb oxide[J]. J Struct Chem, 2009, 49: S116–S123.
|
| [42] |
Kardash T Y, Plyasova L M, Bondareva V M, et al. M5O14-like V-Mo-Nb oxide catalysts: Structure and catalytic performance[J]. Appl Catal A: Gen, 2010, 375(1): 26–36.
DOI:10.1016/j.apcata.2009.12.003 |
| [43] |
Ushikubo T, Oshima K, Kayou A, et al. Ammoxidation of propane over catalysts comprising mixed oxides of Mo and V[J]. J Catal, 1997, 169(1): 394–396.
DOI:10.1006/jcat.1997.1692 |
| [44] |
Jimenez J D, Mingle K, Bureerug T, et al. Statistically guided synthesis of MoV-based mixed-oxide catalysts for ethane partial oxidation[J]. Catalysts, 2018, 8(9): 370–385.
DOI:10.3390/catal8090370 |
| [45] |
Ueda W, Chen N F, Oshihara K. Hydrothermal synthesis of Mo-V-M-O complex metal oxide catalysts active for partial oxidation of ethane[J]. Chem Commun, 1999, 1999(6): 517–518.
|
| [46] |
Ueda W, Oshihara K. Selective oxidation of light alkanes over hydrothermally synthesized Mo-V-M-O (M=Al, Ga, Bi, Sb, and Te) oxide catalysts[J]. Appl Catal A: Gen, 2000, 200(1/2): 135–143.
|
| [47] |
Chen N F, Oshihara K, Ueda W. Selective oxidation of ethane over hydrothermally synthesized Mo-V-Al-Ti oxide catalyst[J]. Catal Today, 2001, 64(1/2): 121–128.
|
| [48] |
Bergh S, Guan S H, Hagemeyer A, et al. Gas phase oxidation of ethane to acetic acid using high-throughput screening in a massively parallel microfluidic reactor system[J]. Appl Catal A: Gen, 2003, 254(1): 67–76.
DOI:10.1016/S0926-860X(03)00264-3 |
| [49] |
Li X B, Iglesia E. Support and promoter effects in the selective oxidation of ethane to acetic acid catalyzed by Mo-V-Nb oxides[J]. Appl Catal A: Gen, 2008, 334(1/2): 339–347.
|
| [50] |
Seoane J L, Boutry P, Montarnal R. Ethylene oxidation to acetic acid with Pd-V2O5type catalysts[J]. J Catal, 1980, 63(1): 182–190.
DOI:10.1016/0021-9517(80)90071-8 |
| [51] |
Holger B, Uwe D. Verfahren zur selektiven Herstellung von Essigsaure[P], DE: 19630832A1, 1982.
|
| [52] |
Al-Zeghayer Y S, Al-Awadi A S, Jibril B Y. Partial oxidation of ethane to acetic acid on titania supported MoVNbPd catalyst[J]. Asian J Chem, 2013, 25(14): 7979–7985.
DOI:10.14233/ajchem.2013.14886 |
| [53] |
Al-Mayman S I, AL-Awadi A S, Al-Zeghayer Y A, et al. Partial oxidation of ethane to acetic acid using a metallic Pd promoted MoVNb catalyst supported on titania[J]. J Chem Soc Pak, 2018, 40(1): 76–88.
|
| [54] |
Bondareva V M, Chernov A N, Ishchenko E V, et al. Effect of pressure on the oxidative conversion of ethane on VMoTeNbO catalyst[J]. Russ J Appl Chem, 2016, 89(11): 1786–1790.
DOI:10.1134/S1070427216110082 |
| [55] |
Ishchenko E V, Gulyaev R V, Kardash T Y, et al. Effect of Bi on catalytic performance and stability of MoVTeNbO catalysts in oxidative dehydrogenation of ethane[J]. Appl Catal A: Gen, 2017, 534: 58–69.
DOI:10.1016/j.apcata.2017.01.023 |
| [56] |
Mishanin I I, Kalenchuk A N, Maslakov K I, et al. Oxidative dehydrogenation of ethane over a Mo-V-Nb-Te-O mixed-oxide catalyst in a cyclic mode[J]. Kinet Catal, 2017, 58(2): 156–160.
DOI:10.1134/S0023158417020094 |
| [57] |
Trunschke A, Noack J, Trojanov S, et al. The impact of the bulk structure on surface dynamics of complex Mo-V-based oxide catalysts[J]. ACS Catal, 2017, 7(4): 3061–3071.
DOI:10.1021/acscatal.7b00130 |
| [58] |
Melzer D, Mestl G, Wanninger K, et al. On the promoting effects of Te and Nb in the activity and selectivity of M1 MoV-oxides for ethane oxidative dehydrogenation[J]. Top Catal, 2020, 63(19/20): 1754–1764.
DOI:10.1007/s11244-020-01304-0 |
| [59] |
Lopez-Median R, Sobczak I, Golinska-Mazwa H, et al. Spectroscopic surface charaterization of MoVNbTe nanostructued catalysts for the partial oxidation of propane[J]. Catal Today, 2012, 187(1): 195–200.
DOI:10.1016/j.cattod.2011.12.035 |
| [60] |
Takita Y, Ozaki A, Moro-oka , Y . Catalytic oxidation of olefins over oxides catalysts containing molybdenum[J]. J Catal, 1972, 27(2): 185–192.
DOI:10.1016/0021-9517(72)90259-X |
| [61] |
Ruth K, Burch R, Kieffer R. Mo-V-Nb oxide catalysts for the partial oxidation of ethane II. Chemical and catalytic properties and structure function relationships[J]. J Catal, 1998, 175(1): 27–39.
DOI:10.1006/jcat.1998.1976 |
| [62] |
Oyama S T. Adsorbate bonding and the selection of partial and total oxidation pathways[J]. J Catal, 1991, 128(1): 210–217.
DOI:10.1016/0021-9517(91)90078-I |
| [63] |
Li X B, Iglesia E. Kinetics and mechanism of ethane oxidation to acetic acid on catalysts based on Mo-V-Nb oxides[J]. J Phys Chem, 2008, 112(38): 15001–15008.
|
| [64] |
Linke D, Wolf D, Baerns M, et al. Catalytic partial oxidation of ethane to acetic acid over Mo1V0.25Nb0.12Pd0.0005Ox II. Kinetic modelling[J]. J Catal, 2002, 205(1): 32–43.
DOI:10.1006/jcat.2001.3368 |
| [65] |
Linke D, Wolf D, Baerns M, et al. Catalytic partial oxidation of ethane to acetic acid over Mo1V0.25Nb0.12Pd0.0005Ox: Reactor operation[J]. Chem Eng Sci, 2002, 57(1): 39–51.
DOI:10.1016/S0009-2509(01)00300-1 |
| [66] |
Rahman F, Loughlin K F, Al-Saleh M A, et al. Kinetics and mechanism of partial oxidation of ethane to ethylene and acetic acid over MoV type catalysts[J]. Appl Catal A: Gen, 2010, 375(1): 17–25.
DOI:10.1016/j.apcata.2009.11.026 |
| [67] |
Karim K, Mamedov A, Al-Hazmi M H, et al. Oxidation dehydrogenation of ethane over MoVMnW oxide catalysts[J]. React Kinet Catal Lett, 2003, 80(1): 3–11.
DOI:10.1023/A:1026012203802 |
 2021, Vol. 35
2021, Vol. 35


