柴油发动机因热效率高、动力强和经济性好等优点而在重型货车、船舶和工程机械等领域得到广泛应用[1], 但是柴油机排放的碳烟会危害生态环境和人体健康[2].近年来我国对于柴油机尾气颗粒物排放限值日益严格, 目前柴油机颗粒捕集器(DPF)技术是解决柴油机尾气PM排放的最有效的举措.在DPF孔道中负载催化剂(CDPF)有望在柴油机尾气温度窗口范围内实现DPF再生[3].目前, 已投入实际应用的催化剂多为贵金属, 但是其价格昂贵且易中毒失活[4], 亟需研发替代产品.
尖晶石催化剂具有出色的热稳定性、理想的催化活性和较高的经济性[5-6].以Cu-Co为代表的尖晶石氧化物催化剂已被广泛用于CO氧化[7-8]、NOx还原[9]、挥发性有机物催化燃烧[10-12]等.Jia等[10]采用沉淀法制备的铜钴尖晶石氧化物可在200 ℃实现甲苯的完全氧化, 其活性与商业催化剂0.5%(质量分数)Pt/Al2O3相当, 可在175 ℃实现乙酸乙酯的完全氧化, 其活性优于0.5%(质量分数)Pt/Al2O3催化剂(300 ℃).Zhang等[12]采用溶剂热醇解法制备了尖晶石型催化剂MCo2O4(M=Co, Ni, Cu)用于丙酮氧化, CuCo2O4具有丰富的活性氧物种和活性位点以及较佳的还原性能, 从而表现出最佳催化活性(T90=183 ℃).同时其还具有出色的稳定性和耐水性能.Salker等[7]采用溶胶凝胶法制备的铜钴尖晶石氧化物在93 ℃实现CO的完全氧化, 其活性优于刘等[13]采用模板法制备的Co3O4-CeO2复合氧化物(T50=101 ℃).铜钴尖晶石产生上述效果的原因在于铜元素进入尖晶石晶格, 取代钴尖晶石中四面体中心的非活性Co2+离子, 使得催化剂表面暴露出高浓度的Co3+离子, 产生更多晶格缺陷和氧空位[12, 14-15].此外, 铜元素存在多种价态, 其可以通过马尔斯-范克雷维伦机理(Mars and van Krevelen mechanism, MvK)促进催化剂表面的氧化还原过程[16], 从而表现出出色的催化氧化活性.此外, 制备方法对催化剂的晶相、表面形貌、活性位点、表面物种组成、还原性等物化性质有较大影响, 从而导致催化活性的差异[17-19].为了适合工业应用, 相关催化剂的制备过程不仅要满足催化活性需求, 而且还要具备制备工艺简单、周期短、成本低、能耗低等特点.此前学者们已研究出许多方法用于催化剂的制备, 如溶胶凝胶法、沉淀法、浸渍法、固态反应法、微波辅助法、自模板法、尿素水热法、胶体晶体模板法等.其中, 尿素水热法采用无模板制备路线, 但制备的催化剂样品仍呈现出纳米花状的多孔结构, 这提供了更多活性位点, 有利于改善催化剂与反应物接触, 从而表现出较高活性[20].而溶胶凝胶法、固相反应法也因原料便宜、制备过程简单以及所制备的催化剂具有不俗的催化活性等优点在工业催化剂的制备中具有广泛的应用前景[21-22].
我们采用溶胶凝胶法、固相反应法和尿素水热法制备了铜钴摩尔比为1∶2的尖晶石氧化物催化剂.采用XRD、BET、SEM、H2-TPR、XPS和O2-TPD等系列表征技术考察了铜钴尖晶石氧化物的物理化学性质, 并通过程序升温氧化(Temperatureprogrammed oxidation, TPO)方式考察了碳烟催化燃烧的活性, 以探讨制备方法对铜钴尖晶石氧化物催化剂的结构形貌、表面活性物种分布、氧化还原特性以及催化碳烟燃烧性能的影响.
1 实验部分 1.1 实验试剂硝酸铜(Cu(NO3)2·3H2O, AR), 购自国药化学试剂有限公司; 硝酸钴(Co(NO3)2·6H2O, 99.99%)、柠檬酸(C6H8O7, AR)、尿素(CH4N2O, AR), 购自阿拉丁试剂有限公司; 草酸(C2H2O4· 2H2O, GR, 99.8%), 购自麦克林试剂有限公司.所有药品均为经过进一步纯化直接使用.
1.2 催化剂的制备(1)溶胶凝胶法[23] : 称量金属盐(0.02 mol硝酸铜+0.04 mol硝酸钴), 将其溶于去离子水中, 然后加入柠檬酸(0.072 mol), 配制成50 mL均匀溶液.溶液在80 ℃下水浴搅拌直至溶液变为湿凝胶.湿凝胶在恒温干燥箱110 ℃干燥过夜变为干凝胶, 后转移至马弗炉700 ℃煅烧6 h.所得催化剂记为SG.
(2)固相反应法[24] : 称量金属盐(0.02 mol硝酸铜+0.04 mol硝酸钴), 用研钵将两者研磨均匀, 之后加入0.09 mol草酸, 再继续研磨20 min.将研磨后的混合物转移到马弗炉中160 ℃燃烧6 h.整个燃烧反应过程缓慢发生, 最后形成蓬松多孔的团状物.之后将马弗炉温度增至700 ℃继续煅烧6 h.所得催化剂记为SS.
(3)尿素水热法[25] : 称量金属盐(0.02 mol硝酸铜+0.04 mol硝酸钴)和尿素(0.06 mol), 将其溶入去离水中, 配制成100 mL均匀溶液.溶液转移至聚四氟乙烯内衬中, 加装不锈钢反应釜, 在恒温箱中150 ℃水热反应12 h.之后过滤溶液获得沉淀物, 用去离子水洗涤3次, 然后在烘箱中110 ℃过夜干燥.后移至马弗炉700 ℃煅烧6 h.所得催化剂记为HT.
上述方法制得的催化剂经压片、研磨、过筛至粒径为0.250~0.420 mm备用.
1.3 催化剂的表征X射线衍射(XRD)用于测定催化剂的物相结构.采用日本Rikagu公司的D-max2000射线粉末衍射仪进行.该设备扫描范围为10°~80°, 扫描步长为0.02°.制备的铜钴尖晶石氧化物的表面形貌(SEM)是由日本Hitachi公司生产的SU-70扫描电子显微镜获得的.通过美国Micromeritics公司TriStar II 3020型气体吸附分析仪对催化剂样品进行N2物理吸脱附测试.使用Brunauer-EmmettTeller(BET)方法从这些获得的等温线确定比表面积值.总孔体积在p/p0=0.05~0.30的相对压力下计算获得.采用美国Micromeritics公司的AutoChem II 2920型化学吸附仪进行氢气程序升温还原(H2-TPR)测试.该设备配有高灵敏度的线性热传导检测器准确测量测试过程中TCD信号强度, 对TCD信号-时间曲线进行积分并与标准曲线(由标准样品CuO测得的TCD信号面积与耗氢量之间的对应关系)对照以获得各催化剂样品的单位质量耗氢量.X射线光电子能谱(XPS)用于测定催化剂的表面化学成分和氧化态.采用美国Thermo Scientific公司的Escalab 250Xi型光电子能谱仪进行.该设备激发源为Al-Kα射线(hv=1486.6 eV).采用天津先权公司的TP-5080化学吸附仪进行O2-TPD测试, 利用氧脱附曲线下积分面积计算氧气的脱附量.
1.4 催化剂的活性评价本实验选用Degussa公司生产的Printex-U作为模拟碳烟.催化活性测试在固定床管式石英反应器(Φ=6 mm)上进行.催化剂与碳烟采用松散接触方式.具体步骤是称量20 mg碳烟和180 mg尖晶石氧化物催化剂放入烧杯, 用药匙搅拌至两者均匀混合, 然后混于400 mg惰性二氧化硅(粒径0.250~0.420 mm)中.用石英棉将混合物固定在石英管反应器中心位置.之后反应器装填到管式炉中, 管式炉以5 ℃/min的升温速率从常温升至700 ℃.管式炉中靠近石英反应管处设有热电偶以准确测量反应区域温度.原料气组分为: (0.1%NO)10%O2(体积分数), N2为平衡气, 气流总量为200 mL/min.体积空速(GHSV)约为27 000 h-1.采用红外气体分析仪(GXH-3010/3011AE, 北京华云仪器)在线连续监测反应器出口的CO和CO2浓度.转化碳烟的质量由CO和CO2浓度曲线积分得到.碳烟转化率达到10%、50%、90%所对应的温度值(T10、T50、T90)和反应器出口CO2的选择性(SCO2)作为评测催化剂催化碳烟燃烧活性的指标.
2 结果与讨论 2.1 物相分析图 1是采用3种方法制备的铜钴尖晶石氧化物催化剂的XRD图谱.3个催化剂样品均在19.1°、31.4°、37.0°、39.0°、45.1°、56.0°、59.6°、65.7°、67.0°、77.5°和83.2°具有明显的衍射峰.这些衍射峰分别与立方相铜钴尖晶石的标准卡片(PDF No.01-1155)的(111)、(220)、(331)、(222)、(440)、(442)、(551)、(440)、(551)、(553)和(444)晶面处相符.此外, 3种方法制备的铜钴尖晶石氧化物均在35.5°、48.7°和61.5°表现出不同程度的杂峰.这些衍射峰分别与CuO标准卡片(PDF No.80-1917)的(002)、(202)和(113)晶面处相符.溶胶凝胶法、固相反应法和尿素水热法制备的铜钴尖晶石氧化物催化剂衍射峰强度依次增强, 说明催化剂样品的结晶度依次增高[26].Wang等[27]研究发现, 尖晶石表面的微量氧化铜相能够与尖晶石相产生协同作用, 与纯净的尖晶石相比, 表现出更高的丙烷催化氧化活性.

|
图 1 不同方法制备的铜钴尖晶石氧化物的XRD图谱 Fig.1 XRD patterns of CuCo2O4 spinel oxides prepared by different methods |
制备的催化剂样品进行了氮气吸脱附测试, 以获得其比表面积、孔容、孔径参数.从表 1可见, 溶胶凝胶法、固相反应法和尿素水热法制备的铜钴尖晶石氧化物比表面积依次为0.8、3.6和2.1 m2·g-1, 孔容依次为0.001、0.007和0.004 cm3·g-1.相比于传统复合氧化物和负载催化剂, 尖晶石氧化物催化剂比表面积和孔容等参数均较小.这主要是因为该催化剂在制备过程中经长时间高温煅烧, 但这是形成稳定尖晶石结构的重要因素之一[28-29].固相反应法制得的铜钴尖晶石氧化物表现出最大的比表面积和孔容.固相反应法、尿素水热法和溶胶凝胶法等不同方法制备的铜钴尖晶石氧化物比表面积和孔容依次减小.
| 表 1 不同方法制备的铜钴尖晶石氧化物的物理特性 Table 1 Physical properties of CuCo2O4 spinel oxides prepared by different methods |
图 2所示为3种方法制备的铜钴尖晶石氧化物的SEM图像, 即催化剂颗粒的表面形貌.图 2-a为溶胶凝胶法制备的铜钴尖晶石氧化物, 可以看出, 该催化剂呈现出较大的面包状颗粒, 且颗粒之间相对紧凑, 表现出较小的孔隙, 这与BET结果中较小的表面积和孔容结果一致.图 2-b为固相反应法制备的催化剂, 这种催化剂主要呈现出大小不一的类球型颗粒.图 2-c为尿素水热法制备的催化剂, 呈现出带有孔隙的片状结构, 并且片状结构上附着有类球型小颗粒.这可能是由于水热制备过程中尿素缓慢分解, 且随着水热温度的上升, 反应釜内压力逐渐升高, 晶体缓慢析出, 导致所形成的晶体颗粒较小[22].

|
图 2 不同方法制备的铜钴尖晶石氧化物的SEM图像 Fig.2 SEM images of CuCo2O4 spinel oxides prepared by(a)SG; (b)SS; (c)HT |
图 3为3种方法制备的铜钴尖晶石氧化物的H2-TPR谱图.由图可见, 制备的铜钴尖晶石氧化物催化剂的还原峰整体位于100~350 ℃之间, 且均可分为两个较明显的还原峰.低温还原峰来源于Cu2+→ Cu+→ Cu0和Co3+→ Co2+的共同还原, 而高温还原峰则是Co2+→ Co0的还原[30].溶胶凝胶法、固相反应法和尿素水热法制备的催化剂氢气吸附量依次为12.0、13.0和13.1 mmol/g, 彼此相差不大.但还原峰位置差异明显, 其中水热法制得的催化剂两个还原峰所对应温度值最小, 为174.2和231.1 ℃, 其次是固相反应法所对应的还原峰, 还原温度为189.6和242.3 ℃, 而溶胶凝胶法所对应的还原峰温度为196.1和252.9 ℃.图 3中可以看出Co3O4样品在297.4 ℃处存在一个强烈的还原峰, 并且在其右侧伴有强烈的肩峰, 它们分别属于Co3+→ Co2+和Co2+→ Co0的分步还原[31]; 而CuO样品在331.6和351.5 ℃处的两个还原峰分别属于Cu2+→ Cu+和Cu+→ Cu0的分步还原[32].与纯Co3O4和CuO物种相比, 铜钴尖晶石氧化物具有更佳的低温还原性, 这可归因于CuCo2O4尖晶石的形成以及Cu和Co物种之间的协同作用.碳烟催化氧化过程主要发生在200~500 ℃之间[33], 催化剂的氧化活性与低温还原性密切相关.此外, 改善的还原性有益于催化剂内部晶格氧(O2-)流动[34], 从而有利于催化反应.
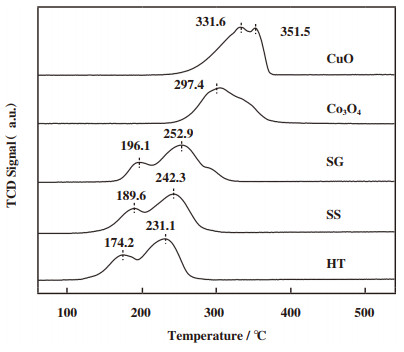
|
图 3 不同方法制备的铜钴尖晶石氧化物的H2-TPR谱图 Fig.3 H2-TPR patterns of CuCo2O4 catalysts prepared by different methods |
采用XPS技术测试了3种方法制备的铜钴尖晶石氧化物的表面化学成分和元素价态分布, 其结果列于表 2.所制备的3个铜钴尖晶石样品表面的铜和钴元素含量有所差异, 其中水热法制备的样品表面具有最丰富的钴含量, 表明有更多的钴元素暴露在催化剂表面.相应地, 其表面的铜元素含量较低.
| 表 2 XPS测试获得的铜钴尖晶石氧化物的表面成分 Table 2 The surface compositions of CuCo2O4 spinel oxides obtained by XPS analysis |
图 4(a)为不同方法制备的铜钴尖晶石氧化物催化剂的Co 2p XPS谱图.各样品均有两个明显的峰, 结合能在778.0~784.0 eV间的谱图属于Co 2p3/2, 而结合能在793.0~800.0 eV间的谱图属于Co 2p1/2.此外, Co 2p1/2和Co 2p2/3可分别解卷积为两个峰, Co2+阳离子特征峰的中心位置在780.8和796.4 eV处, Co3+阳离子特征峰的中心位置在779.7和794.8 eV处[35].中心位置在788.0和804.0 eV处的两个宽而弱的峰属于Co3+的卫星峰.通过对应的峰面积可获得不同价态钴元素阳离子的比值, 其结果列于表 2.结果表明, 水热法制备的铜钴尖晶石氧化物具有最大的Co3+/(Co2++Co3+)比例.由于Cu2+离子的半径(0.073 nm)和Co2+离子(0.074 nm)相当, 在催化剂制备过程中, 当Cu2+进入Co3O4晶格以取代Co2+位点形成铜钴尖晶石氧化物中, 可能引起晶格的微小畸变, 从而提高表面Co3+的浓度[36].而水热法制备过程中, 由于整个水热过程缓慢发生, 这可以促进暴露的低价态Co物种在高热处理下被氧化为Co3+物种.在所制得的铜钴尖晶石氧化物中, 尿素水热法制备尖晶石氧化物的Co3+/(Co2++Co3+)比值最高(36.4%), 接下来依次为固相反应法(34.5%)和溶胶凝胶法(28.4%).
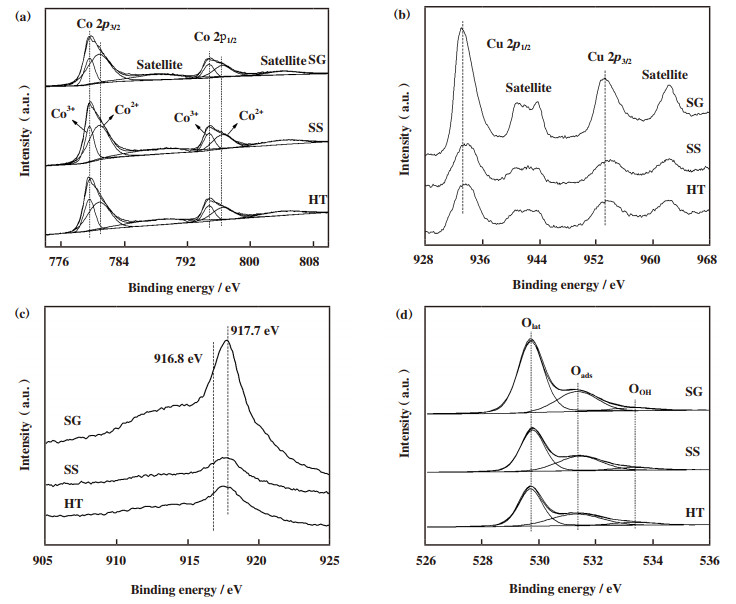
|
图 4 不同方法制备的铜钴尖晶石氧化物的XPS谱图 Fig.4 XPS spectra of CuCo2O4 spinel oxides prepared by different methods (a)Co 2p; (b)Cu 2p; (c)Cu LMM; (d)O 1s |
图 4(b)为不同方法制备的铜钴尖晶石氧化物催化剂的Cu 2p XPS谱图.Cu 2p3/2结合能位于933.4 eV, Cu 2p1/2结合能位于953.3 eV.此外, 在结合能942.0和961.3 eV处存在强烈的Cu2+特有的卫星峰, 这表明在所制备的铜钴尖晶石氧化物中铜主要以Cu2+形式存在[37].在Cu 2p上无法准确识别还原态的Cu物种, 因此采用俄歇电子能谱进一步区分铜元素的化学状态.如图 4(c)所示, 俄歇电子动力能谱中917.7 eV的峰对应于Cu2+物种, 而在动力结合能为916.8 eV的弱峰归属于Cu+物种[38].此外, 俄歇电子动力能谱中并未在919.0~920.0 eV范围内发现属于Cu0的峰, 说明所制备的样品中几乎不含有单质铜.据报道, Cu+的存在与样品的制备有关, 与煅烧过程中两种氧化物界面处的相互作用有关[33].这表明碳烟燃烧过程中可能会发生Co3+/Co2+和Cu2+/Cu+之间的氧化还原循环.
图 4(d)为所制备的铜钴尖晶石氧化物的O 1s谱图.该峰可解卷积为3个子峰.表明所有尖晶石复合氧化物上均存在3类氧物种.峰中心位置在530.2~528.9 eV归于晶格氧(O2-, 记为Olatt)物种, 中心位置在530.7~531.7 eV归于吸附氧(O2-, O-, 记为Oads)物种, 而中心位置在532.9~533.5 eV归于羟基氧(记为OOH)物种[14].研究表明, 过渡金属氧化物的氧物种脱附按照从易到难的顺序依次为: O2(ads)> O2-(ads)> O-(ads)> O2-(latt)[39-40].表 2列出了表面氧物种组成.所制备的尖晶石氧化物中的Oads/(Oads+Olatt)比例为以下顺序: HT(39.8%)> SS(38.1%)>SG(28.7%).水热法制备的尖晶石氧化物的Oads/(Oads+Olatt)比例为39.8%, 远高于其他方法制备的催化剂.这表明不同的制备方法会影响铜钴尖晶石氧化物表面的氧物种分布, 而水热法可使得铜钴尖晶石氧化物拥有更多的表面活性吸附氧物种.
2.6 氧物种分析通常, O2-TPD曲线表明制备的催化剂样品对氧物种的吸附、活化和脱附性能.氧物种的状态和脱附温度与其催化活性相关.如图 5所示, 脱附温度低于600 ℃的α-O2峰归因于表面吸附氧物种, 而脱附温度高于600 ℃的峰(β-O2)可能与晶格氧物种的释放有关[33].对于不同方法制备的铜钴尖晶石氧化物, 可以清楚地观察到氧脱附曲线有显著区别.而α-O2峰的局部放大显示在放大的附图中, 可以观察到两个α-O2峰分别在100~350 ℃和350~600 ℃.按照金属氧化物中的氧物种脱附难易程度分析, 上述两个α-O2峰可能分别属于O2(ads)和O-(ads)物种.此外, 3种方法制备的催化剂在600 ℃以下的O2脱附量分别为HT=75 μmol/g, SS=47 μmol/g, SG=38 μmol/g.这与XPS表征O 1s数据结果相一致.
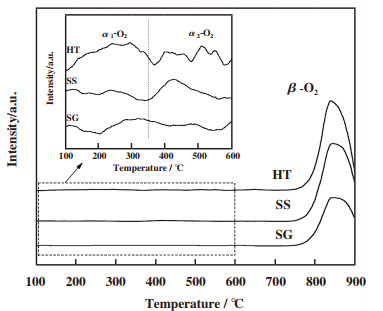
|
图 5 不同方法制备的铜钴尖晶石氧化物的O2-TPD谱图 Fig.5 O2-TPD patterns of CuCo2O4 spinel oxides prepared by different methods |
图 6为不同方法制备的铜钴尖晶石氧化物催化碳烟燃烧的转化曲线, 可以明显看出3种方法制备的催化剂均可有效降低碳烟的燃烧温度.表 3为尖晶石氧化物催化碳烟燃烧温度T10、T50、T90和SCO2值.在10% O2/N2气氛下, 无催化剂碳烟燃烧温度T50为586 ℃.在3种方法制备的尖晶石氧化物中, 尿素水热法制得的催化剂表现出最佳催化活性, 碳烟燃烧温度T50为521 ℃, 比无催化剂时降低了65 ℃.接下来依次为固相反应法和溶胶凝胶法, 它们的碳烟燃烧温度T50分别为535和571 ℃.此外, 尿素水热法和固相反应法制备催化剂的CO2选择性分别为98.6%和94.6%, 而溶胶凝胶法仅有48.1%.而且当NO加入反应后, 碳烟的燃烧温度进一步降低.其中水热法依然具有最佳活性, 其碳烟燃烧温度T50降至414 ℃, 相比于无催化剂时同种反应气氛下该温度值降低了161 ℃.

|
图 6 不同方法制备的铜钴尖晶石氧化物催化碳烟燃烧的转化曲线 Fig.6 Soot conversion over CuCo2O4 spinel oxides prepared by different methods (a)10%O2; (b)0.1% NO+10% O2 |
| 表 3 不同方法制备的铜钴尖晶石氧化物催化碳烟燃烧的T10、T50、T90和SCO2 Table 3 T10, T50, T90 and SCO2 of soot oxidation over CuCo2O4 spinel oxides prepared by different methods |
碳烟催化氧化过程发生在碳烟、催化剂以及反应气体(O2/NO)三相表面[41].催化剂的形貌会影响其与碳烟的接触, 从而对碳烟催化燃烧活性影响较大[42].SEM结果表明水热法制备的铜钴尖晶石催化剂表面呈现出微小片状结构, 并且伴有细小颗粒, 能够与碳烟颗粒形成良好的接触, 利于活性位点与碳烟的接触和物质传递.催化剂比表面积对于催化活性也有较大影响, 较大的比表面积往往表现出较好的活性, 但也不是决定性因素[43].而且尖晶石氧化物催化剂整体呈现出较小的比表面积(小于5 m2/g), 诸如还原性、表面氧物种等因素似乎对催化碳烟燃烧贡献更大[44].图 3所示, 尿素水热法制备的铜钴尖晶石氧化物比其它两种制备方法还原峰温度低, 为174.2和231.1 ℃.而固相反应法和溶胶凝胶法的还原峰分别位于189.6以及242.3, 196.1和252.9 ℃.此外, 就还原过程的耗氢量而言, 尿素水热法(13.1 mmol/g)>固相反应法(13.0 mmol/g)>溶胶凝胶法(12.0 mmol/g).总而言之, 尿素水热法制备的催化剂表现出较佳的低温还原性.研究表明催化剂的低温还原性能有助于碳烟的催化氧化[45].XPS结果表明水热法制备的尖晶石结构同时具有Co2+和Co3+.一般来说, 八面体位置Co3+是氧化的活性中心, 有利于电子转移过程中氧空位的形成和氧物种的转化[11].另外, 氧物种Oads比Olatt更容易脱离催化剂表面与碳烟发生反应, 而被认为是活性氧物种[32, 46].图 7为碳烟燃烧温度T50值和Oads/(Oads+Olatt)和Co3+/(Co2++Co3+)的关系.溶胶凝胶法、固相反应法和尿素水热法制备催化剂的碳烟燃烧温度T50值随着Oads/(Oads+Olatt)和Co3+/(Co2++Co3+)比值的增加而逐渐降低.尿素水热法制备的催化剂表现出最高的表面Oads(39.8%)和Co3+(36.4%)比例以及最佳的催化性能.此外, 催化剂含有更多Co3+阳离子和表面吸附氧物种增强了NO的氧化生成NO2, 而NO2具有比NO更强的氧化性, 可以通过NO2辅助机制进一步提高催化碳烟燃烧活性[31, 37].

|
图 7 铜钴尖晶石氧化物T50(0.1% NO+10%O2/N2)、Oads/(Oads+Olatt)和Co3+/(Co2++Co3+)的关系 Fig.7 Plots of T50(0.1% NO+10%O2/N2), Oads/(Oads+Olatt)ratio and Co3+/(Co2++Co3+)ratio of the CuCo2O4 spinel oxides |
另外, 优化催化剂(HT)进行了循环实验以检测其稳定性.图 8(a)显示了5次循环实验中碳烟燃烧温度变化, 5次循环实验中碳烟燃烧温度T50依次为414、424、427、432和434 ℃.HT催化剂并未出现明显失活.并且随着催化剂的多次使用, 其活性有逐渐稳定的趋势.图 8(b)为循环测试前后催化剂的XRD谱图.可以看出衍射峰位置和强度并未发生明显变化, 说明催化结构未发生改变, 催化剂具有较好的稳定性.
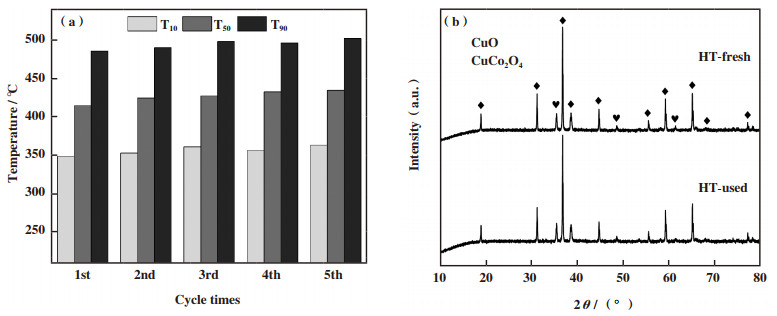
|
图 8 HT催化剂催化碳烟燃烧循环测试以及测试前后的XRD图谱 Fig.8 Soot oxidation over HT catalyst from cycle tests and XRD patterns of fresh, used catalysts |
表 4总结了之前报道的有关尖晶石型催化剂催化烟尘燃烧性能的研究结果.可以看出, 对于优化催化剂-尿素水热法制备的铜钴尖晶石氧化物, 其催化碳烟燃烧活性略逊于采用模板法等制备的具有特殊结构的催化剂, 但要优于采用常规简易方法制备的同类型催化剂.
| 表 4 有关尖晶石型催化剂催化碳烟燃烧性能的总结 Table 4 Summary of the catalytic performances reported over spinel oxides for soot oxidation |
图 9为铜钴尖晶石氧化物催化氧化碳烟过程的可能反应路径.催化过程中氧空位、表面活性氧、催化活性的关系可以通过马尔斯-范克雷维伦机理(Mars and van Krevelen mechanism, MvK)[54]和活性氧机理来分析.催化剂表面的吸附氧物种(Oads)首先与碳烟发生反应而被消耗[40].同时Co3+还原到Co2+过程中发生晶格氧(O2-)向吸附氧物种的转化, 并伴随着氧空位的产生.产生的氧空位可以通过气态氧(O2(g))补充[55].在此过程中, 低价态的Cu+和Co2+物种由于气态氧的补充重新氧化到Cu2+和Co3+, 并再次参与到反应中.气态的NO分子也在这一过程中部分转化为氧化活性更强的NO2, 促进了碳烟氧化过程[37].铜钴尖晶石催化剂中的Cu和Co氧化物之间的相互作用增强了催化剂上的氧气移动性, 加速了气态氧到晶格氧以及活性吸附氧物种在氧空位和金属活性位点上的转换.铜钴尖晶石氧化物催化剂中Co3+/(Co3++Co2+)比例影响活性吸附氧物种和氧空位的转换速率, 从而在催化过程中起着重要作用[14].碳烟颗粒通过上述过程在催化剂表面被不断氧化.

|
图 9 铜钴尖晶石氧化物催化氧化碳烟的可能反应路径 Fig.9 Potential reaction pathway of the CuCo2O4 spinel oxides for soot combustion |
采用3种不同方法制备了铜钴摩尔比为1∶2的尖晶石氧化物催化剂.制得的催化剂均可有效降低碳烟的燃烧温度, 活性顺序为尿素水热法(HT)>固相反应法(SS)>溶胶凝胶法(SG).
3.2尿素水热法制得的催化剂具有最佳活性.在10% O2/N2气氛接触条件下, 碳烟燃烧温度T50从586降至521 ℃, CO2选择性由58.7%增至98.6%.当NO加入反应后, 尖晶石氧化物的碳烟催化活性进一步提高, 碳烟燃烧温度T50降至414 ℃, CO2选择性为96.6%.
3.3尿素水热法制备的铜钴尖晶石氧化物催化剂呈现出带有孔隙的微小片状结构, 改善了催化剂与碳烟的接触.此外催化剂表面还具有丰富的Co3+物种和较高的活性吸附氧含量、出色的低温还原特性, 进而促进了碳烟催化燃烧.
| [1] |
a. Reşitoğlu İ A, Altinişik K, Keskin A. The pollutant emissions from diesel-engine vehicles and exhaust aftertreatment systems[J]. Clean Technol Environ Policy, 2015, 17(1): 15-27. b. Fan Rong-rong(樊蓉蓉), Li Zhao-qiang(李兆强), Wang Yu(王雨), et al. Influence of calcination temperature on performance of diesel oxidation catalyst PtPd-(x) ZrO2/Ce0.3Zr0.7O2-Al2O3(焙烧温度对柴油车氧化催化剂Pt-Pd-(x) ZrO2/Ce0.3Zr0.7O2-Al2O3性能的影响)[J]. J Mol Catal (China)(分子催化), 2021, 35(5): 428-439. c. Bi Xiu-ru(毕秀茹), Meng Xu(孟旭), Zhao Pei-qing (赵培庆). Application of manganese oxide octahedral molecular sieves(OMS-2) in clean synthesis of organic compounds(氧化锰八面体分子筛(OMS-2)在有机分子清洁合成中的催化氧化应用)[J]. J Mol Catal (China)(分子催化), 2020, 34(5): 462-474. |
| [2] |
Ni M, Huang J, Lu S, et al. A review on black carbon emissions, worldwide and in China[J]. Chemosphere, 2014, 107: 83–93.
DOI:10.1016/j.chemosphere.2014.02.052 |
| [3] |
Kumar P A, Tanwar M D, Bensaid S, et al. Soot combustion improvement in diesel particulate filters catalyzed with ceria nanofibers[J]. Chem Eng J, 2012, 207/208: 258–266.
DOI:10.1016/j.cej.2012.06.096 |
| [4] |
Hernández-Giménez A M, Castelló D L, BuenoLópez A. Diesel soot combustion catalysts: Review of active phases[J]. Chem Pap, 2014, 68(9): 1154–1168.
|
| [5] |
Neha , Prasad R, Singh S V. A review on catalytic oxidation of soot emitted from diesel fuelled engines[J]. J Environ Chem Eng, 2020, 8(4): 103945.
DOI:10.1016/j.jece.2020.103945 |
| [6] |
Shangguan W F, Teraoka Y, Kagawa S. Simultaneous catalytic removal of NOx and diesel soot particulates over ternary AB2O4 spinel-type oxides[J]. Appl Catal B, 1996, 8(2): 217–227.
DOI:10.1016/0926-3373(95)00070-4 |
| [7] |
a. Salker A V, Desai M S F. CO-NO/O2 redox reactions over Cu substituted cobalt oxide spinels[J]. Catal Commun, 2016, 87: 116-119. 7b. Su Hui-juan(苏慧娟), Zheng Yu-hua(郑玉华), Sun Xun(孙逊), et al. The research of CO monoxide in different atmosphere on Au/Cu/FLA catalysts at low temperature(Au/Cu/FLA催化剂在不同气氛中CO低温氧化性能研究)[J]. J Mol Catal (China)(分子催化), 2020, 34(1): 65-71. 7c. Xing Jin-yuan(邢金媛), Zhu Meng-ting(朱梦婷), Wang Ting(王婷), et al. CO Oxidation over Pt/MOx(M= Ni, Fe, Co, Ce) catalysts and their tolerance to CO2 and H2O (Pt/MOx(M=Ni, Fe, Co, Ce)催化剂上CO氧化反应中抗H2O与CO2的性能研究)[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 309-322. |
| [8] |
Li G, Li L, Shi J, et al. One-pot pyrolytic synthesis of mesoporous MCo2O4(4.5) (M=Mn, Ni, Fe, Cu) spinels and its high efficient catalytic properties for CO oxidation at low temperature[J]. J Mol Catal A: Chem, 2014, 390: 97–104.
DOI:10.1016/j.molcata.2014.03.012 |
| [9] |
Roberts C A, Paidi V K, Shepit M, et al. Effect of Cu substitution on the structure and reactivity of CuxCo3-xO4 spinel catalysts for direct NOx decomposition[J]. Catal Today, 2021, 360: 204–212.
DOI:10.1016/j.cattod.2020.05.050 |
| [10] |
Jia L, Guo Y, Thanh Phong T, et al. Synergistic effect of copper and cobalt in Cu-Co bulk oxide catalyst for catalytic oxidation of volatile organic compounds[J]. J Chem Eng Jpn, 2012, 45(8): 590–596.
DOI:10.1252/jcej.11we239 |
| [11] |
Lim T H, Park S B, Kim J M, et al. Ordered mesoporous MCo2O4(M=Cu, Zn and Ni) spinel catalysts with high catalytic performance for methane combustion[J]. J Mol Catal A: Chem, 2017, 426: 68–74.
DOI:10.1016/j.molcata.2016.11.002 |
| [12] |
Zhang C, Wang J, Yang S, et al. Boosting total oxidation of acetone over spinel MCo2O4(M=Co, Ni, Cu) hollow mesoporous spheres by cation-substituting effect[J]. J Colloid Interface Sci, 2019, 539: 65–75.
DOI:10.1016/j.jcis.2018.12.061 |
| [13] |
Liu Hua(刘华), Xu Shan(许珊), Wang Xiao-lai(王晓来). Fabrication of mesoporous Co3O4-CeO2 and their application in selective oxidation of CO(介孔Co3O4-CeO2复合氧化物的制备及在CO选择性氧化中的应用)[J]. J Mol Catal(China)(分子催化), 2011, 25(4): 301–307.
|
| [14] |
Zeng J, Xie H, Zhang G, et al. Facile synthesis of CuCo spinel composite oxides for toluene oxidation in air[J]. Ceram Int, 2020, 46(13): 21542–21550.
DOI:10.1016/j.ceramint.2020.05.257 |
| [15] |
Xie X, Li Y, Liu Z Q, et al. Low-temperature oxidation of CO catalysed by Co3O4 nanorods[J]. Nature, 2009, 458(7239): 746–749.
DOI:10.1038/nature07877 |
| [16] |
Andana T, Piumetti M, Bensaid S, et al. CuO nanoparticles supported by ceria for NOx-assisted soot oxidation: Insight into catalytic activity and sintering[J]. Appl Catal B, 2017, 216: 41–58.
DOI:10.1016/j.apcatb.2017.05.061 |
| [17] |
Lv Yi-hao(吕义浩), Li Ning(李凝), Ma Qing-feng(马庆丰), et al. Effect of preapration methods on the performance of the Co3O4-CeO2(制备方法对Co3O4-CeO2催化剂催化性能的影响研究)[J]. J Mol Catal (China)(分子催化), 2010, 24(5): 450–455.
|
| [18] |
Sun Xiao(孙晓), Gao Zi-cheng(高子程), Liu jing(刘晶), et al. Effects of preparation methods on the structure and oxidation properties of CoxZr1-xO2 catalyst(制备方法对CoxZr1-xO2催化剂结构和氧化甲苯性能的影响)[J]. Environ Chem(China)(环境化学), 2020, 39(3): 653–661.
|
| [19] |
Wang S, Xu X, Zhu J, et al. Effect of preparation method on physicochemical properties and catalytic performances of LaCoO3 perovskite for CO oxidation[J]. J Rare Earths, 2019, 37(9): 970–977.
DOI:10.1016/j.jre.2018.11.011 |
| [20] |
Wang Y, Arandiyan H, Liu Y, et al. Template-free scalable synthesis of flower-like Co3-xMnxO4 spinel catalysts for toluene oxidation[J]. ChemCatChem, 2018, 10(16): 3429–3434.
DOI:10.1002/cctc.201800598 |
| [21] |
Song Z, Zhao M, Mao Y, et al. Turning the structural properties and redox ability of Co-La catalyst in the catalytic oxidation of toluene[J]. Sep Purif Technol, 2021, 274: 119025.
DOI:10.1016/j.seppur.2021.119025 |
| [22] |
Ren W, Ding T, Yang Y, et al. Identifying oxygen activation/oxidation sites for efficient soot combustion over silver catalysts interacted with nanoflower-like hydrotalcite-derived CoAlO metal oxides[J]. ACS Catal, 2019, 9(9): 8772–8784.
DOI:10.1021/acscatal.9b01897 |
| [23] |
郭谨玮. 镧锰钙钛矿型催化剂制备及其甲烷燃烧催化性能[D]. 合肥: 合肥工业大学, 2016.
Guo Jin-wei. Preparation of lanthanum manganese perovskite catalysts and their catalytic performance for methane combustion[D]. Hefei: Hefei University of Technology, 2016.
|
| [24] |
Mao Dong-sen(毛东森), Tao Li-hua(陶丽华), Wang Qian(王倩), et al. Low temperature oxidation of CO over CuO-CeO2 catalyst prepared by solid-state chemical reaction(CuO-CeO2的固相反应法制备及其催化CO低温氧化性能)[J]. J Inorg Chem(China)(无机化学学报), 2010, 26(3): 447–452.
|
| [25] |
Gao Er-hao(高尔豪), Zhao Zi-long(赵子龙), Zhu Shaodong(朱绍东), et al. Preparation of MnCr2O4 catalysts and their NH 3-SCR performance(MnCr2O4催化剂的制备方法及其SCR脱硝性能研究)[J]. J Chem Eng Chin Univ (China)(高校化学工程学报), 2021, 35(2): 355–362.
DOI:10.3969/j.issn.1003-9015.2021.02.021 |
| [26] |
Chen L, Liu G, Feng N, et al. Effect of calcination temperature on structural properties and catalytic soot combustion activity of MnOx/wire-mesh monoliths[J]. Appl Surf Sci, 2019, 467/468: 1088–1103.
DOI:10.1016/j.apsusc.2018.10.223 |
| [27] |
Wang B, Yang G, Yang Q, et al. Fabrication of nanohybrid spinel@CuO catalysts for propane oxidation: Modified spinel and enhanced activity by temperaturedependent acid sites[J]. ACS Appl Mater Interfaces, 2021, 13(23): 27106–27118.
DOI:10.1021/acsami.1c06633 |
| [28] |
Hirunsit P, Faungnawakij K. Cu-Cr, Cu-Mn, and CuFe spinel-oxide-type catalysts for reforming of oxygenated hydrocarbons[J]. J Phys Chem C, 2013, 117(45): 23757–23765.
DOI:10.1021/jp407717c |
| [29] |
Liu H, Zhuang M, Zhang Z, et al. Catalytic removal of soot particles over MnCo2O4 catalysts prepared by the auto-combustion method[J]. Chem Pap, 2018, 72(8): 1973–1979.
DOI:10.1007/s11696-018-0397-7 |
| [30] |
Li J R, Wang F K, He C, et al. Catalytic total oxidation of toluene over carbon-supported Cu-Co oxide catalysts derived from Cu-based metal organic framework[J]. Powder Technol, 2020, 363: 95–106.
DOI:10.1016/j.powtec.2019.12.060 |
| [31] |
Zhai G, Wang J, Chen Z, et al. Boosting soot combustion efficiency of Co3O4 nanocrystals via tailoring crystal facets[J]. Chem Eng J, 2018, 337: 488–498.
DOI:10.1016/j.cej.2017.12.141 |
| [32] |
Shen J, Rao C, Fu Z, et al. The influence on the structural and redox property of CuO by using different precursors and precipitants for catalytic soot combustion[J]. Appl Surf Sci, 2018, 453: 204–213.
DOI:10.1016/j.apsusc.2018.05.087 |
| [33] |
Cui B, Yan S, Xia Y, et al. CuxCe1-xO2 nanoflakes with improved catalytic activity and thermal stability for diesel soot combustion[J]. Appl Catal A, 2019, 578: 20–29.
DOI:10.1016/j.apcata.2019.03.025 |
| [34] |
Reddy B M, Thrimurthulu G, Katta L, et al. Structural characteristics and catalytic activity of nanocrystalline ceria-praseodymia solid solutions[J]. J Phys Chem C, 2009, 113(36): 15882–15890.
DOI:10.1021/jp903644y |
| [35] |
Lu C Y, Tseng H H, Wey M Y, et al. Al2O3-supported Cu-Co bimetallic catalysts prepared with polyol process for removal of BTEX and PAH in the incineration flue gas[J]. Fuel, 2009, 88(2): 340–347.
DOI:10.1016/j.fuel.2008.09.012 |
| [36] |
Xie H, Tan X, Zhang G, et al. Porous Co-based spinel oxide prepared by soft-template method for ethanol oxidation[J]. J Phys Chem Solids, 2020, 146: 109562.
DOI:10.1016/j.jpcs.2020.109562 |
| [37] |
Zeng Zhe(曾哲), Zhu Zhi-xin(朱志新), Guo Wei-qi(郭伟琦), et al. Simultaneous catalytic removal of soot and NOx byordered mesoporous CuFe2O4(有序介孔CuFe 2O4同时催化去除碳烟与NOx)[J]. J Mol Catal (China)(分子催化), 2021, 35(1): 13–21.
|
| [38] |
Piumetti M, Bensaid S, Andana T, et al. Cerium-copper oxides prepared by solution combustion synthesis for total oxidation reactions: From powder catalysts to structured reactors[J]. Appl Catal B, 2017, 205: 455–468.
DOI:10.1016/j.apcatb.2016.12.054 |
| [39] |
Zou G, Xu Y, Wang S, et al. The synergistic effect in Co-Ce oxides for catalytic oxidation of diesel soot[J]. Catal Sci Technol, 2015, 5(2): 1084–1092.
DOI:10.1039/C4CY01141D |
| [40] |
Lin Jun-min(林俊敏), Fu Ming-li(付名利), Zhu WenBo(朱文波), et al. An investigation of surface reactive species on MnOx(0.4)-CeO2 catalyst towards soot oxidation(氧化碳烟的MnOx(0.4)-CeO2催化剂表面活性物种研究)[J]. J Mol Catal(China)(分子催化), 2014, 28(2): 165–173.
|
| [41] |
Lin H, Li Y, Shangguan W, et al. Soot oxidation and NO x reduction over BaAl2O4 catalyst[J]. Combust Flame, 2009, 156(11): 2063–2070.
DOI:10.1016/j.combustflame.2009.08.006 |
| [42] |
Tsai Y C, Nhat Huy N, Lee J, et al. Catalytic soot oxidation using hierarchical cobalt oxide microspheres with various nanostructures: Insights into relationships of morphology, property and reactivity[J]. Chem Eng J, 2020, 395: 124939.
DOI:10.1016/j.cej.2020.124939 |
| [43] |
Jin B, Wu X, Weng D, et al. Roles of cobalt and cerium species in three-dimensionally ordered macroporous CoxCe1-xO catalysts for the catalytic oxidation of diesel soot[J]. J Coll Inter Sci, 2018, 532: 579–587.
DOI:10.1016/j.jcis.2018.08.018 |
| [44] |
Guan B, Lin H, Zhan R, et al. Catalytic combustion of soot over Cu, Mn substitution CeZrO2-nanocomposites catalysts prepared by self-propagating high-temperature synthesis method[J]. Chem Eng Sci, 2018, 189: 320–339.
DOI:10.1016/j.ces.2018.05.063 |
| [45] |
Fino D, Bensaid S, Piumetti M, et al. A review on the catalytic combustion of soot in diesel particulate filters for automotive applications: From powder catalysts to structured reactors[J]. Appl Catal A, 2016, 509: 75–96.
DOI:10.1016/j.apcata.2015.10.016 |
| [46] |
Yu Hua-liang(俞华良), Chen Ming-xia(陈铭夏), Zou Gu-chu(邹谷初), et al. Simultaneously catalytic removal of diesel particulates and NOx on K/LiCoO2 catalysts(K/LiCoO2的制备及其同时催化去除碳烟和NOx的性能研究)[J]. J Mol Catal(China)(分子催化), 2013, 27(1): 49–54.
|
| [47] |
Zawadzki M, Staszak W, Lopez-Suarez F E, et al. Preparation, characterisation and catalytic performance for soot oxidation of copper-containing ZnAl2O4 spinels[J]. Appl Catal A, 2009, 371(1/2): 92–98.
|
| [48] |
Zhang S, Zhu X, Zheng C, et al. Study on catalytic soot oxidation over spinel type ACo2O4(A=Co, Ni, Cu, Zn) catalysts[J]. Aerosol Air Qual Res, 2017, 17(9): 2317–2327.
DOI:10.4209/aaqr.2016.12.0564 |
| [49] |
Zawadzki M, Walerczyk W, López-Suárez F E, et al. CoAl2O4 spinel catalyst for soot combustion with NO/O2[J]. Catal Commun, 2011, 12(13): 1238–1241.
DOI:10.1016/j.catcom.2011.04.021 |
| [50] |
Álvarez-Docio C M, Portela R, Reinosa J J, et al. Ptfree CoAl2O4 catalyst for soot combustion with NOx/O2[J]. Appl Catal A, 2020, 591: 117404.
DOI:10.1016/j.apcata.2019.117404 |
| [51] |
Fino D, Russo N, Saracco G, et al. Catalytic removal of NO x and diesel soot over nanostructured spinel-type oxides[J]. J Catal, 2006, 242(1): 38–47.
DOI:10.1016/j.jcat.2006.05.023 |
| [52] |
Wang J, Yang G, Cheng L, et al. Three-dimensionally ordered macroporous spinel-type MCr2O4(M=Co, Ni, Zn, Mn) catalysts with highly enhanced catalytic performance for soot combustion[J]. Catal Sci Technol, 2015, 5(9): 4594–4601.
DOI:10.1039/C5CY00761E |
| [53] |
Zhao M, Deng J, Liu J, et al. Roles of surface-active oxygen species on 3DOM cobalt-based spinel catalysts MxCo3-xO4(M=Zn and Ni) for NOx-assisted soot oxidation[J]. ACS Catal, 2019, 9(8): 7548–7567.
DOI:10.1021/acscatal.9b01995 |
| [54] |
Doornkamp C, Ponec V. The universal character of the Mars and Van Krevelen mechanism[J]. J Mol Catal A: Chem, 2000, 162(1/2): 19–32.
|
| [55] |
Zhu H, Xu J, Yichuan Y, et al. Catalytic oxidation of soot on mesoporous ceria-based mixed oxides with cetyltrimethyl ammonium bromide (CTAB)-assisted synthesis[J]. J Coll Inter Sci, 2017, 508: 1–13.
DOI:10.1016/j.jcis.2017.07.114 |
 2021, Vol. 35
2021, Vol. 35


