化石燃料燃烧产生大量的二氧化碳, 全球的二氧化碳排放量日益增加, 大气中二氧化碳含量从工业化前0.028%上升到2020年的0.0417%[1].随着地球上二氧化碳含量的增加, 气候变化、海平面上升以及全球冰川体积减少等问题也随之而来.为减少大气中二氧化碳浓度的增加, 需要控制二氧化碳的排放, 减少化石燃料的使用, 即寻找可替代化石燃料的能源; 或者对排放的二氧化碳进行捕获、存储和利用.当前替代能源有了一定的发展, 可以取代一部分的化石燃料, 但化石燃料的主要地位在未来几十年内仍然不可撼动, 所以二氧化碳的利用就显得尤为重要[2].二氧化碳加氢生成甲醇是利用二氧化碳的途径之一, 既可减少二氧化碳的排放, 又可以生成高附加值的甲醇, 而甲醇有望成为内燃机和燃料电池的燃料, 更是重要的基础化学原料[3].
目前工业上合成气制甲醇的传统催化剂为Cu基催化剂, 主要存在问题是Cu基催化剂同时催化逆水煤气反应, 甲醇的选择性低, 生成的水加速了Cu基催化剂的失活.在CO2/H2混合气氛下, Cu/ZnO/Al2O3催化剂稳定性也较差.很多研究都针对Cu基催化剂进行改进, 孔秀琴等利用溶胶-凝胶自燃烧法制备CuO-ZnO/Al2O3, 发现柠檬酸用量等于化学计量比时, 催化剂的催化性能最好, 其CO2转化率、甲醇选择性分别为13.7%、61.2%, 甲醇的时空产率为333 mg·g-1·h-1[4].吕鹏等利用固相研磨法制备Cu/ZnO催化剂, 其CO2转化率、甲醇选择性和产率分别为28.3%、74.3%和21.0%[5].加入助剂也会对催化剂性能有所影响, 李博等研究了在Cu-Fe-Zn催化剂中加入碱性金属K作为助剂, nK/nCu/nFe/nZn=0.1/1/3/1时, 催化剂的催化活性最高, CO2的转化率达到68.7%[6].贵金属由于其高活性得到研究者的关注, 但其过高成本抑制了其工业应用.另外, 贵金属结合二氧化碳的能力也比较弱, 对醇的选择性相对较差.近年来, 金属有机骨架(MOF)结构受到了研究人员的关注, 其具有高的比表面积、独特的结构特征以及稳定性.针对不同的需求, 可以对MOF材料进行调控[3, 7-9].MOF材料因其优异的特点, 在气体存储和分离、多相催化、传感、药物输送等方面具有应用前景[10].利用铜纳米晶体修饰UiO-66(Zr)得到Cu@UiO-66催化剂, 其在0.1 MPa, 175~250 ℃, CO2∶H2=1∶3条件下甲醇的选择性可达到100%[11]; 将Pd@ ZIF-8在400 ℃空气中焙烧制备Pd/ZnO催化剂, 在270 ℃, 4.5 MPa反应条件下, 催化剂具有14.9%的CO2转化率和56.2%的甲醇选择性[12].
ZIF-67是含钴的MOF材料, 有机框架结构有效隔离钴颗粒从而促进钴的分散性.钴的电子结构为3d74s2, d带空穴有利于H-H键的断裂形成活性氢, 从而具有较高的加氢反应活性[13].本课题组已报道, 在600 ℃下氮气气氛焙烧ZIF-67得到Co/C-N材料, 具有很高的二氧化碳加氢活性, 在225 ℃反应温度下CO2转化率可达到59.8%, 但甲醇的选择性小于10%[14], 产物主要为甲烷.将钴碳氮材料进一步在氧气条件下焙烧得到外壳为Co3O4, 内核为金属Co的Co@Co3O4/C-N催化剂, 部分氧化的钴削弱了金属钴的强加氢能力, Co3O4表面的氧空穴促进了二氧化碳的解离吸附, 醇选择性大大提高[15].
金属氧化物在还原性气氛下产生的氧空位和缺陷可以有效地吸附活化二氧化碳.人们发现, 氧化铈容易形成氧空位并与钴之间形成较强的相互作用, 有利于二氧化碳加氢反应[16], ZrO2的氧缺陷也可以促进二氧化碳等含氧物质的吸附[17], ZrO2加入还可以提高催化剂的还原性能[18-19].
将不同比例的硝酸铈与硝酸锆共浸渍到ZIF-67载体上, 氮气气氛焙烧, 制备出钴碳氮材料负载铈锆复合氧化物催化剂, 探究其对二氧化碳加氢制甲醇活性与选择性的影响.
1 实验部分 1.1 催化剂制备 1.1.1 ZIF-67的制备称取9.75 g 2-甲基咪唑、4.32 g六水合硝酸钴(Ⅱ)分别溶解于300 mL甲醇溶液中, 将硝酸钴甲醇溶液缓慢引流倒入2-甲基咪唑甲醇溶液, 300 r/min转速下搅拌10 min, 静置24 h后, 离心收集紫色沉淀, 甲醇洗涤3次, 60 ℃干燥24 h, 研磨成粉末状得ZIF-67.
1.1.2 催化剂的制备制备10%、25%、50%CeO2/Co/C-N: 分别将0.48、1.55、3.10 g六水合硝酸铈(Ⅲ)(铈在催化剂中的含量为10%、25%、50%)溶解于去离子水, 称取1.5 g ZIF-67于梨形瓶中, 将硝酸铈水溶液逐滴滴入ZIF-67中并搅拌均匀, 用旋转蒸发仪干燥(50 ℃)至不沾瓶壁.静置过夜, 100 ℃干燥10 h.在N2气氛下600 ℃焙烧5 h, 升温速率为5 ℃/min.
制备25% ZrO2/Co/C-N: 将药品改为2.35 g五水合硝酸锆(Ⅳ)(锆在催化剂中的质量含量为25%), 其余步骤与上述一致.
制备25%Ce0.67Zr0.33O2/Co/C-N: 将药品改为1.55 g六水合硝酸铈(Ⅲ)、0.77 g五水合硝酸锆(Ⅳ)(nCe∶nZr=2∶1), 其余步骤与上述一致.
制备25%Ce0.5Zr0.5O2/Co/C-N: 将药品改为1.55 g六水合硝酸铈(Ⅲ)、1.53 g五水合硝酸锆(Ⅳ)(nCe∶nZr=1∶1), 其余步骤与上述一致.
1.2 催化剂的表征X-射线粉末衍射(XRD): 待测样品的晶相结构在Brucker公司生产的Brucker Advanced D8型X-射线粉末衍射仪上进行分析.该仪器使用Cu靶Kα射线(λ=0.1506 nm), 工作电压为40 kV, 工作电流为40 mA, 大角测试范围10°~80°, 扫描步长为0.0167°.由Scherrer方程计算样品晶粒直径大小.
氢气程序升温还原(H2-TPR): 在美国ZetonAltmira公司的AMI-200型多功能催化剂程序升温脱附仪上进行测试.称取5 mg的催化剂, 在Ar气氛下(30 mL/min), 以10 ℃/min的升温速率升至150 ℃, 保持1 h, 自然降温至50 ℃后, 通入10%H2/Ar(30 mL/min)直至基线平稳, 以10 ℃/min的升温速率升温至800 ℃.
X-射线光电子能谱(XPS): 在美国Thermal Electron公司生产的VG Mulitilab 2000型仪器表征样品表面元素组成及价态信息.使用Al(Kα)靶, 以污染碳的C 1s峰结合能值(284.8 eV)为标准, 校正电荷效应产生的结合能偏移.
1.3 催化剂的CO2加氢活性测试在管式固定床反应器(长53 cm, 内径8 mm)对催化剂进行反应活性测试.催化剂用量为0.2 g, 反应气体为22.5%CO2/67.5%H2/10.0%N2混合气, 气体流速为20 mL/min, 空速为6 L·gcat-1·h-1, 以2 ℃/min的升温速率升温至反应温度进行反应.反应体系的尾气通入Agilent GC 3000进行在线分析, 液相产物在冷肼收集后在Agilent GC 4890离线分析.有关计算公式如下:
| ${{\rm{X}}_{{\rm{C}}{{\rm{O}}_2}}}(\% ) = \frac{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{in}}}} -{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{out }}}}}}{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{in}}}}}} \times 100 $ |
| ${{\rm{S}}_{{\rm{C}}{{\rm{H}}_4}}}(\% ) = \frac{{{{\rm{n}}_{{\rm{C}}{{\rm{H}}_4}, {\rm{out}}}}}}{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{in}}}} -{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{out}}}}}} \times 100 $ |
| ${{\rm{S}}_{{\rm{CO}}}}(\% ) = \frac{{{{\rm{n}}_{{\rm{CO}}, {\rm{out}}}}}}{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{in}}}} -{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{out}}}}}} \times 100 $ |
| ${{\rm{S}}_{{\rm{Cn}}}}(\% ) = \frac{{{{\rm{n}}_{{\rm{product, out}}}} \times {\rm{carbon\;number}}}}{{{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{in}}}} -{{\rm{n}}_{{\rm{C}}{{\rm{O}}_2}, {\rm{out}}}}}} \times 100 $ |
| ${{\rm{S}}_{{{\rm{C}}_{2 + }}}}(\% ) = {{\rm{S}}_{{{\rm{C}}_2}}}{\rm{ + }}{{\rm{S}}_{{{\rm{C}}_3}}} + {{\rm{S}}_{{{\rm{C}}_4}}} $ |
| ${{\rm{S}}_{{\rm{MeOH}}}}(\% ) = 100 -{{\rm{S}}_{{\rm{C}}{{\rm{H}}_4}}} -{{\rm{S}}_{{\rm{CO}}}} -{{\rm{S}}_{{{\rm{C}}_{2 + }}}} $ |
| ${\rm{ST}}{{\rm{Y}}_{{\rm{MeOH}}}}\left( {{\rm{mmol}} \cdot {\rm{g}}_{{\rm{cat}}}^{ -1} \cdot {{\rm{h}}^{ -1}}} \right) = \frac{{{\rm{GHSV}} \times {{\mathrm{\phi}} _{{\rm{C}}{{\rm{O}}_2}}} \times {{\rm{X}}_{{\rm{C}}{{\rm{O}}_2}}} \times {{\rm{S}}_{{\rm{MeOH}}}} \times 1000}}{{22.4\;{\rm{L}} \cdot {\rm{mo}}{{\rm{l}}^{ -1}}}} $ |
式中GHSV为反应空速, 单位L·gcat-1·h-1; ϕCO2为原料气中CO2的体积分数.
2 结果与讨论 2.1 催化剂XRD分析对载体和催化剂的物相组成进行了XRD表征.根据文献[20]报道的方法合成了ZIF-67, XRD谱图如图 1所示, 合成的ZIF-67与文献报道的XRD谱图一致[21].
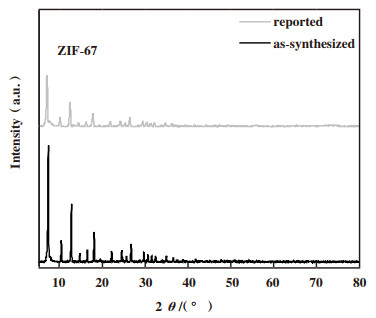
|
图 1 ZIF-67的XRD谱图 Fig.1 XRD patterns of ZIF-67 |
制备的4个催化剂的XRD谱图如图 2a, 10%、25%CeO2/Co/C-N均出现了立方萤石结构的CeO2特征峰(PDF: 43-1002), 随着负载量增加, 其峰强度逐渐增强, 说明其结晶度增加.除了CeO2特征峰, 10%CeO2/Co/C-N还出现立方尖晶石结构的Co3O4(PDF: 42-1467)特征峰, 当负载量增加到25%时, Co3O4的峰强度明显减弱, 说明催化剂表面的钴被氧化铈所覆盖.当往25%CeO2/Co/C-N掺入锆时, 铈与锆形成了铈锆固溶体Ce0.75Zr0.25O2(PDF: 28-0271), 主峰由28.55°偏移至28.89°, 说明Zr4+进入到CeO2中形成固溶体, ZrO2较小的离子半径使CeO2晶格收缩, 这与文献一致[18].随着催化剂中锆含量的增加, 催化剂中Ce0.75Zr0.25O2铈锆固溶体结构并未发生改变, 也没有观察到其它锆物种, 说明多余的锆物种以无定形的形态存在于催化剂中.除了铈锆复合物, 25%Ce0.67Zr0.33O2/Co/C-N还有金属Co的形成; 而25%Ce0.5Zr0.5O2/Co/C-N的钴物种是Co3O4和金属Co的混合物.说明在铈中适量加入锆形成铈锆固溶体, 铈锆固溶体与钴物种较强的相互作用力可以阻止金属Co被氧化.但过量锆的加入又会削弱这一作用力, 部分金属钴被氧化为Co3O4.
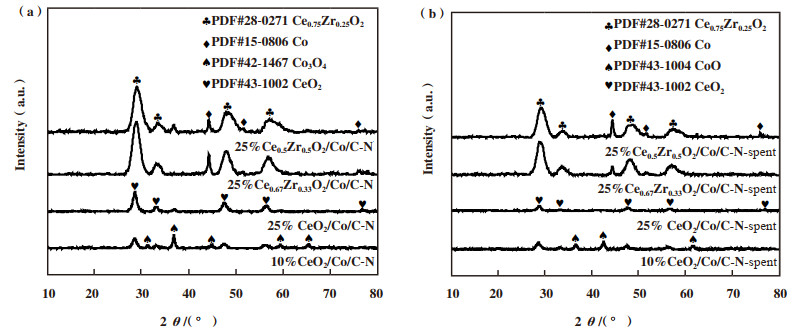
|
图 2 CexZr1-xO2/Co/C-N催化剂的XRD谱图 Fig.2 XRD patterns of fresh CexZr1-xO2/Co/C-N catalysts a)fresh one; b)used one |
图 2b是反应后催化剂的XRD谱图, 与反应前催化剂对比, 反应后的催化剂有一定程度的还原, 10%CeO2/Co/C-N的Co3O4被还原为CoO(PDF: 42-1467), 而25% CeO2/Co/C-N催化剂在反应后XRD并没有检测出金属Co物种, 可能是由于钴物种分散较好, 低于XRD检测限.25%Ce0.5Zr0.5O2/Co/C-N的Co3O4在反应后还原为Co.
2.2 催化剂还原性能分析(H2-TPR)利用H2程序升温还原对催化剂的还原性能进行探究,如图 3所示.可以看到10%CeO2/Co/C-N在283、337以及564 ℃温度下有3个还原峰, 分别归属于Co3O4还原为CoO, CoO继续还原为金属Co[22]以及CeO2的还原[23].25%CeO2/Co/C-N同样具有Co3O4和CoO的还原峰, 但强度相对10%CeO2/Co/C-N催化剂较小, 这是由于随着Ce负载量的提高, 钴的相对含量减少, 还原峰强度减弱.掺入锆的催化剂, CoO的还原温度明显降低, 进一步验证了加入锆可以改善催化剂的还原性能.25%Ce0.5Zr0.5O2/Co/C-N在500 ℃未出现还原峰, 可能是由于铈与锆的相互作用太强导致其没有被还原.ZrO2的结构比较稳定, 在800 ℃内没有发生还原[24].

|
图 3 CexZr1-xO2/Co/C-N催化剂的H2-TPR谱图 Fig.3 H2-TPR profiles of CexZr1-xO2/Co/C-N catalysts |
利用XPS对催化剂的表面元素组成以及价态进行分析, CexZr1-xO2/Co/C-N催化剂的Ce 3d、Co 2p、N 1s和O 1s和Zr 3d的XPS谱图如图 4所示, 部分相关数据列于表 1.图 4a显示了CexZr1-xO2/Co/C-N催化剂的Ce 3d XPS谱图.催化剂的光谱在882.5(v)、885.2(v')、889.0(v'')、898.6(u0)、901.1(u)、903.4(u')、907.6(u'')和916.9(u''')eV处有8个峰.v'和u'处的峰归因于Ce3+离子, 而v、v''、u0、u、u''和u'''处的峰归因于Ce4+离子.将Ce3+和Ce4+的峰面积积分后计算得到Ce3+在各个催化剂的所占的比例基本一样.将Co 2p3/2峰拟合为两个峰, 结合能约为780.1和781.7 eV, 分别归属于Co3+和2+.从XRD结果来看, 掺入锆以后, 有金属Co的形成, 但XPS谱图均没有发现金属Co的峰, 可能是由于催化剂放置过程中表面被氧化.对N 1s的XPS光谱进行分峰, 在结合能约为398.5、399.5和400.6 eV的峰分别归属于吡啶N, 吡咯N和石墨N[25], 从表 1可以看到25%Ce0.67Zr0.33O2/Co/C-N的氮含量最高, 而25%Ce0.5Zr0.5O2/Co/C-N的氮含量最低.碱性氮的存在, 有利于CO2在催化剂上的吸附.对于O 1s谱图, 将其拟合为3个峰, 分别是表面晶格氧, 缺陷氧和吸附氧[15], 对应于结合能约为529.9、531.4和532.9 eV的峰.从表 1的计算数据可以知道, 掺入锆后催化剂中氧缺陷的含量有所增加, 说明锆的掺入有利于氧空位的形成, 改善催化剂的性能.图 4e显示了25%Ce0.67Zr0.33O2/Co/C-N和25%Ce0.5Zr0.5O2/Co/C-N的Zr 3d的XPS谱图, 谱图中在结合能约为182.2和184.5 eV处显示两个峰, 分别归属于Zr 3d5/2和Zr 3d3/2, 表明Zr元素在催化剂中是以+4价的氧化态存在[26].25%Ce0.5Zr0.5O2/Co/C-N的锆氧化物含量明显要比25%Ce0.67Zr0.33O2/Co/C-N的高.

|
图 4 CexZr1-xO2/Co/C-N催化剂的XPS谱图 Fig.4 XPS spectra of CexZr1-xO2/Co/C-N catalysts (a)Ce 3d; (b)Co 2p; (c)N 1s; (d)O 1s; (e)Zr 3d |
| 表 1 CexZr1-xO2/Co/C-N催化剂的XPS数据 Table 1 Summary of XPS data for CexZr1-xO2/Co/C-N catalysts |
对制备的催化剂进行了CO2加氢性能测试, 测试温度从200到300 ℃.从图 5a和5b都可以看出, 随着反应温度的升高, CO2转化率逐渐增加, 甲醇选择性逐渐下降.这是由于受动力学影响, 温度升高, 分子间碰撞加剧, 尽管CO2加氢合成甲醇和甲烷化反应都是放热反应, 但此时催化剂CO2转化率远低于平衡转化率, 因此催化剂活性主要受动力学影响, CO2转化率随温度升高而增加.根据之前XRD结果表明催化剂在反应后都有一定程度的还原, 这主要是由于反应气中CO2∶H2为1∶3, 是还原性气氛, 随着反应温度的升高, 催化剂还原程度加剧, 而金属钴含量的提高更有利于甲烷化反应, 因此甲烷选择性随温度升高而升高.从图 5a中可以看出, Co/C-N催化剂CO2转化率最高, 但80%以上产物都是甲烷, 在Co/C-N中负载10%Ce, CO2转化率迅速下降, 当负载量提高到25%时, CO2转化率又有所提高, 但甲醇选择性却仅略有减小, 而进一步提高铈的含量到50%, 催化剂在275 ℃以下CO2转化率都极低, 因此优化铈的含量为25%.在25%Ce的基础上加入锆, 25%Ce0.67Zr0.33O2/Co/C-N的CO2转化率继续提高, 醇的选择性仍然减少.这主要是因为铈锆固溶体与钴间强相互作用抑制了表面金属钴的氧化.金属钴较强的加氢作用促进了CO2甲烷化反应.25%Ce0.5Zr0.5O2/Co/C-N的CO2转化率相较于25%CeO2/Co/C-N的明显降低, 醇的选择性没有明显的改变, 结合之前表征结果, 我们认为过量锆的加入又会削弱铈锆固溶体与钴间的相互作用力, 部分金属钴被氧化为Co3O4, 导致催化剂活性下降.另外过量的锆可能将部分金属钴活性位点覆盖, 也导致其CO2转化率下降.作为对比, 在Co/C-N材料上负载25%的ZrO2, 与25%CeO2/Co/C-N相比, 催化剂转化率以及选择性较差, 250 ℃以上反应, 甲醇的选择性极低, 主要生成甲烷及C2+烃类物质.

|
图 5 (a)不同Ce含量, (b)不同Ce/Zr比例催化剂在不同温度下的催化性能 Fig.5 Performance of catalysts at different temperature (a) different content of Ce, (b) different molar ratio of Ce/Zr 反应条件: P = 2 MPa, GHSV=6 L·gcat-1·h-1, T = 200~300 ℃ Reaction condition: P = 2 MPa, GHSV = 6 L·gcat-1·h-1, T = 200~300 ℃ |
催化剂在225 ℃的产物分布由图 6可以看到.CexZr1-xO2/Co/C-N催化剂的主要产物是甲烷, 说明催化剂中金属钴是主要活性位点[27].10%CeO2/Co/C-N催化剂具有最高的甲醇选择性性, 为30.2%, 但其CO2转化率较低, 只有8.6%.25%Ce0.67Zr0.33O2/Co/C-N具有最高的CO2转化率(34.2%)和甲醇的时空收率(3.0 mmol/·gcat-1·h-1).产物中除了甲烷和甲醇, 还有少量C2+烃类物质, 未检测到CO的生成.在225 ℃对CexZr1-xO2/Co/C-N催化剂进行稳定性测试, 从图 7可以看到, 随着反应的进行, 催化剂的CO2转化率慢慢增加, 约在8 h后趋于稳定, 并在30 h内未发生失活现象.表 2列出了反应的碳平衡分布, 可以看到, 进料的碳与出料的碳基本一致.
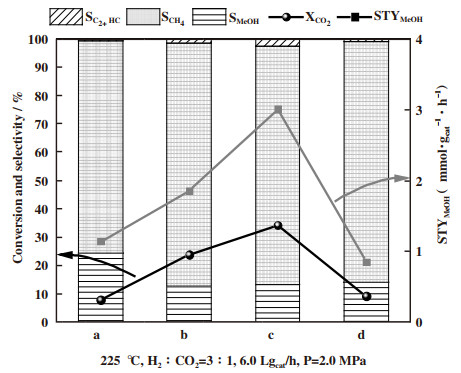
|
图 6 催化剂在225 ℃的产物分布 Fig.6 Products distribution of catalysts at 225 ℃ a. 10%CeO2/Co/C-N; b. 25%CeO2/Co/C-N; c. 25%Ce0.67Zr0.33O2/ Co/C-N; d. 25%Ce0.5Zr0.5O2/Co/C-N |
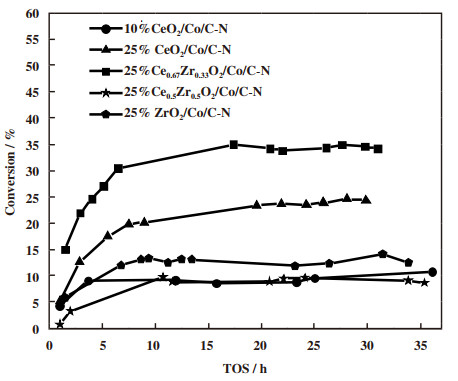
|
图 7 CexZr1-xO2/Co/C-N催化剂的稳定性测试 Fig.7 Catalyst stability experiment over CexZr1-xO2/Co/C-N catalysts 反应条件: P = 2 MPa, GHSV=6 L·gcat-1·h-1, T = 225 ℃ Reaction condition: P = 2 MPa, GHSV = 6 L·gcat-1·h-1, T = 225 ℃ |
| 表 2 碳平衡分布 Table 2 Carbon equilibrium distribution |
前期研究结果表明在氮气下焙烧ZIF-67可以一步法制备Co/C-N催化剂, 焙烧过程中产生的还原气体将钴物种还原为金属钴.Co/C-N催化剂具有较高的CO2加氢性能, 但是产物主要为甲烷, 因此本次实验中我们在Co/C-N的基础上浸渍硝酸铈或硝酸铈和硝酸锆的混合物, 制备CexZr1-xO2/Co/C-N复合催化剂.在Co/C-N浸渍硝酸铈后, 原本被还原的金属钴重新氧化成Co3O4, 催化剂CO2转化率下降, 甲醇选择性却上升.优化后确定铈的最优含量为25%.在25%Ce的基础上进一步添加锆, 适量锆的加入形成Ce0.75Zr0.25O2铈锆固溶体, 铈锆固溶体和钴之间强相互作用可有效阻止金属钴的氧化, 但加入过量的锆主要以无定形的形式存在于催化剂中, 又会降低催化剂的活性.XPS结果表明25%Ce0.67Zr0.33O2/Co/C-N催化剂具有最多的氧空穴, 最高的氮含量, 氧空穴及碱性氮都有利于CO2的解离吸附.尽管25%Ce0.67Zr0.33O2/Co/C-N催化剂中钴含量最低, 但主要是金属钴, 而其他催化剂主要是Co3O4或金属钴与Co3O4的混合物, 金属钴具有较高的氢解离能力, 是主要的催化中心位点.CO2加氢活性评价结果也表明25%Ce0.67Zr0.33O2/Co/C-N催化剂CO2转化率及甲醇时空收率都最高.将我们的催化剂与常见CO2加氢催化剂进行对比, 结果列于表 3.从表中可以看出, 我们制备的25%Ce0.67Zr0.33O2/Co/C-N较常规铜基催化剂在相似反应条件下具有更高的CO2转化率, 但甲醇选择性较低.而常规浸渍法制备的Co/CeO2催化剂虽然具有很高的CO2转化率, 但甲醇选择性几乎为零, 主要产物为甲烷, 以及少量CO.这也说明在CO2加氢反应中金属钴的强加氢作用主要促进了甲烷化反应.如何既能保留金属钴较高的CO2加氢活性, 又能抑制其过强的加氢能力, 提高甲醇选择性是我们后续研究的主要目标, 比如在Co/C-N材料基础上添加Cu、In2O3等其它具有合成甲醇活性的组分.
| 表 3 CO2加氢催化剂活性对比结果 Table 3 Performance comparison of CO2 hydrogenation catalysts |
采用浸渍法制备出不同含量的钴碳氮负载铈锆复合氧化物CexZr1-xO2/Co/C-N催化剂, 通过调控铈锆比例调节催化剂的催化性能.铈锆固溶体与钴之间的强相互作用抑制了表面金属钴的氧化, 铈锆固溶体中较多的氧空穴, 使得催化剂具有更高的CO2转化率.在T=225 ℃, P=2 MPa, GHSV=6 L·gcat-1· h-1反应条件下, 优化后的25%Ce0.67Zr0.33O2/Co/C-N具有最佳的催化性能, CO2转化率为34.2%, 甲醇选择性为13.2%, 甲醇时空收率为3.0 mmol·gcat-1·h-1.
| [1] |
a. Hu J, Qu T, Liu Y, et al. Core-shell-structured CNT@hydrous RuO2 as a H2/CO2 fuel cell cathode catalyst to promote CO2 methanation and generate electricity[J]. J Mater Chem A, 2021, 9(12): 7617-7624. b. Shi Xiao-yu(时晓羽), LI Hui-peng(李会鹏), ZHAO Hua(赵华). Solid-state Z-scheme photocatalytic systems to splitting water and photo-reduce carbon dioxide(全固态Z-Scheme光催化材料应用于二氧化碳还原和光催化分解水研究进展))[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 391-397. c. Zhang Jun-jie(张俊杰), TURSUN Yalkunjan(亚力昆江·吐尔逊), TALIFU Dilinuer(迪丽努尔·塔力甫), et al. In situ synthesis of Ru doped hollow BiOBr microsphere as an efficient photocatalyst for photocatalytic CO2 reduction and organic pollutant degradation(Ru掺杂BiOBr空心微球的原位合成及其光催化CO2还原和有机污染物降解性能研究))[J]. J Mol Catal (China)(分子催化), 2020, 34(1): 8-18. |
| [2] |
a. Wang Q, Luo J, Zhong Z, et al. CO2 capture by solid adsorbents and their applications: Current status and new trends[J]. Energy Environ Sci, 2011, 4(1): 42-55. b. Liang Zhi-ming(梁志铭), Nie Xiao-wa(聂小娃), Guo Xin-wen(郭新闻), et al. DFT insight into the effect of Ni doping on hydrocarbons synthesis from CO2 hydrogenation over Fe catalyst(镍掺杂对Fe催化剂上CO2加氢制烃影响的理论计算研究)[J]. J Mol Catal (China)(分子催化), 2020, 34(4): 293-303. |
| [3] |
Jiang X, Nie X, Guo X, et al. Recent advances in carbon dioxide hydrogenation to methanol via heterogeneous catalysis[J]. Chem Rev, 2020, 120(15): 7984–8034.
DOI:10.1021/acs.chemrev.9b00723 |
| [4] |
Kong Xiu-qin(孔秀琴), Tang Xing-jiang(唐兴江), Xu Shan(许珊), et al. Preparation of CuO-ZnO/Al2O3 by sol-gel auto-combustion method and its catalytic property for methanol synthesis from CO2 hydrogenation(溶胶-凝胶自燃烧法制备的CuO-ZnO/Al2O3及催化二氧化碳加氢制甲醇的性能研究)[J]. J Mol Catal (China)(分子催化), 2013, 27(2): 159–165.
|
| [5] |
Lu Peng(吕鹏), Xu Ding(徐钉), Shen Dong-ming(申东明), et al. Preparation of Cu-based catalyst by solidphase grinding method with citric acid assisting and performance research in methanol synthesis reaction from CO2 hydrogenation(柠檬酸辅助固相研磨法制备铜基催化剂及在CO2加氢合成甲醇反应中的性能研究)[J]. J Mol Catal(China)(分子催化), 2017, 31(2): 141–151.
|
| [6] |
Li Bo(李博), Zhen Wen-long(甄文龙), Lu Gong-xuan(吕功煊), et al. The adjustment of product distribution of CO2 hydrogenation over Cu-Fe-Zn catalyst while maintaining its activity via potassium addition(K助剂对催化剂Cu-Fe-Zn二氧化碳加氢反应产物分布的调整)[J]. J Mol Catal (China)(分子催化), 2015, 29(2): 152–163.
|
| [7] |
Porosoff M D, Yan B, Chen J G. Catalytic reduction of CO2 by H2 for synthesis of CO, methanol and hydrocarbons: Challenges and opportunities[J]. Energy Environ Sci, 2016, 9(1): 62–73.
DOI:10.1039/C5EE02657A |
| [8] |
Kattel S, Liu P, Chen J G. Tuning selectivity of CO2 hydrogenation reactions at the metal/oxide interface[J]. J Am Chem Soc, 2017, 139(29): 9739–9754.
DOI:10.1021/jacs.7b05362 |
| [9] |
Xu Min-jie(徐敏杰), Zhu Ming-hui(朱明辉), Chen Tian-yuan(陈天元), et al. High value utilization of CO2: Research progress of catalyst for hydrogenation of CO2 to methanol(CO2高值化利用: CO2加氢制甲醇催化剂研究进展)[J]. Chem Ind Eng Pro(化工进展), 2021, 40(2): 565–576.
|
| [10] |
Ding M, Flaig R W, Jiang H L, et al. Carbon capture and conversion using metal-organic frameworks and MOF-based materials[J]. Chem Soc Rev, 2019, 48(10): 2783–2828.
DOI:10.1039/C8CS00829A |
| [11] |
Rungtaweevoranit B, Baek J, Araujo J R, et al. Copper nanocrystals encapsulated in Zr-based metal-organic frameworks for highly selective CO2 hydrogenation to methanol[J]. Nano Lett, 2016, 16(12): 7645–7649.
DOI:10.1021/acs.nanolett.6b03637 |
| [12] |
Yin Y, Hu B, Li X, et al. Pd@zeolitic imidazolate framework-8 derived PdZn alloy catalysts for efficient hydrogenation of CO2 to methanol[J]. Appl Catal B, 2018, 234: 143–152.
DOI:10.1016/j.apcatb.2018.04.024 |
| [13] |
Xie F, Xu S, Deng L, et al. CO2 hydrogenation on Co/CeO2-δ catalyst: Morphology effect from CeO2 support[J]. Int J Hydrogen Energy, 2020, 45(51): 26938–26952.
DOI:10.1016/j.ijhydene.2020.05.260 |
| [14] |
Fang T, Liu B, Lian Y, et al. Selective methanol synthesis from CO2 hydrogenation over an In2O3/Co/C-N catalyst[J]. Ind Eng Chem Res, 2020, 59(43): 19162–19167.
DOI:10.1021/acs.iecr.0c02639 |
| [15] |
Lian Y, Fang T, Zhang Y, et al. Hydrogenation of CO2 to alcohol species over Co@Co3O4/C-N catalysts[J]. J Catal, 2019, 379: 46–51.
DOI:10.1016/j.jcat.2019.09.018 |
| [16] |
Deng K, Lin L, Rui N, et al. Studies of CO2 hydrogenation over Cobalt/Ceria catalysts with in situ characterization: The effect of cobalt loading and metal-support interactions on the catalytic activity[J]. Catal Sci Tech, 2020, 10(19): 6468–6482.
DOI:10.1039/D0CY00962H |
| [17] |
Foraita S, Fulton J L, Chase Z A, et al. Impact of the oxygen defects and the hydrogen concentration on the surface of tetragonal and monoclinic ZrO2 on the reduction rates of stearic acid on Ni/ZrO[J]. 2 Chem Eur J, 2015, 21(6): 2423–2434.
DOI:10.1002/chem.201405312 |
| [18] |
Oukaci R, Singleton A H, Goodwin J G. Comparison of patented Co F-T catalysts using fixed-bed and slurry bubble column reactors[J]. Appl Catal A, 1999, 186(1): 129–144.
|
| [19] |
Zhong Shun-he(钟顺和), Wang Xi-tao(王希涛), Mi Lixin(宓立新), et al. Catalytic performance of ZrO2-SiO2 supported Ni-Cu alloy catalysts for CO2 hydrogenation(ZrO2-SiO2负载Cu-Ni催化剂的CO2加氢反应性能)[J]. J Mol Catal (China)(分子催化), 2001, 15(3): 170–174.
DOI:10.3969/j.issn.1001-3555.2001.03.003 |
| [20] |
Aijaz A, Masa J, Rösler C, et al. Co@Co3O4 encapsulated in carbon nanotube-grafted nitrogen-doped carbon polyhedra as an advanced bifunctional oxygen electrode[J]. Angew Chem, Int Ed, 2016, 55(12): 4087–4091.
DOI:10.1002/anie.201509382 |
| [21] |
Zhou P, Yu C, Jiang L, et al. One-pot reductive amination of carbonyl compounds with nitro compounds with CO/H2O as the hydrogen donor over non-noble cobalt catalyst[J]. J Catal, 2017, 352: 264–273.
DOI:10.1016/j.jcat.2017.05.026 |
| [22] |
Zeng Liang-peng(曾良鹏), Huang Fan(黄樊), Zhu Xing(祝星), et al. Chemical looping conversion of methane over CeO2-based and Co3O4-based Co3O4-CeO2 oxygen carriers: Controlling of product selectivity(铈基与钴基Co 3O4-CeO2氧载体上甲烷化学链转化特性: 产物选择性控制)[J]. Chem J Chin Univer(高等学校化学学报), 2017, 38(1): 115–125.
|
| [23] |
Lin B, Liu Y, Heng L, et al. Effect of ceria morphology on the catalytic activity of Co/CeO2 catalyst for ammonia synthesis[J]. Catal Commun, 2017, 101: 15–19.
DOI:10.1016/j.catcom.2017.07.015 |
| [24] |
Zhang H, Wang J, Zhang Y, et al. A study on H2-TPR of Pt/Ce0.27Zr0.73O2 and Pt/Ce0.27Zr0.70La0.03Ox for soot oxidation[J]. Appl Surf Sci, 2016, 377: 48–55.
DOI:10.1016/j.apsusc.2016.03.102 |
| [25] |
Zhang H, Hwang S, Wang M, et al. Single atomic iron catalysts for oxygen reduction in acidic media: Particle size control and thermal activation[J]. J Am Chem Soc, 2017, 139(40): 14143–14149.
DOI:10.1021/jacs.7b06514 |
| [26] |
Jampaiah D, Damma D, Chalkidis A, et al. MOF-derived ceria-zirconia supported Co3O4 catalysts with enhanced activity in CO2 methanation[J]. Catal Today, 2020, 356: 519–526.
DOI:10.1016/j.cattod.2020.05.047 |
| [27] |
Schubert M, Pokhrel S, Thomé A, et al. Highly active Co-Al2O3-based catalysts for CO2 methanation with very low platinum promotion prepared by double flame spray pyrolysis[J]. Catal Sci Tech, 2016, 6(20): 7449–7460.
DOI:10.1039/C6CY01252C |
| [28] |
Li C M, Yuan X D, Fujimoto K. Development of highly stable catalyst for methanol synthesis from carbon dioxide[J]. Appl Catal A: Gen, 2014, 469: 306–311.
DOI:10.1016/j.apcata.2013.10.010 |
| [29] |
Li L, Mao D S, Yu J, et al. Highly selective hydrogenation of CO2 to methanol over CuO-ZnO-ZrO2 catalysts prepared by a surfactant-assisted coprecipitationmethod[J]. J Power Sour, 2015, 279: 394–404.
DOI:10.1016/j.jpowsour.2014.12.142 |
| [30] |
Konsolakis M, Lykaki M, Stefa S, et al. CO2 hydrogenation over nanoceria-supported transition metal catalysts: Role of ceria morphology(nanorods versus nanocubes) and active phasenature (Co versus Cu)[J]. Nanomaterials, 2019, 9(12): 1739–1760.
DOI:10.3390/nano9121739 |
 2021, Vol. 35
2021, Vol. 35


