羰基化合物是合成香料、药品和食品添加剂等精细化学品的重要中间体[1].目前, 工业上主要采用伯醇和仲醇选择氧化的方法来制备相应的羰基化合物[2].传统的醇氧化反应过程中, 通常需要使用过量的铬试剂、锰试剂或高价碘氧化剂, 这类试剂不仅会造成等量废物的产生, 还会对环境构成危害.随着人们对环境和绿色原子经济性的日益重视, 开发绿色、可持续的催化醇选择性氧化反应的新方法是非常有必要的[3-4].
电催化是指在电场的作用下, 负载在电极表面或添加在溶液相中的修饰物影响电极上发生的电子转移反应, 以控制反应方向、促进或抑制反应速率等[5]的催化反应.由于电催化氧化方法具有反应条件温和、环境友好等优点, 是一种非常有前景的绿色工艺[6].因此, 从环境友好和可持续的角度出发, 开发绿色、高效的醇选择性电催化氧化方法是实现绿色醇选择性氧化的有效途径之一[7].
1 直接电催化醇氧化体系直接电催化醇氧化体系作为最简单的电催化方式, 醇在电极的表面直接失去电子而发生氧化生成醛或酮(原理如图 1所示).在该方法中, 除了使用反应原料外, 基本上不再需要其它化学试剂, 因此, 该方法是一种节能环保、成本低下、符合绿色发展的有机合成方式[8].
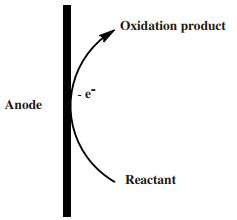
|
图 1 直接电氧化原理示意图 Fig.1 Schematic diagram of direct electrooxidation |
早些时候, Yu等[9]研究过在H2SO4作为酯催化剂的作用下, Pb-PbO2电极对异丁醇直接电氧化合成异丁酸异丁酯.实验结果表明: 电流效率为58%, 产率为66%, 异丁醇经过回收后能继续直接电解氧化, 以使其得到充分利用.其Pb-PbO2电极上异丁醇直接电氧化电极反应如下:
| ${{\left( \text{C}{{\text{H}}_{3}} \right)}_{2}}\text{CHC}{{\text{H}}_{2}}\text{OH}\xrightarrow[\text{Pb}-\text{Pb}{{\text{O}}_{2}}/{{\text{H}}_{2}}\text{S}{{\text{O}}_{4}}]{\text{-}{{\text{e}}^{\text{-}}}}{{\left( \text{C}{{\text{H}}_{3}} \right)}_{2}}\text{CHCOOC}{{\text{H}}_{2}}{{\left( \text{C}{{\text{H}}_{3}} \right)}_{2}} $ | (1) |
在直接电氧化的研究中, Cui等[10]研究了在碱性溶液中, 使用Ti/Ni/NiO作为催化反应的电极, 研究环己醇的直接电催化氧化过程.使用CV(循环伏安)分析, 得出Ti/Ni/NiO对环己醇的催化氧化效果是比较好的.其Ti/Ni/NiO电极发生的氧化还原过程如下:
| $\text{NiO+OH}\to \text{NiOOH +}{{\text{e}}^{-}} $ | (2) |
该研究证实了环己醇在该电极上的电氧化过程是符合电催化机理的.但是该电催化反应进行时, 会在电极表面形成一层较致密的沉积膜而影响电催化氧化效果.这也是大多数直接电催化氧化反应普遍存在的问题.
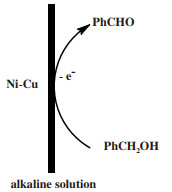
2011年, Ma等[11]通过恒电流电沉积法在不同条件下制备了一系列Ni-Cu合金电极, 并研究了其在碱性溶液条件下苯甲醇的选择性电氧化行为.实验结果表明在特定的反应条件下, Ni-Cu合金电极对醇的氧化具有优异的催化性能以及一定的化学稳定性.其催化机理如图 2所示.
2012年, Zhang等[12]以KNO3为氮源, 以锡微球为载体, 实现了醇的电化学氧化制肟.在没有SnCl2的情况下, 在电极上直接电化学还原硝酸盐时, 只能获得微量的肟.这表明原位生成的Sn是KNO3还原反应的关键介质.基于这样的结果, 提出了一个如图 3所示的反应途径.在铂阳极表面, 在不使用任何化学氧化剂的情况下, 苯甲醇在阳极失去电子发生直接电氧化生成相应的羰基化合物, 因此, 该催化体系如能得到控制, 可以是一种很好的醇选择性氧化制醛酮的方法.
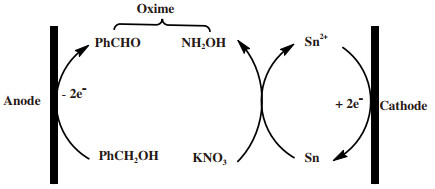
|
图 3 硝酸盐为氮源时, 苯甲醇的氧化过程[12] Fig.3 Oxidation path of benzyl alcohol when nitrate is a nitrogen source[12] |
虽然直接电氧化是一种绿色的氧化醇的方法, 但是直接电催化醇氧化体系在电解时, 原料及其产物可能在电极的表面生成聚合物膜, 被电极吸附后, 电极也因此发生钝化, 结果导致电流效率大大降低, 影响电解的继续进行.除此之外, 要想获得选择性氧化产物, 电极一般都要选择贵金属电极, 而选择普通石墨电极等时, 对醛酮的选择性不太高, 很容易造成过度氧化.因此, 直接电催化氧化对醇的选择性氧化效果并不理想, 这也导致了直接电催化氧化体系存在着极大的弊端.于是, 研究者们便开发了新的绿色催化体系, 即间接电催化体系.
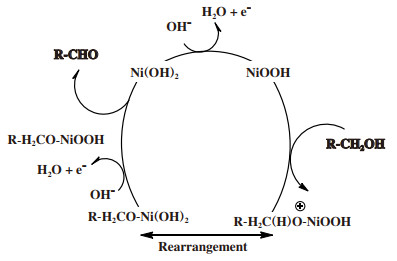
2 间接电催化醇氧化体系间接电催化醇氧化体系是选择性得到醛酮的重要方法.其原理是使用氧化还原电对作为醇反应的媒质, 媒质首先在会电极的表面失去电子发生氧化反应, 然后媒质的氧化产物将会与醇反应使其氧化为醛、酮, 在发生该反应过程中, 氧化后的媒质又将被还原并回到电极表面, 因此媒质在反应前后并不会发生变化, 可将其看作催化剂并且有着循环使用的优势(原理如图 4所示)[13].由于媒质的反应是在电极上, 不会影响产物的分离, 因此可以更加高效地收集产物.并且由于媒质的存在, 避免了醇以及产物与电极的接触, 这样能有效控制反应速率, 解决了醛酮被继续氧化的问题[14].
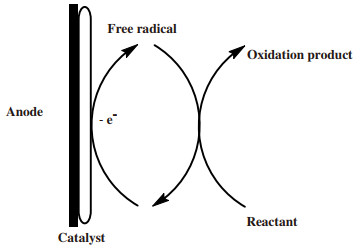
|
图 4 间接电催化氧化原理示意图 Fig.4 Schematic diagram of indirect electrocatalytic oxidation |
金属媒质催化体系由金属离子或者金属氧化物等氧化还原电对所组成, 主要有Mn4+/Mn2+、Ce4+/Ce3+、Ni3+/Ni2+等.以Ce4+/Ce3+为媒质在碱性条件下对苯甲醇电氧化合成苯甲醛为例, Ce4+/Ce3+为媒质在碱性条件下对苯甲醇电氧化合成苯甲醛反应如下:
| $\begin{array}{c} \text{C}{{\text{e}}^{3+}}\to \text{C}{{\text{e}}^{4+}}+{{\text{e}}^{-}} \\ {{\text{C}}_{6}}{{\text{H}}_{5}}\text{C}{{\text{H}}_{2}}\text{OH}-2{{\text{e}}^{-}}+2\text{O}{{\text{H}}^{-}}\to {{\text{C}}_{6}}{{\text{H}}_{5}}\text{CHO}+2{{\text{H}}_{2}}\text{O} \\ \text{C}{{\text{e}}^{4+}}+{{\text{e}}^{-}}\to \text{C}{{\text{e}}^{3+}} \end{array} $ | (3) |
1993年, Huang等[15]研究小组尝试以Mn(Ⅲ)/Mn(Ⅱ)为间接氧化还原体系, 探讨了在相转移催化条件下醇类的电催化氧化反应.研究结果表明, Mn(Ⅲ)可以有效地在电极上生成及再生, 该体系对苄醇类及二级脂肪醇类有很好的催化效果, 能选择性地将其氧化成相应的羰基化合物, 并且产率较高.其中苯甲醛的产率达到89%, 但是当Mn(Ⅲ)/Mn(Ⅱ)作媒介时, Mn(Ⅲ)歧化反应和电解质体积大的矛盾不能很好的解决, 并且反应能量消耗较大, 这也造成该催化体系仅能在实验室中进行.
为了解决该问题, Xu等[16]在后续研究中, 尝试采用MnO2/Mn2+作为氧化还原媒质, 并与PbO2/Pb2+、Ce4+/Ce3+、Cr2O72-/Cr3+进行了比较.在超声条件下, PbO2/Pb2+、Ce4+/Ce3+、Cr2O72-/Cr3+具有较高的氧化电位, 易将苯甲醇进一步氧化成苯甲酸, 不适合用于醇的选择性氧化.当MnO2/Mn2+作为媒质时, 可以有效氧化苯甲醇, 醛的产率可以达到88.9%.其反应机理如图 5所示, M2+在阳极被氧化为MO2, 继而生成的MO2与苯甲醇进行后续反应, 将苯甲醇选择性氧化成苯甲醛, 而自身又被还原为M2+.MO2/Mn2+作媒质时的反应方程如下:
| $\begin{array}{c} {{\text{M}}^{\text{2+}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O}-2{{\text{e}}^{-}}\to \text{M}{{\text{O}}_{\text{2}}}\text{+4}{{\text{H}}^{\text{+}}} \\ {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH +M}{{\text{O}}_{\text{2}}}\text{+2}{{\text{H}}^{\text{+}}}\to {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{CHO +}{{\text{M}}^{\text{2+}}}\text{+2}{{\text{H}}_{\text{2}}}\text{O} \end{array} $ | (4) |
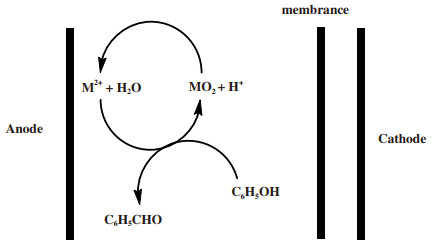
|
图 5 在氧化媒介下间接电合成苯甲醛反应过程[16] Fig.5 Mechanism of indirect electrosynthesis of benzaldehyde under oxidizing medium[16] |
除了以锰离子电对作为氧化媒质, Zhang等[17]在硫酸为支持电解质的条件下, 选用Ce4+/Ce3+为反应媒质, 间接的选择电氧化苯甲醇.反应方程如下式所示:
| $\begin{align} \text{C}{{\text{e}}^{\text{3+}}}\text{+}{{\text{e}}^{-}}\to \text{C}{{\text{e}}^{\text{4+}}} \\ {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{C}{{\text{H}}_{\text{2}}}\text{OH + 2C}{{\text{e}}^{\text{4+}}}\to {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{CHO + 2C}{{\text{e}}^{\text{3+}}}\text{+2}{{\text{H}}^{\text{+}}} \end{align} $ | (5) |
在最佳电解条件下, 苯甲醛的产率高达96%, 并且不会被过度氧化为苯甲酸或二氧化碳, 证明该金属媒质体系的选择性良好, 且在阳极液循环使用10次以上之后, 对醛的产率没有影响.反应中的金属媒质仅仅只起传递电子的作用, 因此该反应仅消耗电能, 说明该方法十分环保经济, 符合绿色化学的要求.之后他们仍以Ce4+/Ce3+为媒体, 在酸性条件下研究了肉桂醇的选择性间接电氧化并取得了比较理想的结果.在最佳条件下进行反应时, 其转化率达到70%, 肉桂醛收率达到90%[18], 反应方程如下式所示:
| $\begin{array}{c} \text{C}{{\text{e}}^{\text{3+}}}-{{\text{e}}^{-}}\to \text{C}{{\text{e}}^{\text{4+}}} \\ {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{CH=CHC}{{\text{H}}_{\text{2}}}\text{OH+2C}{{\text{e}}^{\text{4+}}}\to {{\text{C}}_{\text{6}}}{{\text{H}}_{\text{5}}}\text{CH=CHCHO + 2C}{{\text{e}}^{\text{3+}}}\text{+2}{{\text{H}}^{\text{+}}} \end{array} $ | (6) |
Purgato等[19]也曾使用过铈盐作为媒质, 研究了其对不同醇的电氧化效果.使用CeⅣ-对甲苯磺酸和CeⅣ-对甲氧基苯磺酸作为媒质, 构成CeⅣ/CeⅢ金属催化媒质体系, 并使用其电催化氧化一系列结构不同的醇.实验结果表明, 苯甲醇氧化为苯甲醛的收率为84.2%, 环己醇氧化为己二酸的收率58.7%.因此, 铈盐作媒质的催化体系对一系列醇的选择性氧化均取得了较好的效果, 但是其依旧存在选择性较低, 容易将醇进一步氧化为相应的酸等问题.间接电氧化醇的体系存在着选择性低的缺点, 为了解决该问题, 许多科研组采用相转移法与间接电氧化的联用, 以此提高对醛酮的选择性.
Huang等[20]研究了在相转移的条件下, 使用Cr(Ⅵ)/Cr(Ⅲ)为媒质, 对不同醇进行了选择性氧化反应.实验结果表明: 在该反应体系下, 苄醇类被选择性地氧化为相应的醛酮, 产率较高, 而非苄醇类的醇则无法正常选择性氧化为相应的醇.并且在电解条件下如果不用相转移催化剂, 醇则会轻易被氧化成酸.
在之后的研究中, Yu等[21]根据文献了解到在Ag(Ⅰ)存在下, Cr(Ⅵ)/Cr(Ⅲ)体系氧化苯甲醇生成苯甲醛的产率和电流效率均比单独使用Cr(Ⅵ)/Cr(Ⅲ)时高[22], 因此Ag(Ⅰ)便作为电氧化的有效催化剂使用.于是以Cr(V)/Cr(Ⅲ)及Ag(Ⅱ)/Ag(Ⅰ)为双媒质, 在添加相转移催化剂(Bu4N·HSO4)的条件下, 系统地研究了活泼醇及一级饱和脂肪醇的电催化氧化, 其选择性氧化为醛酮的产率在75.4%~97.5%, 总电流效率>60%, 在对阳极液重复使用探究时, 醛酮产率的重现性表现较好.
此外, 2004年时, Rethinam等[23]使用Ni(OH)2电极间接电氧化肉桂醇, 证实了在电极表面上的Ni3+/Ni2+金属电对氧化还原体系能催化醇的氧化, 并且发现了其对肉桂醇具有很好的电催化效果, 但是该催化体系仅能将醇氧化为对应的酸.其催化机理如图 6所示.
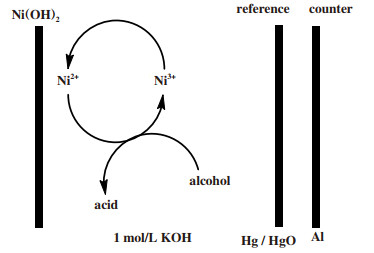
|
图 6 Ni(OH)2电极间接电氧化醇的反应过程[23] Fig.6 Ni(OH)2 electrode indirect electrooxidation of alcohol reaction process[23] |
2014年时, Goransson等[24]研究了在碱性溶液中, 丙烯醇在镀Ni和NiZn纳米结构脉冲合金电极上的间接电氧化, 丙烯醇能生成相应的醛, 且主要产物也为丙烯醛.其丙烯醇的氧化还原反应机理如图 7所示.
虽然众多的研究学者对金属催化媒质体系进行了研究改进, 但是金属媒质催化体系也存在着一些难以解决的问题, 比如其电位不可调, 同时对产物及其环境有一定的污染.因此近年来对金属催化媒质的研究较少.近年来, 学者们都希望能合成电位可调的媒质, 以便更好的控制反应, 且希望不再使用具有污染性的媒质, 以减少对环境的破环.
2.2 有机媒质催化体系当有机媒质的取代基发生改变时, 其氧化还原的电位也将发生相应改变, 这符合电位可调的要求, 于是有机媒质催化体系在醇的选择性氧化中得到了研究与发展.
在有机媒质催化选择性氧化醇的体系中, 含硝酰基自由基的2, 2, 6, 6-四甲基哌啶-1-氧基(TEMPO)被成功地应用于合成醛, 因其清洁、廉价等优点被广泛运用[25], 是醇氧化反应研究中使用最广泛的电催化剂.TEMPO和几种过渡金属的组合, 特别是铁和铜, 在醇合成醛的反应中应用十分普遍.TEMPO结构式如图 8所示.

|
图 8 TEMPO结构式 Fig.8 The structure of TEMPO |
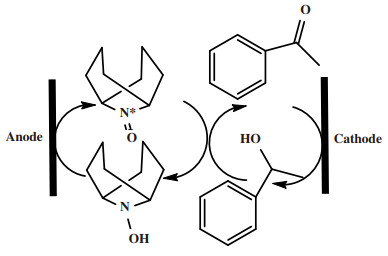
Cu/TEMPO及其催化剂体系被广泛研究用于好氧醇的氧化反应.其中Artavazd Badalyan和Shannon S Stahl[26]在2016年报道了(2, 2'-联吡啶)铜/TEMPO((bpy)Cu(Ⅱ)/(bpy)Cu(Ⅰ))共催化剂体系可用于更快速的电化学醇氧化反应, 而且在操作过程中所用电极电势会比仅用TEMPO作催化剂的化学过程要低半伏.(2, 2′-联吡啶)铜(Ⅱ)和TEMPO氧化还原对表现出了协同反应性, 属于质子偶联TEMPO/TEMPOH氧化还原过程, 而不是高电位TEMPO/TEMPO+反应过程.该催化体系的反应活性好、氧化还原电位低、氧化速率快.而且通过对反应机理的研究和探索, 可以看出这种共催化剂实际上经历了协同催化的机理, 是质子-电子转移媒质, 不同于以往的两电子转移的氧化, 这是两个一电子转移的氧化过程, 这种新型的电催化氧化模式, 可以在较低的电极电势下发生反应, 不仅是一种节能高效的反应, 还是对传统的电子质子转移分开的催化体系的重要补充, 将在电催化领域具有重要应用.该研究也很好地阐明了有机媒质催化体系对醇的选择性氧化机理, 其催化过程如图 9所示.尽管在该催化体系中, 研究者们已经放弃了使用传统的有毒有害的催化剂, 并且使用了分子氧作为氧化剂, 但在这些反应过程中, 对过渡金属催化剂的使用并没有得到减少.

|
图 9 Cu/TEMPO催化体系催化醇氧化过程[26] Fig.9 Schematic diagram of catalytic oxidation of alcohol in Cu/TEMPO catalytic system[26] |
2007年, Xie、He、Shen等[27-29]也曾开发了无过渡金属的有机媒质催化氧化体系, 如TEMPO/HBr/亚硝酸叔丁酯(TBN)/O2、TEMPO/TBN/O2、TEMPO/2, 3-二氯-5, 6-二氰基-1, 4-苯醌(DDQ)/TBN/O2等.虽然人们对TEMPO催化伯醇选择性制备醛进行了大量有意义的研究, 但由于TEMPO中4个甲基产生的了较大的空间位阻, 仲醇合成酮仍然面临着严峻的挑战.
为了解决其空间位阻带来的不利影响, 在之后的研究中, Iwabuchi和他的同事们[30-32]研究了一些空间位阻较小的硝基自由基对醇的选择性电催化氧化, 如2-氮杂金刚烷-N-氧自由基(AZADO)、1-甲基AZADO和5-氟AZADO, 其结构式如图 10所示.
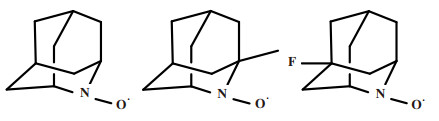
|
图 10 具有硝基自由基的不同物质的结构式 Fig.10 Structural formula for different substances with nitroradical |
由于AZADO及其衍生物在反应中心附近的空间位阻较小, 在低负荷下具有较高的活性, 与TEMPO相比, AZADO及其衍生物在高位阻醇的选择性氧化制备羰基化合物中具有较高的活性.但是AZADO的合成是一个耗时长而且十分复杂的过程, 因此找到一个与之具有相似性质的物质作为有机媒质是有必要的.氮氧自由基9-氮杂双环[3.3.1]壬烷-N-氧基(ABNO)与之具有类似的活性, 并且制备过程也较为简单.ABNO结构式如图 11所示.
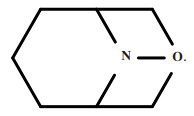
|
图 11 ABNO结构式 Fig.11 The structure of ABNO |
在此情况下, Niu等[33]在2019年提出了在温和条件下, 以ABNO为催化剂, 从一级醇和二级醇中制备相应羰基化合物的可能性.Niu等以9-氮杂双环[3.3.1]壬烷-N-氧基自由基(ABNO)为催化剂, 2, 6-二甲基吡啶为碱, 在乙腈溶液中成功地合成了酮.采用循环伏安法、原位傅立叶变换红外光谱和恒电流电解实验研究了ABNO对1-苯乙醇氧化的电化学活性.其催化过程如图 12所示.
结果表明, 在相同条件下, ABNO比2, 2, 6, 6-四甲基哌啶-1-氧基(TEMPO)具有更高的电化学活性.此外, 在室温下仲醇转化为相应的分离产率在80%~95%.
但Rafiee研究小组[34]在2018年也曾报道了4-乙酰氨基-TEMPO(ACT)在高pH下比AZADO和ABNO具有更高的活性, 并对其氧化还原电位进行了电催化研究.该方法能在室温下成功地将含杂原子的苄基、脂肪族、杂环等醇在水溶液中转化为相应的羧酸, 且得到了较好的产率.
除此之外, 在2012年, Zeng等[35]发现了一类基于三芳基咪唑骨架的有机氧化还原催化剂.该体系优点在于易于合成, 只需改变芳环上的取代基就可以获得合理的电位范围.这些介体表现出了准可逆性, 并观察到在2, 6-二甲基吡啶存在下催化氧化苯甲醇.图 13为三芳基咪唑电催化苯甲醇氧化的反应过程.

|
图 13 三芳基咪唑骨架化合物催化醇氧化过程[35] Fig.13 Catalytic oxidation mechanism of triarylimidazole skeleton compounds[35] |
Zhu等[36]在2016年合成了3种含硝基咔唑骨架化合物, 并采用循环伏安法和室温可控电位电解法研究了硝基咔唑类化合物的电催化氧化活性.电催化剂对于对甲氧基苯甲醇具有很好的选择性, 仅用2.5%(摩尔分数)的电催化压力, 通过电催化氧化, 基本上可将其转化为相应的醛.其催化氧化机理如图 14所示.
有机媒质催化体系在醇选择电氧化中表现出很好的电催化效果, 其清洁、廉价等优点也是符合绿色化学要求的.但是有机媒质催化体系也还存在一些尚未解决的问题, 例如: 有机媒质和产物容易混合, 难以分离, 会造成产物污染等.因此, 有机媒质要想应用于商业化, 还有很大的问题等待克服.所以找到一种易分离产物与媒质的催化体系是十分重要的, 且具有良好的发展前景.
2.3 负载型催化体系近年来, 研究者们为了让催化剂更好地被回收利用, 便将一些金属、金属氧化物、合金催化剂等以及离子液体或者有机媒质等具有催化效果的物质附着在碳纤维、碳纳米管等表面上, 以做成负载型催化剂[37-40].
早些时候, Li[41]将TEMPO固载到多壁碳纳米管上, 研究表明该复载型催化剂对伯醇的氧化具有较高的催化活性.同时Guo等[42]制备了一种新型多孔炭框架(PCF), 其在形成催化剂合成过程中起到了支撑作用, 以次磷酸钠(NaH2PO2)为磷源和还原剂, 合成了PCF负载的磷掺杂钯合金(PdP/PCF), 并将其用作苯甲醇氧化的有效催化剂, 其展示出很好的催化性能.
负载性催化剂表现出了优异的催化性能, 而且与产物也不容易混合, 好分离, 便于回收再利用, 不会造成产物污染.因此将负载型催化剂用于电催化选择性氧化醇可能会得到更好的催化效果.
在对醇的电氧化催化研究中, 负载型催化体系大多都是对醇的燃料电池的探究.例如Zhao等[43]研究组采用溶胶-凝胶法制备了ZnO微米颗粒, 然后运用电沉积Pt合成了Pt-ZnO/C的复合材料.利用循环伏安法研究该复合材料对甲醇和乙醇的电催化活性, 结果表明, 50%(质量分数)的ZnO所制备的催化剂对甲醇和乙醇的电催化氧化活性最好.最近, Tang等[44]通过液相法获得钯金/碳壳纳米复合材料.然后将该纳米复合材料用作电催化剂并探究了其对乙二醇和丙三醇等醇类的电催化氧化性能.实验结果表明, 该纳米复合材料具有较好的电催化氧化活性和稳定性, 其原因可能是钯与金之间发生了协同效应以及碳壳的使用增加了比表面积.
足以见得, 负载型电催化体系对醇的氧化具有不错的效果, 如果能对反应加以控制, 或者研发一种高效选择性氧化为醛的催化体系, 这将对醇选择性氧化的发展起重要推动作用.
在已知的研究中, Geneste等[45]将配合物[RuⅡ(tpy)(bpy)(O)]2+(bpy: 2, 2′-联吡啶; tpy: 2, 2′: 6′, 2″-三联吡啶)连接到石墨毡电极上, 其先被氧化为[RuⅣ(tpy)(bpy)(O)]2+, 然后对醇进行电催化氧化.图 15为该体系电催化醇氧化的反应过程.实验结果表明: 仲醇被氧化成相应的酮, 伯醇被氧化成相应的醛和酸的混合物, 产率适中到良好, 主要还是取决于底物.虽然伯醇的氧化反应不是选择性的, 但部分电解后得到的醛量相对较高(例如苯甲醇的催化氧化, 1 h后苯甲醛收率为63%), 因此这一结果可用于制备规模醛的应用.动力学分析证明了固定化催化剂对苯甲醇氧化为相应醛的贡献, 苯甲醛生成苯甲酸的主要原因是石墨电极上的直接氧化, 而当催化剂共价吸附在聚合物膜上时, 苯甲醇选择性地电催化氧化生成苯甲醛.

|
图 15 [RuⅡ(tpy)(bpy)(O)]2+-石墨毡电极催化醇氧化过程[45] Fig.15 [RuⅡ (tpy)(bpy)(O)] 2+-Graphite felt electrode Catalyzesalcohol oxidation process[45] |
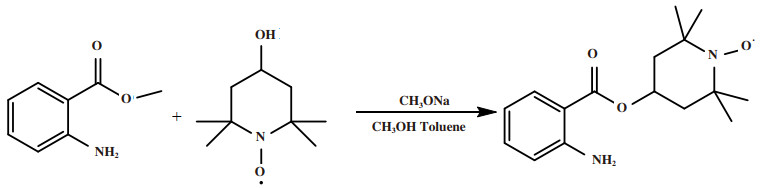
2015年, Yi等[46]合成了具有侧链硝酰基自由基的吡咯衍生物单体PyA-TEMPO(4(3-(pyrrol-1-yl)propionamido)-2, 2, 6, 6-tetramethylpiperidin-1-yloxy).PyA-TEMPO合成路线如图 16所示.在NaClO4/CH3CN溶液中, 在Pt电极上通过循环伏安法成功制备了其相应的聚合物PPyA-TEMPO.PPyATEMPO电极在路易斯碱2, 6-二甲基吡啶的存在下对苯甲醇的氧化显示出高电催化活性.为了进一步研究, 采用原位傅里叶变换红外光谱技术研究了在PPyA-TEMPO电极上苯甲醇的电化学氧化机理.结果表明, 在PPyA-TEMPO的作用下, 苯甲醇被选择性氧化为苯甲醛.
随后在2016年, Tang等[47]又采用水/丙酮电化学聚合法, 在玻璃碳上成功地制备了一种新型的TEMPO修饰聚苯胺电极PAn-TEMPO(poly(4-(2-aminobenzoyl-oxy)-2, 2, 6, 6-tetramethylpiperidin-1-yloxy).An-TEMPO合成路线如图 17所示.采用循环伏安法、制备电解实验等研究了PAn-TEMPO对醇氧化的电催化性能.其电催化效果表现良好, 能使醇在温和条件下选择性氧化.在碳酸钠/碳酸氢钠缓冲的水溶液或水/乙腈溶液中, 各种醇被有效氧化成相应的醛或酮, 具有良好的转化率和选择性.该方法证明了这是一种清洁的电催化体系, 在醇的选择性氧化中非常有用且环境友好.
2017年, Zheng等[48]研究制备了一种自支撑、分层、多孔的氮掺杂的碳(NC)@CuCo2Nx/碳纤维(CF), 应用结果表明, 这是一种高效的双功能电催化剂, 在碱性溶液中不仅对析氢反应有好的活性, 而且对析氧反应也表现出良好的活性和稳定性.当NC@CuCo2Nx/CF在阴极和阳极上用作电催化剂时, 对苯甲醇的选择性电氧化和制氢, 都具有较高的转化率和选择性.NC@CuCo2Nx/CF在恒电流15 mA下, 苯甲醇的选择性氧化为苯甲醛的选择性和产率分别达到96%和95%.NC@CuCo2Nx/CF作为水分解(HER)和苯甲醇选择性电催化氧化(ECO)的双功能电催化剂的过程如图 18所示.
2019年, Chen等[49]通过Ostwald熟化过程结合锌蚀刻, 在碳纤维(CF)上支撑的Ni(OH)2上制备可调控的孔和空位, 以构建三维纳米杂化体(h-Ni(OH)2).使用由其制备的电极表现出优异的电催化性能, 活性和耐用性较高.在最佳反应条件下, 该催化剂成功地应用于苯甲醇在碱性介质中的选择性电催化氧化, 以及在成对电解体系中同时应用于苯甲醇的选择性电催化氧化和氢气生产.其对苯甲醇选择性氧化物苯甲醛的选择性和产率都在90%以上, 表现出十分优异的催化性能.催化机理类似于图 18.
负载型催化体系不仅可以发挥媒质和负载物之间的协同作用, 重要的是可以提高媒质的催化性能.同时相比于单纯的使用有机媒质催化体系, 催化剂也能更加方便地回收利用.
3 总结与展望几年前, 我们报道了一种由乙酰丙酮和l-亮氨酸衍生的铜席夫碱配体, 可在[bmim]BF4中循环使用[50], 并对苯甲醇具有优异的催化氧化效果.在此基础上, 本课题组目前已经开展了廉价金属席夫碱配合物以及使用介孔分子筛固载配合物对苯甲醇选择性催化氧化的相关工作, 研究发现均相和非均相的催化体系对苯甲醇的选择性氧化均具有优良的效果, 其优点表现在选择性高, 转化率高, 可回收利用.但是该催化体系依然依靠传统的氧化剂, 尚不能达到绿色化学的要求.相比之下电催化方法简单、能耗低, 已经成为一种绿色环保的醇选择性氧化方法[51-53].间接电氧化在媒质的作用下可以避免醛酮的过氧化, 相比直接电氧化有着更高的选择性.而对媒质进行固载, 利用载体与媒质的协同作用, 能显著提高体系的催化性能, 且便于回收利用, 该方法也成为了电催化氧化醇的热点.由于其独特的优点, 电催化醇氧化选择性合成相应的醛酮将大有发展前景, 也将成为绿色化学发展的重要技术.
因此结合本课题组工作, 未来在催化剂的研究与改进方面可以考虑以下几点: (1)研发一系列以廉价金属为活性中心的催化剂体系, 如Cu、Fe等.而四齿席夫碱配体是近年来的研究热点, 其易于合成, 在具有不同氧化态的金属离子上可调节的空间和电子配位环境, 其独有的化学稳定性和热稳定性使过渡金属席夫碱配合物成为氧化催化剂的有前途的候选者[54]; (2)可以将具有催化活性的物质固载到SBA-15、MCM-41等介孔分子筛上, 以固定活性中心, 避免催化剂失去活性, 同时也能增强催化效果且避免催化剂与产物的接触, 便于催化剂回收和产物收集.再将其制备为电极后, 研究其电催化性能; (3)对电催化醇选择性氧化的机理进行进一步的探究, 以指导催化剂的合成方向, 减少不必要的投入.
| [1] |
Musawir M, Davey P N, Kelly G, et al. Highly efficient liquid-phase oxidation of primary alcohols to aldehydes with oxygen catalysed by Ru-Co oxide[J]. Chem Commun, 2003, 34(41): 1414–1415.
|
| [2] |
a. Lenze M, Bauer E B. Chemoselective, iron(Ⅱ)-catalyzed oxidation of a variety of secondary alcohols over primary alcohols utilizing H2O2 as the oxidant[J]. Chem Commun, 2013, 49(52): 5889-5891. b. Zhang Fang(张方), Wang Xiao-li(王晓丽), Wu Gong-de(吴功德), et al. Catalytic oxidation of benzene homologues by iodine modified copper-containing mixed oxides(碘改性的含铜复合氧化物催化氧化苯系物)[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 349-354. c. Wei Zhao(魏钊), Yang Hua-meng(杨化萌), Zhang Jin-long(张金龙), et al. Direct construction of axially chiral 4-arylquinoline via acid-promoted dehydrative cyclization/oxidation of diarylmethanols(酸催化的二芳基甲醇脱水环化氧化芳构化直接构筑4-芳基喹啉)[J]. J Mol Catal (China)(分子催化), 2019, 33(4): 371-381. |
| [3] |
a. Campestrini S, Carraro M, Ciriminna R, et al. Alcohols oxidation with hydrogen peroxide promoted by TPAP-doped ormosils[J]. Tetrahedron Lett, 2004, 45(39): 7283-7286. b. Mao Hui-ling(毛会玲), Wang Chen(王晨), Xue Yun (薛云), et al. Synthesis of radical decorated conjugated microporous polymers for selective oxidation of 5-hydroxymethylfurfural(自由基修饰共轭微孔聚合物应用于5-羟甲基糠醛选择性氧化)[J]. J Mol Catal (China)(分子催化), 2019, 33(3): 245-252. c. Zhang Nan(张楠), Li Jian-min(李建民), Liu Haijin(刘海津), et al. Preparation of Ag-Pd/g-C3N4 and selective oxidation of benzyl alcohol in aqueous solution (Ag-Pd/g-C3N4的制备及在水溶液中选择性氧化苯甲醇)[J]. J Mol Catal (China)(分子催化), 2019, 33(1): 75-82. |
| [4] |
Shi Xian-ying(石先莹), Han Xiao-yan(韩晓燕), Ma Wen-juan(马文娟), et al. Research progress on catalytic oxidation of alcohols by transition metals(过渡金属催化醇氧化反应的研究进展)[J]. Chin J Org Chem(有机化学), 2011, 31(3): 297–305.
|
| [5] |
Ying Chuan-you(应传友). Research progress of electrocatalytic oxidation technology(电催化氧化技术的研究进展)[J]. Chin J Chem Eng Equ(化学工程与装备), 2010, 8: 140–142.
|
| [6] |
Roschangar F, Sheldon R A, Senanayake C H. Overcoming barriers to green chemistry in the pharmaceutical industry-the Green Aspiration LevelTM concept[J]. Green Chem, 2015, 17(2): 752–768.
DOI:10.1039/C4GC01563K |
| [7] |
Lima M J, Silva A, Silva C G, et al. Graphitic carbon nitride modified by thermal, chemical and mechanical processes as metal-free photocatalyst for the selective synthesis of benzaldehyde from benzyl alcohol[J]. J Catal, 2017, 353: 44–53.
DOI:10.1016/j.jcat.2017.06.030 |
| [8] |
Liao Yan-mei(廖艳梅), Wu Qian-qian(武倩倩), Zhan An-lun(张安伦). Study on the selective direct electrooxidation of C-H bonds(C-H键选择性直接电氧化研究)[J]. J Electrochem (China)(电化学), 2017, 23(3): 276–282.
|
| [9] |
Yu Bo-zhang(于伯章), Liang Yu(梁宇). Synthesis of isobutyl isobutyrate by direct e-lectrolysis oxidation of isobutanol(异丁醇直接电解氧化合成异丁酸异丁酯的研究)[J]. J Xinxiang Teach Coll(新乡师范高等专科学校学报), 2000, 14(2): 74–76.
DOI:10.3969/j.issn.1674-3334.2000.02.026 |
| [10] |
崔玉青. 电化学氧化环己醇合成己二酸[D]. 太原: 太原理工大学, 2008.
Cui Yu-qing. Synthesis of adipic acid by electrochemical oxidation of cyclohexanol[D]. Taiyuan: Taiyuan Univer Technol, 2008.
|
| [11] |
Ma Chun-an(马淳安), Liao Yan-mei(廖艳梅), Zhu Yinghong(朱英红), et al. Selective electrooxidation of benzyl alcohol on Ni-Cu alloy electrode(Ni-Cu合金电极上苯甲醇的选择性电氧化)[J]. J Chem Ind Eng(China)(化工学报), 2011, 62(1): 142–146.
|
| [12] |
Zhang L, Chen H, Zha Z G, et al. Electrochemical tandem synthesis of oximes from alcohols using KNO3 as the nitrogen source, mediated by tin microspheres in aqueous medium[J]. Chem Commun, 2012, 48(52): 6574–6576.
DOI:10.1039/c2cc32800c |
| [13] |
Gu Den-ping(顾登平), Zhang Xue-ying(张雪英), Zhang Hong-kun(张宏坤), et al. Progress in indirect electrooxidation(间接电氧化的进展)[J]. Chin J Fine Chem(精细化工), 2000, 17(S1): 4–6.
|
| [14] |
Martin P, Eberhard S. Mild and effective removal of dithioketal protecting groups by triarylamine cation radicals as homogeneous electron transfer agents[J]. Chem Ber, 1984, 117(5): 1679–1694.
DOI:10.1002/cber.19841170505 |
| [15] |
Huang You(黄有), Wang Gui-lan(王桂兰), Li Zhi-hong(李志鸿), et al. Mn(Ⅲ)/Mn(Ⅱ) under phase transfer catalysis system for selectivity electric oxidation of alcohols(相转移催化下Mn(Ⅲ)/Mn(Ⅱ)体系对醇类的选择性电氧化)[J]. Chin J Synth Chem(合成化学), 1993, 3: 244–247.
|
| [16] |
Xu Chun-hong(许春红), Chen Ri-yao(陈日耀), Zheng Xi(郑曦), et al. Preparation of benzaldehyde by electrocatalytic oxidation(电催化氧化制备苯甲醛的研究)[J]. J Mol Catal (China)(分子催化), 2007, 21(3): 229–232.
DOI:10.3969/j.issn.1001-3555.2007.03.008 |
| [17] |
Zhang Song-lin(张松林), Li Yi(李毅), Li Zhi-hong(李志鸿), et al. Selective indirect electrooxidation of benzyl alcohol(苄醇的选择性间接电氧化)[J]. Chin J Synth Chem(合成化学), 1995, 3(2): 180–182.
|
| [18] |
Zhang Song-lin(张松林), Zang Yan-li(臧艳丽), Zhang Gui-sheng(张贵生), et al. Selective indirect electrooxidation of cinnamyl alcohol(肉桂醇的选择性间接电氧化)[J]. Chin J Chem Reag(化学试剂), 1998, 4: 62–63.
|
| [19] |
Purgato F L S, Romero J R. Electrooxidation of hydroxyl compounds using cerium salts as mediators: The importance of substrate size for catalyst regeneration[J]. J Catal, 2002, 209(2): 394–400.
DOI:10.1006/jcat.2002.3646 |
| [20] |
Huang You(黄有), Li Zhi-hong(李志鸿), Wang Guilan(王桂兰), et al. Selective electrooxidation of alcohols catalyzed by phase transfer(相转移催化下醇类的选择性电氧化)[J]. Chem J Chin Univ(高等学校化学学报), 1991, 3: 351–352.
DOI:10.3321/j.issn:0251-0790.1991.03.032 |
| [21] |
Yu Bo-zhang(于伯章), Li Yi(李毅), Xue Wang-xin(薛万新), et al. Selective indirect electrooxidation of alcohols in bimedia catalyzed by phase transfer(相转移催化下双媒质体系对醇类的选择性间接电氧化)[J]. Chin J Synth Chem(合成化学), 1996, 1: 93–95.
|
| [22] |
Jow J J, Chou T C. Catalytic effects of the silver ion on the indirect electrochemical oxidation of toluene to benzaldehyde using Ce3+/Ce4+ as mediator[J]. J Appl Electrochem, 1988, 18(2): 298–303.
DOI:10.1007/BF01009278 |
| [23] |
RethinamA J, Kennedy C J. Indirect electrooxidation of crotyl and cinnamyl alcohol using a Ni(OH)2 electrode[J]. J Appl Electrochem, 2004, 34(4): 371–374.
DOI:10.1023/B:JACH.0000016625.59112.da |
| [24] |
Goransson G, Jirkovsky J S, Krtil P, et al. Oxidation of propenol on nanostructured Ni and NiZn electrodes in alkaline solution[J]. Electrochim Acta, 2014, 139: 345–355.
DOI:10.1016/j.electacta.2014.06.169 |
| [25] |
Semmelhack M F, Schmid C R, Cortes D A, et al. Oxidation of alcohols to aldehydes with oxygen and cupricion, mediated by nitrosoniumion[J]. J Am Chem Soc, 1984, 106(11): 3374–3376.
DOI:10.1021/ja00323a064 |
| [26] |
Artavazd B, Stahl S S. Cooperative electrocatalytic alcohol oxidation with electron-proton-transfer mediators[J]. Nature, 2016, 535(7612): 406–410.
DOI:10.1038/nature18008 |
| [27] |
Xie Y, Mo W M, Xu D, et al. Efficient NO equivalent for activation of molecular oxygen and its applications in transition-metal-free catalytic aerobic alcohol oxidation[J]. J Org Chem, 2007, 72(11): 4288–4291.
DOI:10.1021/jo0705824 |
| [28] |
He X J, Shen Z L, Mo W M, et al. TEMPO-tert-butyl nitrite: An efficient catalytic system for aerobic oxidation of alcohols[J]. Adv Synth Catal, 2009, 351(12): 89–92.
|
| [29] |
Shen Z L, Chen M, Fang T T, et al. Transformation of ethers into aldehydes or ketones: A catalytic aerobic deprotection/o-xidationpathway[J]. Tetrahedron Lett, 2015, 56(21): 2768–2772.
DOI:10.1016/j.tetlet.2015.04.033 |
| [30] |
Shibuya M, Tomizawa M, Suzuki I, et al. 2-azaadamantane N-Oxyl (AZADO) and 1-Me-AZADO: Highly efficient organocatalysts for oxidation of alcohols[J]. J Am Chem Soc, 2006, 128(26): 8412–8413.
DOI:10.1021/ja0620336 |
| [31] |
Iwabuchi Y. Discovery and exploitation of AZADO: The highly active catalyst foralcohol oxidation[J]. Chem Pharm Bull, 2013, 61(12): 1197–1213.
DOI:10.1248/cpb.c13-00456 |
| [32] |
Shibuya M, Osada Y, Sasano Y, et al. Highly efficient, organocatalytic aerobic alcohol oxidation[J]. J Am Chem Soc, 2011, 133(17): 6497–6500.
|
| [33] |
Niu P, Liu X, Shen Z, et al. Electrochemical performance of ABNO for oxidation of secondary alcohols in acetonitrile solution[J]. Molecules, 2018, 24(1): 100–114.
|
| [34] |
Rafiee M, Konz Z M, Graaf M D, et al. Electrochemical oxidation of alcohols and aldehydes to carboxylic acids catalyzed by 4-acetamido-TEMPO: An alternative to "Anelli" and "Pinnick" oxidations[J]. ACS Catal, 2018, 8(7): 6738–6744.
|
| [35] |
Zeng C C, Zhang N T, Lam C M, et al. Novel triarylimidazoleredox catalysts: Synthesis, electrochemical properties, and applicability to electrooxidative C-H activation[J]. Org Lett, 2012, 14(5): 1314–1317.
|
| [36] |
Zhu Y, Zhang J, Chen Z, et al. Synthesis of nitrocarbazole compounds and their electrocatalytic oxidation of alcohol[J]. Chin J Catal, 2016, 37(4): 533–538.
|
| [37] |
Yurii V, Geletii , Bogdan , et al. An all-inorganic, stable, and highly active tetrarutheniumhomogeneous catalyst for water oxidation[J]. Angew Chem Int Ed, 2008, 47(21): 3896–3899.
|
| [38] |
Sartorel A, Carraro M, Scorrano G, et al. Polyoxometalate embedding of a tetraruthenium(Ⅳ)-oxo-core by template-directed metalation of[γ-SiW10O36]8: Atotally inorganic oxygen-evolving catalyst[J]. J Am Chem Soc, 2008, 130(15): 5006–5007.
|
| [39] |
Liu Y, Zhao S F, Guo S X, et al. Electrooxidation of ethanol and methanol using the molecular catalyst[{Ru4O4(OH)2(H2O)4}(γ-SiW10O36)2]10-[J]. J Am Chem Soc, 2016, 138(8): 2617–2628.
|
| [40] |
Benipal N, Qi J, Liu Q, et al. Carbon nanotube supported Pd/Ag nanoparticles for electrocatalytic oxidation of glycerol in anion exchange membrane fuel cells[J]. Appl Catal B, 2017, 210: 121–130.
|
| [41] |
李娜. 多壁碳纳米管负载TEMPO催化剂的制备及其在醇氧化中的应用[D]. 兰州: 兰州大学, 2008.
Li Na. Preparation of TEMPO catalyst supported by multi-walled carbon nan-otubes and its application in alcohol oxidation[D]. Lanzhou: Lanzhou Univer, 2008.
|
| [42] |
GuoW Y, Niu S, Zhang B S, et al. Pd-P nanoalloys supported on a porous carbon frame as an efficient catalyst for benzyl alcohol oxidation[J]. Catal Sci Technol, 2008, 8(9): 2333–2339.
|
| [43] |
Zhao Hong-xiao(赵红晓), Wang Shu-ming(王淑敏), Xue Deng-qi(薛登启), et al. Synthesis of Pt-ZnO/C composites and study on catalytic activity of alcohols(PtZnO/C复合材料的合成及对醇类催化活性的研究)[J]. J Fuel Chem Technol(燃料化学学报), 2011, 39(2): 140–143.
|
| [44] |
Tang Yan-ping(唐艳萍), Liu Shan-xin(刘尚新), Liu Zhe-lin(刘哲林). Preparation and electrocatalytic properties of Pd/Au/carbon shell nanocomposites(钯金/碳壳纳米复合材料的制备与电催化性能)[J]. Int J Mol Sci(分子科学学报), 2020, 36(3): 217–222.
|
| [45] |
Geneste F, Moinet C. Electrocatalytic activity of a polypyridyl ruthenium-oxo complex covalently attached to a graphite felt electrode[J]. New J Chem, 2004, 28(6): 722–726.
|
| [46] |
Yi J M, Tang D Y, Song D D, et al. Selective oxidation of benzyl alcohol on poly(4-(3-(pyrrol-1-yl) propionamido)-2, 2, 6, 6-tetramethylpiperidin-1-yloxy) electrode[J]. J Solid State Electr, 2015, 19(8): 2291–2297.
|
| [47] |
Tang D Y, Yang X J, Chen Q G. Efficient electrooxidation of alcohols using TEMPO-modified polyaniline electrode prepared by electrochemical polymerization[J]. J Electrochem Soc, 2016, 163(5): 321–326.
|
| [48] |
Zheng J, Chen X L, Zhong X, et al. Hierarchical porous NC@CuConitride N-anosheetnetworks: Highly efficient bifunctional electrocatalyst for overall water splitting and selective electrooxidation of benzyl alcohol[J]. Adv Funct Mater, 2017, 27(46): 18652–18657.
|
| [49] |
Chen X L, Zhong X, Yuan B W. Defect engineering of nickel hydroxide nanosheets by ostwald ripening for enhanced selective electrocatalytic alcohol oxidation[J]. Green Chem, 2019, 21(3): 578–588.
|
| [50] |
Rong M Z, Wang J, Shen Y P, et al. Catalytic oxidation of alcohols by a novel manganese schiff base ligand derived from salicylaldehyd and l-phenylalanine in ionic liquids[J]. Catal Commun, 2012, 20: 51–53.
|
| [51] |
Thompson M S, Meyer T J. Mechanisms of oxidation of 2-propanol by polypyridyl complexes of ruthenium(Ⅲ) and ruthenium(Ⅳ)[J]. J Am Chem Soc, 1982, 104(15): 4106–4115.
|
| [52] |
Gallagher L A, Meyer T J. Surface control of oxidation by an adsorbed Ru(IV)-oxocomplex[J]. J Am Chem Soc, 2001, 123(22): 5308–5312.
|
| [53] |
Stultz L K, Huynh M, Binstead R A, et al. Allylic oxidation of cyclohexene and indene by cis[Ru-Ⅳ (bpy)2(py)(O)]2+[J]. J Am Chem Soc, 2000, 122(25): 5984–5996.
|
| [54] |
Mehdi H A, Samira S, Parvaneh I, et al. Anchoring of copper(Ⅱ) schiffbase complex into aminopropylfunctionalised MCM-41:Anovel, efficient and reusable catalyst for selective oxidation of alcohols[J]. J Inorg Org Polym Mater, 2017, 27(S1): 146–155.
|
 2021, Vol. 35
2021, Vol. 35