2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
锰是元素周期表中的第25号元素, 最外层电子排布为3d54s2, 位于第四周期第VIIB族, 元素符号为Mn. 锰元素是地壳中的丰产元素, 在过渡金属中排在第3位, 仅次于铁和钛.
早在17万年前的石器时代, 软锰矿(锰的氧化物)被人们当作颜料用于洞穴的壁画制作上, 后来在古希腊斯巴达人使用的武器中也检测到了金属锰. 伴随着科技的发展, 锰的用途也被广泛开发出来, 并用于人类生活的各个方面, 如全球生产90%的锰被用于钢铁工业, 其他10%被用于有色冶金、电子、农业等行业. 锰也是人体必需的微量元素, 在体内含量少, 但起着非常重要的作用[1]. 此外, 光合作用为地球上的生物提供了能量和物质来源, 是地球上最重要的合成反应, 而光合系统中的产氧活性中心就是一个锰-氧-钙的簇合物. 综上所述, 锰对人类的日常生活有着重要的影响.
20世纪以来, 有机锰化合物在催化领域中的应用也逐渐的被化学家开发出来, 主要应用于三个方面. 第一: Salen锰被应用于烯烃的环氧化反应. 环氧化物是有机合成中最重要的中间体之一, 被广泛应用于医药、农药、香料等精细化学品的合成, 是有机化学领域研究的热点. 最常见的合成环氧化合物的方法主要采用卤醇法和过酸氧化法等, 尽管这些传统的合成方法得到了广泛的应用, 然而依然面临着以下缺陷: 如工艺繁琐、产物选择性差、原料价格昂贵、环境污染等. 具备高活性、高选择性的过渡金属(铬, 镍, 钴, 钌, 锰等)催化的烯烃的环氧化反应逐渐被开发出来. 相比其他的过渡金属, 锰由于储量丰富、氧化价态稳定、易于配位等特点, 作为催化剂在烯烃的环氧化反应中占有重要地位. 卟啉、Salen、非血红素、噁嗪等配体辅助锰催化氧化体系逐渐被开发出来[2], 其中Salen锰金属配合物被发现是烯烃不对称催化环氧化反应的高效催化剂之一. 潜手性的烯烃在Salen锰的催化作用下能够转化为相应的手性环氧化合物, 随后通过后续转化方便地合成多种有价值的手性化合物. 过去十多年由Salen锰参与的烯烃环氧化反应已取得了令人瞩目的成绩[3].
第二: 羰基锰在C-H活化领域表现出了独特的催化活性. C-H键广泛地存在于各种有机化合物中, 实现碳氢键的直接官能团化一直是化学工作者的研究重点. 然而, 两个现实性的问题一直制约着碳氢键直接官能团化反应的应用: 其一, 碳氢键具有较高的化学键能, 很难被活化;其二, 同一个有机化合物存在活性比较接近的多种碳氢键, 难以活化特定位置的碳氢键. 过渡金属和导向基团被科研工作者引入, 用于解决以上问题. 近年来, 基于导向策略的过渡金属催化的定位碳氢官能团化反应发展迅速, 目前, 用于C-H活化领域的过渡金属多为4d或者5d的贵金属, 如钯、铑、铱等, 但是这些贵金属面临着资源枯竭、价格昂贵、对环境有害等缺点, 因此需要寻找廉价易得的金属催化剂来代替贵金属. 金属锰由于其高丰度、廉价易得、具有低毒低污染、对环境友好、高催化活性等特点, 在最近几年已经被化学家开发并用于催化C-H键活化方面, 也取得了较大的研究进展[4-6].
第三: 2016年被开发出来的Pincer-锰化合物在加氢/脱氢反应中表现出了良好的催化活性, 随后非Pincer-锰化合物在加氢反应中的应用也被化学工作者开发出来. 我们系统地综述了锰配合物在加氢反应中的研究进展.
2 锰催化的加氢反应过渡金属催化不饱和有机化合物的氢化反应作为化学研究的热点, 具有操作简单、条件温和、副反应少及原子利用率高等优点. 1960年Wilkinson[7]催化剂的发明使得均相催化剂逐渐替代非均相催化剂, 主导氢化反应. 目前过渡金属催化的氢化反应中催化剂多采取铑、钌等贵金属并取得巨大成就, 但是存在储量少, 价格贵, 部分金属具有毒性且存在重金属残留等缺点, 严重限制其工业发展潜力. 锰是全球储量第3的过渡金属元素, 价格相对低廉, 而且具有较好的生物兼容性. 正是由于这些特点, 锰催化的氢化反应逐渐成为研究热点.
2.1 pincer型锰配合物催化加氢反应 2.1.1 pincer型锰配合物催化醛和酮的加氢反应2016年, Beller课题组[8]首次报道了锰金属配合物催化的氢化反应. 作者使用PNP钳形三齿配体和MnBr(CO)5形成的金属配合物作为催化剂, 叔丁醇钠为碱, 在甲苯中实现了一系列腈、醛和酮类化合物的高效氢化(图 1).

|
图 1 锰钳配合物选择性催化腈、酮和醛的加氢 Fig.1 Selective catalytic hydrogenations of nitriles, Ketones, and aldehydes by manganese pincer complexes |
经过机理研究, 作者建议该反应可能经由球外协同的机理完成. 首先催化剂Mn-I在碱的作用下生成Mn-Ⅱ物种, 在氢气的存在下, 得到该反应的活性物种Mn-Ⅲ, 氢原子从活性物种Mn-Ⅲ转移至原料酮, 从而得到相应的目标产物醇和Mn-Ⅱ. 最后, Mn-Ⅱ经过氢气的加成使得活性物种Mn-Ⅲ再生(图 2).

|
图 2 锰催化羰基化合物加氢反应的机理 Fig.2 Proposed mechanism for Mn-catalyzed hydrogenation of carbonyl compounds |
2016年, Kempe课题组[9]报道了多齿配体和MnBr(CO)5形成的配合物对C=O双键的加氢反应. 该催化体系底物适应性广, 芳基、烷基、二芳基、二烷基、环烷基酮以及醛类都能够被催化加氢制备相应的醇. 在底物同时存在C=C双键和C=O双键时, 只选择性的催化氢化C=O双键, 而C=C能够得以保存(图 3).

|
图 3 锰钳配合物选择性催化碳氧双键的加氢 Fig.3 Selective catalytic hydrogenations of C=O by manganese pincer complexes |
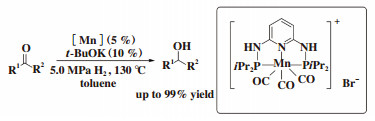
2017年, Sortais课题组[10]利用PN3P型pincer配体和MnBr(CO)5在甲苯溶剂中制备得到新的锰配合物, 该锰配合物在空气中较稳定. 作者将其用于酮的加氢反应中, 在5.0 MPa H2, 温度为130 ℃下, 多种酮被顺利还原, 以中等至良好的收率获得相应的醇(图 4).
|
图 4 PN3P型锰催化酮加氢到醇 Fig.4 Hydrogenation of ketones with a manganese PN3P pincer pre-catalyst |
2018年, Kirchner课题组[11]报道了[Mn(PNP-iPr)(CO)2(H)]催化醛的加氢反应. 与以往的锰催化氢化体系相比, 该体系反应条件温和、高效(催化剂量仅为0.1%~0.05%)、室温、无需添加碱作为辅助剂. 在底物含有烯烃、吡啶等官能团的情况下, 能够选择性地对醛进行催化加氢, 而保留烯烃和吡啶等官能团(图 5).

|
图 5 无碱温和条件下锰催化选择性加氢 Fig.5 Manganese-catalyzed chemoselective hydrogenation of aldehydes under base-free |
2016年, 在前面工作的基础上, Beller课题组[12]报道了锰催化酯的加氢制备相应的醇, 催化剂是该课题组开发出的pincer类型的锰配合物, 叔丁醇钠为碱, 溶剂为1, 4-二氧六环, 该体系不仅仅适用于芳香酯和脂肪酯, 对于内酯和二酯也有较好的催化效果(图 6).

|
图 6 锰配合物选择性催化酯的加氢 Fig.6 Selective catalytic hydrogenations of esters by manganese pincer complexes |
2016年, Milstein课题组[13]将具有吡啶骨架的PNP钳形锰催化剂引入酯的均相催化氢化. 该催化体系对酯基有独特的催化选择性. 底物中存在C=C双键、C≡N三键和酯基时, 能够选择性地催化加氢酯基成相应的醇, 而C=C双键、C≡N三键不被催化氢化(图 7).
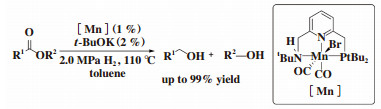
|
图 7 锰催化酯加氢到醇 Fig.7 Manganese-catalyzed hydrogenation of esters to alcohols |
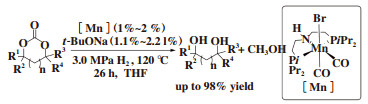
2018年, Leitner课题组[14]首次报道了PNP类型锰配合物催化环状碳酸脂氢化反应. 在报道中, 作者以[Mn(CO)2(Br)-[HN(C2H4PiPr2)2]为催化剂, 叔丁醇钠为碱, THF为溶剂, 氢气压力为3.0 MPa, 温度为120 ℃, 反应时间为26 h, 相应的二醇化合物和甲醇均有优良的收率(图 8).
|
图 8 锰催化环状碳酸酯加氢 Fig.8 Catalytic hydrogenation of cyclic carbonates using manganese complexe |
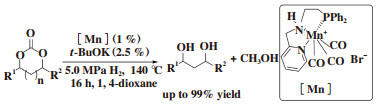
同样在2018年, Rueping课题组[15]也报道了PNN类型锰配合物催化环状碳酸脂氢化反应. 与Leitner课题组的反应条件类似, 以PNN类型锰配合物为催化剂, 叔丁醇钾为碱, 1, 4-dioxane为溶剂, 氢气压力为5.0 MPa, 温度为140 ℃, 反应时间为16 h. 该反应体系底物普适性较好, 各种五元或者六元环状碳酸脂都能够被还原成相应的二醇化合物和甲醇, 值得一提的是, 聚碳酸酯也能够以91%的收率得到降解后的小分子目标产物(图 9).
|
图 9 PNN锰催化环状碳酸酯加氢 Fig.9 Catalytic hydrogenation of cyclic carbonates using manganese complexe |
2018年, Milstein课题组[16]报道了含有吡啶骨架的PNN类型的锰配合物催化碳酸酯氢化反应. 该催化体系底物适应性广, 对称和不对称的碳酸脂和环状碳酸酯都能够被加氢还原成相应的醇类化合物和甲醇. 该催化体系也为聚合碳酸酯的氢化降解提供了一个选择方案(图 10).

|
图 10 PNN锰催化碳酸酯加氢 Fig.10 Catalytic hydrogenation of carbonates using manganese complexe |
2017年, Gonsalvi课题组[17]报道了锰催化CO2加氢生成HCOOH的反应, 相比于同类型的铁配合物, 该课题组制备的[Mn(PNPNH-iPr)(H)(CO)2]表现出较高的稳定性和活性. 在DBU的存在下, CO2加氢生成相应的甲酸盐, 催化剂的TON高达10 000, 在添加三氟甲磺酸锂作为辅助剂, [Mn]: DBU=1:50 000时, TON提升至30 000(图 11).

|
图 11 Mn(I)PNP配合物催化二氧化碳加氢 Fig.11 Carbon dioxide hydrogenation catalyzed by Mn(I) PNP pincer complexes |
2018年, Prakash课题组[18]报道了PNP类型锰催化CO2连续加氢的反应, 经历甲酰胺中间体, 生成产物甲醇. 在胺存在下, Mn(I)-PNP首先催化CO2加氢生成甲酰胺, 然后Mn(I)-PNP继续催化甲酰胺加氢生成甲醇和胺, 获得了高达84%甲醇收率和71%胺收率. 这种Mn-PNP催化剂在空气中很稳定且对CO2和甲酰胺都有催化加氢活性, 当使用苄胺和吗啉作为胺源时, 催化剂的TON能达到36(图 12).

|
图 12 Mn催化二氧化碳连续加氢到甲醇 Fig.12 Manganese-catalyzed sequential hydrogenation of CO2 to methanol |
值得一提的是, 2019年, 雷鸣课题组[19]采用密度泛函理论(DFT)对锰配合物催化二氧化碳加氢生成甲酸的反应进行了理论研究. 研究结果表明甲酸的参与降低了氢气活化的反应能垒, 有助于反应的进行, 二氧化碳的氢化过程遵循外层机理并且氢转移是分步进行的, 决速步骤为氢负离子的转移过程. 研究结果能为锰配合物的设计以及二氧化碳加氢制备甲酸的实验提供一定的理论参考.
2.1.4 pincer型锰配合物催化酰胺和含氮杂环的加氢反应2017年, Beller课题组[20]报道了首例锰催化的酰胺的加氢制备胺和醇的反应, 作者使用含有咪唑骨架的PNN型配体和MnBr(CO)5制备了锰配合物, 将该配合物用于酰胺的加氢反应中, 该催化体系底物实用性广, 叔酰胺和伯酰胺都能够较好地被加氢还原成相应的胺和醇(图 13).

|
图 13 锰高效催化酰胺加氢到胺和醇 Fig.13 Efficient and selective hydrogenation of amides to alcohols and amines using manganese complex |
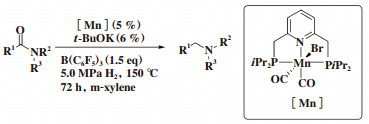
2018年, Zou等[21]报道了首例PNP类型锰催化酰胺加氢制备相应的胺的反应. 作者以含有吡啶骨架的PNP锰作为催化剂, B(C6F5)3作为助催化剂, 叔丁醇钾作为钾, 苯甲醚作为溶剂, 氢气压力为5.0 MPa, 在150 ℃温度下, 高效高选择性地催化酰胺的加氢, 从而获得相应的胺类化合物(图 14).
|
图 14 锰催化酰胺的加氢反应 Fig.14 Mn-catalyzed hydrogenation of amides |
2019年, Milstein课题组[22]报道了首例pincer型PNN锰配合物对氨基甲酸酯和尿素的催化氢化反应. 作者发现带有连吡啶骨架的PNN型锰配合物能够将氨基甲酸酯和尿素经过催化加氢转化成相应的胺和甲醇, 而氨基甲酸酯和尿素是由二氧化碳出发制备的大宗化学品, 如此, 该催化体系间接实现了二氧化碳高效转化成甲醇的反应历程, 值得注意的是, 在反应体系中, 作者通过核磁谱图验证了Mn-H物种的形成(图 15).

|
图 15 锰催化氨基甲酸酯和尿素的加氢 Fig.15 Manganese catalyzed hydrogenation of carbamates and urea derivatives |
在pincer型锰配合物催化加氢反应中, 关于反应机理的研究相对较少, 基于此, 2019年, Liu课题组[23]和Lan课题组将理论计算与实验相结合, 作者通过密度泛函理论(DFT)计算了空间效应和电子效应对过渡态能垒和负氢解离能的影响, 证明了NNP钳形锰配合物要比PNP钳形锰配合物的反应活性高. 基于计算结果, 开发了首例锰催化的含氮芳杂环的氢化反应(图 16). 随后Fan课题组[24]对该报道做了详细的评述.

|
图 16 锰催化含氮杂环的加氢反应 Fig.16 Mn-catalyzed hydrogenation of N-heterocycles |
2018年, Sortais课题组[25]将含有吡啶骨架双齿配体的锰催化剂应用于酮的加氢反应. 与昂贵的三齿配体相比, 双齿配体的锰催化剂变现出更高的催化活性, 温度为50 ℃, 催化剂负载量降低至0.5%(摩尔分数), 反应仍然能以96%的收率获得相应的目标产物(图 17).

|
图 17 锰催化羰基的加氢还原 Fig.17 Hydrogenation of carbonyl derivatives catalysed by manganese complexes |
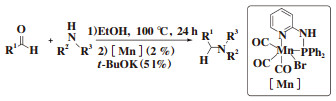
2018年, Sortais课题组[26]报道了由胺和醛出发一锅法制备相应的胺类化合物的反应, 在该反应中, 胺和醛首先生成亚胺, 然后亚胺被吡啶基双齿PN配体锰配合物催化还原, 获得新的胺类产物. 该催化体系底物普适性广, 能够容忍芳香醛、脂肪醛、芳香胺、脂肪胺等底物(图 18).
|
图 18 锰催化醛的还原胺化 Fig.18 Manganese catalyzed reductive amination of aldehydes |
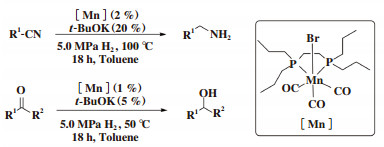
2018年, Kirchner课题组[27]开发出双P配体的锰配合物催化的氰基和酮的加氢反应. 一系列芳香族、脂肪族腈和酮均能够以优异的收率转化为伯胺和醇. 在温度为100 ℃, 催化剂用量为2%(摩尔分数), 碱(t-BuOK)用量为20%(摩尔分数)下进行腈的催化加氢反应; 在温度为50 ℃, 催化剂用量为1%, 5%(摩尔分数)t-BuOK充当碱, 发生酮的加氢反应. 以上这两种情况下, 氢气压力均为5.0 MPa(图 19).
|
图 19 锰催化氰基和酮的加氢 Fig.19 Hydrogenation of nitriles and ketones catalyzed by Mn(I) complex |
2017年, Pidko[28]报道了以非pincer型配体和MnBr(CO)5制备的锰配合物为催化剂, 对酯催化加氢制备相应的醇的反应. 在该报道中, 作者使用双齿N、P配体, 0.2%(摩尔分数)的锰催化剂就能够高选择地实现酯的氢化(图 20).
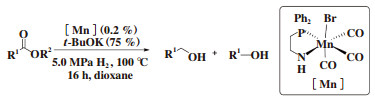
|
图 20 非pincer型锰催化酯的加氢 Fig.20 Non-pincer-type manganese complexes as efficient catalysts for the hydrogenation of esters |
2017年, Khusnutdinova课题组[29]报道了首例锰催化的二氧化碳的加氢反应, 作者使用6, 6'-二羟基-2, 2'-联吡啶和MnBr(CO)5制备了锰配合物, 并将其用于二氧化碳的催化加氢反应中, 在DBU存在下, 二氧化碳经过加氢生成甲酸盐, TON高达6250, 在仲胺存在下, 二氧化碳经过加氢生成甲酰胺, TON达到588(图 21).

|
图 21 非pincer型锰催化二氧化碳的加氢 Fig.21 Non-pincer-type manganese complexes as efficient catalysts for the hydrogenation of CO2 |
2019年, García课题组[30]报道了非pincer型Mn(I)配合物fac-[(CO)3Mn{iPr2P(CH2)2PiPr2}(OTf)]作为催化前体将腈选择性催化加氢生成伯胺. 其中, 以KOtBu作为碱, 2-BuOH作为溶剂. 该催化体系反应条件温和, 在氢气压力为0.7 MPa, 温度为90 ℃, 反应历经15 min就能够将苄腈、富电子芳香族和脂肪族腈催化加氢得到相应的胺. 对于缺电子的芳香腈和对苯二甲腈类底物, 则需要增加氢气压力至0.5 MPa, 反应时间至30 min, 就能够以极好的收率(94%~98%)获得相应的胺类产物. 需要特别指出的是, 己二腈能够被还原为己二胺, 分离产率为53%(图 22).

|
图 22 锰催化氰基的加氢 Fig.22 Hydrogenation of nitriles catalyzed by Mn(I) complex |
2020年, Wang课题组[31]报道了MnBr(CO)5或Mn2(CO)10催化喹啉和亚胺的氢化反应. 作者使用市售的MnBr(CO)5或Mn2(CO)10为催化剂, 无需配体稳定金属锰, 无需碱辅助, 反应温度为130 ℃, 反应溶剂为THF, 氢气压力为3.0 MPa, 历时8 h, 即可实现喹啉和亚胺的氢化, 得到相应的胺类化合物(图 23).

|
图 23 锰催化亚胺和喹啉的加氢 Fig.23 Simple manganese carbonyl catalyzed hydrogenation of quinolines and imines |
2017年, Beller课题组[32]报道了新型的手性PNP类型锰催化酮的不对称加氢反应. 该催化体系条件温和, 在温度为30~40 ℃时, 氢气压力为3.0 MPa情况下, 手性PNP型锰催化在对酮的不对称催化氢化中表现出较高的催化活性和高的对映选择性. 除了对芳香底物的高催化活性外, 脂肪酮的不对称氢化也有良好的对映选择性, 获得了高达92:8的ee值(图 24).

|
图 24 锰催化酮的不对称加氢 Fig.24 Manganese(I)-catalyzed enantioselective hydrogenation of ketones |
2017年, Clarke课题组[33]将手性二茂铁骨架引入PNP类型配体中和MnBr(CO)5制备新型手性PNN锰催化剂. 在报道中, 我们以1%(摩尔分数)的催化剂, 10%(摩尔分数)叔丁醇钾, 50 ℃, 5.0 MPa H2, 溶剂为乙醇的反应条件, 对底物的普适性进行了考察, 仲烷基醇和叔烷基醇都能够以优良的收率和ee值得到相应的醇类化合物. 当把反应温度提升至75~90 ℃时, 该催化剂对酯的加氢反应也有较好的催化活性, 能够以优良的收率获得一系列的醇类化合物(图 25).
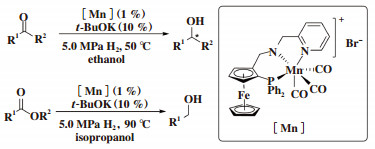
|
图 25 手性锰催化酮和酯的不对称加氢反应 Fig.25 A highly active manganese catalyst for ketone and ester hydrogenation |
2019年, Ding课题组[34]报道了一例含吡啶骨架的手性PNN类型配体的锰配合物催化酮的不对称氢化反应. 作者合成一系列的含有吡啶骨架的手性PNN型锰配合物, 并将该系列的锰配合物用于反应转化数可达9800, 同时具有底物适用性广, 基团耐受性强, 手性醇的对映值高等特点(85%~98% ee)(图 26).

|
图 26 锰催化酮的不对称加氢 Fig.26 Manganese catalysts for enantioselective hydrogenation of ketones |
2019年, Zhong课题组[35]报道了MnBr(CO)5为催化剂前体, 二茂铁骨架手性PNN为配体的二苯甲酮类化合物氢化反应, 虽然该体系仅仅适用于二苯甲酮, 但是表现出高效的催化活性(TON高达13 000)和优秀的对映选择性(ee值大于99%). 通过对机理的探究, 作者发现配体中的亚胺基团有助于获得更高的催化效率和更好的对映选择性(图 27).
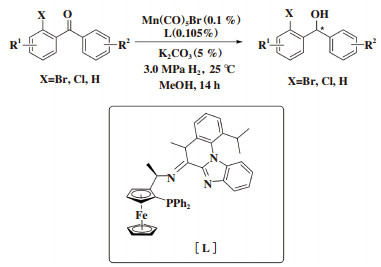
|
图 27 锰催化二苯甲酮的不对称加氢 Fig.27 Manganese catalysts for enantioselective hydrogenation of benzophenones |
2021年, Liu课题组[36]报道了首例锰催化喹啉的不对称氢化反应, 手性配体为含有二茂铁骨架的pincer型配体. 该催化体系具有高的催化活性, 高的对映选择性(高达97%ee), 底物普适性广等优点. 值得一提的是, 当MnBr(CO)5用量降低至0.025%(摩尔分数), 配体的用量为0.0275 %(摩尔分数)时, 反应的TON达到3040(图 28).

|
图 28 锰催化喹啉的不对称加氢 Fig.28 Manganese catalysts for enantioselective hydrogenation of quinolines |
综上所述, 不饱和化合物的加氢反应是有机化学中研究最为广泛的反应之一. 自2016年, Beller课题组报道第一例金属锰催化的氢化反应, 锰催化的加氢反应吸引越来越多化学工作者的研究兴趣, 各种pincer类型的PNN或PNP配体锰配合物被相继开发出来用于不饱和化合物的高效氢化反应, 然而非pincer类型锰配合物用于氢化反应的报道仅有几例. 为了提高氢化反应的催化效率和反应选择性, 开发新型配体的锰配合物是十分有必要的. 此外, 由于手性广泛存在于天然产物和药物分子中, 设计和发展新型手性配体和催化剂, 也是这一领域的挑战和机遇.
| [1] |
Emsley J. In your element: Manganese the protector[J]. Nat Chem, 2014, 6(11): 1026.
|
| [2] |
Wang Shou-feng(王寿峰), Yu Song-jie(于松杰), Sun Wei(孙伟), et al. Catalytic monoepoxidation of 1, 3-butadiene over Manganese complex catalysts(锰配合物催化1, 3-丁二烯环氧化合成环氧丁烯)[J]. J Mol Catal(China)(分子催化), 2011, 25(2): 105–108.
|
| [3] |
Zhou X C, Shi K Y, Fu X K, et al. Research progress on epoxidation of olefins catalyzed by Mn(Ⅱ, Ⅲ, V) in different valence states[J]. Chin J Org Chem, 2016, 36(8): 1765–1778.
DOI:10.6023/cjoc201604010 |
| [4] |
a. Hu Y Y, Zhou B W, Wang C Y. Inert C-H bond trans-formations enabled by organometallic Manganese catalysis[J]. Acc Chem Res, 2018, 51(3): 816-827. b. Zhang Ze-shi(张泽石), Nie Xiao-wa(聂小娃), GuoXin-wen(郭新闻), et al. A theoretical study on hydro-deoxygenation of guaiacol over Pd doped Fe catalyst(Pd掺杂Fe催化剂上愈创木酚加氢脱氧理论研究)[J]. J Mol Catal(China)(分子催化), 2021, 35(4): 299-318. c. Yuan Ya-mei(袁亚梅), Chen Hui(陈慧), Zhao Dan-yang(赵丹阳), et al. Stability and activity of Ni2P and NiSx for the hydrotreating reactions(硫化镍和磷化镍的HDS加氢活性和稳定性)[J]. J Mol Catal(China)(分子催化), 2021, 35(3): 263-272. |
| [5] |
a. Liu T, Hu Y Y, Wang C Y, et al. Manganese-catalyzed deoxygenative[3+2]annulations of ketones and aldehy-desvia C-H activation[J]. CCSChem, 2020, 3(2): 749-757. b. Hu Yi-ming(胡一鸣), Zheng Wan-bin(郑万彬), Tang Cen(汤岑), et al. Recent advances in selective hydrogenation of crotonaldehyde over noble metal catalysts(贵金属催化剂上巴豆醛选择性加氢的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(4): 366-377. |
| [6] |
Wang Z L, Wang C Y. Manganese/NaOPh co-catalyzed C2-selective C-H conjugate addition of indoles to α, β-unsaturated carbonyls[J]. Green Synthesis Catal, 2021, 2(1): 66–69.
DOI:10.1016/j.gresc.2021.01.010 |
| [7] |
Osborn J A, Jardine F H, Wilkinson G, et al. The preparation and properties of tris(triphenylphosphine)halogenorhodium(I) and some reactions there of including catalytic homogeneous hydrogenation of olefins and acetylenes and their derivatives[J]. J Chem Soc A, 1966, 1966: 1711–1732.
|
| [8] |
Elangovan S, Topf C, Beller M, et al. Selective catalytic hydrogenations of nitriles, ketones, and aldehydes by well-defined manganese pincer complexes[J]. J Am Chem Soc, 2016, 138(28): 8809–8814.
DOI:10.1021/jacs.6b03709 |
| [9] |
Kallmeier F, Irrgang T, Kempe R, et al. Highly active and selective manganese C=O bond hydrogenation catalysts: The importance of the multidentate ligand, the ancillary ligands, and the oxidation state[J]. Angew Chem Int Ed, 2016, 55(39): 11806–11809.
DOI:10.1002/anie.201606218 |
| [10] |
Bruneau-Voisine A, Wang D, Sortais J B, et al. Hydr-ogenation of ketones with a manganese PN3P pincer pre-catalyst[J]. Catal Commun, 2017, 92: 1–4.
DOI:10.1016/j.catcom.2016.12.017 |
| [11] |
Glatz M, Stöger B, Kirchner K, et al. Chemoselective hydrogenation of aldehydes under mild, base-free conditions: Manganese outperforms rhenium[J]. ACS Catal, 2018, 8(5): 4009–4016.
DOI:10.1021/acscatal.8b00153 |
| [12] |
Elangovan S, Garbe M, Beller M, et al. Hydrogenation of esters to alcohols catalyzed by defined manganese pincer complexes[J]. Angew Chem Int Ed, 2016, 55(49): 15364–15368.
DOI:10.1002/anie.201607233 |
| [13] |
Espinosa-Jalapa N A, Nerush A, Milstein D, et al. Mang-anese-catalyzed hydrogenation of esters to alcohols[J]. Chem Eur J, 2017, 23(25): 5934–5938.
DOI:10.1002/chem.201604991 |
| [14] |
Kaithal A, Hölscher M, Leitner W. Catalytic hydro-genation of cyclic carbonates using Manganese complexes[J]. Angew Chem Int Ed, 2018, 57(41): 13449–13454.
DOI:10.1002/anie.201808676 |
| [15] |
Zubar V, Lebedev Y, Rueping M, et al. Hydrogenation of CO2-derived carbonates and polycarbonates to methanol and diols by metal-ligand cooperative manganese catalysis[J]. Angew Chem Int Ed, 2018, 57(41): 13439–13443.
DOI:10.1002/anie.201805630 |
| [16] |
Kumar A, Janes T, Milstein D, et al. Manganese catalyzed hydrogenation of organic carbonates to methanol and alcohols[J]. Angew Chem Int Ed, 2018, 57(37): 12076–12080.
DOI:10.1002/anie.201806289 |
| [17] |
Bertini F, Kirchner K, Gonsalvi L, et al. Carbon dioxide hydrogenation catalysed by well-defined Mn(I) PNP pincer hydride complexes[J]. Chem Sci, 2017, 8(7): 5024–5029.
DOI:10.1039/C7SC00209B |
| [18] |
Kar S, Goeppert A, Surya Prakash G K, et al. Manganese-catalyzed sequential hydrogenation of CO2 to methanol via formamide[J]. ACS Catal, 2017, 7(9): 6347–6351.
DOI:10.1021/acscatal.7b02066 |
| [19] |
Zhang Lin(张林), Zhang Wei(张尉), Lei Ming(雷鸣), et al. Theoretical study on mechanism of CO2 hydroge-nation to formic acid catalyzed by Manganese complex(锰配合物催化CO2加氢生成甲酸的理论研究)[J]. Chem J Chin Univer(高等学校化学学报), 2019, 9: 1911–1917.
DOI:10.7503/cjcu20190292 |
| [20] |
Papa V, Cabrero-Antonino J R, Beller M, et al. Efficient and selective hydrogenation of amides to alcohols and amines using a well-defined manganese-PNN pincer complex[J]. Chem Sci, 2017, 8(5): 3576–3585.
DOI:10.1039/C7SC00138J |
| [21] |
Zou Y Q, Chakraborty S, Nerush A, et al. Highly selec-tive, efficient deoxygenative hydrogenation of amides catalyzed by a manganese pincer complex via metal-ligand cooperation[J]. ACS Catal, 2018, 8(9): 8014–8019.
DOI:10.1021/acscatal.8b02902 |
| [22] |
Das U K, Kumar A, Milstein D, et al. Manganese cataly-zed hydrogenation of carbamates and urea derivatives[J]. J Am Chem Soc, 2019, 141(33): 12962–12966.
DOI:10.1021/jacs.9b05591 |
| [23] |
Wang Y J, Lan Y, Liu Q, et al. Unmasking the ligandeffect in Manganese-catalyzed hydrogenation: Mechan-istic insight and catalytic application[J]. J Am Chem Soc, 2019, 141(43): 17337–17249.
DOI:10.1021/jacs.9b09038 |
| [24] |
He Y M, Fan Q H. Ligand effect in Maganese-catalyzed hydrogenation: Mechanism and application studies[J]. Chin J Org Chem, 2019, 39(11): 3310–3311.
DOI:10.6023/cjoc201900005 |
| [25] |
Wei D, Bruneau-Voisine A, Sortais J B, et al. Hydrog-enation of carbonyl derivatives catalysed by manganese complexes bearing bidentate Pyridinyl-Phosphine ligands[J]. Adv Synth Catal, 2018, 360(4): 676–681.
DOI:10.1002/adsc.201701115 |
| [26] |
Wei D, Bruneau-Voisine A, Sortais J B, et al. Manganese catalyzed reductive amination of aldehydes using hydrogen as a reductant[J]. Chem Commun, 2018, 54(34): 4302–4305.
DOI:10.1039/C8CC01787E |
| [27] |
Weber S, Stöger B, Kirchner K. Hydrogenation of nitriles and ketones catalyzed by an air-stable bisphosphine Mn(I) complex[J]. Org Lett, 2018, 20(22): 7212–7215.
DOI:10.1021/acs.orglett.8b03132 |
| [28] |
vanPutten R, Uslamin E A, Pidko E A, et al. Non-pincer-type manganese complexes as efficient catalysts for the hydrogenation of esters[J]. Angew Chem Int Ed, 2017, 56(26): 7531–7534.
DOI:10.1002/anie.201701365 |
| [29] |
Dubey A, Nervi C, Khusnutdinova J R, et al. Bio-inspired Mn(Ⅰ) complexes for the hydrogenation of CO2 to formate and formamide[J]. ACS Catal, 2017, 7(6): 3864–3868.
DOI:10.1021/acscatal.7b00943 |
| [30] |
Garduno J A, García J J. Non-pincer Mn(I) organ-ometallics for the selective catalytic hydrogenation of nitriles to primary amines[J]. ACS Catal, 2019, 9(1): 392–401.
DOI:10.1021/acscatal.8b03899 |
| [31] |
Wang Z L, Chen L, Wang C Y, et al. Simple manganese carbonyl catalyzed hydrogenation of quinolines and imines[J]. Chin Chem Lett, 2020, 31(7): 1890–1894.
DOI:10.1016/j.cclet.2020.02.025 |
| [32] |
Garbe M, Junge K, Beller M, et al. Manganese(I)-catalyzed enantioselective hydrogenation of ketones using a defined chiral PNP pincer ligand[J]. Angew Chem Int Ed, 2017, 56(37): 11237–11241.
DOI:10.1002/anie.201705471 |
| [33] |
Widegren M B, Harkness G J, Clarke M L, et al. A highly active manganese catalyst for enantioselective ketone and ester hydrogenation[J]. Angew Chem Int Ed, 2017, 56(21): 5825–5828.
DOI:10.1002/anie.201702406 |
| [34] |
Zhang L, Tang Y, Ding K L, et al. Lutidine-based chiral pincer manganese catalysts for enantioselective hydrogenation of ketones[J]. Angew Chem Int Ed, 2019, 58(15): 4973–4977.
DOI:10.1002/anie.201814751 |
| [35] |
Ling F, Hou H, Zhong W H, et al. Highly enantioselective synthesis of chiral benzhydrols via manganese catalyzed asymmetric hydrogenation of unsymmetrical benzophenones using an imidazole-based chiral PNN tridentate ligand[J]. Org Lett, 2019, 21(11): 3937–3941.
DOI:10.1021/acs.orglett.9b01056 |
| [36] |
Liu C G, Wang M Y, Liu Q, et al. Manganese-catalyzed asymmetric hydrogenation of quinolines enabled by π-π interaction[J]. Angew Chem, 2021, 133(10): 5168–5173.
DOI:10.1002/ange.202013540 |
 2022, Vol. 36
2022, Vol. 36


