2. 浙江省环境科技有限公司, 浙江 杭州 311121
2. Zhejiang Environmental Technology Co., Ltd, Hangzhou 311121, China
工业生产对现代化生活极为重要, 其中近80%以上的化工过程涉及催化剂. 石油炼化、制药、钢铁冶炼、精细化学品、环境保护等行业的发展都涉及催化过程. 贵金属负载型催化剂在催化作用中显示优异的催化性能, 约占负载型催化剂的50%[1-7]. 随着纳米科学的发展, 目前研究可通过对贵金属纳米粒子的尺寸、形貌、表面电荷结构进行调控来提高催化剂的催化活性[8-10]. 但是, 对于实际工业应用而言, 一个难以避免的问题是贵金属的稀缺性. 与此同时, 目前催化研究者认为负载的贵金属只有最外层的原子参与催化过程, 气体分子仅能接触贵金属表面的活性位点, 无法触及其内部的活性位点, 使得贵金属原子的利用率很低, 造成贵金属资源的浪费[11].
基于上述原因, 加上当前工业的发展已经消耗了大量的贵金属资源, 有限的贵金属材料难以满足全部需求, 使得贵金属催化剂的成本不断提高. 因此, 降低贵金属催化剂的成本、开发新型催化剂是当前亟需解决的问题. 通过降低活性金属的颗粒尺寸, 增加活性中心的数量来构建新型低成本催化剂是一种可行的解决办法[12]. 具有较小颗粒尺寸的活性金属一般具有较低的配位环境, 影响贵金属负载型催化剂的催化活性. 另一方面, 金属和载体之间的相互作用会影响催化界面和活性位点原子的电子转移以及金属的配位环境和价态等[13-14]. 由于不同金属原子轨道之间能带的产生, 强金属-载体相互作用对于催化剂的催化性能、活性相分散性和稳定性具有很深的影响. 因此, 单原子催化剂的开发是解决上述问题的良策. 单原子催化剂理论上可以实现贵金属原子100%的利用率, 可以充分利用贵金属资源, 并且可以构建有利于催化剂稳定性的强金属-载体相互作用, 从而在保持高催化效率的同时降低贵金属负载型催化剂工业应用的成本.
2011年, Qiao等[15]提出单原子催化剂, 其定义为在载体上构成孤立的单原子活性位点的催化剂. 单个Pt原子被锚定在FeOx表面或亚表面, 由于单个Pt原子的空轨道较多, Pt1/FeOx单原子催化剂在CO催化氧化中表现出优异的催化活性和较好的稳定性. 单原子催化剂实现了活性中心的孤立、均匀单分散, 可以同时结合非均相催化剂稳定、易分离和均相催化剂活性位点均匀单分散的优势, 因此单原子催化剂的研究迅速成为非均相催化研究中的热点[16-21]. 2019年, Yang等[22]合成了Pt1/meso-Fe2O3单原子催化剂, 将单原子贵金属基催化剂用于VOCs催化氧化, 并发现Pt单原子催化剂较Pt纳米颗粒催化剂催化效果更好, 并且二者热稳定性相当. 2019年, Chen等[23]通过氧化还原驱动水解沉淀使Pt离子吸附并锚定在Mn-TiO2载体上, 合成了Pt1/Mn-TiO2单原子催化剂, 并且探究了该催化剂在水蒸气存在情况下对低浓度甲醛低温催化燃烧的反应机理. 上述例子均说明单原子催化剂在催化氧化中具有广阔的应用前景, 不仅具有高催化反应活性, 而且有望降低贵金属负载型催化剂的成本, 推动工业发展的进步.
因此, 综述了几种单原子催化剂的制备方法, 介绍了单原子催化剂在完全催化氧化领域的应用. 最后简述了单原子催化剂目前在催化氧化领域应用中存在的问题, 期望可以为应用于催化氧化过程的单原子催化剂的设计提供指导, 从而制备出针对催化氧化过程的高效、稳定的单原子催化剂. 以M1(M1=Pt, Au, Pd, Rh等)代表单原子催化剂中的贵金属单原子.
1 单原子催化剂制备技术进展对于单原子催化剂而言, 孤立的单个原子高度分散, 具有极高的表面能, 在催化剂制备和使用过程中很容易发生单个原子的迁移, 团聚成大颗粒[24]. 因此, 在制备单原子催化剂时不仅需要考虑负载金属的分散性, 也要避免单个原子在载体表面的团聚. 目前制备单原子催化剂主要有两种方案: 一是增大载体比表面积, 一般选择比表面积较大的载体或者构造具有多孔、形貌特殊的三维立体载体; 二是增强载体与金属间的相互作用, 通过对载体表面进行修饰来调节单原子的配位环境[25].
1.1 原子层沉积法制备单原子催化剂原子层沉积法即原子层沉积技术(ALD技术), 源自Ahonen等[26]在开发发光薄膜材料中使用的薄膜沉积技术, 是一种在一定温度下, 将载体材料交替暴露于不同反应前驱体的脉冲蒸汽中, 原子以自限制的方式(由于反应前驱体在载体表面的空间位阻)沉积在载体表面的方法, 通过调节周期循环次数可以精确控制沉积过程, 理论上可以精确控制原子层的生长, 形成具有可控形貌、尺寸、表面特性等的催化剂[27]. 如图 1所示, Hermida等[28]选择球形Al2O3作为基质, 在100 ℃下暴露六氟乙酰丙酮钯, 使Pd原子沉积在Al2O3表面, 后在150 ℃下交替暴露TiCl4和去离子水, 经过几个周期循环得到具有纳米空腔薄膜结构的TiO2载体, 将贵金属Pd以单个原子的形式锚定在TiO2纳米腔结构中. Cheng等[29]通过调节ALD的周期循环次数可以精确控制Pt纳米簇的大小和密度, 在氮掺杂的石墨烯纳米片(NGNs)上负载贵金属单原子和纳米簇, 相比于商业Pt/C催化剂, 其催化活性增加了约37倍. 此外, 贵金属原子在载体的不同晶面上的沉积具有一定倾向性. Bartholomew等[30]通过ALD技术发现单个Pt原子更倾向于沉积在CeO2的(110)晶面和(100)晶面. 综上所述, ALD技术是在原子尺度上研究载体与负载金属之间构效关系的有效手段, 但是其催化剂制备成本较高, 可能限制该方法的广泛应用.

|
图 1 使用ALD合成的热稳定Pd单原子催化剂的示意图[28] Fig.1 Scheme of thermally stable Pd catalysts synthesized using Atomic Layer Deposition (ALD)[28] |
湿法化学法是制备用于催化氧化过程的催化剂的常用方法, 所制备的催化剂本身具有一定的分散性, 并且可以制备不同尺寸大小的贵金属纳米颗粒, 所以用湿法化学法制备具有单分散活性位点的催化剂是一种可行的合成方法. 湿法化学法由于其操作简单, 适合于大规模生产催化剂, 有望将单原子催化剂应用到商业化生产. 湿法化学法包括共沉淀法、浸渍法、沉积-沉淀法、静电吸附法等, 我们只介绍共沉淀法和浸渍法这两种常见的用于催化氧化过程的单原子催化剂制备的方法.
1.2.1 共沉淀法制备共沉淀法是最早应用于单原子催化剂制备的方法, 是一种将两种或两种以上金属阳离子溶液混合, 加入合适的沉淀剂并调节pH, 得到金属负载型催化剂的常用制备方法. 如图 2所示, Qiao等[15]通过向氯铂酸和硝酸铁的混合溶液中加入沉淀剂, 调节溶液pH值约为8, 经过滤、洗涤、煅烧后制备Pt1/FeOx单原子催化剂. 结合密度泛函理论(DFT)研究发现, Pt原子与FeOx表面或近亚表面的3个氧原子配位, 通过金属-载体间强相互作用稳定单个Pt原子, 电子通过Pt-O键转移到FeOx表面使单个Pt原子的空轨道较多, 有利于提高CO催化氧化活性. 需要注意的是, 通过共沉淀法制备的单原子催化剂可能会使一些负载金属原子被包埋在载体内部, 无法接触反应气体分子, 反而降低了活性中心的数量, 不利于提高原子利用率.

|
图 2 (1)共沉淀法制备Pt1/FeOx单原子催化剂示意图; (2)Pt1/FeOx单原子催化剂的高环形暗场扫描透射电子显微镜(HAADF-STEM)表征图[15] Fig.2 (1) Schematic diagram of Pt1/FeOx single-atom catalyst prepared by coprecipitation method, (2) HAADF-STEM image of Pt1/FeOx single-atom catalyst[15] |
浸渍法是制备非均相催化剂的传统方法, 通过载体与金属盐溶液的混合将金属离子吸附在载体表面, 或者利用载体中孔道结构将金属离子限定在特定大小的孔道中, 从而实现负载金属以原子形式负载在载体表面. Zhang等[31]以氯铂酸溶液为前驱体, 通过预先在载体表面吸附抗坏血酸, 用于还原、锚定Pt原子, 这种方法制备的Pt1/CeO2单原子催化剂的负载贵金属呈现单分散状态. 由于单个Pt活性位点是独立存在的, 不存在多个相邻的活性位点, 该催化剂可以抑制正己烷的裂解反应, 提高了正己烷环化和芳构化的选择性. Wan等[32]通过H2热还原在TiO2纳米片表面构建缺陷位(Def), 即阴离子氧空位, 金前驱体正离子吸附在阴离子氧空位上, 形成具有稳定Ti-Au-Ti结构、分散度良好的Au1/Def-TiO2单原子催化剂, 如图 3所示. Jeong等[33]选择具有较高比表面积的氧化铝作为载体, 构建具有缺陷结构、高比表面积的CeO2-Al2O3载体, 通过调节浸渍还原温度锚定Pt原子并控制金属原子的氧化态. Wang等和Feng等[34-36]的研究表明, Al2O3这种缺少表面缺陷的载体, 可以通过表面富含的羟基基团稳定负载贵金属, 使负载贵金属呈现单原子分散. Yang等[22]采用KIT-6作为硬膜板合成meso-Fe2O3载体, 以Pt(NH3)4(NO3)2为前驱体, 通过保护剂作用可以在浸渍过程中限制Pt离子前驱体在载体表面介孔结构中聚集, 从而限制了Pt-Pt键的生成, 再经还原煅烧制备出低负载量的Pt1/meso-Fe2O3单原子催化剂.
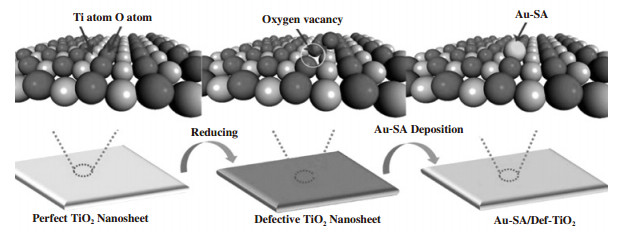
|
图 3 Au1/Def-TiO2单原子催化剂的合成示意图[32] Fig.3 Schematic illustration for synthesis of Au1/Def-TiO2 single-atom catalyst[32] |
光化学辅助法是制备单原子催化剂的一种新型方法. Zhang等[37-38]利用紫外光照条件下载体表面有机溶剂与光生空穴形成自由基, 负载金属原子与自由基进行配位可以有效除去前驱体原本的配体, 形成原子级分散的贵金属原子. 如图 4(1)所示, 首先将超薄TiO2纳米片加入乙二醇溶剂中, 使超薄TiO2纳米片被乙二醇覆盖形成乙二醇基. 超薄TiO2纳米片上乙二醇基在紫外光作用下与光生空穴结合生成稳定的乙二醇自由基, 由于自由基的高活泼性更易与Pd原子结合形成Pd-O键, 从而有效地除去Pd前驱体中的配位氯原子, 同时稳定Pd原子. 随后, 又以同样的方法制备Pd1/TiO2-EG(Ethylene Glycolate)单原子催化剂, 再经煅烧得到Pd1/TiO2单原子催化剂, 独特的Ti-O-Pd界面促进了氧气分子的活化形成超氧化物, 从而促进了催化剂的催化氧化性能, 进一步证明单原子催化剂的金属氧化物载体也参与活性位点的催化反应[39].

|
图 4 (1)紫外光诱导合成Pd1/TiO2单原子催化剂的机理示意图[38]; (2)Pt1/MC单原子催化剂光化学合成示意图[40] Fig.4 (1) Schematic diagram of the synthesis of Pd1/TiO2 single-atom catalyst induced by ultraviolet light[38]; (2) Schematic diagram of photochemical synthesis of Pt1/MC single-atom catalyst[40] |
在光化学还原过程中, 纳米晶体的成核和生长强烈依赖于离子和原子在液体环境中的扩散. 如图 4(2)所示, Wei等[40]在黑暗条件下用液氮将氯铂酸溶液快速冷冻, 形成均匀分散的Pt前驱体冰层, 限制还原后分散的Pt原子的团聚. 在较低温度下(-25 ℃)紫外光照射还原1 h, 室温过夜形成Pt原子分散液, 与载体MC(Mesoporous Carbon)混合可以制备出Pt1/MC单原子催化剂.
1.4 热解法制备单原子催化剂热解法通常以碳基材料或金属有机骨架(MOF)材料作为载体, 利用金属前驱体与载体表面的修饰基团发生配位将负载金属原子锚定在载体表面[41-42]. 配位环境往往影响催化剂的结构和电子特性, Pan等[43]采用热解法制备了具有不同配位环境的Fe基催化剂, 由于Fe-N配位数的增加促进了关键中间体O=Fe=O物种的产生和活化, 因此四配位氮原子锚定的Fe活性位点表现出最高的苯氧化还原性能. 由于MOF材料及结构具有可调节性, 因此可以通过该方法合理地设计单原子催化剂的结构. 如图 5所示, Wang等[44]利用金属有机骨架UiO-66-NH2中游离胺基(-NH2)配体与Ru3+进行配位来稳定Ru原子, 通过孤对电子与d轨道之间的强相互作用确保Ru原子被限制在MOF材料的孔中, 防止负载金属原子在高温过程中团聚. 在热解过程中, UiO-66-NH2的配体和Zr基分别形成多孔碳材料和ZrO2纳米颗粒, 同时Ru离子被周围的碳还原, 再借助HF溶液刻蚀ZrO2纳米颗粒, 最终得到Ru单原子催化剂.
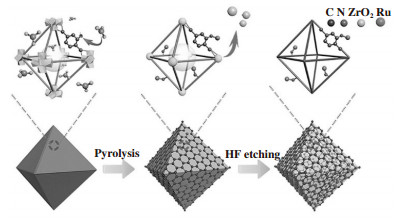
|
图 5 固定在UiO-66-NH2碳化骨架上的单个Ru原子的形成过程[44] Fig.5 Formation procedure of single Ru atoms immobilized on the carbonized skeleton of UiO-66-NH2[44] |
除了上述所述外, 还有其他用于单原子催化剂制备的方法, 包括逐步还原法[45]、氧化还原水解法[23]、高温气相捕集法[46]、原子捕获法[47]、离子交换法[48]、质量-分离软着陆法[49-51]、原位熔盐法[52]、一锅合成法[53]等. 其中, 逐步还原法需先制备一种纳米团簇, 随后在该纳米团簇表面负载另一种金属原子, 进而制备金属纳米团簇负载的单原子催化剂. 如图 6(1)所示, 通过在1.4 nm的Pd55母簇上负载单个Au原子, Au原子可以稳定吸附在Pd纳米簇的(111)晶面上, 电子从Pd转移到Au原子使Au原子带负电, 带负电的单原子Au活性位点催化葡萄糖氧化活性是单一Au或Pd催化活性的17~40倍[45]. 氧化还原水解法是常见催化剂缺陷构筑方法的一种, 即化学刻蚀, 主要是利用催化剂的化学性质, 选择酸、碱、还原性物质或氧化性物质等对催化剂的表面部分进行刻蚀. 如图 6(2)所示, Chen等[23]在TiO2中掺杂Mn制备Mn-TiO2载体, 分散在氯铂酸溶液中并滴加少量的H2O2溶液, 在酸性介质中, H2O2分解消耗H+使氯铂酸不断水解, 同时还原Mn阳离子, 载体表面电荷平衡被破坏形成带有负电荷的缺陷, Pt阳离子吸附在载体表面缺陷部位, 制备出Pt1/Mn-TiO2单原子催化剂.

|
图 6 (1)L-抗坏血酸为还原剂液相还原制备Pd簇负载的单原子金催化剂[45]; (2)氧化还原水解法合成Pt1/Mn-TiO2单原子催化剂示意图[23] Fig.6 (1) Schematic illustration of the deposition of single Au atoms on Pd mother clusters by the successive reduction method using L-ascorbic acid as a reductant[45]; (2) Schematic diagram of synthesis of Pt1/Mn-TiO2 single-atom catalyst by redox hydrolysis method[23] |
最后, 对上述几种常用的贵金属单原子催化剂的制备方法进行了总结, 如表 1所示. 其中原子层沉积技术具有形貌、尺寸等可控的优点, 缺点是制备成本较高; 湿法化学法虽然操作简单、制备成本低, 但是贵金属单原子负载量低; 光化学辅助法可以解决负载量的问题, 但是制备过程复杂; 热解法有利于防止贵金属高温团聚, 但是难以控制配位环境. 虽然上述几种方法各自具有优缺点, 但是相比于其他用于制备单原子催化剂的制备方法, 例如逐步还原法对液相还原条件的要求高、氧化还原法对载体表面的掺杂元素的分散要求较高等, 我们论述的这4种方法仍然具有显著的优势, 因此仍然是制备单原子催化剂的最主要方法.
| 表 1 常用的贵金属单原子催化剂制备方法 Table 1 Common preparation methods for noble metal single-atom catalyst |
单原子催化剂兼具均相催化剂和非均相催化剂的优点, 结合了均相催化剂的孤立活性位点、高活性、高选择性和非均相催化剂的稳定易分离的特点, 被认为是有望沟通均相催化和非均相催化的桥梁, 并且在电催化领域得到了广泛的应用[54-61]; 此外, 研究表明其在催化氧化(CO催化氧化、甲醛催化氧化、芳香烃催化氧化、甲醇催化氧化等)中也有一定的应用前景. 下面将针对贵金属单原子催化剂在催化氧化反应中的应用展开论述, 其中M1(M1=Pt, Au, Pd, Rh等)代表单原子催化剂中的贵金属单原子.
2.1 CO催化氧化CO催化氧化是研究单原子催化剂的典型反应, 通过研究单原子催化剂对CO的催化氧化, 可以探究CO催化氧化机理, 还有望实现单原子催化剂的工业化应用[61-67]. 并且文献研究表明上述的ALD技术、湿法化学法、光化学辅助法都可以应用于制备CO完全催化氧化催化剂.
Qiao等[15]合成Pt1/FeOx单原子催化剂后以CO催化氧化作为探针反应探究催化剂的催化性能, 其催化活性是Pt纳米颗粒催化剂的2~3倍. 结合高环形暗场扫描透射电子显微镜(HAADF-STEM)和扩展X射线吸收精细结构(EXAFS)等表征手段证明单个孤立Pt原子的存在, 在CO-漫反射傅里叶变换红外光谱(CO-DRIFT)谱图中2080 cm-1处CO的线性键合进一步说明载体表面无Pt-Pt键的存在. 此外, 传统上认为Au纳米颗粒或Au纳米团簇是CO低温催化反应的活性中心, 但Qiao等[68]分别将Au单原子、Au纳米颗粒和Au纳米团簇分散在合适的氧化物载体上, 对比发现单原子Au基催化剂对CO低温催化氧化也具有高活性, 在工业应用上具有高比活度、较好的稳定性. 一般而言, 负载金属原子的负载量极低时, 金属原子具有较高的分散性. 如图 7(1)所示, Qiao等[69]通过降低贵金属的负载合成0.05%(质量分数)Au1/Co3O4单原子催化剂, 可以在室温下实现一氧化碳的转化, 通过比较载体Co3O4和0.05%(质量分数)Au1/Co3O4对一氧化碳的催化活性, 发现催化反应的高活性源于负载在Co3O4纳米微晶上的孤立的Au单原子. Qiao等[70]将Au单原子嵌入到FeOx表面的氧空位, 高价的Fe原子对嵌入的Au单原子具有很强的共价金属-载体相互作用, 使得0.03%(质量分数)Au1/FeOx单原子催化剂具有较好的抗烧结能力, 如图 7(2)所示. 另外, CO吸附对CO催化氧化也具有很大影响. Li等[71]通过光化学辅助法在多孔纳米棒状CeO2(PN-CeO2)载体上负载0.57%(质量分数)的Pt原子形成Pt1/PN-CeO2单原子催化剂, 通过氢热预处理诱导孤立的PtCe双金属位点作为新型的表面活性中心, 催化反应条件下PtCe双金属位与低配位氧作用形成Pt-O-Ce界面, 在该反应界面上CO具有适当的吸附作用力, 促进CO低温催化氧化.

|
图 7 (1)0.05%(质量分数)Au1/Co3O4单原子催化剂上CO催化氧化活性测试[69]、(2)300和400 ℃下, CO氧化在0.03%(质量分数)Au1/FeOx单原子催化剂和FeOx上的稳定性测试[70] Fig.7 (1)CO catalytic oxidation on 0.05%(Mass fraction) Au1/Co3O4 single-atom catalyst[69], (2)Stability tests for CO oxidation on the 0.03%(Mass fraction) Au1/FeOx single-atom catalyst and on FeOx at 300 and 400 ℃, respectively[70] |
挥发性有机化合物(VOCs)的排放可能会导致二次污染物的形成, 例如对流层臭氧、过氧乙酰硝酸盐和光化学烟雾等, 严重影响人类的健康和生活环境[72-76]. 然而, 城市化的快速发展和现代工业化的需要导致VOCs排放量不断增加[77-78]. 到目前为止, 催化氧化被认为是减少VOCs排放的最经济、有效的末端处理技术之一, 而且不产生其他有机副产物. 有关VOCs排放的环境法规日益严格, 现有的催化剂已经不能满足其要求, 特别是负载型贵金属催化剂. 因此, 开发具有较高贵金属原子利用率和催化性能的单原子催化剂是解决目前VOCs末端处理所存在问题的可行的办法.
2.2.1 甲醛催化氧化建筑材料、木制家具、木制地板、油漆等室内用品随着时间会释放出甲醛气体, 这些释放的甲醛严重危害人类健康和居住环境. 催化氧化是除去甲醛的最有效的技术之一, 但是由于去除甲醛的贵金属催化剂的高成本问题, 使甲醛的有效去除面临新的挑战[79]. 为了解决这一问题, 寻求新型的负载型金属催化剂被认为是一种可行的方法.
Chen等[80]利用酸性条件下H2O2的分解对MnO2载体进行化学刻蚀, 形成表面缺陷. 同时由于H+的消耗促进前驱体的水解, 形成贵金属胶体, 形成的贵金属胶体沉积在被刻蚀的位点上, 随后在酸性介质中被还原成贵金属原子, 成功制备出高分散Au1/α-MnO2单原子催化剂. 由于载体表面缺陷被单个Au原子占据, 使得催化剂表面吸附氧物种减少, 促进了晶格氧的激活和迁移, 导致其表面VOCs催化反应倾向于遵循MvK催化机理. 其中0.25%(质量分数)Au1/α-MnO2催化剂具有最佳的表面活性氧物种和晶格氧迁移率, 反应如图 8所示, 可以实现室温下除去低浓度甲醛(体积分数1×10-6), 有望去除室内甲醛, 净化室内空气.
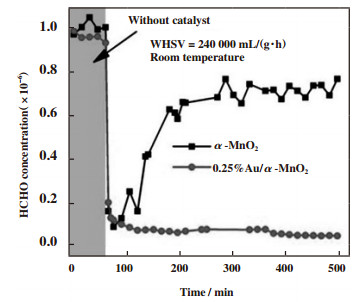
|
图 8 室温(25 ℃)下α-MnO2催化剂和0.25%(质量分数)Au1/α-MnO2单原子催化剂对低浓度HCHO(体积分数1 ×10-6)的催化氧化测试[80] Fig.8 Catalytic oxidation of low-concentration HCHO (volume fraction 1 ×10-6) by α-MnO2 catalyst and 0.25%(Mass fraction) Au1/α-MnO2 single-atom catalyst at room temperature (25 ℃)[80] |
无论是工业环境还是自然环境条件下, 水汽对催化剂的活性都有一定的影响. Chen等[23]同样用氧化还原水解的方法, 将Mn锚定在TiO2载体上, 在酸性条件下, MnO2作为催化剂促进H2O2分解, 该过程中少量Mn2+的浸出使催化剂表面产生空穴呈现负电性, 易于吸附带正电的Pt前驱体, 形成Pt1/Mn-TiO2单原子催化剂. 对于遵循MvK催化机理的催化反应, 晶格氧的消耗和补充决定了反应的进程, 其中晶格氧的补充与贵金属的配位息息相关. 如图 9(1)所示, 在Pt1/Mn-TiO2单原子催化剂的X射线吸收精细结构(XAFS)表征中, 被载体表面晶格氧所稳定的单个Pt原子高度不饱和, 具有较低的配位数, 加快了吸附氧分子的活化分解, 可以快速补充消耗的晶格氧, 促进催化氧化反应的进行. 甲醛化学吸附在载体表面的氧空位上, 被晶格氧吸附-活化形成中间体, 有利于加快甲醛催化降解[81]. 更进一步, 利用Hydrogen-Deuterium(H-D)同位素交换, 在反应气中引入一定D2O, 同位素追踪结果表明水蒸气的引入抑制了甲醛的聚合, 同时形成具有强氧化性的表面羟基, 促进甲醛的深度氧化, 具体如图 9(2)机理图所示.

|
图 9 (1)Pt1/Mn-TiO2单原子催化剂的k3加权傅里叶变换XAFS、(2)Pt1/Mn-TiO2单原子催化剂上HCHO催化氧化反应机理的例证[23] Fig.9 (1) k3-weighted Fourier transformed XAFS of Pt1/Mn-TiO2 single-atom catalyst, (2) Illustration of reaction mechanism about catalytic oxidation of HCHO over Pt1/Mn-TiO2 single-atom catalyst[23] |
芳香烃(如: 苯、甲苯)是典型的VOCs排放废气, 具有剧毒性和致癌性[82-85]. 针对此类污染物, 目前已经通过原位熔盐法、水热法和浸渍法等制备了可用于催化芳香烃氧化的单原子催化剂.
利用传统的浸渍还原的方法, Yang等[22]通过增大载体比表面积的方法构造了三维有序介孔Fe2O3载体, 进一步合成了Pt载量均为0.25%(质量分数)的Pt1/meso-Fe2O3单原子催化剂和PtNP/meso-Fe2O3纳米颗粒负载型催化剂用于苯的催化氧化. Pt1/meso-Fe2O3催化剂的催化活性远高于PtNP/meso-Fe2O3催化剂, 在160 ℃时Pt1/meso-Fe2O3的TOFPt(Turn over frequency)值(2.69 s-1)远高于PtNP/meso-Fe2O3的TOFPt(1.16 s-1), 主要是因为在Pt1/meso-Fe2O3催化剂中活性位点高度分散, 具有更多的活性位点. 此外, 作者还评价了水汽对该催化剂的影响. 如图 10(1)和(2)所示, 在反应气中分别引入3.0%(体积分数)H2O, Pt1/meso-Fe2O3和PtNP/meso-Fe2O3都具有良好的抗水性. 在经过3个循环后, Pt1/meso-Fe2O3催化剂的催化效果明显提高, 这主要是因为催化剂表面形成更多的Pt-O(OH)x物种, 促进分子氧的吸附-活化[86]; 另一方面, H2O有助于催化剂表面碳酸盐的分解, 从而提高催化剂活性[87]. 相反, 水汽存在下PtNP/meso-Fe2O3催化剂的轻微失活可能是因为水蒸气与反应物的竞争吸附.

|
图 10 SV = 20 000mL/(g·h)时, 通入或停止1.0%(体积分数)或3.0%(体积分数)水蒸气情况下, 苯转化率随反应时间的变化 Fig.10 Benzene conversion as a function of on-stream reaction time in the presence or absence of 1.0%(volume fraction) or 3.0%(volume fraction) water vapor at SV = 20 000 mL/(g·h) over(1) Pt1/meso-Fe2O3 at 192 ℃, (2) PtNP/meso-Fe2O3 at 250 ℃[22] (1)192 ℃下Pt1/meso-Fe2O3、(2)250 ℃下PtNP/meso-Fe2O3[22] |
通常, 工业废气中会含有少量的SO2, 影响催化剂的稳定性, 甚至使催化剂失活[88]. Huo等[89]研究发现Pd1Co1/Al2O3单原子合金催化剂具有抗硫性. 如图 11所示, 在反应气中加入体积分数25×10-6的SO2后, 负载Pd纳米颗粒的Pd/Al2O3催化剂和Pd1Co1/Al2O3单原子催化剂的活性都有所下降, 这是因为SO2吸附在催化剂表面, 转化为硫酸盐覆盖催化剂表面活性位点. 当催化剂表面的亚硫酸盐或硫酸盐在特定温度下分解时, 催化剂表面活性位点重新暴露出来, Pd1Co1/Al2O3单原子合金催化剂活性逐渐恢复. Pd1Co1/Al2O3单原子合金催化剂超过原本的催化活性, 这主要是因为单原子分散的PdCo表面形成的亚硫酸盐或硫酸盐的快速分解, 增加了催化剂表面的氧物种, 苯在催化剂表面吸附后与这些活性表面氧物种反应, 因此提高了催化剂的催化活性[90]. 然而, 即使维持在较高的温度下, Pd/Al2O3催化剂表面仍存在一定量未分解的亚硫酸盐或硫酸盐覆盖在催化剂表面的活性位点上, 使得SO2老化后的催化剂无法恢复到原来的催化活性.
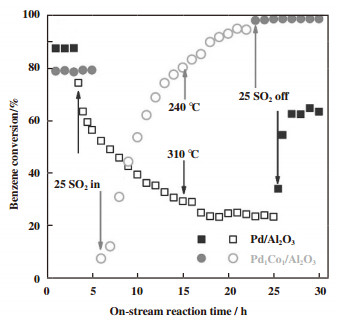
|
图 11 在不同SO2浓度情况下, Pd/Al2O3和Pd1Co1/Al2O3两种催化剂表面苯转化率随反应时间的变化[89] Fig.11 The surface benzene conversion rate of Pd/Al2O3 and Pd1Co1/Al2O3 catalysts versus on-stream reaction time under different SO2 concentrations[89] |
此外, 单原子催化剂在低浓度芳香烃的催化氧化过程中也具有良好的催化活性. Zhang等[91]用一锅法在水热条件下制备了0.1%(体积分数)Pt1/MnO2单原子催化剂, 用于催化氧化低浓度(体积分数10×10-6和100×10-6)甲苯, 在低于50 ℃条件下甲苯转化率达到80%, 160 ℃条件下可以达到体积分数100×10-6甲苯的完全转化. 这主要归因于单个Pt原子沉积在载体表面时, 极大地活化了表面氧, 产生了具有强氧化性的羟基自由基(·OH), 在较低温度下氧化甲苯[92]. 同样, Zhao等[93]通过在反应气中引入H2O, 发现分子氧在单个Pt原子表面更倾向于解离成·OH, 作为主要的活性氧物种催化甲苯氧化. 如图 12所示, 水蒸气存在下, 催化剂表面形成·OH氧物种(O2→2O*+H2O→4·OH), Pt1/MgO单原子催化剂表面·OH表观活化能(2.48 eV)远低于MgO上的表观活化能(4.13 eV), 大量的·OH氧物种生成有利于提高催化剂的催化活性.
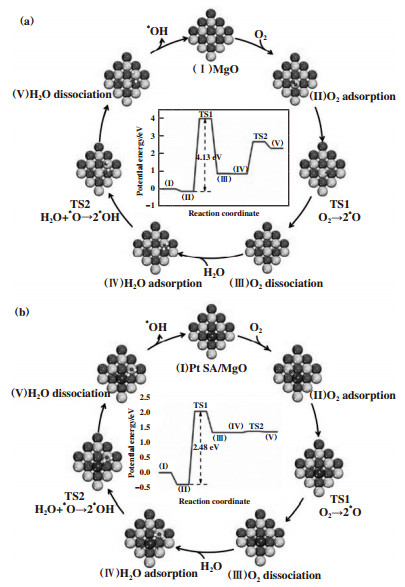
|
图 12 (1)MgO和(2)Pt1/MgO上H2O和O2之间反应的能量分布和优化后的过渡态[93] Fig.12 Energy profiles and optimized TSs (Transition states) of the reaction between H2O and O2 on (1) MgO and (2) Pt1/MgO[93] |
由上可见, 单原子催化剂在催化氧化领域中有很大的应用前景, 其不仅对VOCs催化氧化具有较好的催化活性、抗水性和抗毒性, 同时也是在原子尺度上研究催化氧化反应催化机理的良好手段. Jiang等[94]还通过对Pt1/Co3O4单原子催化剂上低温甲醇催化氧化的研究, 从原子尺度上提出了甲醇催化氧化的路径. Pt原子对相邻Co原子的3d轨道表现出很强的亲和力, 导致电子从Pt单原子转移到Co, 增加催化剂表面存在的氧空位比例, 促进甲醇和O2的共吸附, 从而加速C-H键的解离. 此外, Jiang等[95]通过水热法制备了不同形貌的CeO2载体, 并制备了一系列Pt1/CeO2单原子催化剂, 构建了不同CeO2晶面上的Pt-O-Ce活性界面, 结果发现畸变的Pt-O-Ce界面在低温甲醇催化氧化时表现出很好的催化效果, 并发现该催化剂表面的甲醇催化氧化反应在低温下遵循L-H机理、高温下遵循MvK机理.
2.3 催化机理研究基于单原子催化剂催化活性的研究, 可以在原子尺度上研究催化反应的反应途径, 推测不同催化反应的催化机理, 为未来催化剂的设计提供思路, 制备更高效的催化剂. 与传统的贵金属纳米颗粒催化剂不同的是, 单原子催化剂以单个贵金属原子作为活性位点, 而不是纳米颗粒或者纳米团簇. 纳米颗粒或者纳米团簇在参与反应时, 仅表面一层贵金属原子作为活性位点参与反应. 因此, 在相同贵金属负载量的条件下, 单原子催化剂表面可参与反应的活性位点较多. 单原子催化剂中贵金属原子和载体之间存在金属-载体强相互作用, 贵金属和载体协同参与催化反应, 有利于CO和VOCs的深度氧化.
2.3.1 CO催化机理通常认为, CO在纳米催化剂上的催化反应机理为双分子吸附的Langmuir-Hinshelwood机理(L-H机理), O2和CO共吸附在活性位点, 形成OCOO*中间体, 后裂解释放出CO2, 残留的O原子继续与另一CO分子反应生成CO2, 完成一个完整催化循环[96-97]. 相反, Han等[98]的研究表明, Rh1/ZnO单原子催化剂上的CO催化氧化可能遵循Mars-van-Krevelen机理(MvK机理), 其中载体表面氧空位处O2的分解是反应的决速步骤. 如图 13所示, Long等[99]通过具有Hubbard型库仑作用的密度泛函理论研究CO分别在Au原子掺杂ThO2催化剂和Au1/ThO2单原子催化剂上的催化机理. 在ThO2(111)晶面上掺杂Au原子时, CO催化氧化遵循MvK机理: 如图 13(1)所示, CO与晶格氧反应形成CO2-, 以低能垒(0.17 eV)转化为CO2并生成氧空位; O2吸附在上述氧空位中形成活化的O2-; CO与O2-结合形成OCOO*中间体, 后分解成CO2和O*, 恢复ThO2(111)晶面. 相反, Au单原子负载在ThO2(111)晶面上时不遵循传统的MvK催化机理: 如图 13(2)所示, CO吸附在Au单原子上, O2同时吸附在相邻的Au单原子上; 电子从Au单原子转移到O2形成O2-; 又一CO分子攻击O2-, 生成CO2和O*; 原吸附的CO与O*反应生成另一CO2分子. 通过对单原子催化剂的理论研究, 有望为未来负载型催化剂的设计提供思路, 并结合实验探究催化氧化反应本质.
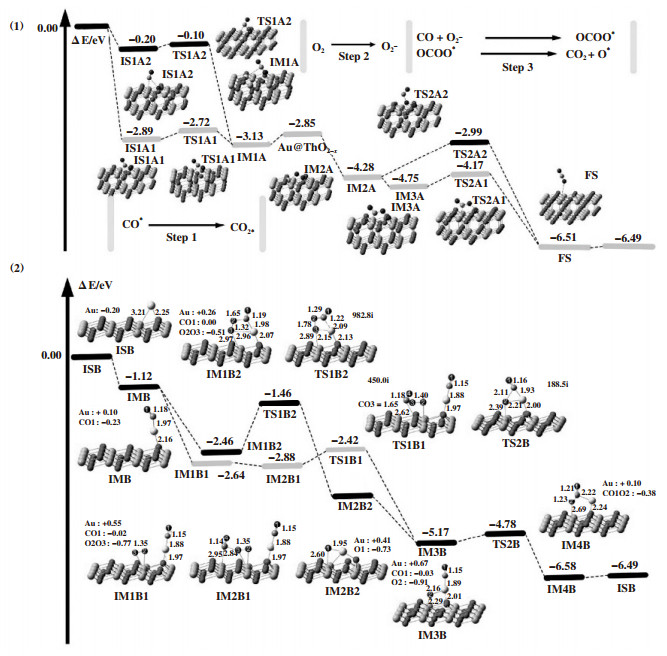
|
图 13 (1)计算得到Au原子掺杂ThO2(111)上CO氧化的势能曲线;(2)计算得到Au单原子负载ThO2(111)上CO氧化的势能曲线[99] Fig.13 (1) Calculated potential energy profile of CO oxidation on Au-atom doped ThO2(111);(2) Calculated potential energy profile for CO oxidation on a gold single-atom supported by ThO2(111)[99] |
目前, MvK催化机理、L-H催化机理和E-R(Eley-Rideal)催化机理被认为是VOCs催化氧化的3大主要催化机理. 其中MvK催化机理较为常见, 分子氧在催化剂表面活化和催化剂表面氧空位的形成是该反应机理的关键因素之一. Zhao等[93]选择MgO这种非氧化还原型的氧化物作为载体, MgO表面具有较高的氧空位形成能(6.29 eV), 负载单个Pt原子后, 该氧空位形成能降低4.19 eV, 促进催化剂表面氧空位的形成; 另一方面, 甲苯和氧气分子很难吸附在MgO上, 而氧气分子会优先吸附在单个Pt原子上, 电子从Pt转移到吸附氧上, 激活分子氧. Wang等[100]采用氧化还原型的氧化物载体TiO2, 借助Gas Chromatography-Mass Spectrometry(GC-MS)等表征手段提出了甲苯在同时负载Pt纳米颗粒和Pt单原子的Pt/TiO2催化剂上可能的催化氧化途径. 如图 14所示, 反应可能通过两种不同路径最终生成二氧化碳和水. 在较低的温度下(约小于160 ℃), 一部分甲苯可能发生歧化反应生成苯和对二甲苯, 进一步转化为邻苯二甲酸; 而另一部分甲苯则被催化剂表面活性氧物种依次氧化形成苯甲醇、苯甲醛、苯甲酸. 随着反应温度的提高, 苯甲酸和邻苯二甲酸进一步氧化为马来酸酐和衣康酸酐, 并在更高温度下发生开环反应, 最后完全氧化为CO2和H2O. 然而该方案并未就反应动力学方面进一步探究, 对于甲苯在微观层次的动力学探究仍需要借助单原子催化剂, 从而更深入了解甲苯催化氧化反应的决速步骤, 以合理设计用于甲苯高效催化氧化的催化剂. 相反, 该课题组还发现在Pd1Co1/Al2O3双金属单原子催化剂表面, 苯的催化氧化遵循L-H催化机理[89]. 通常对于单金属负载催化剂, 分子氧在贵金属位点上吸附、活化, 同时VOCs也吸附在贵金属位点上, 两者存在竞争吸附. 在Pd1Co1/Al2O3双金属负载催化剂中, 苯吸附在Pd单原子位点, O2在Co位点吸附、活化, 这种双活性位点不仅阻碍O2和VOCs竞争吸附, 也加快了苯的催化氧化.

|
图 14 负载型Pt/TiO2(Pt纳米颗粒+Pt单原子)催化剂上甲苯氧化的可能催化机理[100] Fig.14 Possible catalytic mechanism for toluene oxidation over supported Pt/TiO2 (Pt nanoparticles + Pt single atom)[100] |
Jiang等[95]的研究结果表明甲醇在Pt1/CeO2单原子催化剂上的催化机理并不是简单的按照MvK催化机理或者L-H催化机理进行. 在低温(< 85 ℃)条件下, 表面吸附氧作为活性氧物种参与反应, 甲醇分子主要形成DOM(Dioxy-Methylene), 甲醇分子主要通过C-H键的逐步断裂而分解, 此时甲醇的活化遵循L-H机制. 随着反应温度升高(150 ℃), 晶格氧参与甲醇的分解形成DOM和羧基, 促进甲醇深度氧化, 该条件下甲醇氧化遵循MvK催化机制. Chen等[101]研究表明甲醛首先被Au1/CeO2单原子催化剂的表面羟基组活化, 后被晶格氧氧化为DOM, 进一步被晶格氧深度氧化为碳酸盐, 在H2O分子作用下, 碳酸盐解离生成CO2, 催化剂表面羟基组恢复.
3 总结与展望单原子催化剂的研究为非均相催化氧化开拓了新的领域. 近几年, 单原子催化剂的研究在VOCs催化氧化领域也取得了显著进展, 单原子催化剂的各类新型制备方法也不断涌现. 综述了目前用于单原子催化剂催化氧化的制备和应用, 同时也发现对于单原子催化剂的研究需要进一步深入, 如: (1)ALD技术很难实现工业化的大规模生产, 光化学辅助法和热解法在制备过程中能耗也相对较高, 而最适合工业化大规模制备单原子催化剂的湿法化学法存在贵金属分散性较差的问题. 对此, 未来一段时间内, 利用合适的封端剂或金属-载体强相互作用制备可大规模工业化生产的单原子催化剂仍是一项挑战; (2)单原子催化剂的化学稳定性仍旧是需要考虑的问题. 虽然目前的研究表明单原子催化剂有一定的抗硫性, 但是具体抗硫的原因仍然不明确, 仍需要进一步研究. 此外, 单原子催化剂能否抵抗含氯物质对催化剂的毒害实现工业催化领域的突破性进展是急需解决的问题. 具有高比表面积的单个原子在反应过程中很容易迁移, 聚集成纳米颗粒, 从而影响催化反应; (3)单原子催化剂的热稳定性是将其用于完全催化氧化领域的另一项挑战, 单个贵金属原子具有极高的表面势能, 在高温催化过程中极易团聚, 对于这种贵金属团聚的单原子催化剂的再生、还原, 李亚栋院士[102]已经给出先例, 后期还需要进一步探究多种单原子催化剂再生、还原的手段, 实现贵金属资源的重复利用; (4)单原子催化剂的催化机理也是未来需要深入研究的, 从原子尺度上探究动态的催化反应, 对进一步了解其构效关系至关重要, 对此不仅可以借助DRIFT表征手段, 飞行时间质谱(TOF)可能也是一种可行的手段. 我们从原子尺度上探讨了贵金属单原子催化剂在VOCs催化氧化反应过程中的机理和作用, 从而希望研发出用于VOCs工业废气治理的低成本贵金属基催化剂, 开拓环境污染治理的新型催化路径.
| [1] |
Deng H, Kang S Y, Ma J Z, et al. Silver incorporated into cryptomelane-type manganese oxide boosts the catalytic oxidation of benzene[J]. Appl Catal B Environ, 2018, 239(30): 214–222.
|
| [2] |
a. Liang Y J, Liu Y X, Deng J G, et al. Coupled palla-dium-tungsten bimetallic nanosheets/TiO2 hybrids with enhanced catalytic activity and stability for the oxidative removal of benzene[J]. Environ Sci Technol, 2019, 53(10): 5926-5935. b. Hu Yi-ming(胡一鸣), Zheng Wan-bin(郑万彬), Tang Cen(汤岑), et al. Recent advances in selective hydrogenation of crotonaldehyde over noble metal catalysts(贵金属催化剂上巴豆醛选择性加氢的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(4): 366-377. |
| [3] |
a. Wang M M, Chen D Y, Li N J, et al. Highly efficient catalysts of bimetallic Pt-Ru nanocrystals supported on ordered ZrO2 nanotube for toluene oxidation[J]. ACS Appl Mater Inter, 2020, 12(12): 13781-13789. b. Xie Yan-ling(谢艳玲), Zhu Lin-hua(祝琳华), Si Tian(司甜). Influence of modification methods of halloysite on the catalytic performance of halloysite-supported gold catalysts for selective oxidation of cyclohexane(埃洛石纳米管的改性方式对其负载的金催化剂在环己烷液相选择性氧化反应中的催化性能的影响)[J]. J Mol Catal(China)(分子催化), 2021, 35(6): 518-528. |
| [4] |
Li S M, Hao Q L, Zhao R Z, et al. Highly efficient cata-lytic removal of ethyl acetate over Ce/Zr promoted copper/ZSM-5 catalysts[J]. Chem Eng J, 2016, 285(1): 536–543.
|
| [5] |
Liu X L, Han Q Z, Shi W B, et al. Catalytic oxidation of ethyl acetate over Ru-Cu bimetallic catalysts: Further insights into reaction mechanism via in situ FTIR and DFT studies[J]. J Catal, 2019, 369: 482–492.
DOI:10.1016/j.jcat.2018.11.025 |
| [6] |
Naoto K, Tomohiro M, Hiroki M, et al. Catalytic comb-ustion of ethyl acetate and nano-structural changes of ruthenium catalysts supported on tin oxide[J]. Appl Catal B: Environ, 2010, 97: 120–126.
DOI:10.1016/j.apcatb.2010.03.031 |
| [7] |
Qin Y, Liu X L, Zhu T L, et al. Catalytic oxidation of ethyl acetate over silver catalysts supported on CeO2 with different morphologies[J]. Mater Chem Phys, 2019, 229: 32–38.
DOI:10.1016/j.matchemphys.2019.02.065 |
| [8] |
Chen C Y, Chen F, Zhang L, et al. Importance of plati-num particle size for complete oxidation of toluene over Pt/ZSM-5 catalysts[J]. Chem Commun, 2015, 51: 5936–5938.
DOI:10.1039/C4CC09383F |
| [9] |
Lu A L, Sun H L, Zhang N W, et al. Surface partial-charge-tuned enhancement of catalytic activity of plati-num nanocatalysts for toluene oxidation[J]. ACS Catal, 2019, 9(8): 7431–7442.
DOI:10.1021/acscatal.9b01776 |
| [10] |
Losch P, Huang W X, Goodman E D, et al. Colloidal nanocrystals for heterogeneous catalysis[J]. Nano Today, 2019, 24: 15–47.
DOI:10.1016/j.nantod.2018.12.002 |
| [11] |
Schauermann S, Hoffmann J, Johánek V, et al. Catalytic activity and poisoning of specific sites on supported metal nanoparticles[J]. Angew Chem Int Ed, 2002, 41(14): 2532–2535.
DOI:10.1002/1521-3773(20020715)41:14<2532::AID-ANIE2532>3.0.CO;2-3 |
| [12] |
Yang X F, Wang A Q, Qiao B T, et al. Single-atom catalysts: A new frontier in heterogeneous catalysis[J]. Acc Chem Res, 2013, 46(8): 1740–1748.
DOI:10.1021/ar300361m |
| [13] |
Li Z, Ji S F, Liu Y W, et al. Well-defined materials for heterogeneous catalysis: From nanoparticles to isolated single-atom sites[J]. Chem Rev, 2020, 120(2): 623–682.
DOI:10.1021/acs.chemrev.9b00311 |
| [14] |
Zhang N Q, Li L C, Chu Y, et al. High Pt utilization efficiency of electrocatalysts for oxygen reduction reaction in alkaline media[J]. Catal Today, 2019, 332: 101–108.
DOI:10.1016/j.cattod.2018.07.018 |
| [15] |
Qiao B T, Wang A Q, Yang X F, et al. Single-atom catal-ysis of CO oxidation using Pt1/FeOx[J]. Nat Chem, 2011, 3: 634.
DOI:10.1038/nchem.1095 |
| [16] |
Chen F, Jiang X Z, Zhang L L, et al. Single-atom cata-lysis: Bridging the homo- and heterogeneous catalysis[J]. Chin J Catal, 2018, 39(5): 893–898.
DOI:10.1016/S1872-2067(18)63047-5 |
| [17] |
Xiong Y, Dong J C, Huang Z Q, et al. Single-atom Rh/N-doped carbon electrocatalyst for formic acid oxidation[J]. Nat Nanotechnol, 2020, 15: 390–397.
DOI:10.1038/s41565-020-0665-x |
| [18] |
Mao J J, He C T, Pei J J, et al. Isolated Ni atoms disp-ersed on Ru nanosheets: High-performance electroc-atalysts toward hydrogen oxidation reaction[J]. Nano Lett, 2020, 20(5): 3442–3448.
DOI:10.1021/acs.nanolett.0c00364 |
| [19] |
Zhang L F, Zhao W H, Zhang W H, et al. g-C3N4 coordinated single atom as an efficient electrocatalyst for nitrogen reduction reaction[J]. Nano Res, 2019, 12: 1181–1186.
DOI:10.1007/s12274-019-2378-8 |
| [20] |
Zhang Z, Ma C, Tu Y C, et al. Multiscale carbon foam confining single iron atoms for efficient electrocatalytic CO2 reduction to CO[J]. Nano Res, 2019, 12: 2313–2317.
DOI:10.1007/s12274-019-2316-9 |
| [21] |
Ye C L, Peng M, Wang Y H, et al. Surface hexagonal Pt1Sn1 intermetallic on Pt nanoparticles for selective propane dehydrogenation[J]. ACS Appl Mater Inter, 2020, 12(23): 25903–25909.
DOI:10.1021/acsami.0c05043 |
| [22] |
Yang K, Liu Y X, Deng J G, et al. Three-dimensionally ordered mesoporous iron oxide-supported single-atom platinum: Highly active catalysts for benzene combustion[J]. Appl Catal B Environ, 2019, 244: 650–659.
DOI:10.1016/j.apcatb.2018.11.077 |
| [23] |
Chen J, Jiang M Z, Xu W J, et al. Incorporating Mn cation as anchor to atomically disperse Pt on TiO2 for low-temperature removal of formaldehyde[J]. Appl Catal B Environ, 2019, 259: 118013.
DOI:10.1016/j.apcatb.2019.118013 |
| [24] |
Zhang Ning-qiang(张宁强), Li Ling-cong(李伶聪), Huang Xing(黄星), et al. Research progress of single-atom catalysis(单原子催化剂的研究进展)[J]. J Chin Soc Rare Earths(中国稀土学报), 2018, 5(5): 513–532.
|
| [25] |
Li X Y, Rong H P, Zhang J T, et al. Modulating the local coordination environment of single-atom catalysts for enhanced catalytic performance[J]. Nano Res, 2020, 13: 1842–1855.
DOI:10.1007/s12274-020-2755-3 |
| [26] |
Ahonen M, Pessa M, Suntola T. A study of zinc telluride films grown on glass substrates using an atomic layer evaporation method[J]. Thin Solid Films, 1980, 65(3): 301.
DOI:10.1016/0040-6090(80)90240-0 |
| [27] |
Zhang L, Banis M N, Sun X L. Single-atom catalysts by the atomic layer deposition technique[J]. Natl Sci Rev, 2018, 5(5): 628–630.
DOI:10.1093/nsr/nwy054 |
| [28] |
Hermida M P, Lu Z, White A, et al. Towards ALD thin film stabilized single-atom Pd1 catalysts[J]. Nanoscale, 2016, 8: 15348–15356.
DOI:10.1039/C6NR04403D |
| [29] |
Cheng N C, Stambula S, Wang D, et al. Platinum single-atom and cluster catalysis of the hydrogen evolution reaction[J]. Nat Commun, 2016, 7: 13638.
DOI:10.1038/ncomms13638 |
| [30] |
Bartholomew C H, Robert J F. Fundamentals of Industrial Catalytic Processes[M]. New York: John Wiley & Sons, 2008.
|
| [31] |
Zhang S C, Chen L N, Qi Z Y, et al. Insights into the mechanism of n-Hexane reforming over a single site platinum catalyst[J]. J Am Chem Soc, 2020, 142(39): 16533–16537.
DOI:10.1021/jacs.0c07911 |
| [32] |
Wan J W, Chen W X, Jia C Y, et al. Defect effects on TiO2 nanosheets: Stabilizing single atomic site Au and promoting catalytic properties[J]. Adv Mater, 2018, 30(11): 1705369.
DOI:10.1002/adma.201705369 |
| [33] |
Jeong H, Shan D, Kim B S, et al. Controlling the oxidation state of Pt single atoms for maximizing catalytic activity[J]. Angew Chem Int Ed, 2020, 59(46): 2–8.
|
| [34] |
Wang F, Ma J Z, He H, et al. Resolving the puzzle ofsingle-atom silverdispersion on nanosized γ-Al2O3 surfacefor high catalytic performance[J]. Nat Commun, 2020, 11: 529.
DOI:10.1038/s41467-019-13937-1 |
| [35] |
Feng Y Y, Guan Y X, Wang Y, et al. Selectively anchoring Pt single atoms at hetero-interfaces of γ-Al2O3/NiS to promote the hydrogen evolution reaction[J]. J Mater Chem A, 2018, 6: 11783–11789.
DOI:10.1039/C8TA02556H |
| [36] |
Zhou Guang-he(周广贺), Han Wei-gao(韩维高), Tang Zhi-cheng(唐志诚), et al. Research progress in the construction of single-atom catalysts on the surface of substrates and their catalytic performance(基底表面构建单原子催化剂与催化性能研究进展)[J]. J Mol Catal (China)(分子催化), 2021, 35(1): 54–64.
|
| [37] |
Zhang Tao(张涛). New strategy for photochemical syn-thesis of monoatomic palladium catalyst(单原子钯催化剂的光化学合成新策略)[J]. Acta Phys-Chim Sin(物理化学学报), 2016, 32(7): 1551–1552.
|
| [38] |
Liu P X, Zhao Y, Qin R X, et al. Photochemical route for synthesizing atomically dispersed palladium catalysts[J]. Science, 2016, 352: 6287.
|
| [39] |
Liu P X, Zhao Y, Qin R X, et al. A vicinal effect for promoting catalysis of Pd1/TiO2: Supports of atomically dispersed catalysts play more roles than simply serving as ligands[J]. Sci Bull, 2018, 63(11): 675–682.
DOI:10.1016/j.scib.2018.03.002 |
| [40] |
Wei H H, Huang K, Wang D, et al. Iced photochemical reduction to synthesize atomically dispersed metals by suppressingnanocrystal growth[J]. Nat Commun, 2017, 8: 1490.
DOI:10.1038/s41467-017-01521-4 |
| [41] |
Fang X Z, Shang Q C, Wang Y, et al. Single Pt atoms confined into a metal-organic framework for efficient photocatalysis[J]. Adv Mater, 2018, 30(7): 1705112.
DOI:10.1002/adma.201705112 |
| [42] |
He T, Chen S M, Ni B, et al. Zirconium-porphyrin-based metal-organic framework hollow nanotubes for immobilization of noble-metal single atoms[J]. Angew Chem Int Ed, 2018, 57(13): 3493–3498.
DOI:10.1002/anie.201800817 |
| [43] |
Pan Y, Chen Y J, Wu K L, et al. Regulating the coord-ination structure of singleatom Fe-NxCy catalytic sites for benzene oxidation[J]. Nat Commun, 2019, 10: 4290.
DOI:10.1038/s41467-019-12362-8 |
| [44] |
Wang X, Chen W X, Zhang L, et al. Uncoordinated amine groups of metal-organic frameworks to anchor single Ru sites as chemoselective catalysts toward the hydrogenation of quinoline[J]. J Am Chem Soc, 2017, 139(28): 9419–9422.
DOI:10.1021/jacs.7b01686 |
| [45] |
Zhang H J, Kawashima K, Okumura M, et al. Colloidal Au single-atom catalysts embedded on Pd nanoclusters[J]. J Am Chem Soc, 2014, 2: 13498–13508.
|
| [46] |
Jones J, Xiong H F, DeLaRiva A T, et al. Thermally stable single-atom platinum-on-ceria catalysts via atom trapping[J]. Science, 2016, 353: 150.
DOI:10.1126/science.aaf8800 |
| [47] |
He Y P, Song X Z, Ding F, et al. The TiO2 topotactic transformation assisted trapping of an atomically disp-ersed Pt catalyst for low temperature CO oxidation[J]. RSC Adv, 2019, 9: 16774–16778.
DOI:10.1039/C9RA02739D |
| [48] |
Zhang L L, Wang A Q, Miller J T, et al. Efficient and durable Au alloyed Pd single-atom catalyst for the ullmann reaction of aryl chlorides in water[J]. ACS Catal, 2014, 4(5): 1546.
DOI:10.1021/cs500071c |
| [49] |
Vajda S, White M G. Catalysis applications of size-selected cluster deposition[J]. ACS Catal, 2015, 5(12): 7152–7176.
DOI:10.1021/acscatal.5b01816 |
| [50] |
Liu J Y. Catalysis by supported single metal atoms[J]. ACS Catal, 2017, 7(1): 34–59.
DOI:10.1021/acscatal.6b01534 |
| [51] |
Abbet S, Sanchez A, Heiz U, et al. Acetylene cyclotrim-erization on supported size-selected Pdn clusters (1 ≤ n ≤ 30): One atom is enough[J]. J Am Chem Soc, 2000, 122(14): 3453–3457.
DOI:10.1021/ja9922476 |
| [52] |
Zhang Y, Liu Y X, Xie S H, et al. Supported ceria-modified silver catalysts with high activity and stability for toluene removal[J]. Environ Int, 2019, 128: 335–342.
DOI:10.1016/j.envint.2019.04.062 |
| [53] |
Han B, Lang R, Zhang T, et al. Highlights of the major progress in single-atom catalysis in 2015 and 2016[J]. Chin J Catal, 2017, 38(9): 1498–1507.
DOI:10.1016/S1872-2067(17)62872-9 |
| [54] |
Xiong H F, Lin S, Goetze J, et al. Thermally stable and regenerable platinum-tin clusters for propane dehydrogenation prepared by atom trapping on ceria[J]. Angew Chem Int Ed, 2017, 56(31): 8986–8991.
DOI:10.1002/anie.201701115 |
| [55] |
Wang Y J, Zhao N, Fang B, et al. Carbon-supported Pt based alloy electrocatalysts for the oxygen reduction reaction in polymer electrolyte membrane fuel cells: Particle size, shape, and composition manipulation and their impact to activity[J]. Chem Rev, 2015, 115(9): 3433–3467.
DOI:10.1021/cr500519c |
| [56] |
Yang S, Tak Y J, Kim J, et al. Support effects in single-atom platinum catalysts for electrochemical oxygen reduction[J]. ACS Catal, 2017, 7(2): 1301–1307.
DOI:10.1021/acscatal.6b02899 |
| [57] |
Wang X X, Cullen D A, Pan Y T, et al. Nitrogen-coordinated single cobalt atom catalysts for oxygen reduction in proton exchange membrane fuel cells[J]. Adv Mater, 2018, 30(11): 1706758.
DOI:10.1002/adma.201706758 |
| [58] |
Chen Y J, Ji S F, Wang Y G, et al. Isolated single iron atoms anchored on N-doped porous carbon as an efficient electrocatalyst for the oxygen reduction reaction[J]. Angew Chem Int Ed, 2017, 56(24): 6937–6941.
DOI:10.1002/anie.201702473 |
| [59] |
Zhang L H, Han L L, Liu H X, et al. Potential-cycling synthesis of single platinum atoms for efficient hydrogen evolution in neutral media[J]. Angew Chem Int Ed, 2017, 56(44): 13694–13698.
DOI:10.1002/anie.201706921 |
| [60] |
Deng J, Li H B, Xiao J P, et al. Triggering the electroc-atalytic hydrogen evolution activity of the inert two-dimensional MoS2 surface via single-atom metal doping[J]. Energy Environ Sci, 2015, 8: 1594–1601.
DOI:10.1039/C5EE00751H |
| [61] |
Gao S, Lin Y, Jiao X C, et al. Partially oxidized atomic cobalt layers for carbon dioxide electroreduction to liquid fuel[J]. Nature, 2016, 529: 68–71.
DOI:10.1038/nature16455 |
| [62] |
Li Z Y, Yuan Z, Li X N, et al. CO oxidation catalyzed by single gold atoms supported on aluminum oxide clus-ters[J]. J Am Chem Soc, 2014, 136(40): 14307–14313.
DOI:10.1021/ja508547z |
| [63] |
Wu P, Du P, Zhang H, et al. Graphyne-supported single Fe atom catalysts for CO oxidation[J]. Phys Chem Chem Phys, 2015, 17: 1441–1449.
DOI:10.1039/C4CP04181J |
| [64] |
Liu X, Sui Y H, Duan T, et al. Monodisperse Pt atoms anchored on N-doped graphene as efficient catalysts for CO oxidation: A first-principles investigation[J]. Catal Sci Technol, 2015, 5: 1658–1667.
DOI:10.1039/C4CY01327A |
| [65] |
Lin Z Z. Graphdiyne-supported single-atom Sc and Ti catalysts for high efficient CO oxidation[J]. Carbon, 2016, 108: 343–350.
DOI:10.1016/j.carbon.2016.07.040 |
| [66] |
Xu G L, Wang R, Yang F, et al. CO oxidation on singlePd atom embedded defect-graphene via a new termo-lecular Eley-Rideal mechanism[J]. Carbon, 2017, 118: 35–42.
DOI:10.1016/j.carbon.2017.03.034 |
| [67] |
Zou X P, Wang L N, Li X N, et al. Noble-metal free single atom catalysts CuAl4O7-9 for CO oxidation by O2[J]. Angew Chem Int Ed, 2018, 57(34): 10989–10993.
DOI:10.1002/anie.201807056 |
| [68] |
Qiao B T, Liang J X, Wang A Q, et al. Single atom gold catalysts for low-temperature CO oxidation[J]. Chin J Catal, 2016, 37(10): 1580–1586.
DOI:10.1016/S1872-2067(16)62529-9 |
| [69] |
Qiao B T, Lin J, Wang A Q, et al. Highly active Au1/Co3-O4 single-atom catalyst for CO oxidation at room tempe-rature[J]. Chin J Catal, 2015, 36(9): 1505–1511.
DOI:10.1016/S1872-2067(15)60889-0 |
| [70] |
Qiao B T, Liang J X, Wang A Q, et al. Ultrastable single-atom gold catalysts with strong covalent metal-support interaction[J]. Nano Res, 2015, 8: 2913–2924.
DOI:10.1007/s12274-015-0796-9 |
| [71] |
Li J, Tang Y, Ma Y Y, et al. In situ formation of isolated bimetallic PtCe sites of single dispersed Pt on CeO2 for low-temperature CO[J]. ACS Appl Mater Inter, 2018, 10(44): 38134–38140.
DOI:10.1021/acsami.8b15585 |
| [72] |
Leclercq J, Giraud F, Bianchi D, et al. Novel indu-ctively-heated catalytic system for fast VOCs abatement[J]. Appl Catal B: Environ, 2014, 146: 131–137.
DOI:10.1016/j.apcatb.2013.03.049 |
| [73] |
Bai B Y, Li J H, Hao J M. 1D-MnO2, 2D-MnO2 and 3D-MnO2 for low-temperature oxidation of ethanol[J]. Appl Catal B: Environ, 2015, 164: 241–250.
DOI:10.1016/j.apcatb.2014.08.044 |
| [74] |
Przekop R E, Kirszensztejn P. Highly dispersed Pt on B2O3/Al2O3 support: Catalytic properties in the total oxidation of 1-Butene[J]. React Kinet Mech Catal, 2016, 118: 325–335.
DOI:10.1007/s11144-016-1006-9 |
| [75] |
Aboukaïs A, Skaf M, Hany S, et al. Comparative study of Cu, Ag and Au doped CeO2 in the total oxidation of Volatile Organic Compounds (VOCs)[J]. Mater Chem Phys, 2016, 177: 570–576.
DOI:10.1016/j.matchemphys.2016.04.072 |
| [76] |
Zhu Z Z, Lu G Z, Zhang Z G, et al. Highly active and atable Co3O4/ZSM-5 catalyst for propane oxidation: Effect of the preparation method[J]. ACS Catal, 2013, 3(6): 1154–1164.
DOI:10.1021/cs400068v |
| [77] |
Chen H H, Zhang H P, Yan Y. Gradient porous Co-Cu-Mn mixed oxides modified ZSM-5 membranes as high efficiency catalyst for the catalytic oxidation of isopropanol[J]. Chem Eng Sci, 2014, 111: 313–323.
DOI:10.1016/j.ces.2014.02.031 |
| [78] |
Zhang J N, Xiao J F, Chen X F, et al. Allowance and allocation of industrial volatile organic compounds emission in China for Year 2020 and 2030[J]. J Environ Sci, 2018, 69: 155–165.
DOI:10.1016/j.jes.2017.10.003 |
| [79] |
Torres J Q, Royer S, Bellat J, et al. Formaldehyde: Catalytic oxidation as a promising soft way of elimination[J]. ChemSusChem, 2013, 6(4): 578–592.
DOI:10.1002/cssc.201200809 |
| [80] |
Chen J, Yan D X, Xu Z, et al. A novel redox precip-itation to synthesize Au-doped α-MnO2 with high dispersion toward low-temperature oxidation of formald-ehyde[J]. Environ Sci Technol, 2018, 52(2): 4728–4737.
|
| [81] |
Wang H C, Zhao X Y, Huang C Q, et al. Adsorption features of formaldehyde on TiO2(110) surface probed by high-resolution scanning tunnelling microscopy[J]. J Phys Chem Lett, 2019, 10(12): 3352–3358.
DOI:10.1021/acs.jpclett.9b00522 |
| [82] |
Luo Y J, Wang K C, Xu Y X, et al. The Role of Cu species in electrospun CuO-CeO2 nanofibers for total benzene oxidation[J]. New J Chem, 2015, 39: 1001–1005.
DOI:10.1039/C4NJ01500B |
| [83] |
Park E J, Lee J H, Kim K D, et al. Toluene oxidation catalyzed by NiO/SiO2 and NiO/ TiO2/SiO2: Towards development of humidity-resistant catalysts[J]. Catal Today, 2016, 260: 100–106.
DOI:10.1016/j.cattod.2015.03.038 |
| [84] |
Li D L, Fan Y Y, Ding Y Y, et al. Preparation of cobalt-copper-aluminum spinel mixed oxides from layered double hydroxides for total oxidation of benzene[J]. Catal Commun, 2017, 88: 60–63.
DOI:10.1016/j.catcom.2016.09.035 |
| [85] |
Li D Y, Li W H, Deng Y Z, et al. Effective Ti doping of δ-MnO2 via anion route for highly active catalytic combustion of benzene[J]. J Phys Chem C, 2016, 120(19): 10275–10282.
DOI:10.1021/acs.jpcc.6b00931 |
| [86] |
Yang M, Li S, Wang Y, et al. Catalytically active Au-O(OH)x-species stabilized by alkali ions on zeolites and mesoporous oxides[J]. Science, 2014, 346: 1051–1498.
|
| [87] |
Daté M, Okumura M, Tsubota S, et al. Vital role of moisture in the catalytic activity of supported gold nanop-articles[J]. Angew Chem Int Ed, 2004, 116(16): 2129–2132.
|
| [88] |
Peng H G, Rao C, Zhang N, et al. Confined ultrathin Pd-Ce nanowires with outstanding moisture and SO2 tolerance in methane combustion[J]. Angew Chem Int Ed, 2018, 57(29): 8953–8957.
DOI:10.1002/anie.201803393 |
| [89] |
Huo Z Q, Dai L Y, Liu Y X, et al. Highly efficient and enhanced sulfur resistance supported bimetallic single-atom palladium-cobalt catalysts for benzene oxidation[J]. Appl Catal B Environ, 2021, 285: 119844.
DOI:10.1016/j.apcatb.2020.119844 |
| [90] |
Wilburn M S, Epling W S. Sulfur deactivation and regeneration of mono- and bimetallic Pd-Pt methane oxidation catalysts[J]. Appl Catal B Environ, 2017, 206: 589–598.
DOI:10.1016/j.apcatb.2017.01.050 |
| [91] |
Zhang H Y, Sui S H, Zheng X M, et al. One-pot synthesis of atomically dispersed Pt on MnO2 for efficient catalytic decomposition of toluene at low temperatures[J]. Appl Catal B Environ, 2019, 257: 117878.
DOI:10.1016/j.apcatb.2019.117878 |
| [92] |
Nosaka Y, Nosaka A Y. Generation and detection of reactive oxygen species in photocatalysis[J]. Chem Rev, 2017, 117(17): 11302–11336.
DOI:10.1021/acs.chemrev.7b00161 |
| [93] |
Zhao S Z, Wen Y F, Liu X J, et al. Formation of active oxygen species on single-atom Pt catalyst and promoted catalytic oxidation of toluene[J]. Nano Res, 2020, 13: 1544–1551.
DOI:10.1007/s12274-020-2765-1 |
| [94] |
Jiang Z Y, Feng X B, Deng J L, et al. Atomic-scale insi-ghts into the low-temperature oxidation of methanol over a single-atom Pt1-Co3O4 catalyst[J]. Adv Funct Mater, 2019, 29: 1902041.
DOI:10.1002/adfm.201902041 |
| [95] |
Jiang Z Y, Jing M Z, Feng X B, et al. Stabilizing plat-inum atoms on CeO2 oxygen vacancies by metal-support interaction induced interface distortion: Mechanism and application[J]. Appl Catal B, 2020, 278: 119304.
DOI:10.1016/j.apcatb.2020.119304 |
| [96] |
Zheng Z L. Graphdiyne-supported single-atom Sc and Ti catalysts for high efficient CO oxidation[J]. Carbon, 2016, 108: 343–350.
DOI:10.1016/j.carbon.2016.07.040 |
| [97] |
Xu G L, Wang R, Lu Z S, et al. CO oxidation on sin-gle Pd atom embedded defect-graphene via a newter-molecular Eley-Rideal mechanism[J]. Carbon, 2017, 118: 35–42.
DOI:10.1016/j.carbon.2017.03.034 |
| [98] |
Han B, Lang R, Tang H L, et al. Superior activity of Rh1/ZnO single-atom catalyst for CO oxidation[J]. Chin J Catal, 2019, 40(12): 1847–1853.
DOI:10.1016/S1872-2067(19)63411-X |
| [99] |
Long B, Tang Y, Li J. New mechanistic pathways for CO oxidation catalyzed by single-atom catalysts: Supported and doped Au1/ThO2[J]. Nano Res, 2016, 9: 3868–3880.
DOI:10.1007/s12274-016-1256-x |
| [100] |
Wang Z W, Yang H G, Liu R, et al. Probing toluene cat-alytic removal mechanism over supported Pt nano- and single-atom-catalyst[J]. J Hazard Mater, 2020, 392: 122258.
DOI:10.1016/j.jhazmat.2020.122258 |
| [101] |
Chen J, Jiang M Z, Jia H P, et al. Selective immob-ilization of single-atom Au on cerium dioxide for low temperature removal of C1 gaseous contaminants[J]. J Hazard Mater, 2020, 392: 122511.
DOI:10.1016/j.jhazmat.2020.122511 |
| [102] |
Wei S J, Li A, Liu J C, et al. Direct observation of noble metal nanoparticles transforming to thermally stable single atoms[J]. Nat Nanotechnol, 2018, 13: 856–861.
DOI:10.1038/s41565-018-0197-9 |
 2022, Vol. 36
2022, Vol. 36


