长期以来, 人类一直使用化石燃料来满足其能源需求. 由于这些不可再生能源不断增加的消耗已对环境造成影响, 使得可再生能源和清洁能源的开发成为了研究重点. 氢气已被公认为是未来的清洁燃料, 其具有相同质量的已知燃料中最高的能量密度[1], 氢气也可以作为一种可再生的、更清洁的传统化石燃料代替品[2]. 在燃料电池的应用中, 以H2为燃料, 使得燃料电池具有污染少, 效率高的优势. 然而燃料电池对CO较为敏感, 导致电极中毒, 因此燃料电池的发展受到了限制. 水煤气变换反应不仅可以有效地利用CO, 而且可以产生丰富的H2, 对燃料电池的应用具有重要意义[3]. 水煤气变换反应是CO和水蒸汽在合适的催化剂上发生的反应, 使得气体混合物中含有H2, 因此水煤气变换反应是用于生产氢气的主要反应之一. 反应方程式如下所示:
| $ \mathrm{CO}+\mathrm{H}_2 \mathrm{O} \leftrightarrow \mathrm{CO}_2+\mathrm{H}_2 \Delta \mathrm{H}=-41.09 \mathrm{~kJ} \cdot \mathrm{mol}^{-1} $ | (1) |
该反应是放热反应, 平衡常数随温度的升高而降低, 该反应对低温下的热力学和高温下的动力学都是有利的, 且不受压力变化的影响[4]. 一般情况下, CO的浓度受到反应温度的影响, 为了降低成本, 研究稳定性高、低温活性高的催化剂对于水煤气反应的发展至关重要并且具有重要的科学意义. 水煤气变换反应中的催化剂以铁铬系高温变化催化剂、钴钼系宽温耐硫变换催化剂、铜锌系低温变换催化剂为主.
铁铬系高温变化催化剂在350~450 ℃内具有较高的催化活性[5], 其活性相是由Fe2O3部分还原得到尖晶石结构的Fe3O4, 采用的结构助剂为Cr2O3, 结构助剂起到提高催化剂耐热性、防止烧结引起活性下降的作用[6]. 铁铬系高温变换催化剂具有机械强度高, 有一定耐毒性和耐热性的优势, 但是其缺陷为不适用低汽气比、能耗大、Cr2O3有毒致癌, 可造成严重的环境污染[7]等. 钴钼系宽温耐硫变换催化剂具有较好的低温活性, 反应温区宽, 起活温度为170~200 ℃, 可高至450~500 ℃[8-9]. 该类催化剂一般将活性组分Co-Mo的氧化物负载在γ-Al2O3或Al2O3/MgO等载体上, 另外添加碱金属或稀土金属的氧化物作助催化剂[10]. 钴钼系宽温耐硫变换催化剂有突出的耐硫与抗毒性能, 并且强度高, 寿命长, 可再生. 该类催化剂使用前因需进行硫化, 只能用于有含硫气氛的原料气的工艺中, 只有充分的硫化才能提高活性, 所以应用过程中工艺较复杂[11]. 铜锌系低温变化催化剂的操作温度控制在150~250 ℃之间, 工业低温催化剂一般有3类: CuO-ZnO系、CuO-ZnO-Al2O3系和CuO-ZnO-Cr2O3系[2], 由于温度较高时耐热性差并且催化活性低, 为改善耐热性而加入Al2O3或Cr2O3, 两者均为性能较好的抗烧结剂[12]. 考虑到Al2O3的低毒性和廉价易得而广泛适用于工业中. CuO-ZnO-Al2O3系催化剂具有高活性和选择性, 低温下可达到较高的转化率, 但该催化剂热稳定性差、不抗硫、对氯化物敏感、易中毒而失活.
以上3种催化剂是工业应用于水煤气变换反应的传统催化剂, 然而, 传统水煤气变化反应催化剂具有复杂的活化程序, 容易造成环境污染. 随之贵金属催化剂得到越来越广泛的关注和研究. 在低温水煤气变换反应中, 如将铂(Pt)、钯(Pd)、金(Au)、铑(Rh)等贵金属负载在氧化物载体上制备的催化剂表现出较好的催化活性[13-21]. Au是具有最强化学惰性的金属, 不易高度分散, 通常认为Au作为催化剂是难以实现的. 然而, 负载型Au催化剂的突出特点是具有较高的低温催化活性、较好的抗中毒性和稳定性, 并且Au相比于经常使用的贵金属催化材料Pt、Pd的价格便宜, 使得以Au为催化活性中心的材料成本大大降低, 应用范围更广泛[22]. 目前Au催化研究以负载型催化剂为主, 载体不仅能够保持Au颗粒稳定, 也与Au颗粒相互作用影响催化反应性能. 我们旨在汇总Au负载催化剂的相关文献, 进行载体分类分析及制备过程的介绍, 展现其应用在低温水煤气反应中的最新进展及发展趋势, 强调了影响催化剂活性的重点参数. 为提高催化剂活性的研究者提供必要的参考信息.
1 Au负载型催化剂的载体种类对于贵金属来说, 催化剂金属多以微晶形式高度分散在整个载体表面, 形成较大的活性表面. 载体的存在可以增强催化剂的抗毒性, 催化剂的使用寿命被延长[6]. 此外负载型贵金属催化剂选择不同的载体, 其催化活性、选择性和稳定性都表现出不同的差异. 一般地, 对于适用于做金催化剂的载体可分为惰性载体(非氧化还原载体)和氧化还原载体. 常见的惰性载体有Al2O3、MgO和SiO2等, 氧化还原载体有TiO2、CeO2和Fe2O3等[23].
Au负载催化剂常采用的载体有Al2O3、TiO2、Fe2O3、ZnO、CeO2、α-MoC、ZrO2、Co3O4等. Daly等[24]将CeO2浸渍在Al2O3载体上, 然后将Au均匀沉积在CeO2/Al2O3上, 制备得到Au-CeO2/Al2O3催化剂. 研究发现催化剂的活性随着Ce负载量的增加而显著增加, CeO2过多时, 活性增加缓慢. 张燕杰等[25]采用水热法合成了一系列ZrO2, 并用沉积-沉淀法制得Au/ZrO2催化剂, 在模拟甲醇重整气的气氛下评价了其低温水煤气变换(WGS)反应催化性能. 研究结果发现, 在150 ℃下合成的Au/ZrO2催化剂, 反应温度为240 ℃时CO达到较高的转化率. 与相同条件下Au/ZrO2催化剂的催化活性均明显高于Au/Fe2O3、Au/CeO2及Au/CeZrO4催化剂. 卫帅[26]制备了Au负载CeO2催化剂, 表征分析证实了由于Au团簇的修饰提高了CeO2表面解离水的效率, 促进了水煤气变换反应的进行.
因此, 通常氧化物载体促进Au催化剂活性主要是通过以下几个方面: (1)载体能够为反应物提供吸附位点, 特别是能向Au颗粒移动的氧化物载体[27]; (2) Au颗粒与氧化物载体之间的电荷转移[28-29]; (3)促进活泼Au-氧化物界面和颗粒边界周长的形成[30]. Nilius等[31]通过测量结合密度泛函数理论计算研究了Au在氧化铝/NiAl(110)上的吸附作用. 金原子组装成链是由有利的吸附位点的线性排列引起的, 这使其与氧化铝/NiAl载体的结合特别强. 这种相互作用机制是由于Au的电负性特性和由此产生的电荷通过氧化物膜转移. Lin等[27]通过在1×10-8 MPa的O2和297 ℃的条件下将Mg沉积在溅射和退火的Ag(001)表面上制备MgO薄膜. 单原子Au从高纯度的金属丝中蒸发出来并且在-173 ℃时沉积在样品上. 由于入射原子的热能和它们在MgO上的低扩散势垒, Au聚集成超小的团簇. 根据Bader电荷分析, 由于来自MgO/Ag界面的电荷转移, 包含多达20个原子的聚集物积累了1~4个额外的电子. 随着团簇大小的增加, 过量电子的积累, 验证了MgO/Ag的电荷转移机制. Chen等[32]研究了(1.7±0.6)~(3.7±0.9) nm粒径的Au在CO氧化过程中表面各物质的变化. CO吸附在Au/CeO2催化剂上形成CO(a)、碳酸盐、碳酸氢盐和甲酸盐. 并且O2的存在也促进了碳酸盐、碳酸氢盐和甲酸盐的形成. CO(a)的反应活性不受载体粒径尺寸的影响, 然而碳酸盐、碳酸氢盐和甲酸盐的反应活性随载体尺寸的增大而增大.
2 Au负载型催化剂的制备方法Au负载型催化剂自身的3个因素会影响其催化活性: (1) 金属氧化物载体的种类; (2) Au颗粒的尺寸; (3) Au颗粒与载体间的连接结构以及相互作用. 这3个因素均和Au负载型催化剂的制备方法有密切的关联.
2.1 浸渍法浸渍法是制备Au负载型催化剂较常用且较简单的方法. 浸渍法是将氧化物载体浸渍到含有活性组分的液体或气体中, 活性组分被吸附在氧化物载体上, 浸渍平衡后去除剩下的液体, 然后进行干燥、焙烧、活化等过程即可制得催化剂. 浸渍法的优点为: (1)载体形状尺寸已确定, 载体具有合适的比表面积; (2)成本较低, 活性组分利用率高; (3)生产方法简单, 生产能力高. 但浸渍法存在焙烧过程中产生污染气体, 干燥过程中会导致活性组分烧结的问题. 于强强等[33]分别采用了浸渍法和沉积-沉淀法制备了CeO2-Al2O3复合氧化物, 水煤气变换反应中评价负载Au复合氧化物的催化活性. 结果表明500 ℃焙烧后负载Au的催化剂, 催化活性最高, 水煤气变换反应温度为250 ℃时CO转化率达到78.1%. 通过表征手段分析, 制备方法明显影响了载体氧化物的比表面积及其孔结构. 一般地, 采用浸渍法所制得的催化剂表现出较大的比表面积和孔体积, 从而能提高催化剂的催化活性.
2.2 沉积-沉淀法沉积-沉淀法是将需负载的目的金属溶液(如HAuCl4水溶液)加入到载体悬浊液中, 加入碱性溶液对其中和, 并充分搅拌, 调节反应条件使活性物质沉积在载体表面, 随后进行过滤、洗涤、干燥、焙烧等处理过程. 沉积-沉淀法的优点: (1)由于其活性物质在载体表面上全部保留, 载体内部不存在包埋, 其活性物质的利用率被提高; (2)金属颗粒尺寸分布窄, 颗粒尺寸较均匀. 沉积-沉淀法的缺点为: (1)针对Au负载量较低的催化剂的制备; (2)载体应具有较高的比表面积(至少50 m2/g), 其不适用于较低零电荷点的的活性炭载体和金属氧化物. Perez等[34]分别采用双重浸渍法(DIM)、沉积-沉淀法(DP)、液相还原沉积法(LPRD) 3种不同的制备方法制得Au/TiO2催化剂, 研究表明当Au负载量较高时, DP法制备催化剂在300 ℃下水煤气反应的CO转化率为85%, 均高于DIM和LPRD法制备的催化剂. Au在TiO2载体上可以高度分散, 但在低温水煤气反应过程中Au纳米颗粒会趋于团聚. DP法可以使Au与TiO2载体相互作用更强, 反应前后Au纳米颗粒保持在较小的尺寸, 使得催化活性更高. Soria等[35]以同样3种方法(DIM、DP、LPRD)制备了Au/Fe2O3催化剂. 催化活性研究表明DP法制备的Au/Fe2O3依然保持较高的CO的转化率, 反应温度在200 ℃左右时, CO转化率为65%. HRTEM显示Au纳米颗粒尺寸大小与制备方法有关, DP法Au平均粒径为2.2 nm, DIM法Au平均粒径为6.6 nm, 而LPRD法Au平均粒径随着Au负载量的增加而略有增加. 并且DP法制备的催化剂, Au与Fe2O3载体相互作用更强, Fe2O3的还原性更高, 从而导致了Au/Fe2O3活性更高.
2.3 共沉淀法共沉淀法是将载体对应的金属硝酸盐溶液和硝酸金溶液加入到碱性沉淀剂溶液中形成共沉淀, 然后经过滤、洗涤、干燥、焙烧等处理得到催化剂. 共沉淀的优点为: (1)可得到较小尺寸的负载金属颗粒; (2)共沉淀过程可以预防金属聚集的现象. 李锦卫等[36]采用共沉淀法制备了一系列Au/α-Fe2O3-MOx(M =Zr、Al、Mg、Ca、Ba)催化剂, MOx作为助剂加入到前驱体溶液中. 在富氢的条件下对低温水煤气反应的催化活性进行测试, 结果表明ZrO2作为助剂时, 反应温度为150 ℃时CO的转化率可达88.45%.
Au负载型催化剂的制备除了以上3种常用方法之外, 还有胶体负载法[37], 离子交换法[38], 金属有机配合物固载法[39]等, 表 1中总结了不同方法制备的Au负载型催化剂应用于水煤气变换反应时CO的转化率.
| 表 1 不同方法制备的Au负载型催化剂的催化性能 Table 1 Catalytic performance of Au supported catalysts prepared by different methods |
不同的制备方法对催化剂的活性有影响, 在制备过程中不同的制备参数条件变化也会显著影响催化剂的活性和稳定性. 制备过程中影响因素有Au含量、焙烧条件、碱金属助剂等.
3.1 Au含量对于Au负载催化剂, Au的含量对催化剂活性起着直接作用, Soria等[35]采用沉积-沉淀法分别制备了1.5%、3%、5%(质量分数)Au含量的Au/Fe2O3催化剂如图 1所示, CO的转化率随着Au负载量的增加而升高, 200 ℃左右时5%(质量分数) Au/Fe2O3催化剂的CO转化率达到65%. 实验表征发现Au促进了Fe2O3的还原, 并且当Au含量较低时, 沉积-沉淀法制备的样品上有较大的Au纳米颗粒尺寸, 从而影响了Au的分散性. Perez等[34]同样采用沉积-沉淀法制备了不同Au含量的Au/TiO2催化剂, CO转化率随Au含量的升高而升高. Au/TiO2催化剂在反应前后均具有较小的Au纳米颗粒, 稳定性高且活性高. 张然清[47]通过浸渍法制备Au负载的Co2Mn1的催化剂. 如表 2, 结果表明Au的负载量对Co2Mn1催化剂在水煤气变换反应中的活性有影响. 当负载Au为0.5%(质量分数)时, 由于Au发生了团聚现象, 催化活性降低. 当负载Au为2%(质量分数)时, 即使Au也发生了团聚现象, 但由于Au含量较高, 活性点位增加, 因此催化活性升高.
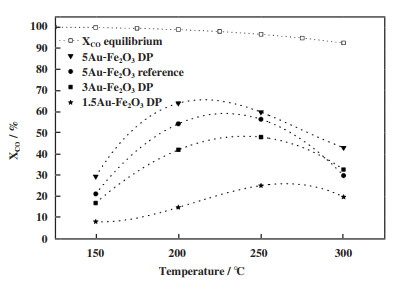
|
图 1 沉积沉淀法制备Au/Fe2O3催化剂在低温水煤气变换反应中, 不同催化温度下Au含量对CO转化率的影响 Fig.1 The effect of Au content on CO conversion at different catalytic temperatures in the low-temperature water-gas conversion reaction of Au/Fe2O3 catalyst prepared by sedimentation method |
| 表 2 不同Au负载量Co2Mn1催化剂的水煤气变换反应活性 Table 2 Activity of Co2Mn1 catalyst with different Au loading for water-gas shift reaction |
焙烧条件(焙烧温度)的不同会对负载体的比表面积、孔结构以及水煤气变换反应活性有明显的的影响. Zhang等[49]采用沉积沉淀法制备了一系列Au含量较低的Au/ZrO2催化剂, 在富氢重整产品气氛下的低温水煤气反应中评价具有不同ZrO2预煅烧温度(120~450 ℃) 的催化剂活性. 随着ZrO2预煅烧温度的升高, CO转化率先升高后下降, 在350 ℃时达到最高, 其CO转化率为95.2%. 李锦卫等[50]采用改性沉积-沉淀法制备了Au/Fe2O3催化剂, 如图 2所示, 研究了焙烧温度对Au/Fe2O3催化剂的催化活性影响. 经300 ℃煅烧后的样品, 反应温度为200 ℃时CO转化率最高, 其活性最佳. Au/Fe2O3催化剂超过300 ℃后, CO转化率明显下降. 结果表明焙烧温度引起的Au和载体Fe2O3的相互作用以及载体还原性质的变化与催化剂性能有密切的联系. 张燕杰等[51]采用沉积-沉淀法制备Au/ZrO2催化剂, 考察了空气和氮气焙烧对催化剂的水煤气变换反应的活性影响. 发现空气焙烧后的催化活性明显高于氮气焙烧后催化剂. 如图 3所示, 对催化剂样品进行了UV-Vis DRS表征, 在波长545 nm左右处是纳米Au的表面等离子共振特征吸收峰, 以此研究催化剂的Au分散度. 样品Au/ZrO2-Air比Au/ZrO2-N2具有更高的Au分散度. 图 4所示为采用电子顺磁共振技术(EPR)对不同气氛焙烧的ZrO2载体的表面缺陷的表征. 结合分析可知, 空气焙烧后的催化剂表面有较多的配位不饱和Zr3+, 有助于Au的分散度, 从而提高了催化剂的活性.
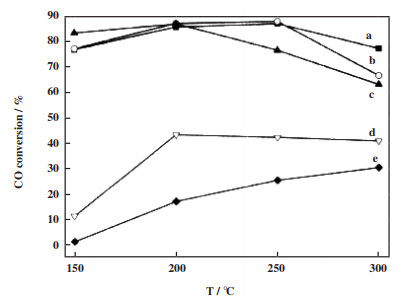
|
图 2 在不同焙烧温度下Au/Fe2O3催化剂在水煤气变换反应中CO的转化率(a)未焙烧; (b)Au/Fe-200; (c)Au/Fe-300; (d)Au/Fe-400; (e)Au/Fe-500 Fig.2 CO conversion of Au/Fe2O3 catalyst in water-gas shift reaction at different roasting temperatures (a) without roasting; (b)Au/Fe-200; (c)Au/Fe-300; (d)Au/Fe-400; (e)Au/Fe-500 |
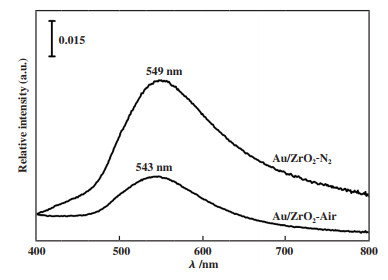
|
图 3 样品Au/ZrO2-Air和Au/ZrO2-N2的UV-Vis DRS谱图 Fig.3 UV-Vis DRS spectra of Au/ZrO2-Air andAu/ZrO2-N2 samples |

|
图 4 载体ZrO2-Air和ZrO2-N2的EPR谱图 Fig.4 EPR spectra of vectors ZrO2-Air and ZrO2-N2 |
相关研究表明, 在Au负载型催化剂的制备过程中加入碱金属助剂可以中和催化剂上的一些酸中心, 调节催化剂的酸碱性. 此外, 由于高温或长时间运行, 催化剂上形成积炭使得催化剂逐渐失活. 然而, 碱金属助剂的添加能够提高Au负载型催化剂的抗积碳性能, 进而改善催化剂的稳定性[52]. 另外, 碱金属作为电子型助剂可以调变催化剂的电子结构, 从而改变反应分子的化学吸附能力和活化能[53]. 同时, 制备过程中加入碱金属也能够引起催化剂几何结构的变化[54]. 于强强等[48]制备了碱金属M(M=Na、K、Rb和Cs)掺杂的Au-Pt/CeO2催化剂, 水煤气变换反应活性测试显示少量电负性较低的K的引入可提高催化剂活性, 250 ℃时转化率高达95%. 加入过量的K, CO转化率则呈现下降趋势, 因为过量的碱金属覆盖了Au-Pt/CeO2催化剂上的活性位点. 对于Au-Pt/CeO2催化剂来说K的引入使得Au倾向于零价态, 还原Pt变难, 有利于CeO2还原产生更多的Ce3+和氧空位, 活性中心增多. 李锦卫等[36]利用共沉淀法加入不同的助剂制备了一系列Au/α-Fe2O3-MOx(M=Zr、Al、Mg、Ca、Ba)催化剂, 反应温度为150 ℃时, 富氢条件下的低温水煤气反应活性测试发现CO转化率可达88.45%, 且催化剂具有较高的稳定性. 通过表征分析研究表明, 加入ZrO2助剂可以减小载体的晶粒大小, 抑制载体晶粒的增长, 从而有效地提高催化剂的比表面积, 催化剂的还原性和表面酸碱度得以改善, 因此Au/α-Fe2O3-ZrO2的催化活性较高且稳定性较好.
综上, 表 3提供了不同制备参数所制备的代表性的Au负载型催化剂的性能总结.
| 表 3 不同制备参数对Au负载型催化剂的影响 Table 3 Effect of different preparation parameters on Au supported catalysts |
对于水煤气变换反应催化剂的催化活性机理国内外研究人员进行了广泛的长期研究, 由于催化体系的复杂性, 催化活性机理也存在不同的看法和争论. 其中负载型Au催化剂在水煤气变换反应中具有较高的活性, 一方面是制备的催化剂具有高度分散的Au微颗粒, 另一方面Au与金属氧化物载体间具有某种协同作用. 由此, 研究人员们通过采用各种物化分析手段对负载Au催化剂的催化活性机理本质进行了探索. 目前, Au负载催化剂有两种主要的活性机理: 一是甲酸盐机理, 二是氧化还原机理.
4.1 甲酸盐机理在水煤气变换反应催化活性甲酸盐机理中, 水解离生成羟基自由基(·OH)同时与吸附在催化剂表面上的CO发生缔合反应, 进而生成甲酸根(HCOO)中间体, 该吸附态的甲酸中间体分解成二氧化碳(CO2)和氢气(H2)[58-59].
| $ \mathrm{CO}+* \leftrightarrow \mathrm{CO}^* $ | (2) |
| $ \mathrm{H}_2 \mathrm{O}+* \leftrightarrow \mathrm{H}_2 \mathrm{O}^* $ | (3) |
| $ \mathrm{H}_2 \mathrm{O}^*+* \leftrightarrow \mathrm{OH}^*+\mathrm{H}^* $ | (4) |
| $ \mathrm{OH}^*+\mathrm{CO}^* \leftrightarrow \mathrm{HCOO}^*+* $ | (5) |
| $ \mathrm{HCOO}^*+\mathrm{OH}^* \leftrightarrow \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_2{ }^* $ | (6) |
| $ \mathrm{HCOO}^*+* \leftrightarrow \mathrm{H}^*+\mathrm{CO}_2^* $ | (7) |
| $ 2 \mathrm{H}^* \leftrightarrow \mathrm{H}_2+2^* $ | (8) |
| $ \mathrm{CO}_2{ }^* \leftrightarrow \mathrm{CO}_2+* $ | (9) |
其中, *为活性位点.
Burch[60]提出了水煤气变换反应的机理, 图 5显示了一种通用机理. 对于Au负载型催化剂应用于水煤气反应中, 催化剂载体吸附H2O解离产生·OH, Au活化吸附CO, 其反应机理大致为:
| $ \mathrm{CO} \rightarrow \mathrm{Au}^{+}-\mathrm{CO}+\mathrm{H}_2 \mathrm{O} \rightarrow \mathrm{Au}+[\mathrm{HCOO}]^{-}+\mathrm{H}^{+} \rightarrow \mathrm{CO}_2+\mathrm{H} $ | (10) |
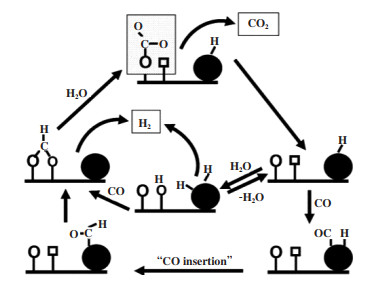
|
图 5 水煤气变换反应的一般机理 Fig.5 General mechanism of water gas shift reaction |
氧化还原机理是由Poorter最先提出[61]的. 吸附态的CO或CO直接氧化生成CO2, 氧中间体是通过CO或H2O解离得到. 具体如下:
| $ \mathrm{CO}_{\text {gas }} \rightarrow \mathrm{CO}_{\mathrm{ads}} $ | (11) |
| $ \mathrm{H}_2 \mathrm{O}_{\text {gas }} \longrightarrow \mathrm{H}_2 \mathrm{O}_{\text {ads }} $ | (12) |
| $ \mathrm{H}_2 \mathrm{O}_{\mathrm{ads}} \rightarrow \mathrm{H}_{2, \mathrm{gas}}+\mathrm{O}_{\mathrm{ads}} $ | (13) |
| $ \mathrm{CO}_{\mathrm{ads}}+\mathrm{O}_{\mathrm{ads}} \longrightarrow \mathrm{CO}_{2, \mathrm{ads}} $ | (14) |
| $ \mathrm{CO}_{2, \mathrm{ads}} \longrightarrow \mathrm{CO}_{2, \mathrm{gas}} $ | (15) |
图 6展示了一种简化水煤气变换反应的氧化还原机理. 氧化还原机理主要取决于金属氧化物载体能够生成氧原子的还原能力. 目前较多文献报道的氧化还原机理是CO吸附在金属表面, 进而与载体的氧反应生成CO2, H2O氧化复原还原态的载体, 产生出H2[62].
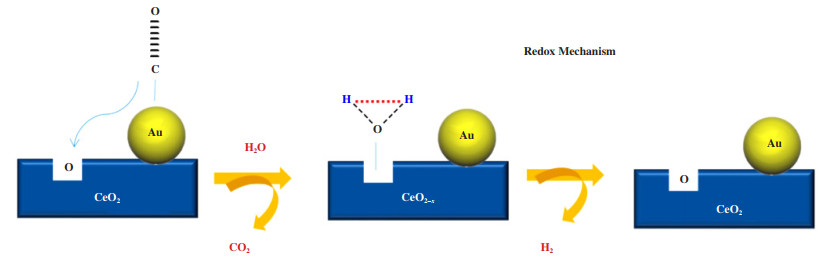
|
图 6 一种Au/CeO2模型催化剂的简化水煤气变换反应氧化还原机理[61] Fig.6 Redox mechanism of a simplified water gas shift reaction with Au/CeO2 model catalyst |
对于不同的研究使用不同反应气原料, 不同的反应温度、压力、空速等条件, 水煤气反应过程中可能存在着多种反应机理并存的情况, 而非单一的反应机理. 在支持甲酸盐机理中水在反应条件下二氧化碳的比例非常高, 温度处于中间水平. 在支持氧化还原机理的结果中, 水与二氧化碳的比例处于中间水平, 温度相对较高. 此外, 周涛[63]通过密度泛函理论研究了Au(111)面上水煤气变换反应的反应机理, 通过对基元反应的反应热、活化能以及过渡态的讨论, 明确了Au(111)面上的最优路径是羧酸中间体机理. 所以综上所述, 主导机制似乎仅取决于实验条件的选择.
5 结语通过上述讨论可知, Au负载型催化剂具有良好的催化活性和稳定性. 所以, Au负载型催化剂有望在环境保护和燃料电池等领域内得到应用. 我们综述了Au负载型催化剂的载体种类、制备方法、制备参数对水煤气变换反应的影响. 阐述了Au负载催化剂作为新型水煤气变换反应催化剂的优势.
(1) 传统的Au负载型催化剂在实际应用中存在催化效率低、活性物质利用率低以及易团聚等问题, 这些成为限制该种催化剂在工业中大规模应用的瓶颈. 人们对能够应用于低温水煤气变换反应中Au负载催化剂的性能提出了更高的要求. 其中载体可以增加催化剂的抗毒性, 延长使用寿命, 同时载体具有催化作用, 提供更多的活性中心. 因此, 载体的选择成为至关重要的因素.
(2) 制备的催化剂的比表面积和孔体积越大, Au颗粒的粒径越小, Au颗粒的分散度越高, 其在水煤气变换反应中催化活性越高. 因此, 通过不同的制备方法和制备参数来调控Au颗粒的大小以及Au颗粒与载体之间的接触结构和相互作用也是关键.
(3) Au负载催化剂的催化性能受到载体种类、晶粒大小和性质的影响. 不同的载体、制备方法和制备参数的不同, 催化反应机理也不同. 所以对于Au负载催化剂的活性机理依然存在争议.
为了将Au负载催化剂应用在低温水煤气变换反应中, 设计催化剂时需要充分考虑以上因素. Au负载催化剂能够实现在较低温度下具有较高活性, 并且实现CO高转化率, 这些都将为工业大规模产氢增加可行性. 因此, 亟需研究开发成本效益高、稳定性高、活性高的Au负载型催化体系.
| [1] |
a. Hua Jin-ming(华金铭), Zheng Qi(郑起), Lin Xing-yi(林性贻), et al. New progress in the research of water gas shift catalyst(水煤气变换催化剂研究新进展)[J]. J Mol Catal(China)(分子催化), 2004, 18(1): 68-80. b. Sun Nan-nan(孙楠楠), Zhao Zhi-chao(赵志超), ZhangYu(张宇), et al. Investigation of the hydrogen evolution reaction on two-dimensional tetragonal TiC monolayer sheet(二维四角TiC单层片上的析氢反应研究)[J]. J Mol Catal(China)(分子催化), 2022, 36(1): 12-21. c. Wang Yu-ying1(王玉营), Chen Jian-biao(陈建彪), Zhang Xu-qiang(张旭强), et al. Effects of different lineardiamines on the performance of photocatalysts for hydrogenproduction of sensitized graphene(不同直链二胺对敏化石墨烯制氢光催化剂性能的影响)[J]. J Mol Catal(China)(分子催化), 2020, 34(1): 1-7. |
| [2] |
a. Pal D B, Chand R, Upadhyaya S N, et al. Performance of water gas shift reaction catalysts: A review[J]. Renew Sust Energ Rev, 2018, 93: 549-565. b. Cheng Xiang(程翔), Bi Ying-pu(毕迎普). Research advancement of the TiO2 nanoarrays photoanode for photoe-lectrochemical water splitting(TiO2纳米阵列光阳极光电催化水分解研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(4): 341-365. c. Liu Hong-xia(刘洪霞), Lu Gong-xuan(吕功煊). Research progress for hydrogen evolution from formaldehyde(甲醛催化制氢的研究进展)[J]. J Mol Catal(China)(分子催化), 2020, 34(3): 210-226. |
| [3] |
Yang Da-fei(杨达飞). Experimental study of water gas shift reaction by low-temperature plasma-catalysis(低温等离子体协同催化水煤气变换反应的实验研究)[D]. Chongqing(重庆): Chongqing University(重庆大学), 2020.
|
| [4] |
Smith R J B, Loganathan M, Shantha M S, et al. A review of the water gas shift reaction kinetics[J]. Int J Chem React Eng, 2010, 2010(8): R4.
|
| [5] |
Zhu M H, Wachs I E. Iron-based catalysts for the high-temperature water-gas shift (HT-WGS) reaction: A review[J]. ACS Catal., 2016, 6(2): 722–732.
DOI:10.1021/acscatal.5b02594 |
| [6] |
Liu Quan-sheng(刘全生), Zhang Qian-cheng(张前程), Ma Wen-ping(马文平), et al. Progress in water-gas-shift catalysts(变换催化剂研究进展)[J]. Prog Chem(化学进展), 2005, 17(3): 389-398.
|
| [7] |
Shi Yu-Shan(施玉山). Research progress of carbon monoxideshift catalyst(一氧化碳变换催化剂研究进展)[J]. Guangdong Chemical Industry(广东化工), 2014, 41(1): 88-90.
|
| [8] |
Muhammad Y, Shoukat A, Rahman A U, et al. Oxidative desulfurization of dibenzothiopheneover Fe promoted Co-Mo/Al2O3 and Ni-Mo/Al2O3 catalysts using hydrogen peroxide and formic acid as oxidants[J]. Chin J Chem Eng, 2018, 26(3): 593–600.
DOI:10.1016/j.cjche.2017.05.015 |
| [9] |
Ardakani S J, Alyani M, Smith K J. Stability of a Cspromoted Co-Mo/Al2O3 catalyst during synthesis gas conversion[J]. Can J Chem Eng, 2016, 94(4): 655–661.
DOI:10.1002/cjce.22381 |
| [10] |
Van Haandel L, Bremmer G M, Hensen E J M, et al. The effect of organic additives and phosphoric acidon sulfidation and activity of (Co)Mo/Al2O3 hydrodesulfu-rization catalysts[J]. J Catal, 2017, 351: 95–106.
DOI:10.1016/j.jcat.2017.04.012 |
| [11] |
Guo Xiao-yang(郭晓勇). Preparation of supported nanometal catalyst and its catalytic performance of WGSR(负载型金属纳米催化剂的制备及其对水煤气的催化变换作用)[D]. Suzhou(苏州): Soochow University(苏州大学), 2007.
|
| [12] |
Daniel M C, Astruc D. Gold nanoparticles: Assembly, supramolecular chemistry, quantum-size-related properties and applications toward biology, catalysis and nanotechnology[J]. Chem Rev, 2004, 104(1): 293–346.
DOI:10.1021/cr030698+ |
| [13] |
Barrio L, Zhou G, González I D, et al. In situ characterization of Pt catalysts supported on ceria modified TiO2 for the WGS reaction: Influence of ceria loading[J]. Phys Chem Chem Phys, 2012, 14(7): 2192–2202.
DOI:10.1039/C1CP22509J |
| [14] |
Jeong D W, Potdar H S, Roh H S. Comparative study on nano-sized 1wt%Pt/Ce0.8Zr0.2O2 and 1wt%Pt/Ce0.2Zr0.8O2 catalysts for a single stage water gas shift reaction[J]. Catal Lett, 2012, 142(4): 439–444.
DOI:10.1007/s10562-012-0786-4 |
| [15] |
Aranifard S, Ammal S C, Heyden A. Nature of Ptn/CeO2(111) surface under water-gas shift reaction conditions: A constrained ab initio thermodynamics study[J]. J Phys Chem C, 2012, 116(16): 9029–9042.
DOI:10.1021/jp300515b |
| [16] |
Kugai J, Miller J T, Guo N, et al. Oxygen-enhanced water gas shift on ceria-supported Pd-Cu and Pt-Cu bimetallic catalysts[J]. J Catal, 2011, 277(1): 46–53.
DOI:10.1016/j.jcat.2010.10.014 |
| [17] |
Mendes D, Sá S, Tosti S, et al. Experimental and modelingstudies on the low-temperature water-gas shift reaction in a dense Pd-Ag packed-bed membrane reactor[J]. Chem Eng Sci, 2011, 66(11): 2356–2367.
DOI:10.1016/j.ces.2011.02.035 |
| [18] |
Gamboa-Rosales N K, Ayastuy J L, González-Marcos M P, et al. Oxygen-enhanced water gas shift over ceriasupported Au-Cu bimetallic catalysts prepared by wet impregnation and deposition-precipitation[J]. Int J Hydrogen Energy, 2012, 37(8): 49–56.
|
| [19] |
Idakiev V, Tabakova T, Tenchev K, et al. Gold catalysts supported on ceria-modified mesoporous zirconia for low-temperature water-gas shift reaction[J]. J Porous Mater, 2012, 19(1): 15–20.
DOI:10.1007/s10934-010-9441-x |
| [20] |
Maestri M, Reuter K. Molecular-level understanding of WGS and reverse WGS reactions on Rh through hierarchical multiscale approach[J]. Chem Eng Sci, 2012, 74(28): 296–299.
|
| [21] |
Galletti C, Djinović P, Specchia S, et al. Influence of the preparation method on the performance of Rh catalysts on CeO2 for WGS reaction[J]. Catal Today, 2011, 176(1): 336–339.
DOI:10.1016/j.cattod.2010.11.069 |
| [22] |
Quiney A S, Germani G, Schuurman Y. Optimization of a water-gas shift reactor over a Pt/ceria/alumina monolith[J]. J Power Sources, 2006, 160(2): 1163–1169.
DOI:10.1016/j.jpowsour.2006.03.019 |
| [23] |
Nguyen-Phan T D, BaBer A E, Rodriguez J A, et al. Au and Pt nanoparticle supported catalysts tailored for H2 production: From models to powder catalysts[J]. Appl Catal. A. 2016, 2016(518): 17–47.
|
| [24] |
Daly H, Goguet A, Hardacre C, et al. The effect of reaction conditions on the stability of Au/CeZrO4 catalysts in the low-temperature water-gas shift reaction[J]. J Catal, 2010, 273(2): 257–265.
DOI:10.1016/j.jcat.2010.05.021 |
| [25] |
Zhang Yan-jie(张燕杰), Zhan Ying-ying(詹瑛瑛), Cao Yan-ning(曹彦宁), et al. Low-temperature water-gas shiftreaction over Au/ZrO2 catalysts using hydrothermally synthesized zirconia as supports(以水热法合成的ZrO2负载Au催化剂上的低温水煤气变换反应)[J]. Chin J Catal(催化学报), 2012, 33(2): 230-236.
|
| [26] |
Wei Shuai(卫帅). Study on the structure-function relationship in catalyzing CO oxidation and water-gas shift reaction over supported highly dispersed gold/copper catalysts(负载型高分散金/铜催化剂催化CO氧化和水煤气变换反应的构效关系研究)[D]. Shandong(山东): Shandong University(山东大学), 2020.
|
| [27] |
Lin X, Nilius N, Freund H J, et al. Quantum well states in two-dimensional gold clusters on MgO thin films[J]. Phys Rev Lett, 2009, 102(20): 206801.
DOI:10.1103/PhysRevLett.102.206801 |
| [28] |
Vayssilov G N, Lykhach Y, Migani A, et al. Support nanostructure boosts oxygen transfer to catalytically active platinum nanoparticles[J]. Nat Mater, 2011, 10(4): 310–315.
DOI:10.1038/nmat2976 |
| [29] |
Ren G Q, Pei G X, Zhang J C, et al. Activity promotion of anti-sintering Au₲MgGa2O4 using ceria in the water gas shift reaction and catalytic combustion reactions[J]. Chin J Catal, 2019, 40: 600–608.
DOI:10.1016/S1872-2067(19)63295-X |
| [30] |
Wang Dong-hui(王东辉), Cheng Dai-yun(程代云), HaoZheng-ping(郝郑平), et al. Carbon monoxide low-temperatureoxidation over nanosize gold catalyst(纳米金催化剂上CO低(常)温氧化的研究)[J]. Prog Chem(化学进展), 2002, 14(5): 360-367.
|
| [31] |
Nilius N, Ganduglia-Pirovano M V, Brázdová V, et al. Countingelectrons transferred through a thin alumina film into Au chains[J]. Phys Rev Lett, 2008, 100(9): 096802.
DOI:10.1103/PhysRevLett.100.096802 |
| [32] |
Chen S L, Luo L F, Jiang Z Q, et al. Size-dependent reaction pathways of low-temperature CO oxidation on Au/CeO2 catalysts[J]. ACS Catal, 2015, 5(3): 1653–1662.
DOI:10.1021/cs502067x |
| [33] |
Yu Qiang-qiang(于强强), Dong Yuan-yuan(董园园), LiaoWei-ping(廖卫平), et al. Preparation of ceria-alumina andcatalytic activity of gold catalyst supported on ceriaalumina for water gas shift reaction(CeO2-Al2O3负载金催化剂用于水煤气变换反应的催化活性)[J]. J Fuel Chem Technol(燃料化学学报), 2010, 38(2): 223-229.
|
| [34] |
Perez P, Soria M A, Carabineiro S A C, et al. Application of Au/TiO2 catalysts in the low-temperature water-gas shift reaction[J]. Int J Hydrogen Energy, 2016, 41(8): 4670–4681.
DOI:10.1016/j.ijhydene.2016.01.037 |
| [35] |
Soria M A, Pérez P, Carabineiro S A C, et al. Effect ofthe preparation method on the catalytic activity and stability of Au/Fe2O3 catalysts in the low-temperature water-gas shift reaction[J]. Appl Catal A - Gen, 2014, 470(2): 45–55.
|
| [36] |
Li Jin-wei(李锦卫), Chen Chong-qi(陈崇启), Lin Xing-yi(林性贻), et al. Effect of promoter on the performance of low-temperature water-gas shift reaction in H2-rich steam over supported gold catalyst(助剂对低温水煤气变换反应Au/α-Fe2O3催化剂性能的影响)[J]. J Fuel Chem Technol(燃料化学学报), 2006, 34(6): 712-716.
|
| [37] |
Lee M S, Lee J Y, Lee D W, et al. The effect of Zn addition into NiFe2O4 catalyst for high-temperature shift reaction of natural gas reformate assuming no external steam addition[J]. Int J Hydrogen Energy, 2012, 37(15): 11218–11226.
DOI:10.1016/j.ijhydene.2012.04.130 |
| [38] |
Edwards P P, Kuznetsov V L, David W I F, et al. Hydrogen and fuel cells: Towards a sustainable energy future[J]. ENERG POLICY, 2008, 36(12): 4356–4362.
DOI:10.1016/j.enpol.2008.09.036 |
| [39] |
Maeda K, Teramura K, Lu D, et al. Photocatalyst releasing hydrogen from water-Enhancing catalytic performance holds promise for hydrogen production by water splitting in sunlight[J]. Nature, 2006, 440(7082): 295–295.
DOI:10.1038/440295a |
| [40] |
Zhang Xue-bing(张雪冰). The Au/CeO2-Al2O3 catalyst onCO conversion intrinsic dynamics research(Au/CeO2-Al2O3催化剂上CO变换本征动力学研究)[D]. Beijing(北京): Beijing University of Chemical Technology(北京化工大学), 2016.
|
| [41] |
Sun Qi(孙琦), Zhang Yu-Ting(张玉亭), Gu Xue-Hong(顾学红). Preparation, characterization and water-gas-shiftreaction activity over Au/CeNaY zeolite catalysts(Au/CeNaY催化剂的制备、表征及其水汽变换反应性能)[J]. Journal of Nanjing Tech University(Natural Science Edition)(南京工业大学学报: 自然科学版), 2015, 37(4): 11-16.
|
| [42] |
Li Kai(李凯), Wang Pan(王攀), Li Zhen-Guo(李振国), et al. Study on water gas shift reaction with Au/CeO2 catalyst under oxygen conditions(Au/CeO2催化剂有氧条件下催化水煤气变换反应的研究)[J]. J Jiangsu Univer(Natural Science Edition)(江苏大学学报: 自然科学版), 2020, 41(6): 655-660.
|
| [43] |
Wang Xiu-ling(王秀玲). Properties study of ceria supportedAu catalyst in catalyzing CO oxidation and water gas shift reactions(二氧化铈纳米金催化剂催化CO氧化和水煤气变换反应的性能研究)[D]. Ji-nan(济南): Shandong University(山东大学), 2019.
|
| [44] |
Kang Y M, Wan B Z. Preparation of gold in Y-type zeolite for carbon monoxide oxidation[J]. Appl Catal A - Gen, 1995, 128(10): 53–60.
|
| [45] |
Zou Xu-hua(邹旭华), Qi Shi-xue(齐世学), An Li-dun(安立敦), et al. Preparation and catalytic performance of Au/NiO catalyst derived from Au(PPh3)(NO3) for CO oxidation(以Au(PPh3)(NO3)为前体的Au/NiO催化剂的制备及其对CO的催化氧化)[J]. J Mol Catal(China) (分子催化), 2000, 14(3): 171-174.
|
| [46] |
Baiker A, Tagliaferri S, Hug P, et al. Carbon-monoxide oxidation over catalysts prepared by in-situ activation of amorphous gold-silver-zirconium and gold-iron-zirconium alloys[J]. J Catal, 1995, 151(2): 407–419.
DOI:10.1006/jcat.1995.1043 |
| [47] |
Zhang Ran-qing(张然清). Preparation of Co2C-basedcatalystsfor low-temperature water-gas shift reaction(Co2C基低温水煤气变换催化剂的设计及其反应性能研究)[D]. Shanghai(上海): Shanghai University(上海大学), 2019.
|
| [48] |
Yu Qiang-qiang(于强强), Li Yang(李杨), Zou Xu-hua(邹旭华), et al. Effect of alkali metal promoters on water-gas shift activity over Au-Pt/CeO2 catalyst(碱金属助剂对Au-Pt/CeO2催化剂催化水煤气变换反应活性的影响)[J]. Chin J Catal(催化学报), 2010, 31(6): 671-676.
|
| [49] |
Zhang Y J, Zhan Y Y, Chen C Q, et al. Highly efficient Au/ZrO2 catalysts for low-temperature water-gas shift reaction: Effect of pre-calcination temperature of ZrO2[J]. Int J Hydrogen Energy, 2012, 37(17): 12292–12300.
DOI:10.1016/j.ijhydene.2012.06.025 |
| [50] |
Li Jin-wei(李锦卫), Zhan Ying-ying(詹瑛瑛), Lin Xing-yi(林性贻), et al. Influence of calcination temperature on properties of Au/Fe2O3 catalysts for low temperature water gas shift reaction(焙烧温度对低温水煤气变换Au/Fe2O3催化剂性能的影响)[J]. Acta Phys - Chim Sin(物理化学学报), 2008, 24(6): 932-938.
|
| [51] |
Zhang Yan-jie(张燕杰), Chen Chong-qi(陈崇启), ZhanYing-ying(詹瑛瑛), et al. Preparation of highly active Au/ZrO2 catalysts for water-gas shift reaction: Calcination of ZrO2 in air vs N2(ZrO2空气焙烧与氮气焙烧对Au/ZrO2水煤气变换催化剂性能的影响)[J]. J MinJiangUniver(闽江学院学报), 2018, 39(2): 54-61.
|
| [52] |
Minemura Y, Kuriyama M, Ito S, et al. Additive effect of alkali metal ions on preferential CO oxidation over Pt/Al2O3[J]. Catal Commun, 2006, 7(9): 623–626.
DOI:10.1016/j.catcom.2006.01.028 |
| [53] |
Asano K, Ohnishi C, Iwamoto S, et al. Potassium-doped Co3O4 catalyst for direct decomposition of N2O[J]. Appl Catal B Environ, 2008, 78(3/4): 242–249.
|
| [54] |
Tang Q H, Huang X N, Chen Y T, et al. Characterization and catalytic application of highly dispersed manganese oxides supported on activated carbon[J]. J Mol Catal A - Chem, 2009, 301(1/2): 24–30.
|
| [55] |
Xiao Qi(肖琦). Study on the structure-function relationshipof CO oxidation or water gas shift reaction catalyzed by gold or platinum supported with titanium dioxide(二氧化钛负载金或铂催化CO氧化或水煤气变换反应的构效关系研究)[D]. Ji-nan(济南): Shandong University(山东大学), 2021.
|
| [56] |
Liu Ning(刘宁). Preparation of gold-based catalysts fromhydrotalcite precursors towards low temperature water gas shift reaction(水滑石前体法制备金基催化剂及其低温水煤气变换反应的研究)[D]. BeiJing(北京): Beijing University of Chemical Technology(北京化工大学), 2019.
|
| [57] |
Chen Wei(陈葳), Xiao Yi-hong(肖益鸿), Zhan Ying-ying(詹瑛瑛). Au/Fe2O3 Water-gas shift catalyst preparedby microemulsion method I. effect of synthesis parameters on catalyst activity(微乳法制备Au/Fe2O3水煤气变换反应催化剂Ⅰ. 制备参数对催化剂活性的影响)[J]. Chin J Catal(催化学报), 2003, 24(11): 867-871.
|
| [58] |
Choung S Y, Ferrandon M, Krause T. Pt-Re bimetallic supported on CeO2-ZrO2 mixed oxides as water-gas shift catalysts[J]. Catal Today, 2005, 99(3/4): 257–262.
|
| [59] |
Zhang Ying-chao(张颖超). Study on low-temperature water gas shift reaction catalyzed by ruthenium-based catalyst with ionic liquid(引入离子液体的钌基催化剂催化低温水煤气变换反应研究)[D]. Chengdu(成都): Southwest Petroleum University(西南石油大学), 2016.
|
| [60] |
Burch R. Gold catalysts for pure hydrogen production in the water-gas shift reaction: Activity, structure and reaction mechanism[J]. Phys Chem Chem Phys, 2006, 8(47): 5483–5500.
DOI:10.1039/B607837K |
| [61] |
Centeno M A, Reina T R, Ivanova S, et al. Au/CeO2 Catalysts: Structure and CO oxidation activity[J]. Catalysts, 2016, 6(10): 158.
DOI:10.3390/catal6100158 |
| [62] |
Schiffman J D, Schauer C L. A review: Electrospinning of biopolymer nanofibers and their applications[J]. Polym Rev, 2008, 48(2): 317–352.
DOI:10.1080/15583720802022182 |
| [63] |
Zhou Tao(周涛). Theoretical study of water gas shift reactionon Ni group and Cu group metals(Ni族和Cu族金属上水煤气变化反应的理论研究)[D]. Taiyuan(太原): Taiyuan University of Technology(太原理工大学), 2018.
|
 2023, Vol. 37
2023, Vol. 37


