多相催化剂的活性中心多由纳米颗粒、纳米团簇甚至单原子组成, 纳米颗粒上的原子位通常是不均匀的, 且受粒径大小、形状和化学环境等差异性因素的影响[1−8], 载体的性质也会影响活性金属的粒径和金属与载体的相互作用, 导致同时存在多种活性中心位, 从而具有不同催化活性和选择性[9−10]. 明确催化剂活性位本质和构效关系是多相催化研究的瓶颈难题, 由于多相催化反应基本上发生在催化剂的最表面, 从原子/分子水平认识真实表面结构和动态变化对催化剂的设计和优化至关重要, 特别是应用原位和准原位技术实时跟踪催化剂的表面动态变化[11−16].
丙烯是一种重要的化工原料, 目前主要由石脑油、原油副产品等的裂化获得. 随着丙烯需求日益增大, 丙烷直接脱氢(PDH)逐渐成为另一重要途径[11, 17−22]. 目前国内的丙烷脱氢制丙烯的催化剂和配套生产工艺完全依赖进口, Pt-和CrOx基催化剂是PDH工业过程已有的两大类催化剂, 具有良好活性, 但均易失活、需频繁再生. CrOx基催化剂主要用于Catofin技术, 工业过程中每20~30 min再生一次, 不仅操作费用高且精密阀门受损严重, 同时铬的毒性致使催化剂废去物处理困难; Pt-基催化剂主要用于Oleflex技术, 工业催化剂每7 d需要通过氧氯过程再生, 氯气不仅腐蚀设备且对环境造成危害, 又因其价格昂贵, 仍需要进一步优化以提高其稳定性和降低Pt用量[23−25]. Pt-基催化剂也广泛应用于氧化、脱氢、加氢、异构、重整、裂解等催化反应工业过程中, 也是很多重要的电化学过程的高效电极, 如可持续能源转化系统电极[3−6, 13, 26−30]. 明确Pt基催化剂的构效关系(如PDH)、失活机制和Pt的再分散等, 对高效Pt基催化剂的设计具有重要意义[31−36]. 近年来Pt-基催化剂的研制仍着重于低负载量、高分散性、高稳定性、均匀表面中心位以具有高目标产物选择性, 特别是单原子Pt位点催化剂的设计和研制[13, 20−26, 29−33, 35−41].
采用表面灵敏的低能离子散射谱(LEIS)和以CO为探针的原位红外光谱(CO-FTIR), 并结合X-射线衍射(XRD)、球差扫描电镜(HAADF-STEM)、X-光电子能谱(XPS)、程序升温氧化(TPOC)和Raman光谱等表征手段,以单组分催化剂作为模型体系, 系统研究Al2O3负载的Pt-基催化剂在丙烷脱氢反应过程中的表面动态变化和Pt的分散等, 以期明确催化剂失活和再生机制.
1 实验方法 1.1 催化剂的制备片状γ-Al2O3载体的制备: 称取37.5 g Al(NO3)3∙9H2O和5.4 g尿素于高压釜的内胆中, 再加60 mL去离子水, 搅拌20 min, 在100 ℃反应48 h. 反应后抽滤获得固态物经80 ℃干燥12 h, 再在马弗炉中600 ℃煅烧2 h, 马弗炉升温速度为1 ℃∙min−1.
不同Pt负载量(质量分数)Pt/Al2O3催化剂的制备: 用浸渍法制备, 以氯铂酸作为Pt的前驱盐. 量取不同体积的氯铂酸溶液于30 mL坩埚中, 再加去离子水至一定体积, 各加入1 g所合成的γ-Al2O3载体, 并连续搅拌4 h后于80 ℃烘干, 于80 ℃干燥8 h, 再在马弗炉中500 ℃煅烧2 h, 升温速度为10 ℃∙min−1. 制成的5个催化剂标记为: 0.05%Pt/Al2O3、0.1%Pt/Al2O3、0.5%Pt/Al2O3、1%Pt/Al2O3和3%Pt/ Al2O3.
1.2 催化剂的活性评价丙烷脱氢反应装置为常压固定床反应器, 催化剂经研磨、压片、破碎、过筛(粒径0.450~0.280 mm), 装入石英反应管, 反应产物用配有FID检测器的FULI GC 9790型气相色谱仪分析.
丙烷转化率X (C3H8/ %):
| $ X\left( {{{\rm{C}}_3}{{\rm{H}}_8}/ \text{%}} \right)\text{}\text=\text{}\text{1}-\frac{n\text{(}{\text{C}}_{\text{3}}{\text{H}}_{\text{8}}\text{)}}{\text{[}n{\text{(CH}}_{\text{4}}\text{)}-n{\text{(C}}_{\text{2}}{\text{H}}_{\text{6}}\text{)}-n\text{(}{\text{C}}_{\text{2}}{\text{H}}_{\text{4}}\text{)]/2 + }n{\text{(C}}_{\text{2}}{\text{H}}_{\text{6}}\text{) + }n{\text{(C}}_{\text{2}}{\text{H}}_{\text{4}}\text{) + }n{\text{(C}}_{\text{3}}{\text{H}}_{\text{8}}\text{) +} n{\text{(C}}_{\text{3}}{\text{H}}_{\text{6}}\text{)}}\text{×100\%} $ |
丙烯选择性S (C3H6/ %):
| $ S\left( {{{\rm{C}}_3}{{\rm{H}}_6}/ \text{%}} \right)\text{}\text=\text{}\frac{n{\text{C}}_{\text{3}}{\text{H}}_{\text{6}}}{\text{[}n{\text{(CH}}_{\text{4}}\text{) + 2}n{\text{(C}}_{\text{2}}{\text{H}}_{\text{6}}\text{) +}2n{\text{(C}}_{\text{2}}{\text{H}}_{\text{4}}\text{) ]/3 + }n{\text{(C}}_{\text{3}}{\text{H}}_{\text{6}}\text{)}}\text{×100\%} $ |
式中n(CH4)、n(C2H4)、n(C2H6)、n(C3H6)、n(C3H8)分别为反应尾气色谱分析对应CH4、C2H4、C2H6、C3H6、C3H8组分的相对物质量, 又因C2H4和C2H6的量很少, 物种平衡主要考虑总碳原子数, 同时兼顾氢原子数, 如C3H8裂解可以生成一分子CH4加一分子C2H4或C2H6(反应气氛有氢气), 也可生成两分子CH4加一个碳, C2H4、C2H6的生成则仅考虑加一个碳.
1.3 催化剂的表征X-射线粉末衍射仪(XRD)测试采用Ulitima-IV仪器, 以Cu Kα (λ=0.154 06 nm)为光源, 工作电压40 kV, 电流30 mA, 扫谱范围10°~90°, 扫谱速度5 (°)·min−1. HAADF-STEM测试用Thermo Scientific, Themis Z仪器. 显微Raman光谱测试用英国Renishaw in via显微拉曼光谱仪, 采用254 nm激光光源. 反应后催化剂的程序升温氧化(TPOC)尾气用RGA 4级杆小型质谱仪Hiden Analytical QIC-20在线检测CO2、CO和H2O信号, 催化剂用量20 mg, 氧化气体为5% O2/Ar混合气(体积比, 20 mL∙min−1), 升温速率20 ℃∙min−1. 原位红外光谱实验(CO-FTIR)用Thermo Nicolet Nexus型傅里叶红外光谱仪, 扫谱范围4 000~1 000 cm−1, 每张谱图重复扫描64次, 采用自制的石英衬底不锈钢透射原位样品池, 将25 mg样品压成片装入原位池中, 分别用H2还原、及随后的丙烷处理, 再分别用He吹扫后测背景谱, 然后通入CO/He混合气至CO吸附饱和后测谱、并扫He吹扫后的谱图[14, 42−43]. X射线光电子能谱(XPS)测试用德国Omicron公司的X-射线光电子能谱仪, 采用SPHERA能量分析器和XM1000MK单色化X射线源(Al Kα=1 486.6 eV); 低能离子散射谱测试(HS-LEIS)用德国IONTOF产的Qtac100谱仪, 样品可在自主设计的准原位池中不同气氛、温度下处理[44−45].
2 结果与讨论 2.1 催化剂的表征不同Pt负载量(质量分数)Pt/Al2O3催化剂的XRD衍射图, 仅显示对应γ-Al2O3的特征衍射峰(图1(a)), 表明Pt在载体上分散较好. 载体Al2O3和Pt/Al2O3催化剂(负载量从低到高)的比表面积分别约为235、238、228、214、209和210 m2∙g−1, 随Pt负载量增加略有下降. 用HAADF-STEM球差电镜[46−47]观察0.5%Pt/Al2O3和3%Pt/Al2O3催化剂的形貌(图1), 发现Pt单原子和Pt纳米粒子(含团簇)共同存在, 0.5%Pt/Al2O3催化剂有较多的Pt单原子、而3%Pt/Al2O3催化剂则以Pt纳米粒子(含团簇)为主.

|
图 1 不同Pt负载量的Pt/Al2O3催化剂的(a) XRD图, (b) 0.5%和(c) 3%的HAADF-STEM电镜图 Fig.1 XRD patterns (a) and HAADF-STEM images ((b) 0.5%, (c) 3%) of Pt/Al2O3 catalysts with different Pt loadings |
不同Pt负载量的Pt/Al2O3催化剂的丙烷脱氢反应(PDH)性能测试结果如图2所示. 载体Al2O3的PDH催化活性很低, 初始丙烷转化率仅为3%; 当负载极少量的Pt时(0.05%), 初始丙烷转化率上升为14%, 初始丙烯选择性高达91%, 初始甲烷选择性为7.2%; 当Pt负载量为0.1%时, 初始丙烷转化率上升至18%、随后逐渐下降, 丙烯选择性为90%~92%; 当负载0.5%的Pt时, 初始丙烷转化率上升到62%, 初始丙烯选择性为57%, 随后上升至92%; 当Pt负载量为1%和3%时, 初始丙烷的转化率均高达100%、初始气相产物全部为甲烷, 随着反应的进行丙烷的转化率下降、甲烷的选择性下降、而丙烯的选择性升高并逐步达到90%. 这一阶段可称为催化剂的“诱导”阶段, 该“诱导”阶段过程随Pt负载量增大而增长, “诱导期”最初阶段气相产物主要是甲烷. 反应4 h后载体Al2O3和0.05%、0.1%、0.5%、1%、3%负载量的Pt/Al2O3催化剂的丙烷转化率分别约为2%、4%、6%、12%、15%、21%, 随Pt负载量的增加而增大, 但1%Pt/Al2O3和3%Pt/Al2O3催化剂的活性仍随反应的进行有较大的下降幅度. 从PDH性能随Pt负载量的变化表明了Pt是PDH的活性中心, 这种在反应初期活性的快速下降是Pt-基催化剂上丙烷脱氢反应的普遍现象, 为了提高其稳定性多通过研制特定催化活性位或添加其它组分等以期抑制积碳生成和延缓Pt组分的烧结[11, 17−18, 20, 23−25, 32−36, 48]. 考虑甲烷(CH4)的C∶H原子比为1∶4、而丙烷(C3H8)的为3∶8, 大量甲烷的生成必然伴随表面的积碳. 从诱导过程PDH性能的变化可以推测大量积碳沉积覆盖了表面的高活性位、进而提高丙烯的选择性.

|
图 2 不同Pt负载量的Pt/Al2O3催化剂的PDH性能 Fig.2 PDH performance of the Pt/Al2O3 catalysts with different Pt loadings (a) Al2O3; (b) 0.05%; (c) 0.1%; (d) 0.5%; (e) 1%; (f) 3% Pt/Al2O3 |
进而对反应后催化剂可能的积碳进行分析. 1%Pt/Al2O3催化剂在原位池中500 ℃还原1 h, 其XPS全谱图(图3(a))显示主要有Pt、Al、O 3种元素、表面C的含量几乎检测不到; 当该催化剂在丙烷和氮气混合气(4 + 16 mL∙min−1) 600 ℃处理10 min, XPS谱图(图3(a), (b))在284.6 eV处对应于C 1s的峰出现, 证明丙烷处理产生了表面积碳[2−3].

|
图 3 催化剂1%Pt/Al2O3丙烷处理前后的XPS全谱图(a)和C 1s图(b) Fig.3 XPS full spectra (a) and C 1s spectra (b) of 1%Pt/Al2O3 catalyst before and after propane treatment |
0.5%Pt/Al2O3、1%Pt/Al2O3和3%Pt/Al2O3催化剂经过PDH催化反应4 h后的Raman谱图(图4)中位于~1 330和~1 600 cm−1处出现的两个峰, 分别对应碳材料的D和G峰, D峰的出现和比较宽的两个峰, 表明所生成的积碳有序性差、且可能含有与氢键连的碳[48].
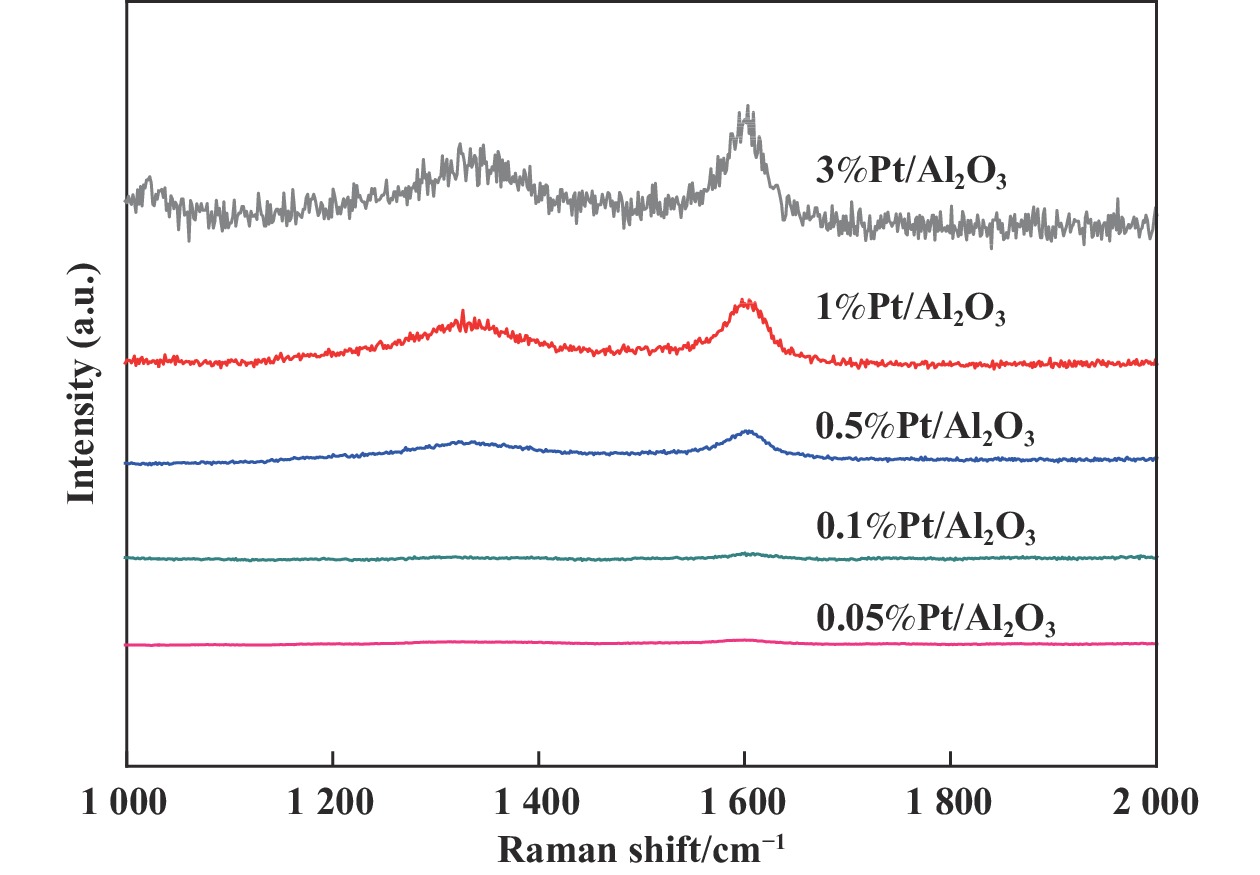
|
图 4 不同Pt负载量的Pt/Al2O3催化剂的Raman光谱图 Fig.4 Raman spectra of the Pt/Al2O3 catalysts after 4 h propane reaction |
接着通过程序升温氧化燃烧表面积碳(TPOC)来分析PDH反应之后催化剂的积碳、及可能含碳物种[49−50], 图5(a), (b)显示在400~600 ℃区间检测的CO2和CO信号均有两个峰、而H2O仅有一个峰比较明显, CO和CO2相近的峰形状表明CO信号可能来于CO2碎片化物种, H2O的峰和CO2第1个信号峰变化趋势相近说明了CO2在452 ℃的峰为碳氢化合物的氧化峰、在523 ℃的峰为石墨碳的氧化峰. TPOC结果和Raman结果都证明了积碳含碳氢化合物和石墨碳两种, 而且Pt的负载量越高, 积碳量越多.
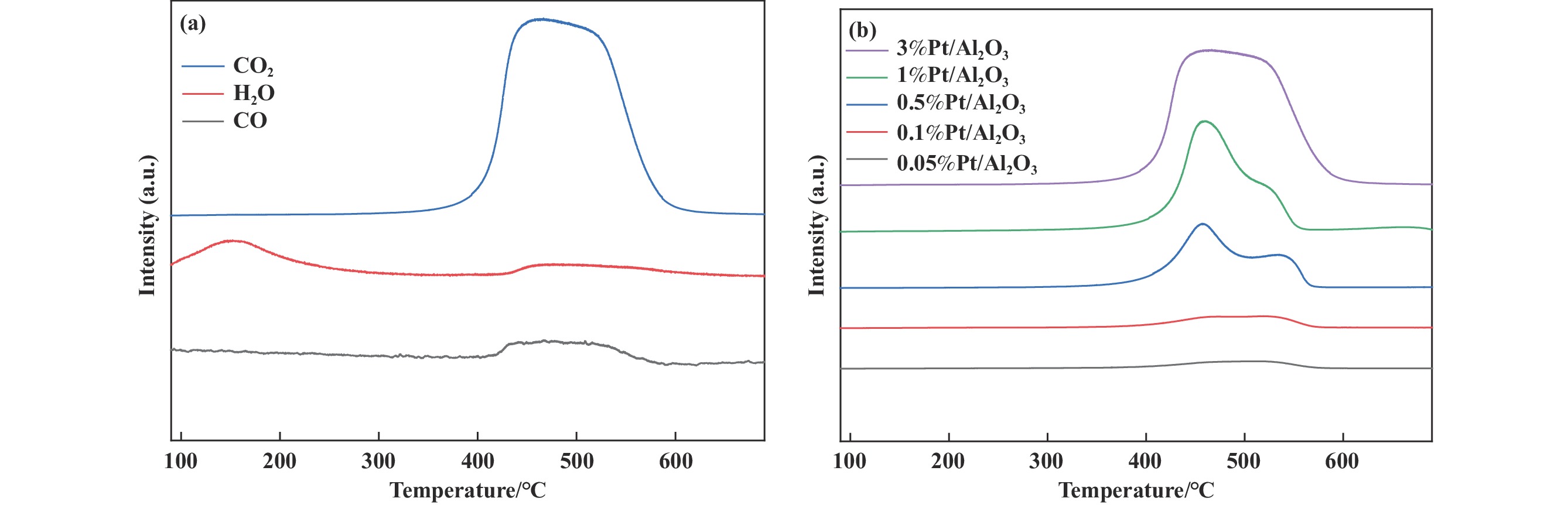
|
图 5 (a) 3%Pt/Al2O3催化剂PDH反应后的TPOC图; (b) 不同Pt负载量的Pt/Al2O3催化剂PDH反应后的CO2-TPOC信号图 Fig.5 (a) TPOC of the 3%Pt/Al2O3 catalyst after PDH reaction; (b) CO2-TPOC of the spent Pt/Al2O3 catalysts with different Pt loadings |
催化剂活性位点的认识对理解催化反应过程至关重要, 我们通过CO为探针分子的原位红外光谱(CO-FTIR)研究Pt/Al2O3催化剂在PDH过程中的动态变化(图6). 图6(a), (b), (c)中每一幅图的底部一条谱线为不同Pt负载量催化剂经还原后的CO吸附谱图, 在~2 055 cm−1出现一个很强的吸附峰, 2 125和~1 824 cm−1出现弱的吸附峰. 据文献报道氧化铝负载的Pt催化剂上CO吸附振动峰(νCO): 2 020~2 100 cm−1为Pt0上的端式吸附峰, ~2 125 cm−1为Pt2+—CO端式吸附峰, 1 820~2 020 cm−1为纳米Pt上的桥式吸附峰[3, 51−53]. 不同催化剂在600 ℃进行丙烷脉冲处理后(图6), 端式吸附峰强度逐渐降低直至稳定, 而桥式吸附峰和Pt2+—CO端式峰强度逐渐降低直至消失, νCO峰强度随丙烷脉冲量下降幅度与Pt负载量有关, 负载量越高下降越慢、且达到稳定需要的丙烷量也越大, 如0.5%Pt/Al2O3的丙烷量约为0.4 mL, 1%Pt/Al2O3约为1.0 mL, 3%Pt/Al2O3需要1.3 mL以上. 这些结果表明脉冲丙烷后表面形成积碳、且覆盖在活性组分Pt表面, 导致CO吸附峰强度大幅度下降.

|
图 6 催化剂0.5%Pt/Al2O3(a); 1%Pt/Al2O3(b); 3%Pt/Al2O3(c)和(d)丙烷脉冲处理的CO-FTIR谱图 Fig.6 CO-FTIR spectra for propane pulse treatment on catalyst 0.5%Pt/Al2O3(a); 1%Pt/Al2O3 (b); 3%Pt/Al2O3(c) and (d) |
电镜结果显示Pt/Al2O3催化剂中Pt单原子和Pt纳米粒子(含团簇)共同存在, 前者的CO吸附仅有端式吸附、后者可以有端式和桥式/穴位吸附模式, 脉冲丙烷后端式吸附峰强度下降至一稳定值、而桥式/穴位吸附峰强度减弱直至消失, 表明Pt单原子上较不易形成积碳、而纳米粒子上易形成积碳. 产生的积碳使丙烷转化率降低而丙烯的选择性提高, Pt单原子仍然暴露作为丙烯生成的高选择性活性中心. 综合前面的表征手段验证了“诱导”阶段会产生积碳, CO-FTIR表明生成的积碳覆盖在Pt表面, 又高Pt负载量的催化剂具有较多的纳米粒子(含团簇)、有较高的初活性、活性下降较快, 所以推测Pt纳米粒子(含团簇)上发生了深度脱氢或C—C键的断裂形成了积碳, 且积碳覆盖在了Pt纳米粒子(含团簇)的表面.
用准原位XPS探究了3%Pt/Al2O3催化剂在氧化-还原循环过程中的价态变化(图7). 每个温度点的还原和氧化处理分别用纯H2和空气在原位池中处理1 h, 元素的结合能用Al 2p峰做定标, 因为Pt的XPS最灵敏峰Pt 4f和载体Al 2p峰重叠, 故检测其次强峰Pt 4d5/2的峰. 根据文献报道PtOx物种的4d5/2结合能约316.3 eV, Pt0为314.5 eV [54]. 图7(a)为500 ℃氧化后程序升温还原的XPS图, 经200 ℃还原后Pt 4d5/2峰的结合能从316.3 eV逐渐向低结合能偏移, 经500 ℃还原后为314.5 eV, 表明PtOx逐渐被氢气还原为Pt0. 图7(b)为500 ℃还原后催化剂程序升温氧化的XPS图, 发现经100 ℃氧化后Pt 4d5/2峰的结合能从314.5 eV逐渐向高结合能偏移, 经500 ℃氧化后为316.3 eV, 表明Pt0被氧化为PtOx.
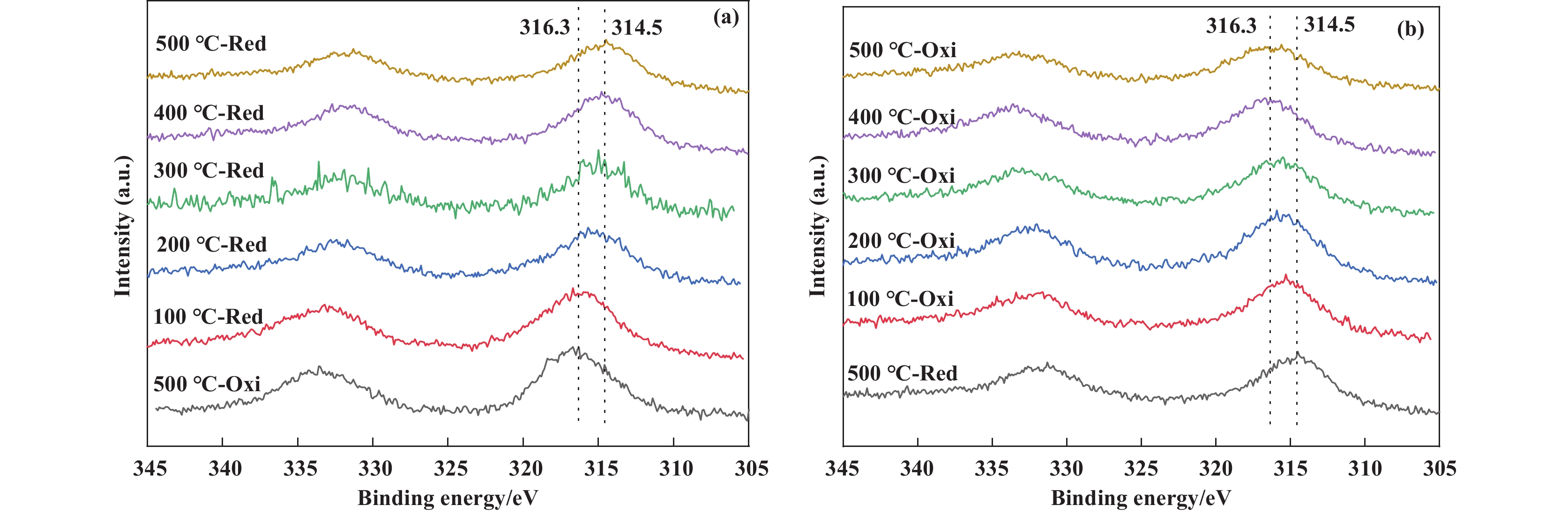
|
图 7 催化剂3%Pt/Al2O3的XPS Pt 4d5/2图 (a) 500 ℃氧化后的程序升温还原处理; (b) 500 ℃还原后的程序升温氧化处理 Fig.7 XPS Pt 4d5/2 spectra of the 3%Pt/Al2O3 catalyst (a) Temperature-programmed reduction of the 500 ℃ oxidation sample; and (b) Temperature-programmed oxidation of the 500 ℃ reduction sample |
低能离子散射谱(HS-LEIS)因采用低能量离子与表面作用, 仅检测固体材料最表面层元素的信息[43−44]. 如图8为3%Pt/Al2O3催化剂在氧化-还原循环过程中最表面的元素组成变化, 催化剂在500 ℃用空气氧化后从100 ℃程序升温还原的过程中, 表面Pt的信号随着还原温度的升高而逐渐减弱(图8(a)), 直观体现在表面Pt/Al原子比的连续降低(图8(b)), 从500 ℃氧化后的1.6%降到500 ℃还原后的0.4%. 这些结果表明氧化态PtOx在催化剂表面分散较好, 还原的过程中分散的PtOx被H2还原为Pt0并发生团聚, 使其分散度降低. 进而将500 ℃还原后的催化剂在空气中程序升温氧化处理(图8(c), (d)), 发现随着氧化温度的升高催化剂表面Pt的信号逐渐增强、Pt/Al比增大, 经过500 ℃氧化后Pt/Al升至1.3%, 表明氧化处理可以使Pt在催化剂表面再分散, 还原时的团聚和氧化时的再分散几乎是一个可逆的过程.

|
图 8 催化剂3%Pt/Al2O3的HS-LEIS谱图 (a) 500 ℃氧化后的程序升温还原处理; (b) Pt/Al原子比; (c) 500 ℃还原后的程序升温氧化处理; (d) Pt/Al原子比 Fig.8 HS-LEIS spectra of the 3%Pt/Al2O3 catalyst (a) Temperature-programmed reduction of the 500 ℃ oxidation sample; (b) surface Pt/Al ratio; (c) Temperature-programmed oxidation of the 500 ℃ reduction; (d) surface Pt/Al ratio |
基于原位或准原位表征技术研究浸渍法制备的不同Pt负载量的Pt/Al2O3催化剂在丙烷脱氢反应过程的动态变化, 发现丙烷脱氢反应初期存在一个诱导期, 该过程中丙烷转化率大幅度下降、丙烯选择性大大提高. XRD、HAADF-STEM结果表明表面Pt单原子和纳米粒子(含团簇)共存, XPS测试发现诱导期中表面生成大量积碳, TPOC和Raman结果表明含石墨碳和碳氢化合物碳两种碳物种, CO-FTIR和LEIS结果表明积碳主要落在Pt纳米粒子(含团簇)上. 这些结果表明Pt纳米粒子(含团簇)上更易发生C—C键断裂生成表面积碳、和甲烷, 而单原子Pt位点不易生成积碳, Pt纳米粒子(含团簇)上的积碳抑制了丙烷的过度活化和C—C键断裂, 提高丙烯的生成选择性. 因此Pt/Al2O3催化剂上丙烷脱氢是一个结构敏感反应、产物的选择性与Pt的尺寸有关. 氧化处理可以使Pt在Al2O3上较好的分散, 也表明氧化处理是一种可以使负载贵金属再分散或再生的方法.
| [1] |
Thermally stable single-atom heterogeneous catalysts[J]. Adv Mater, 2021, 33(50): 2004319.
DOI:10.1002/adma.202004319 |
| [2] |
Understanding catalyst surfaces during catalysis through near ambient pressure X-ray photoelectron spectroscopy[J]. Chem Rev, 2019, 119(12): 6822–6905.
DOI:10.1021/acs.chemrev.8b00114 |
| [3] |
Kinetics and active surfaces for CO oxidation on Pt-group metals under oxygen rich conditions[J]. Topic Catal, 2013, 56(15/17): 1299–1313.
|
| [4] |
Interfacial effects in iron-nickel hydroxide- platinum nanoparticles enhance catalytic oxidation[J]. Science, 2014, 344(6183): 495–499.
DOI:10.1126/science.1252553 |
| [5] |
Catalysis under shell: improved CO oxidation reaction confined in Pt@h-BN core-shell nanoreactors[J]. Nano Res, 2017, 10(4): 1403–1412.
DOI:10.1007/s12274-017-1512-8 |
| [6] |
Electron penetration triggering interface activity of Pt-graphene for CO oxidation at room temperature[J]. Nat Commun, 2021, 12(1): 5814.
DOI:10.1038/s41467-021-26089-y |
| [7] |
NO Reduction on Cu-based model catalysts studied by in-situ IRAS[J]. Chin J Chem, 2022, 40(11): 1267–1274.
DOI:10.1002/cjoc.202100862 |
| [8] | |
| [9] |
Surface and interface control in nanoparticle catalysis[J]. Chem Rev, 2020, 120(2): 1184–1249.
DOI:10.1021/acs.chemrev.9b00220 |
| [10] | |
| [11] |
Single-atom Pt in intermetallics as an ultrastable and selective catalyst for propane dehydrogenation[J]. Nat Commun, 2020, 11(1): 2838.
DOI:10.1038/s41467-020-16693-9 |
| [12] |
The structure of catalytically active gold on titania[J]. Science, 2004, 306(5694): 252–255.
DOI:10.1126/science.1102420 |
| [13] |
Effect of Dispersion on catalytic performance of supported Pt catalysts for CO oxidation[J]. Chin J Catal, 2012, 33(12): 1901–1905.
|
| [14] |
Applications of in‐situ wide spectral range infrared absorption spectroscopy for CO oxidation over Pd/SiO2 and Cu/SiO2 catalysts[J]. Chin J Catal, 2022, 43(8): 2001–2009.
DOI:10.1016/S1872-2067(21)64054-8 |
| [15] |
Reshaping of metal nanoparticles under reaction conditions[J]. Angew Chem Int Ed, 2020, 59(6): 2171–2180.
DOI:10.1002/anie.201906799 |
| [16] |
Chen Ming-shu(陈明树). Toward understanding the nature of the active sites and structure-activity relationships of heterogeneous catalysts by model catalysis studies (催化剂活性位本质和构效关系的模型催化研究) [J]. Acta Phys-Chim Sin (物理化学学报), 2017, 33 (12): 2424−2437.
|
| [17] |
Recent progress on the traditional and emerging catalysts for propane dehydrogenation[J]. J Ind Eng Chem, 2023, 118: 1–18.
DOI:10.1016/j.jiec.2022.11.001 |
| [18] |
Propane dehydrogenation: Catalyst development, new chemistry, and emerging technologies[J]. Chem Soc Rev, 2021, 50(5): 3315–3354.
DOI:10.1039/D0CS00814A |
| [19] |
Dendritic mesoporous silica nanoparticle supported PtSn catalysts for propane dehydrogenation[J]. Int J Mol Sci, 2022, 23(21): 12724.
DOI:10.3390/ijms232112724 |
| [20] |
Advanced design and development of catalysts in propane dehydrogenation[J]. Nanoscale, 2022, 14(28): 9963–9988.
DOI:10.1039/D2NR02208G |
| [21] | |
| [22] |
Catalytic dehydrogenation of light alkanes on metals and metal oxides[J]. Chem Rev, 2014, 114(20): 10613–10653.
DOI:10.1021/cr5002436 |
| [23] | |
| [24] | |
| [25] |
Propylene synthesis: recent advances in the use of Pt-based catalysts for propane dehydrogenation reaction[J]. Catalyst, 2021, 11(9): 1070.
DOI:10.3390/catal11091070 |
| [26] |
Mastering the surface strain of platinum catalysts for efficient electrocatalysis[J]. Nature, 2021, 598(7879): 76–81.
DOI:10.1038/s41586-021-03870-z |
| [27] |
Lan X C, Wang T F. Highly selective catalysts for the hydrogenation of unsaturated aldehydes: A review [J]. ACS Catal, 2020, 10 (4): 2764−2790.
|
| [28] |
Selective hydrogenolysis of glycerol to 1, 3-propanediol over Pt-W based catalysts[J]. Chin J Catal, 2020, 41(9): 1311–1319.
DOI:10.1016/S1872-2067(20)63586-0 |
| [29] |
Recent advances in single-atom catalysts for CO oxidation[J]. Catal Rev Sci Eng, 2022, 64(3): 491–532.
DOI:10.1080/01614940.2020.1821443 |
| [30] |
Protruding Pt single-sites on hexagonal ZnIn2S4 to accelerate photocatalytic hydrogen evolution[J]. Nat Commun, 2022, 13(1): 1287.
DOI:10.1038/s41467-022-28995-1 |
| [31] |
Nanostructured catalysts toward efficient propane dehydrogenation[J]. Acc Mater Res, 2020, 1(1): 30–40.
DOI:10.1021/accountsmr.0c00012 |
| [32] |
Size-dependent reaction mechanism and kinetics for propane dehydrogenation over Pt catalysts[J]. ACS Catal, 2015, 5(11): 6310–6319.
DOI:10.1021/acscatal.5b01423 |
| [33] |
Size dependence of Pt catalysts for propane dehydrogenation: from atomically dispersed to nanoparticles[J]. ACS Catal, 2020, 10(21): 12932–12942.
DOI:10.1021/acscatal.0c03286 |
| [34] |
On the role of Sn segregation of Pt-Sn catalysts for propane dehydrogenation[J]. ACS Catal, 2021, 11(8): 4401–4410.
DOI:10.1021/acscatal.1c00639 |
| [35] |
Highly dispersed Pt stabilized by ZnOx-Si on self-pillared zeolite nanosheets for propane dehydrogenation[J]. Ind Eng Chem Res, 2023, 62(9): 3853–3861.
DOI:10.1021/acs.iecr.2c04041 |
| [36] |
Germanium-enriched double-four-membered-ring units inducing zeolite- confined subnanometric Pt clusters for efficient propane dehydrogenation[J]. Nat Catal, 2023, 6(6): 506–518.
DOI:10.1038/s41929-023-00968-7 |
| [37] |
Boosting propane dehydrogenation over PtZn encapsulated in an epitaxial high-crystallized zeolite with a low surface barrier[J]. ACS Catal, 2022, 12(2): 1310–1314.
DOI:10.1021/acscatal.1c04092 |
| [38] | |
| [39] | |
| [40] |
Chemical synthesis of single atomic site catalysts[J]. Chem Rev, 2020, 20(21): 11900–11955.
|
| [41] |
Ensemble effect for single-atom, small cluster and nanoparticle catalysts[J]. Nat Catal, 2022, 5(9): 766–776.
DOI:10.1038/s41929-022-00839-7 |
| [42] |
The study of the active surface for CO oxidation over supported Pd catalysts[J]. Sci China: Chem, 2015, 58(1): 174–179.
DOI:10.1007/s11426-014-5277-6 |
| [43] |
Evidence of the encapsulation model for strong metal-support interaction under oxidized conditions: A case study on TiOx/Pt(111) for CO oxidation by in situ wide spectral range infrared reflection adsorption spectroscopy[J]. ACS Catal, 2018, 8(11): 10156–10163.
DOI:10.1021/acscatal.8b02883 |
| [44] |
The effect of the support on the surface composition of PtCu alloy nanocatalysts: in situ XPS and HS‐LEIS studies[J]. Chin J Catal, 2017, 38(7): 1229–1236.
DOI:10.1016/S1872-2067(17)62857-2 |
| [45] |
Disclosure of the surface composition of TiO2 supported gold-palladium bimetallic catalysts by high- sensitivity low-energy ion scattering spectroscopy[J]. ACS Catal, 2018, 8(3): 1790–1795.
DOI:10.1021/acscatal.7b03839 |
| [46] | |
| [47] |
Gao Y, Yang B, Fu Q, et al. In situ identification of the metallic state of Ag nanoclusters in oxidative dispersion[J]. Nat Commun. 2021, 12 (1): 1406.
|
| [48] |
Weng Wei-zheng(翁维正), Luo Chun-rong(罗春容), Li Jian-mei(李建梅), et al. In situ Time-resolved FTIR and Raman characterizations of the partial oxidation of methane to synthesis gas over Ir/SiO2 catalyst (Ir/SiO2上甲烷部分氧化制合成气反应的原位时间分辨红外和原位Raman光谱表征) [J]. Acta Chim Sin (化学学报) 2004, 62 (18): 1853−1857.
|
| [49] |
Wang H Z, Sun L L, Sui Z J, et al. Coke formation on Pt-Sn/Al2O3 catalyst for propane dehydrogenation[J]. Ind Eng Chem Res, 2018, 57 (26): 8647−8654.
|
| [50] |
Alcala R, Dean D P, Chavan I, et al. Strategies for regeneration of Pt-alloy catalysts supported on silica for propane dehydrogenation[J]. Appl Catal A: Gen, 2023, 658 : 119157.
|
| [51] |
Utilizing quantitative in situ FTIR spectroscopy to identify well-coordinated Pt Atoms as the active site for CO oxidation on Al2O3-supported Pt catalysts[J]. ACS Catal, 2016, 6(8): 5599–5609.
DOI:10.1021/acscatal.6b01128 |
| [52] |
High catalytic activity of Pt/Al2O3 catalyst in CO oxidation at room temperature—A new insight into strong metal-support interactions[J]. Catalysts, 2021, 11(12): 1475.
DOI:10.3390/catal11121475 |
| [53] |
Gas phase vs. liquid phase: Monitoring H2 and CO adsorption phenomena on Pt/Al2O3 by IR spectroscopy[J]. Catal Sci Technol, 2022, 12(4): 1359–1367.
DOI:10.1039/D1CY02233D |
| [54] |
Effect of reduction temperature on the activity of Pt-Sn/Al2O3 catalysts for propane dehydrogenation[J]. Catal Today, 2023, 411/412: 113957.
DOI:10.1016/j.cattod.2022.11.018 |
 2024, Vol. 38
2024, Vol. 38


