为了降低铝-空气电池中氧还原反应(ORR)受到动力学缓慢的限制, 人们一直在努力寻找高效且廉价的非贵金属ORR催化剂. 金属氧化物具有成本低、储量大以及结构灵活性高等特点, 具有良好的氧还原电化学性能, 其中钙钛矿型氧化物(ABO3)因为A或B位的金属容易被其他元素取代, 生成具有合适结构、氧含量以及优异电催化性能的理想钙钛矿而在催化剂方面具有广泛研究, 但由于钙钛矿纳米颗粒易团聚限制了其催化性能[1−2]. 研究表明, 氮掺杂的碳基体在ORR过程中能够提高载流子的界面导电性, 实现电子向活性位点的转移[3]. 因此, 金属化合物纳米粒子与氮掺杂的碳材料相结合的催化剂, 不仅具有高电流密度, 而且能够防止催化剂团聚, 从而获得更好的ORR性能 [4−5]. 近年来, 缺陷型尖晶石ZnMnO3因其优异性能应用于电池阴阳电极和光催化等领域, 如Su等[6]将ZnMnO3作为可充电锂离子电池的负极材料, 表现出高储锂性能; Kohei等[7]利用ZnMnO3制备了一种应用于镁可充电电池的高性能正极材料, 具有优异的循环性能及容量. ZnMnO3常用制备方法主要有热解法[8]、水热法[9]、溶胶-凝胶法[10]以及共沉淀法[11]等, 但不同制备方法对ZnMnO3氧还原性能的影响研究较少. 因此, 我们通过ZnMnO3与N掺杂的碳纳米管结合, 通过不同的方法制备催化剂研究其结构、ORR性能及催化活性.
1 实验部分 1.1 材料制备与表征通过溶胶-凝胶法、共沉淀法和水热法3种方法制备ZnMnO3与N掺杂的碳纳米管的复合催化材料.
溶胶-凝胶法: 将Zn(NO3)2·6H2O、Mn(NO3)2 (50%)溶解于蒸馏水中, 加入一定量的碳纳米管、双氰胺(DCDA)、乙二胺四乙酸(EDTA)和柠檬酸(CA), 用NH3·H2O调节溶液pH值至8左右. 将溶液置于80 ℃水浴中搅拌凝胶状, 烘干研磨后得到前驱体, 记为ZnMnO3/N-CNT-s.
共沉淀法: 取Zn(NO3)2·6H2O和Mn(NO3)2(50%)按比例配置成均匀混合溶液, 在三口烧瓶中加入一定浓度的双氰胺(DCDA)溶液及一定量的碳纳米管. 在60 ℃水浴条件下, 通过蠕动泵同时将一定浓度的碳酸钠溶液与Zn(NO3)2·6H2O和Mn(SO4)2·H2O的混合溶液泵入三口烧瓶中, 经搅拌和静置后将沉淀洗涤、过滤及干燥获得前驱体, 记为ZnMnO3/N-CNT-c.
水热法: 将MnC2O4、ZnC2O4·2H2O、双氰胺(DCDA)和碳纳米管加入70 mL蒸馏水, 在磁力搅拌下加入一定浓度的NaOH溶液和2 mL H2O2溶液, 将混合溶液搅拌均匀后倒入聚四氟乙烯内衬中, 130 ℃条件下反应24 h. 待反应釜冷却至室温后, 对悬浊液静置过滤, 沉淀经洗涤后干燥获得前驱体, 记为ZnMnO3/N-CNT-h.
将3种方法制备的前驱体在氮气气氛中先以5 ℃∙min−1的升温速率升温至500 ℃煅烧1 h, 然后升温至900 ℃煅烧 4 h, 将得到的黑色粉末洗涤至中性, 烘干得到催化材料.
XRD采用荷兰帕纳科公司生产的Empyrean锐影型X射线衍射仪; SEM采用场发射扫描电子显微镜(SEM, Sigma 500)进行分析; 比表面积(BET)采用美国 Micromeritics ASAP 2460 型比表面积分析测试仪; TEM采用美国 FEI Tecnai G2 TF 30 S-Twin 透射电子显微镜分析.
1.2 电化学性能测试使用瑞士万通(PGSTAT204)电化学工作站对催化剂ZnMnO3/N-CNT进行电化学测试. 测试采用三电极体系, 参比电极为Ag/AgCl, 对电极为铂片, 工作电极为玻碳电极(GC), 电解液为0.1 mol·L−1的KOH溶液, 电化学测试前先通30 min的高纯氧, 同时测试过程中持续通入氧气, 保证电解液中氧气饱和, 通氧量为60 mL·min -1. 循环伏安法测量(CV)的扫描速度为50 mV·s−1, 线性电势扫描伏安法(LSV)测试曲线转速为1 600 r∙ min−1, 扫描速度为10 mV·s−1.
催化剂负载过程如下: 将研磨后的催化剂、导电炭黑和50 μL的Nafion树脂溶液分散在200 mL水与800 mL无水乙醇的混合液中, 超声震荡30 min 使其分散均匀. 取10 μL催化剂混合液滴加到光滑玻碳电极(GC)上, 在空气中自然风干后进行测试.
1.3 铝-空气电池组装与测试通过辊压机先将自制的扩散层(3 cm × 4 cm)辊压在集流体镍网(3 cm × 4.5 cm)的两侧, 再将催化层(3 cm × 4 cm)压合在其中一侧, 使4部分紧密结合在一起, 然后用去离子水将电极表面洗净, 放入烘箱干燥.
负极为高纯铝板(99.99%), 正极为自制的空气电极, 铝板与空气电极间隔1 cm, 电解液为6 mol·L−1 NaOH溶液, 采用蠕动泵循环, 通氧量为60 mL·min−1. 在自制的电池槽中组装成铝-空气电池并进行电化学测试.
2 结果与讨论 2.1 催化剂物相结构图1为不同催化剂的 XRD 图, 和标准PDF卡片(PDF 19-1461)相比, 可以看出不同方法制备出的ZnMnO3/N-CNT其XRD图大致相同, 为纯钙钛矿结构, 均没有杂峰出现, 表明结晶度较好.

|
图 1 不同方法制备的ZnMnO3/N-CNT催化剂XRD图 Fig.1 XRD Patterns of ZnMnO3/N-CNT catalysts prepared by different methods |
图2、图3分别是不同制备方法得到的前驱体SEM和TEM照片, 图4为不同方法制备的ZnMnO3/N-CNT催化剂的典型拉曼光谱, 表1为不同制备方法所得样品的比表面积.

|
图 2 溶胶-凝胶法(a)、水热法(b)、共沉淀(c)法制备的ZnMnO3/N-CNT催化剂SEM图 Fig.2 SEM images of ZnMnO3/N-CNT catalysts prepared by sol-gel (a), hydrothermal (b), and co-precipitation (c) |

|
图 3 溶胶-凝胶法(a)、水热法(b)、共沉淀(c)、部分溶胶-凝胶(d)法制备的ZnMnO3/N-CNT催化剂TEM图 Fig.3 TEM images of ZnMnO3/N-CNT catalysts prepared by sol-gel (a), hydrothermal (b), and co-precipitation (c) |
|
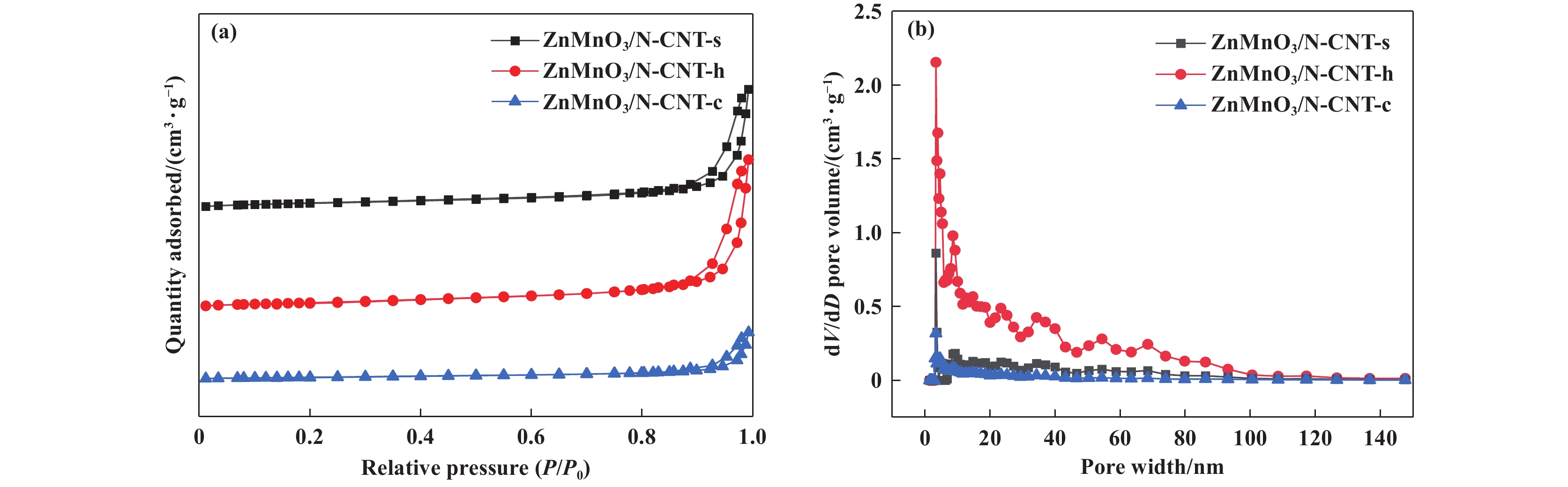
图 4 ZnMnO3/N-CNT催化剂N2吸附/脱附等温线(a)和孔径分布图(b) Fig.4 N2 Adsorption/desorption isotherms (a) and pore size distribution (b) of ZnMnO3/N-CNT catalysts |
| 表 1 ZnMnO3/N-CNT的比表面积(SBET)及孔容(VPore) Table 1 Specific surface area (SBET) and pore capacity (VPore) of ZnMnO3/N-CNT |
从图2、图3的SEM和TEM图中可以清晰看出, 采用不同方法制备的ZnMnO3/N-CNT催化剂的碳纳米管结构保留完整, 纳米颗粒无明显团聚. 采用溶胶-凝胶法制备的ZnMnO3/N-CNT催化剂中部分出现了核壳结构, 这可能是由于添加的柠檬酸在高温下分解生成的碳与原添加的碳纳米管融合形成了外包袱的碳壳, 将ZnMnO3包袱在壳内, 形成了图中的核壳结构. TEM图像表明, 复合氧化物纳米颗粒尺寸大小各不相同但都成功附着于碳纳米管上. 大多数复合氧化物纳米颗粒附着于碳纳米管外壁上, 部分被碳纳米管包裹进入内壁, 部分纳米金属颗粒附着于多条碳纳米管外壁.
由图4(a)可知, 所有样品的N2吸附和脱附曲线都没有重合, 具有明显的回滞环, 属于IV型等温线, 说明所有方法制备出样品都具有的介孔结构. 从表1汇总的催化剂样品比表面积和孔容数据可以看出, 水热法制备的ZnMnO3/N-CNT比表面积大于溶胶-凝胶法和共沉淀法制备出的样品, 能够提供更多的活性反应位点, 有助于催化氧化.
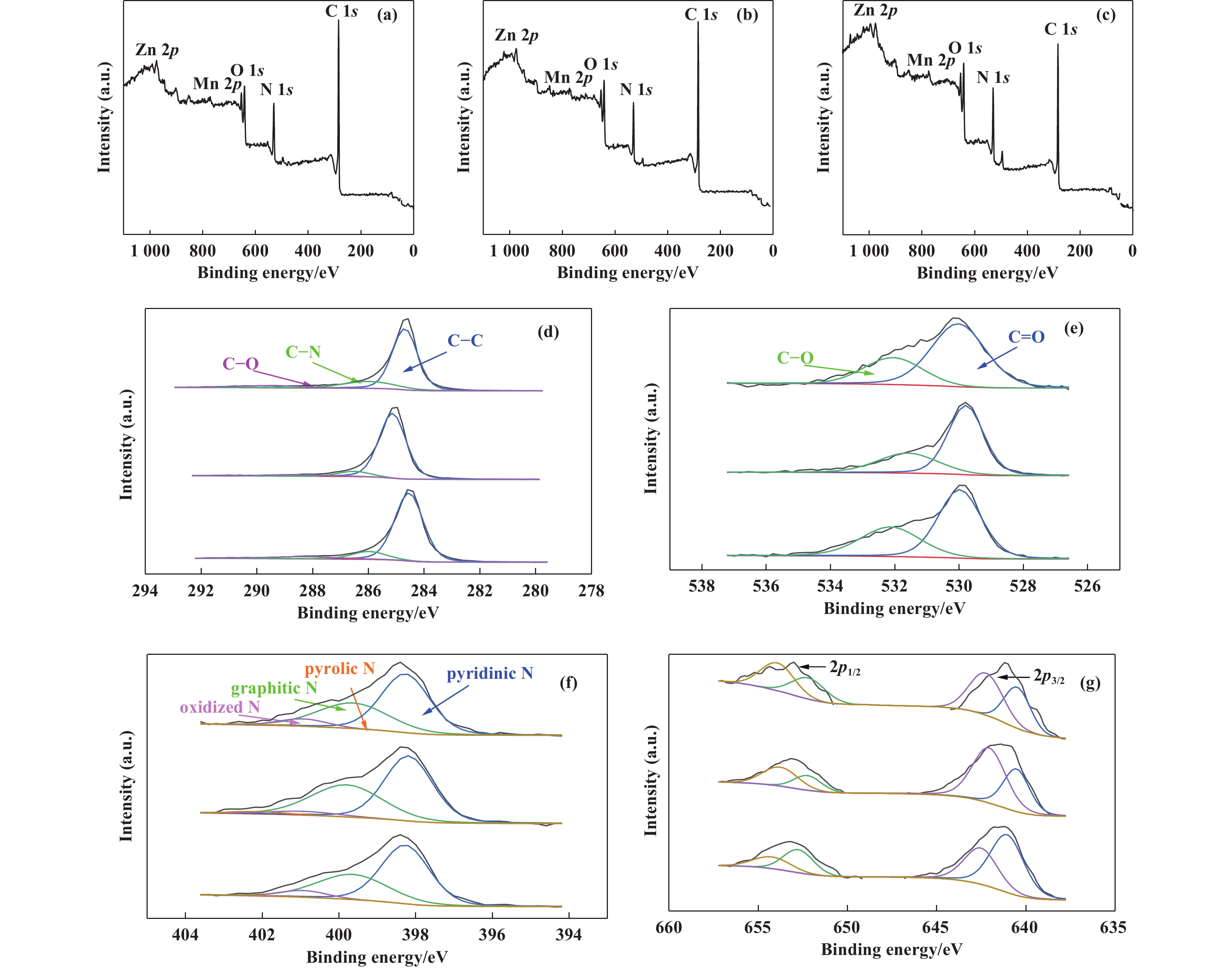
通过 XPS 分析确定元素组成, 如图5(a), (b), (c)中可以看出不同方法制备的ZnMnO3/N-CNT催化剂中存在C, N, O、Zn和Mn元素. 图5(e)中O 1s图谱532.4和533.3 eV的分峰可以表明C=O和C―O键的存在. 图5(f)为N 1s 谱图, 存在氧化态氮(403.2 eV)、石墨氮(401.5 eV)、吡啶氮(398.2 eV)、和吡咯氮(400.1 eV) 4种氮, 表2总结了4种氮在样品中的具体含量. 研究表明, 吡啶氮旁边的碳原子作为氧分子吸附的活性位点起着重要作用, 这是因为氧分子首先吸附在吡啶氮N旁边的碳原子作为ORR的初始步骤 [12]. 此外, 吡咯氮位于碳层边缘伴有结构缺陷, 能够提供更多的活性位点. 通过比较发现水热法制备的ZnMnO3/N-CNT催化剂具有大量吡啶氮和吡咯氮, 这可能会提高其ORR性能.
|
图 5 溶胶-凝胶(a)、水热(b)、共沉淀(c)法制备的ZnMnO3/N-CNT催化剂XPS全谱及C 1s (d)、O 1s (e)、N 1s (f)、Mn 2p (g)能谱图 Fig.5 XPS full spectra of ZnMnO3/N-CNT catalysts prepared by sol-gel (a), hydrothermal (b), and co-precipitation (c) and XPS patterns of C 1s (d), O 1s (e), N 1s (f), Mn 2p (g) |
| 表 2 催化剂中4种类型氮在元素总量中的具体原子含量 Table 2 Specific atomic content of the four types of nitrogen in the catalyst in the total number of elements |
在电解液氧气饱和的情况下对催化剂样品进行电化学性能测试. 图6(a)为样品的CV曲线, 从图中可以看出所有样品均具有明显的氧化还原峰, 说明样品均具有氧还原性能, 其中水热法制备的ZnMnO3/N-CNT催化剂的氧还原电位(0.62 V)更正, 说明其ORR活性更高. 图6(b)为样品的ORR曲线, 基于起始电势(Eonset)和半波电势(E1/2)比较, 水热法制备的ZnMnO3/N-CNT催化剂相对于其它方法制备的催化剂ORR性能更好, 催化活性更高. 与商业Pt/C催化剂相比, 水热法制备的ZnMnO3/N-CNT催化剂的起始电势(Eonset)和半波电势(E1/2)均高于Pt-C, 但其极限电流密度相对较低. 水热法制备的ZnMnO3/N-CNT催化剂的优异ORR性能可能是由于其更大的比表面积和更高的吡啶氮提供了更多活性反应位点, 有助于催化氧化.

|
图 6 ZnMnO3/N-CNT催化剂循环伏安图及极化曲线 Fig.6 Cyclic voltammogram and polarization curves of ZnMnO3/N-CNT catalyst |
图7是不同方法制备的ZnMnO3/N-CNT催化剂在0.1 mol∙L−1 KOH溶液中在转速为400、600、800、1 000、1 200、1 400、1 600、1 800和2 000 r∙min−1下的ORR极化曲线. 由图可以看出, 转速的提升主要影响的数据是电流密度, 这是因为转速越高传质阻力越小.

|
图 7 ZnMnO3/N-CNT催化剂不同转速(r∙min−1)极化曲线(a 溶胶-凝胶; b 水热; c 共沉淀)和K-L曲线(d) Fig.7 Polarization curves at different rotational speeds (r∙min−1) of ZnMnO3/N-CNT catalysts prepared by sol-gel (a); hydrothermal (b); and co-precipitation (c); and the K-L curves (d) |
此外, 通过不同转速LSV曲线在电压为0.6 V时的数据计算出了各催化剂的电子转移数n. 结果表明, 水热法、溶胶-凝胶法和共沉淀法制备的ZnMnO3/N-CNT催化剂的n值分别为1.91、1.63、1.73.
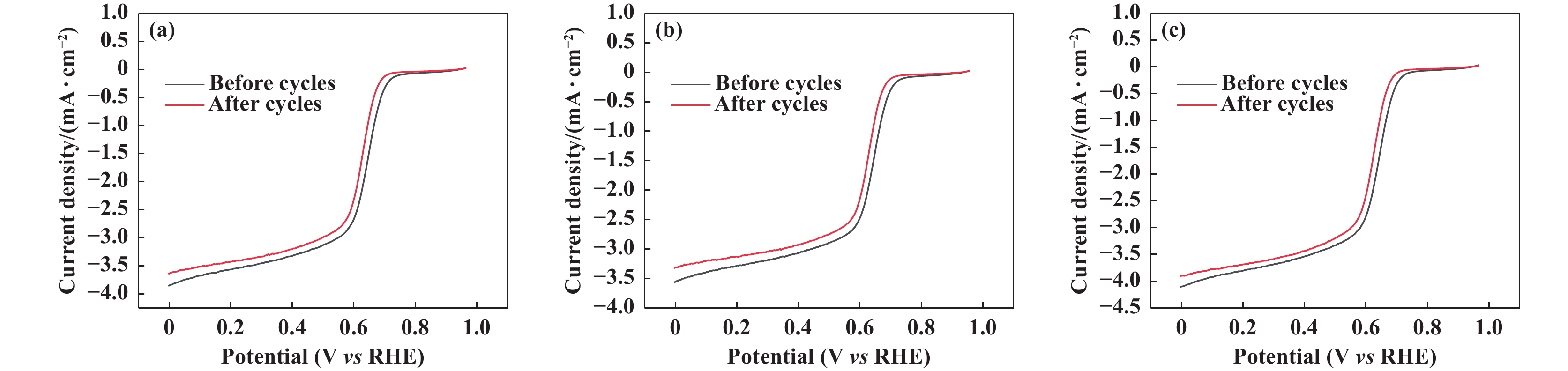
除了催化活性外, 稳定性是催化剂应用中的另一个重要指标. 将催化剂在扫描速率为10 mV·s−1条件下进行200次CV循环, 然后再次进行LSV测试, 得到如图8所示的极化曲线. 由图8可以看出, 不同方法制备的ZnMnO3/N-CNT催化剂循环后的极限电流密度衰减较小, 循环前后的半波电势仅相差约2 mV, 表明所有方法制备出的ZnMnO3/N-CNT催化剂均显示出了优良的稳定性.
|
图 8 ZnMnO3/N-CNT催化剂((a) 溶胶-凝胶; (b) 水热; (c) 共沉淀)经过200次循环前后的极化曲线 Fig.8 Polarization curves before and after 200 cycles of ZnMnO3/N-CNT catalysts prepared by sol-gel (a); hydrothermal (b); and co-precipitation (c) |
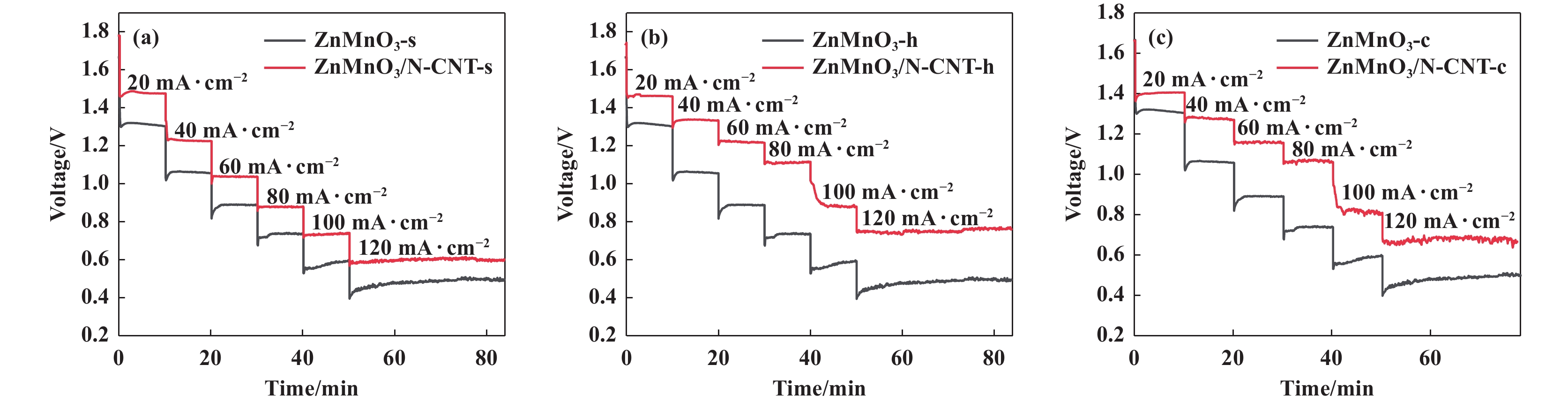
由图9可以看出, 与低电流密度相比, 电池的放电电压在高电流密度下都出现下降趋势. 与无碳纯ZnMnO3相比, 不论何种方法所制备的ZnMnO3/N-CNT催化剂的放电电压都明显得到提升, 尤其水热法所制备的ZnMnO3/N-CNT催化剂随着电流密度的增加, 放电电压降低最小, 在高的电流密度下放电电压相对稳定这与CV及LSV得到的结果一致. 样品在高的电流密度下出现了小幅度的波动, 这是由于采用不同的方法, 所制备的ZnMnO3的粒径大小有所不同, 正如SEM及TEM所示, ZnMnO3部分附着于碳纳米管外壁部分附着于碳纳米管内壁所以引起了在高电流密度下的小幅度波动.
|
图 9 ZnMnO3/N-CNT催化剂((a) 溶胶-凝胶法; (b)水热法; (c) 共沉淀法)恒流放电图 Fig.9 Constant current discharge plots of ZnMnO3/N-CNT catalysts prepared by sol-gel (a); hydrothermal (b); and co-precipitation (c) |
通过计算, 得到水热法、溶胶-凝胶法、共沉淀法所制备的ZnMnO3/N-CNT催化剂制成的电池释放的总能量分别为55.59、48.07和52.09 MWh·cm−2, 可以看出水热法所制备的ZnMnO3/N-CNT催化剂所释放的能量最高.
3 结论综上所述, 采用不同方法制备的ZnMnO3/N-CNT催化剂纳米颗粒均无明显团聚现象, 且碳纳米管的结构保留完整, 其中水热法制得样品比表面积更大, 具有较大的孔容, 能够产生更多的活性位点; 水热法的起始电势和半波电势高于共沉淀法、溶胶-凝胶法以及商业Pt-C催化剂, 具有优异的ORR催化活性; 3种方法制得的催化剂在铝-空气电池中的放电电压均有明显提升, 但水热法制备的催化剂拥有更高的放电电压且释放的能量最高.
| [1] |
Perovskite oxides: Preparation, characterizations, and applications in heterogeneous catalysis[J]. ACS Catal, 2014, 4(9): 2917–2940.
DOI:10.1021/cs500606g |
| [2] |
Synergistic bifunctional catalyst design based on perovskite oxide nanoparticles and intertwined carbon nanotubes for rechargeable zinc-air battery applications[J]. ACS Appl Mater Interfaces, 2015, 7(1): 902–910.
DOI:10.1021/am507470f |
| [3] |
Tailoring the ORR and HER electrocatalytic performances of gold nanoparticles through metal-ligand interfaces[J]. J Mater Chem A, 2019, 7: 20435.
DOI:10.1039/C9TA90203A |
| [4] |
Nitrogen-doped carbon coupled FeNi3 intermetallic compound as advanced bifunctional electrocatalyst for OER, ORR and Zn-air batteries[J]. Appl Catal B:Environ, 2020, 268: 118729.
DOI:10.1016/j.apcatb.2020.118729 |
| [5] |
Self-catalyzed growth of Co, N-codoped CNTs on carbon-encased CoSx surface: A noble-metal-free bifunctional oxygen electrocatalyst for flexible solid Zn-air batteries[J]. Adv Funct Mater, 2019, 29: 1904481.
DOI:10.1002/adfm.201904481 |
| [6] |
Hierarchical porous ZnMnO3 yolk-shell microspheres with superior lithium storage properties enabled by a unique one-step conversion mechanism[J]. RSC Adv, 2018, 8(55): 31388–31395.
DOI:10.1039/C8RA05871G |
| [7] |
Structure design of long-life spinel-oxide cathode materials for magnesium rechargeable batteries[J]. Adv Mater, 2021, 33(7): e2007539.
DOI:10.1002/adma.202007539 |
| [8] |
Facile synthesis of porous ZnMnO3 spherulites with a high lithium storage capability[J]. Electrochim Acta, 2015, 151: 56–62.
DOI:10.1016/j.electacta.2014.11.020 |
| [9] |
Room temperature operation of magnesium rechargeable batteries with a hydrothermally treated ZnMnO3 defect spinel cathode: Articles[J]. Electrochemistry, 2022, 90(2): 027005.
DOI:10.5796/electrochemistry.21-00125 |
| [10] |
Stabilization of ZnMnO3 phase from sol-gel synthesized nitrate precursors[J]. J Sol-gel Sci Techn, 2010, 53(2): 141–147.
DOI:10.1007/s10971-009-2067-2 |
| [11] |
Synthesis, characterization and investigation of photocatalytic activity of ZnMnO3/Fe3O4 nanocomposite for degradation of dye Congo red under visible light irradiation[J]. Int J Ind Chem, 2020, 11: 1–12.
|
| [12] |
Active sites of nitrogen-doped carbon materials for oxygen reduction reaction clarified using model catalysts[J]. Science, 2016, 351(6271): 361–365.
DOI:10.1126/science.aad0832 |
 2024, Vol. 38
2024, Vol. 38


