随着经济的发展, 化石能源过度使用产生了大量CO2等对环境不利的气体. CO2是温室气体, 其大量排放导致全球变暖, 海平面上升从而造成重大的环境问题. 中国目前是全球最大的CO2排放国, 约占CO2总排放量的29.4%[1]. 人们暂时还未找到能完全替代化石能源的其他物质, 根据《2021年世界能源展望》, 化石能源的总需求在短期内仍将继续上升[2]. 2020年9月中国政府向全球承诺在2030年达到碳达峰, 2060年达到碳中和. CCS(碳捕获和储存)和CCUS(碳捕获、利用和储存)是实现“双碳”目标的主要手段, 由于CCS的成本高, 且储存后有泄露的风险, 科学家们将研究重点转向CCUS. 在CCUS中, 如何将CO2再利用受到科学家们的广泛关注[3]. 甲醇是一种清洁的汽油和柴油替代燃料, 是重要化学品的生产原料, 其在“液态阳光”中有着不可忽视的作用[4−5], 因此人们致力于寻找一种能将CO2高效转化为甲醇的催化剂. CO2转化为甲醇有不同的途径, 包括多相催化、均相催化、酶催化、光催化、电催化, 考虑到生产率、稳定性、操作条件、成本、技术成熟度等方面, 多相催化和电催化是大规模还原CO2为CH3OH最有希望的方法[6].
CO2制甲醇的多相催化剂主要是Cu基催化剂、贵金属基(Pd、Pt)催化剂、ZnO基二元固溶体催化剂、In2O3基催化剂、Ga基金属间化合物催化剂和MOF/ZIF衍生纳米结构催化剂[7]. 目前, CO2加氢制甲醇主要为Cu基催化剂, Cu基催化剂成本低并能有效地合成甲醇[8]. 2020年9月, 世界首台5 000 t/a 二氧化碳加氢制甲醇工业试验装置在海南省稳定运行. 该项目采用了由中国科学院上海高等研究院高鹏团队构建的纳米限域结构的铜基催化剂[9]. 但铜基催化剂同时具有逆水煤气变换反应活性, 高温时主要生成CO, 甲醇选择性降低.
以Pd为代表的贵金属基催化剂具有低温CO加氢生成甲醇活性[10], 在这一基础上研究者们将Pd基催化剂用于CO2加氢生成甲醇反应. Saputro等[11]用密度泛函理论计算研究了Pdx簇上CO2加氢生成甲醇的过程, 研究发现只有使用较小尺寸的Pdx簇才能有效地吸附CO2. 贵金属基催化剂虽然对H2有很好的解离脱附能力, 但吸附活化CO2能力差, 研究者们希望在合适的载体上负载贵金属来解决这一问题. 在ZnO[12−13]、In2O3[14]、CeO2[15]上负载Pd都大大地提高了其催化性能. Lee等[16]在ZnZrOx固溶体中负载Pd, 发现Pd的加入生成更多的氧空位, 从而促进甲醇的生成. Qu等[17]通过研究Pd与Ga2O3之间的金属载体相互作用, 设计更好的甲醇合成催化剂. Rui等[14]制备了高度分散的Pd/In2O3催化剂, 3.6 nm的Pd颗粒有更好的氢气解离吸附能力, Pd和In2O3界面位具有较高的CO2吸附和氢气解离活性, 这些都使得催化剂具有优异的CO2加氢制甲醇性能.
金属有机骨架材料(MOFs)由有机配体和金属簇组装而成, 它具有高孔隙率、低密度、大比表面积等优点[18], 已有研究证明MOF材料可以用于CO2加氢制甲醇[19]. 沸石咪唑酯骨架材料(ZIF)材料是MOFs的一种, 它是一种四面体框架, 由有机咪唑酯交联到过渡金属上[20]. Hu等[21]利用ZIF-8合成了ZnO/Cu催化剂, 在260 ℃、4.5 MPa条件下, 甲醇的时空产率可达到933 g/(kgcat·h), 亚纳米ZnO的形成使Cu-ZnO界面最大化, 有益于甲醇的合成; Li等[22]将ZIF-8作为涂层, 使其在ZnO纳米棒上生长, 特殊的结构可以负载Pd亚纳米粒子, 合成的Pd-Zn@Z8-1催化剂在250~290 ℃、4.5 MPa下的甲醇产量为12.1~19.8 g/(gPd·h), 并提出了PdZn合金相与表面氧缺陷协同催化合成甲醇的机理.
CO2加氢制甲醇的纯金属体系结合CO2能力较弱, 催化活性较低, 金属氧化物能够吸附和解离CO2, 具有一定的CO2合成甲醇活性. 金属-氧化物界面间的相互作用有利于在氧化物表面形成氧缺陷位点, 而氧缺陷位可以增强其对CO2的活化. 已有研究证明将Pd负载在In2O3[14]、ZnO[12]、CeO2[23]等不同的金属氧化物上时, 其CO2加氢制甲醇的催化活性较Pd有一定程度的提高. Pd/ZnO催化剂中, ZnO上的氧空位通过向CO2转移电子而增强了与CO2的相互作用, 这一定程度上解决了Pd不能很好吸附解离CO2的问题, 与其他载体不同的是在一定条件下ZnO载体可以和Pd形成活性位PdZn合金.
将不同比例的硝酸钯还原到ZIF-8焙烧的Zn/C-N载体上, 制备出Pd/Zn/C-N催化剂, 探究其对二氧化碳加氢制甲醇活性与选择性的影响.
1 实验部分 1.1 催化剂制备 1.1.1 载体的制备称8.92 g的Zn(NO3)2·6H2O和9.86 g的2-甲基咪唑分别溶解于300 mL的甲醇中, 将Zn(NO3)2·6H2O的甲醇溶液用玻璃棒引流至2-甲基咪唑的甲醇溶液中, 室温搅拌10 min, 再室温静置24 h, 离心后用甲醇洗3次, 得到的白色沉淀利用烘箱60 ℃下干燥12 h, 研磨成粉末状, 即为ZIF-8. 将ZIF-8用N2管式炉在800 ℃焙烧5 h后得到Zn/C-N(N2流量为20 mL/min, 以1 ℃/min从室温升至40 ℃, 保持30 min, 接着以5 ℃/min升温至600 ℃, 最后以2 ℃/min升温至800 ℃, 保持5 h后自然降温).
1.1.2 催化剂的制备利用NaBH4还原法制备Pd理论负载量为0.05%、0.1%、0.25%、0.5%Pd/Zn/C-N催化剂. 0.05%Pd/Zn/C-N催化剂制备过程如下: 称取焙烧得到的Zn/C-N载体1.03 g分散于20 mL去离子水中, 将0.023 g硝酸钯溶液(硝酸钯溶液中钯的质量分数为4%~5%)加去离子水至10 mL, 再倒入Zn/C-N悬浮液中, 室温搅拌1 h后立即倒入10 mL NaBH4溶液(0.1 mg/mL), 再室温搅拌2 h, 离心后得到的黑色沉淀用去离子水洗涤3次, 接着将其在50 ℃下干燥12 h, 最后用N2管式炉在300 ℃焙烧2 h后得到0.05%Pd/Zn/C-N催化剂(N2流量为20 mL/min, 以1 ℃/min从室温升至40 ℃, 保持30 min, 接着以1 ℃/min升温至300 ℃, 保持2 h后自然降温). 制备0.1%Pd/Zn/C-N催化剂, 硝酸钯溶液质量为0.045 g, 硼氢化钠溶液加入量为0.2 mg/mL, 10 mL. 制备0.25%Pd/Zn/C-N催化剂, 硝酸钯溶液质量为0.12 g, 硼氢化钠溶液加入量为0.4 mg/mL, 10 mL, 制备0.5% Pd/Zn/C-N催化剂, 硝酸钯溶液质量为0.23 g, 硼氢化钠溶液加入量为0.8 mg/mL, 10 mL, 其余步骤与上述一致.
ICP测试结果表明Pd/Zn/C-N催化剂中Pd实际负载量为0.02%、0.05%、0.1%、0.3%, 按实际负载量对催化剂分别命名为0.02%Pd/Zn/C-N、0.05%Pd/Zn/C-N、0.1%Pd/Zn/C-N、0.3%Pd/Zn/C-N.
1.2 催化剂的表征X-射线粉末衍射(XRD): 为得到待测样品的物相结构, 在德国布鲁克斯公司生产的Brucker Advanced D8 型X-射线粉末衍射仪上进行测试分析. 该仪器使用了Cu 靶Kα射线(λ = 0.150 6 nm), 管电压是40 kV, 管电流是40 mA, 扫描范围是10°~80°, 扫描步长是0.0167°. 利用Jade 6软件对样品和标准PDF卡片进行比对以分析样品的物相组成.
氢气程序升温还原(H2-TPR): 利用BELCAT-Ⅱ全自动化学吸附仪对样品进行氢气程序升温测试, 以分析测试样品的还原性能. 称取50 mg催化剂装入玻璃管中, 首先通入Ar(30 mL/min), 接着升温至300 ℃并保持60 min(5 ℃/min), 以除去样品中的水分. 待样品自然降温至50 ℃后, 通10% H2/Ar(30 mL/min)吹扫30 min, 基线平稳后升温至600 ℃并保持30 min(10 ℃/min).
二氧化碳程序升温脱附(CO2-TPD): 利用BELCAT-Ⅱ全自动化学吸附仪对样品进行二氧化碳程序升温脱附, 以分析测试样品的碱性位点强弱、数量等信息. 称取50 mg催化剂装入玻璃管中, 通入He(30 mL/min)升温至300 ℃并保持30 min (5 ℃/min), 以除去样品中的水分. 待样品自然降温至100 ℃后, 保持10 min, 切换10% CO2/He(30 mL/min)吸附60 min, 基线平稳后重新切换He(30 mL/min)并保持30 min, 最后程序升温至600 ℃并保持30 min (10 ℃/min).
X-射线光电子能谱(XPS): 为得到样品的表面元素组成和价态, 使用了美国Thermal Electron公司生产的VG Mulitilab 2000型仪器对样品进行分析. 该仪器使用Al(Kα)靶, 在处理测量数据时以污染碳的C 1s峰结合能值(284.8 eV)为标准.
扫描透射电子显微镜(STEM): 样品的形貌表征以及粒径分布统计由美国Thermo Frisher公司生产的Talos F200X型号扫描透射电子显微镜完成. 将少量的催化剂置于研钵中研磨成细粉后分散于无水乙醇中, 超声处理约30 min后用毛细管蘸取少量溶液滴于铜管网中, 用红外灯将其烘干, 即可进行电镜测试.
电感耦合等离子体发射光谱(ICP-OES): 称取0.05 g样品于PTFE容器中, 加入5 mL浓硝酸、3 mL HCl、1 mL HF、2 mL H2O2, 密封放在微波消解炉中, 1 200 W下升温20 min至130 ℃, 保持5 min, 升温20 min至180 ℃, 保持40 min, 冷却至室温. 将冷却后的溶液转移至25 mL塑料容量瓶中, 最后用去离子水定容, 依次测试消解好的溶液, 超出曲线范围的稀释后再测试.
N2物理吸-脱附: 通过美国麦克仪器公司ASAP 2020 HD88仪器对载体和催化剂的比表面积、孔容和孔径进行表征. 测试前, 催化剂需要在200 ℃真空处理8 h以上, 待真空度达到1.33×10−4 Pa后, 用液氮(−196 ℃)进行冷却后测试. 采用(BET)和(BJH)模型分别测定了比表面积和孔径、孔体积分布.
1.3 催化剂的CO2加氢活性测试催化剂的反应活性测试在管式固定床反应器(长53 cm, 内径8 mm)中进行. 催化剂用量为0.2 g, 反应气体为22.5%CO2/67.5%H2/10.0%N2混合气, 混合气流量为20 mL/min, 空速为6 L/(gcat·h), 以2 ℃/min的升温速率升温至反应温度后进行活性测试. 反应体系的尾气通入Agilent GC 3000进行在线分析, 液相产物在冷肼收集后使用Agilent GC 4890进行离线分析. 相关计算公式如下所示:
| $ {X}_{\rm{CO}_{2}}\left(\%\right)=\frac{{n}_{\rm{CO}_{2,in}}-{n}_{\rm{CO}_{2,\rm out}}}{{n}_{\rm{CO}_{2,\rm in}}}\times 100 $ |
| $ {S}_{\rm {CH}_{4}}\left(\%\right)=\frac{{n}_{\rm {CH}_{4, out}}}{{n}_{\rm {CO}_{2,\rm in}}-{n}_{\rm {CO}_{2,\rm out}}}\times 100 $ |
| $ {S}_{\rm CO}\left(\%\right)=\frac{{n}_{\rm {CO}_{\rm out}}}{{n}_{\rm {CO}_{2,in}}-{n}_{\rm {CO}_{2,out}}}\times 100 $ |
| $ {S}_{{\rm C}_{n}}\left(\%\right)=\frac{{n}_{\rm product,out}\times\rm carbon\;number}{{n}_{\rm {CO}_{2,in}}-{n}_{\rm {CO}_{2,out}}}\times 100 $ |
| $ {S}_{\rm {C}_{2+}}\left(\%\right)={S}_{\rm {C}_{2}}+{S}_{\rm {C}_{3}}+{S}_{\rm {C}_{4}} $ |
| $ {S}_{\rm MeOH}\left(\%\right)=100-{S}_{\rm {CH}_{4}}-{S}_{\rm {C}_{2+}}-{S}_{\rm CO} $ |
| $\begin{aligned} {{\rm{STY}}}_{ \rm MeOH} \left( {\rm{mmol}}/{{\rm{g}}}_{{\rm{cat}}} \cdot {\rm{h}} \right) = \frac{{\rm{GHSV}} \times {\varphi }_{\rm{CO}_{2}} \times {S}_{ {\rm{MeOH}}} \times 1\,000}{22.4\;{\rm{L/mol}}} \end{aligned} $ |
式中GHSV为反应空速, 单位L/(gcat·h);
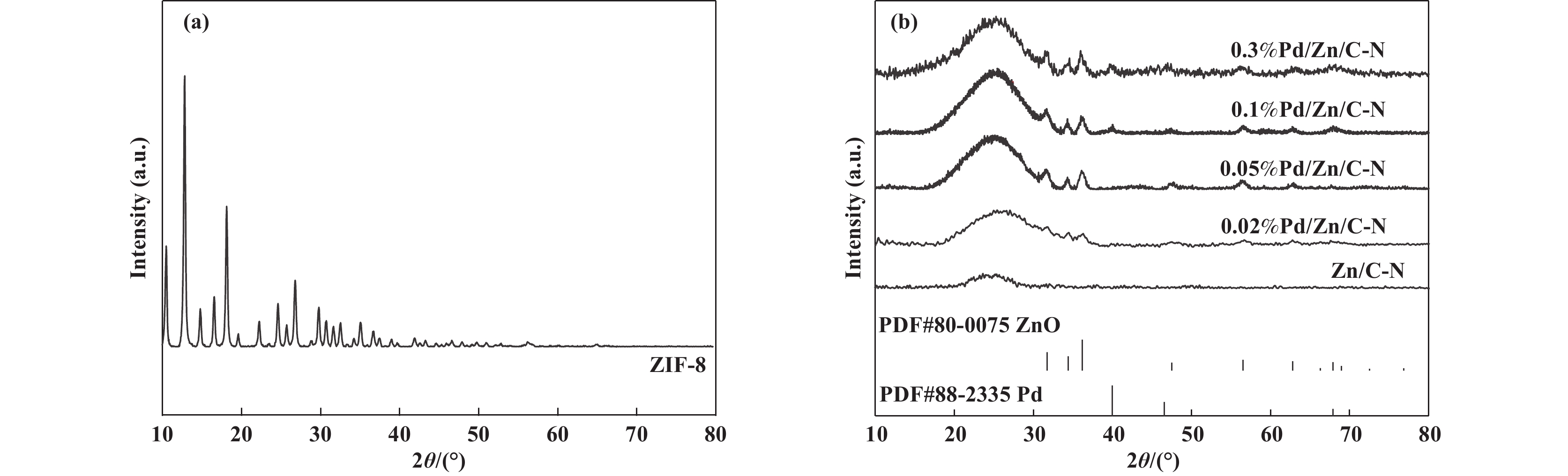
对ZIF-8、Zn/C-N和Pd/Zn/C-N的物相组成进行了XRD表征. 根据文献报道的方法合成了ZIF-8, XRD谱图如图1(a)所示, 合成的ZIF-8与文献报道的XRD谱图一致[24], 证明成功制备了ZIF-8.
|
图 1 (a) ZIF-8和(b)Pd/Zn/C-N的XRD谱图 Fig.1 XRD Patterns of (a) ZIF-8 and (b) Pd/Zn/C-N |
制备的4个催化剂和Zn/C-N的XRD谱图如图1(b)所示, ZIF-8在800 ℃焙烧后得到的Zn/C-N只有一个在25°左右的石墨碳峰, 部分Zn在焙烧过程中以金属Zn的形式挥发, 剩下的以无定形的形式存在, 故没有观察到关于Zn的特征衍射峰. 在Zn/C-N上分别负载0.02%、0.05%、0.1%、0.3%的Pd后, 石墨碳峰一直存在, 并显著增大, 说明金属Pd的加入有利于催化剂石墨碳化过程. 4个Pd/Zn/C-N催化剂在31.7°、34.4°、36.2°均出现了ZnO的特征衍射峰, 而Zn/C-N没有观察到关于ZnO的特征衍射峰, 这说明Pd促进了结晶态ZnO的形成, 这是因为Pd与Zn相互作用, 使得Zn不容易挥发, 而以结晶态ZnO形式存在于催化剂中. 0.02%Pd/Zn/C-N和0.05%Pd/Zn/C-N的XRD结果未发现Pd的衍射峰, 可能是由于0.02%和0.05%的Pd含量低于XRD仪器检测限或Pd分散性较好. 随着Pd负载量增加至0.1%, 可以观察到金属Pd的特征衍射峰, 且峰强度随负载量增加逐渐增强, 说明其结晶度增加. 4种催化剂中均没有观察到PdZn合金的衍射峰.
2.2 催化剂元素含量(ICP-OES)对所制备的4个催化剂进行了ICP-OES测试(见表1), Pd含量低于理论计算的负载量, 这可能是由于在催化剂洗涤过程中部分Pd溶解到溶剂中有所损失. 催化剂中Zn含量在Pd负载后略有增加, 也证明了Pd与Zn相互作用, 使得Zn不容易挥发.
| 表 1 Pd/Zn/C-N催化剂的ICP-OES数据 Table 1 Summary of ICP-OES data for Pd/Zn/C-N catalysts |
通过STEM对4个催化剂的形貌进行表征并统计了Pd颗粒的粒径分布, 图2是具有代表性的4种催化剂的STEM图及Pd粒径的分布图, Pd的粒径分布均统计了200个以上Pd纳米颗粒. 图2中黑色颗粒通过测量得到它的晶格间距是0.23 nm, 归属于Pd的(111)晶面, 从图上可以明显地观察Pd纳米粒子负载于ZnO上, 0.02%Pd/Zn/C-N催化剂(图2(a))的Pd颗粒明显较少, 0.05%Pd/Zn/C-N催化剂(图2(b))中的Pd颗粒分布得最均匀, 这也解释了XRD中没有Pd的特征衍射峰的原因. 随着Pd的负载量的逐渐增加, Pd颗粒逐渐团聚, Pd颗粒的粒径也从0.02%Pd/Zn/C-N(图2(a))中的4.9 nm增大到0.3%Pd/Zn/C-N(图2(d))中的7.8 nm, 这可能导致催化剂的性能变差.

|
图 2 Pd/Zn/C-N催化剂的STEM图及Pd颗粒分布统计图(a) 0.02% Pd/Zn/C-N; (b) 0.05%Pd/Zn/C-N; (c) 0.1%Pd/Zn/C-N; (d) 0.3%Pd/Zn/C-N Fig.2 STEM And distribution of Pd nanoparticles profiles of Pd/Zn/C-N catalysts(a) 0.02% Pd/Zn/C-N; (b) 0.05%Pd/Zn/C-N; (c) 0.1%Pd/Zn/C-N and (d) 0.3%Pd/Zn/C-N |
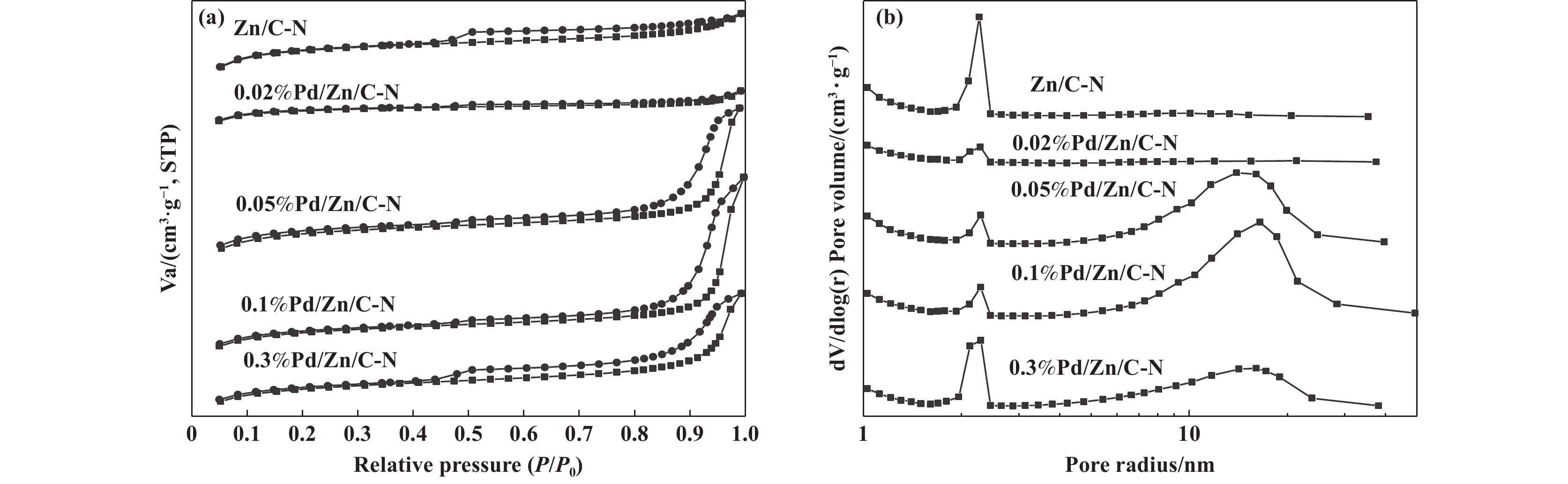
通过N2物理吸附脱附表征探究分析了催化剂和载体的比表面积和孔结构, 图3(a)是氮气吸附脱附等温曲线, 图3(b)是孔径分布图, 表2是根据N2吸附脱附等温线计算的BET比表面积和空体积数据. 图3(a)中4种催化剂及载体均表现出IV型吸附等温线和H4型滞后环, 这表示催化剂及载体中存在由片状或层状结构产生的介孔. 图3(b)中Zn/C-N和0.02%Pd/Zn/C-N的孔径集中在2 nm, 而0.05%Pd/Zn/C-N、0.1%Pd/Zn/C-N和0.3%Pd/Zn/C-N的孔径集中在2和10.5 nm, 这是因为Pd(NO3)2具有酸性, 腐蚀Zn/C-N载体后形成了较大的孔, 0.02%Pd/Zn/C-N中使用的Pd(NO3)2量最少, 不足以腐蚀Zn/C-N. Zn/C-N载体上负载Pd后, 催化剂的比表面积降低, 这是因为Pd堵塞了催化剂部分孔道.
|
图 3 Pd/Zn/C-N催化剂的(a)氮气吸附脱附等温线和(b)孔径分布 Fig.3 (a) Nitrogen adsorption-desorption isotherms and (b) pore size distribution of Pd/Zn/C-N catalysts |
| 表 2 Pd/Zn/C-N催化剂的结构特性 Table 2 Textural properties of Pd/Zn/C-N catalysts |
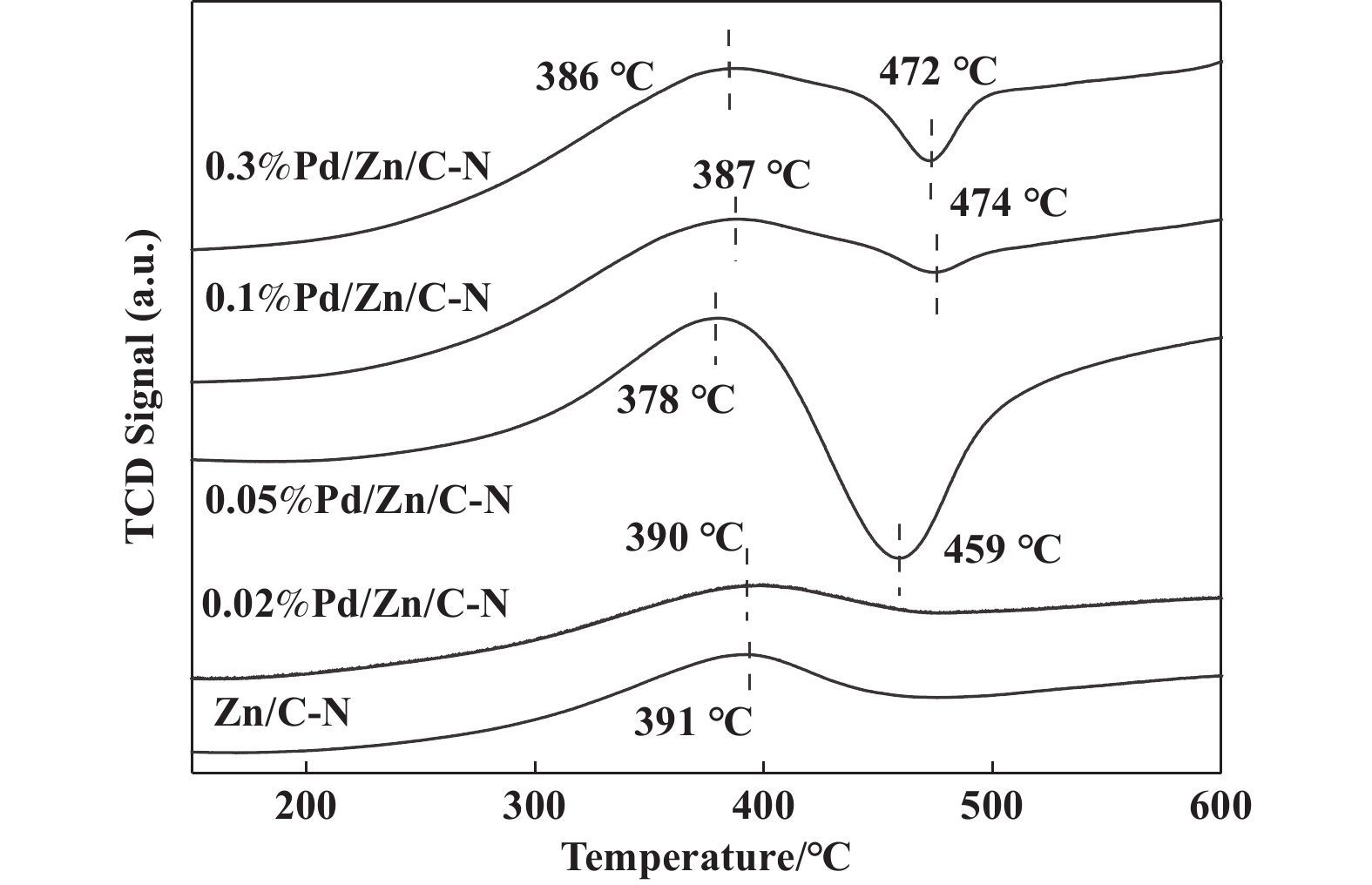
利用H2-TPR对催化剂的还原性能进行探究. 如图4所示, 可以看到Zn/C-N 在391 ℃温度出现还原峰, 将其归属于表面ZnO的还原峰[25]. 图中4种Pd/Zn/C-N催化剂在380 ℃左右的还原峰均归属于表面ZnO的还原峰, 470~600 ℃左右还原峰归属于ZnO的体相还原峰. 负载Pd后可以看出表面ZnO的还原峰明显增强, 且还原峰略向低温方向移动, 这是由于Pd表面的氢溢流造成的. Pd 表面吸附的氢气解离为氢原子, 溢流到ZnO表面, 促进了表面ZnO的还原[26]. 相比于其他Pd负载量催化剂, 0.05%Pd/Zn/C-N催化剂的表面ZnO还原峰更加尖锐, 这说明0.05%Pd/Zn/C-N 催化剂上的Pd分散的更好, 粒径更加均一, 导致Pd与ZnO的相互作用更强, 这与STEM的结果一致(图2(b)). 另外0.05%Pd/Zn/C-N催化剂在470 ℃左右信号降至基线以下, 即出现负峰, 这说明催化剂在升温过程中放出氢气, 这可能是由于在升温过程中载体里碳与氢气反应生成甲烷, 甲烷在TCD上显示为副峰. Pd 在低温下0.02%Pd/Zn/C-N 催化剂与Zn/C-N载体的H2-TPR差别不大, 这是因为太低Pd的负载量不能明显改变Zn/C-N的还原性能.
|
图 4 Pd/Zn/C-N催化剂的H2-TPR谱图 Fig.4 H2-TPR Profiles of Pd/Zn/C-N catalysts |
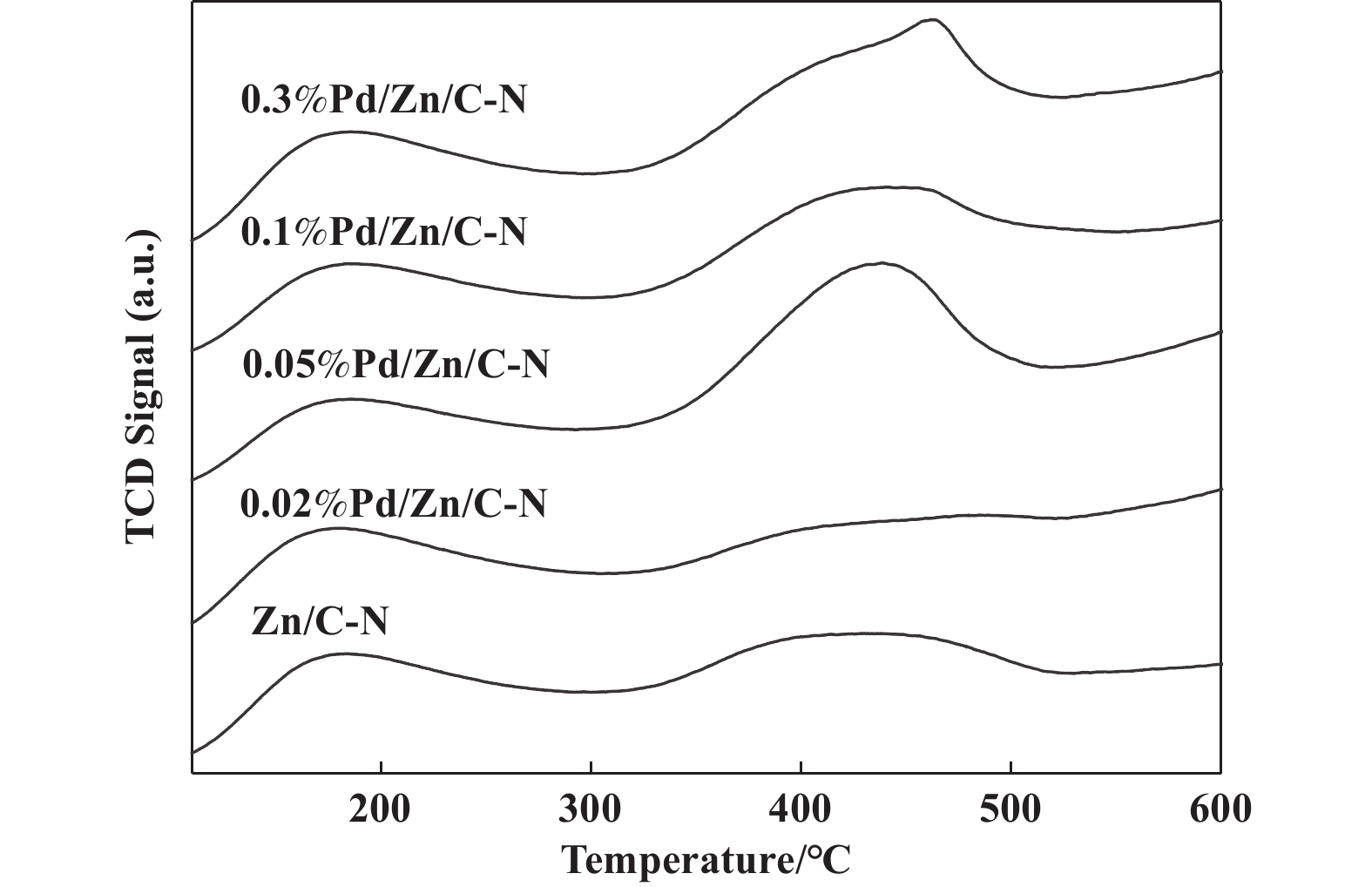
对催化剂进行CO2-TPD表征, 如图5所示, 催化剂具有相似的碱性位点, 180 ℃左右的低温脱附峰是由催化剂表面物理吸附CO2的脱附引起的; 430 ℃左右的高温脱附峰归因于ZnO或者Pd/ZnO界面处CO2的化学吸附[27]. 除了较少0.02% Pd负载量催化剂, 其余负载Pd之后, CO2高温脱附峰均有所增加, 说明适量的Pd有利于CO2的解离吸附.
|
图 5 Pd/Zn/C-N催化剂的CO2-TPD谱图 Fig.5 CO2-TPD Profiles of Pd/Zn/C-N catalysts |
利用XPS对催化剂的表面元素组成以及价态进行分析, Pd/Zn/C-N催化剂的O 1s、Pd 3d、N 1s 和Zn 2p的XPS谱图如图6所示, 相关数据列于表3. 图6(a)是O 1s的XPS谱图, 将其拟合为结合能中心为530.8、531.8、532.5 eV的3个分峰, 分别对应于ZnO晶格中的O2−离子、氧缺陷位点的O2−离子以及化学吸附的氧物种或者表面羟基物种 [28−30], 对所分峰的峰面积进行积分计算, 得到表面氧原子中的不同状态氧的相对含量(表3). 可以明显观察到加入Pd后, 催化剂表面氧含量增加. 且随着Pd负载量的增加, 催化剂表面缺陷氧占总氧含量的比例增加, 这表明Pd的加入促进了氧缺陷的生成, 更有利于 CO2的解离吸附. Pd 3d的XPS图谱由Pd0 3d5/2、Pd0 3d3/2、Pd2+ 3d5/2和Pd2+ 3d3/2 4个峰拟合而成, 其对应的结合能分别是335.8、341.1、337.2和342.5 eV(图6(b)), Pd2+归属于PdO. 由表3可以看到催化剂表面Pd的含量略高于ICP测定值, 这是由于XPS测定的数值为元素表面含量, 这也说明Pd主要负载在催化剂表面. 0.02%Pd/Zn/C-N的Pd2+ 3d峰较其它催化剂向低结合能方向移动, 这可能是因为小颗粒的Pd与Zn相互作用更强. 对于N 1s的XPS图谱, 将其拟合为吡啶氮、吡咯氮和石墨氮3个分峰, 对应的结合能分别为398.5、399.5、400.6 eV[31]. 结合图表可以看到催化剂表面N的含量没有发生明显变化, 但是Pd的负载量增多, 催化剂表面吡啶氮的比例降低, 0.05%Pd/Zn/C-N的吡啶氮的比例最高, 碱性最强, 更易于吸附CO2. 从Zn 2p 峰可以看出加入Pd后, Zn向高结合能方向移动, 这也证实了Pd与ZnO间的相互作用.
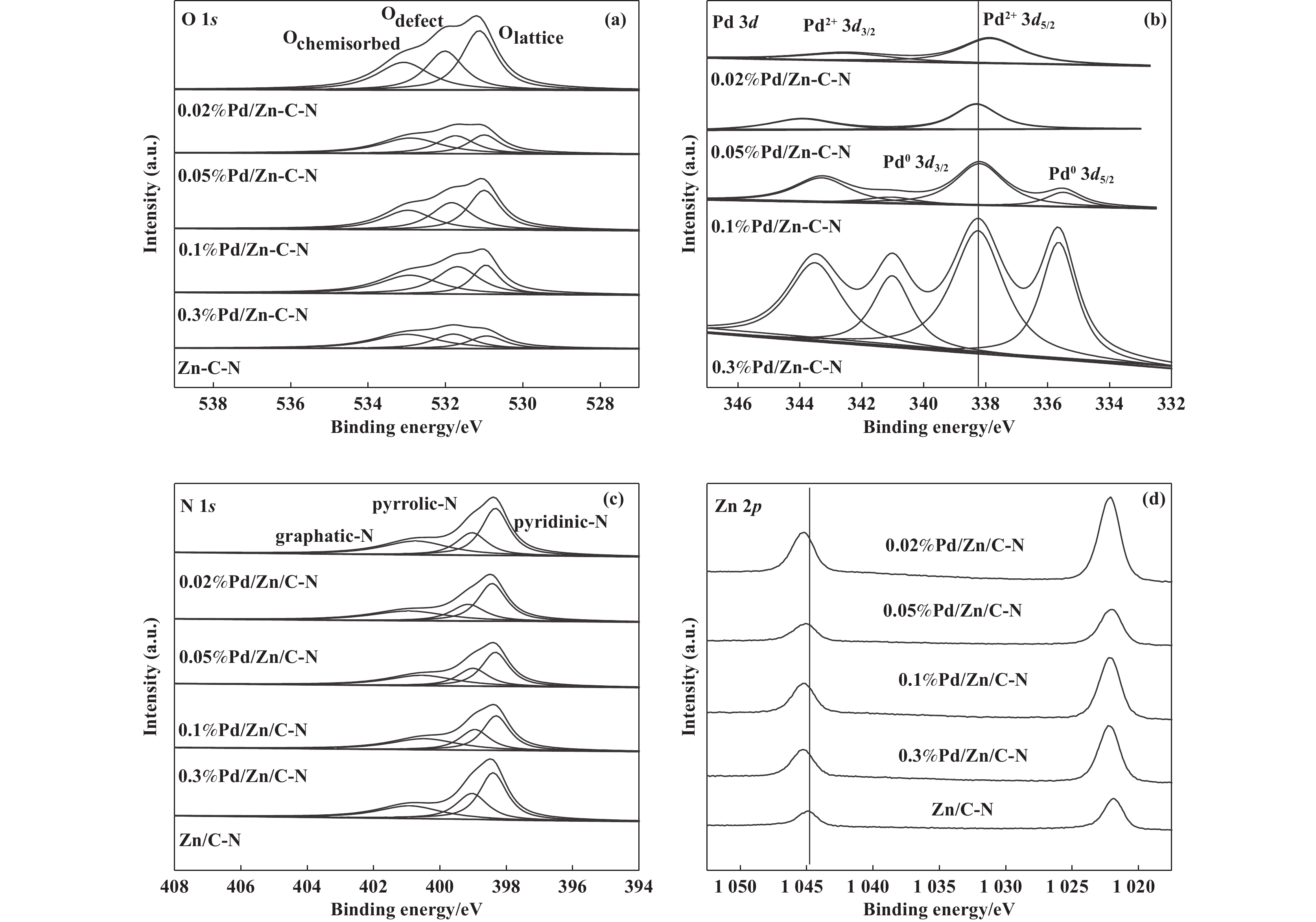
|
图 6 Pd/Zn/C-N催化剂的XPS谱图(a) O 1s; (b) Pd 3d; (c) N 1s; (d) Zn 2p Fig.6 XPS Spectra of Pd/Zn/C-N catalysts (a) O 1s; (b) Pd 3d; (c) N 1s; (d) Zn 2p |
| 表 3 Pd/Zn/C-N催化剂的XPS数据 Table 3 Summary of XPS data for Pd/Zn/C-N catalysts |
对制备的Pd/Zn/C-N催化剂进行了CO2加氢性能测试. 从图7可以看出, 随着反应温度的升高, 4种催化剂的CO2转化率均逐渐增加. 这是由于动力学影响, 温度越高, CO2分子和H2分子运动得越剧烈, 反应速率更快. 4种催化剂的甲醇选择性随温度的升高均逐渐下降, CO选择性逐渐上升, 这是由于受热力学的影响, CO2加氢制甲醇是放热反应, 因此低温更加有利于甲醇的生成; 而逆水煤气变换(RWGS)反应是吸热反应, 高温更加有利于CO的生成. 随着Pd负载量的增大, CO2转化率有所增加, 这是因为高Pd负载量具有更多的活性位点, 高含量的Pd表面氧空穴数量更多, 更有利于CO2解离吸附, CO2转化率更高. 但高负载量时催化剂中Pd发生聚集, 不能被充分利用, 所以CO2转化率增加并不明显. 以275 ℃反应数据为例, 0.02%Pd/Zn/C-N、0.05%Pd/Zn/C-N、0.1%Pd/Zn/C-N、0.3%Pd/Zn/ C-N催化剂的CO2转化率依次为3.7%、6.6%、6.8%和 7.1%. 随着Pd负载量的增大, 甲醇选择性有所下降, CO选择性上升, 这说明催化剂选择性受Pd纳米颗粒大小影响显著, 小颗粒Pd更有利于甲醇生成. 这主要是因为Pd纳米颗粒越小, 与ZnO相互作用越强, 更有利于甲醇生成. 同样以275 ℃反应数据为例, 0.02%Pd/Zn/C-N、0.05%Pd/Zn/C-N、0.1%Pd/Zn/C-N、0.3%Pd/Zn/C-N催化剂甲醇选择性依次为84.0%、81.5%、65.8%和60.0%. 对载体Zn/C-N进行活性测试, 对比发现在我们的实验条件下, Zn/C-N载体上没有检测到CO2转化, 说明载体Zn/C-N没有CO2转化活性.

|
图 7 (a) 0.02%Pd/Zn/C-N; (b) 0.05%Pd/Zn/C-N; (c) 0.1%Pd/Zn/C-N; (d) 0.3%Pd/Zn/C-N催化剂在不同温度下的催化性能(反应条件: P = 2 MPa, GHSV = 6 L/(gcat·h), T = 250~300 ℃) Fig.7 Performance of catalysts at different temperature (a) 0.02%Pd/Zn/C-N; (b) 0.05%Pd/Zn/C-N; (c) 0.1%Pd/Zn/C-N; (d) 0.3%Pd/Zn/C-N (Reaction condition: P = 2 MPa, GHSV = 6 L/(gcat·h), T = 250~300 ℃) |
用STYMeOH对催化剂进行综合评价(见表4), 0.02%Pd/Zn/C-N, 0.05%Pd/Zn/C-N催化剂在275 ℃有一个STYMeOH的峰值, 这是因为在更高温度下, RWGS反应占据主导地位, 甲醇选择性下降. 以每克Pd上甲醇收率计算, 0.02%Pd/Zn/C-N具有最佳的催化性能, 在T = 275 ℃, P = 2 MPa, GHSV = 6 L/(gcat·h)反应条件下, CO2转化率为3.7%, 甲醇选择性为84.0%, 甲醇时空收率11.0 mol/(gPd·h).
| 表 4 Pd/Zn/C-N催化剂的活性数据 Table 4 Summary of activity data for Pd/Zn/C-N catalysts |
将我们制备的催化剂与文献的Pd/ZnO催化剂CO2加氢活性对比, 如表5所示, 可以看出, 尽管文献的CO2转化率较高, 但文献中使用的催化剂Pd负载量为2.5%~5%, 远高于我们0.05%的Pd负载量, 而我们的甲醇选择性(81.5%)在对比的催化剂中也是最高的, 反应压力也更低, 更有工业化前景.
| 表 5 Pd/ZnO催化剂CO2加氢性能对比 Table 5 Comparison of CO2 hydrogenation activity of Pd/ZnO catalysts |
对我们制备的0.02%Pd/Zn/C-N 和0.05%Pd/Zn/C-N催化剂进行50 h稳定性实验, 结果如图8所示, 可以看出, 在我们测试的条件下 (GHSV=6 L/(gcat·h), P = 2 MPa, H2∶CO2 = 3∶1, T = 275 ℃), 催化剂反应50 h没有明显的失活.
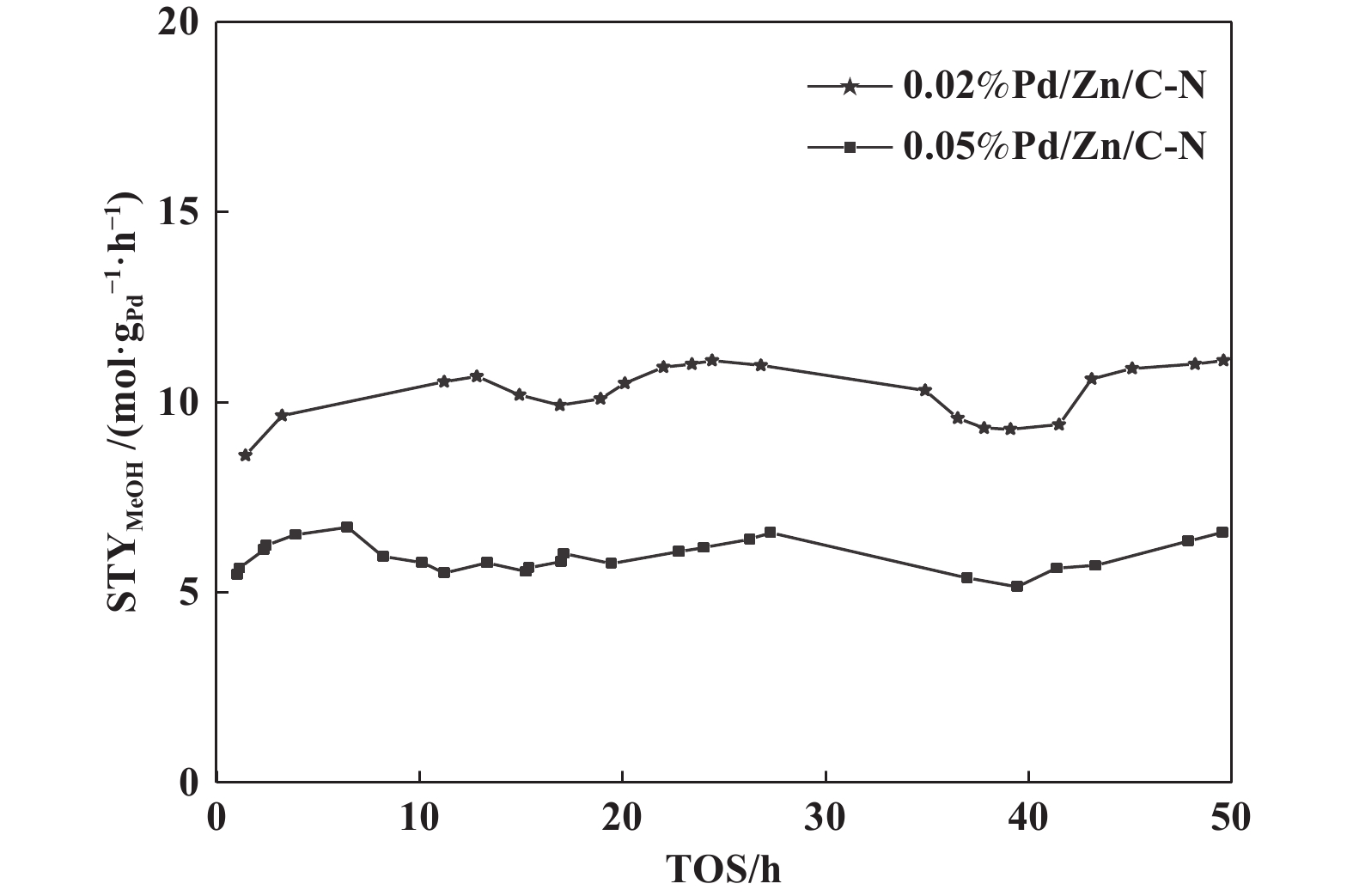
|
图 8 0.05%Pd/Zn/C-N和0.02%Pd/Zn/C-N催化剂的稳定性 Fig.8 Stability of 0.05%Pd/Zn/C-N and 0.02%Pd/Zn/C-N catalysts |
采用NaBH4还原法制备出不同Pd含量的Pd/Zn/C-N催化剂, 通过改变Pd的含量来调节催化剂的催化性能. 0.02%Pd/Zn/C-N, 0.05%Pd/Zn/C-N催化剂中的Pd纳米颗粒较小且分布均匀, Pd与ZnO相互作用更强, 更有利于甲醇生成. 综合考虑在T = 275 ℃, P = 2 MPa, GHSV = 6 L/(gcat·h), 反应条件下, 0.02%Pd/Zn/C-N每克钯上甲醇收率最高, CO2转化率为3.7%, 甲醇选择性为84.0%, 甲醇时空收率11.0 mol/(gPd·h).
| [1] |
a. Abbasi K R, Shahbaz M, Zhang J, et al. Analyze the environmental sustainability factors of china: The role of fossil fuel energy and renewable energy[J]. Renew Energ, 2022, 187: 390−402.b. Ye Zhen(叶 朕), Luo Hao-lin(罗皓霖), Jiang Zhi(江 治), et al. Recent advances of photocatalytic CO2 overall reduction(光催化还原二氧化碳全反应的研究进展)[J]. J Mol Catal(China)(分子催化), 2023, 37(2): 174−186.c. Tang Wen-bin(唐文彬), Zhang Zhi-xiang(张志翔), Chi Jia-sheng(池家晟), et al. The state of the art review on the photo-thermal reactor of CO2 reduction(光热催化还原二氧化碳反应器研究进展)[J]. J Mol Catal (China) (分子催化), 2022, 36(5): 499−512.
|
| [2] |
a. Gao P, Zhong L, Han B, et al. Green carbon science: Keeping the pace in practice[J]. Angew Chem Int Edit, 2022, 61(46): e202210095.b. Yan Wei(鄢 维), Li Yuan(李 渊). Recent progress on the electrocatalysts for urea electrosynthesis reactions(基于尿素电合成反应的电催化剂研究进展)[J]. J Mol Catal(China)(分子催化), 2023, 37(2): 187−201.
|
| [3] |
A review of optimization and decision-making models for the planning of CO2 Capture, Utilization and Storage (CCUS) systems
[J]. SPAC, 2018, 13: 1–15.
|
| [4] |
Powering the future with liquid sunshine[J]. Joule, 2018, 2(10): 1925–1949.
DOI:10.1016/j.joule.2018.08.016 |
| [5] |
Beyond oil and gas: The methanol economy[J]. Angew Chem Int Edit, 2005, 44(18): 2636–2639.
DOI:10.1002/anie.200462121 |
| [6] |
Highlights and challenges in the selective reduction of carbon dioxide to methanol[J]. Nat Rev Chem, 2021, 5(8): 564–579.
DOI:10.1038/s41570-021-00289-y |
| [7] |
Recent advances in carbon dioxide hydrogenation to methanol via heterogeneous catalysis[J]. Chem Rev, 2020, 120(15): 7984–8034.
DOI:10.1021/acs.chemrev.9b00723 |
| [8] |
Comprehensive review of Cu-based CO2 hydrogenation to CH3OH: Insights from experimental work and theoretical analysis
[J]. Int J Hydrogen Energ, 2022, 47(15): 9183–9200.
DOI:10.1016/j.ijhydene.2022.01.021 |
| [9] |
Direct carbon dioxide hydrogenation to produce bulk chemicals and liquid fuels via heterogeneous catalysis[J]. Chin J Catal, 2022, 43(8): 2045–2056.
|
| [10] |
The influence of the support on the activity and selectivity of Pd in CO hydrogenation[J]. Appl Catal A:Gen, 2001, 213(2): 225–232.
DOI:10.1016/S0926-860X(01)00465-3 |
| [11] |
Theoretical study of CO2 hydrogenation to methanol on isolated small Pdx clusters
[J]. J Energ Chem, 2019, 35: 79–87.
DOI:10.1016/j.jechem.2018.11.005 |
| [12] |
CO2 Hydrogenation to methanol at atmospheric pressure: Influence of the preparation method of Pd/ZnO catalysts
[J]. Catal Lett, 2016, 146(2): 373–382.
DOI:10.1007/s10562-015-1627-z |
| [13] |
Pd/ZnO Catalysts for direct CO2 hydrogenation to methanol
[J]. J Catal, 2016, 343: 133–146.
DOI:10.1016/j.jcat.2016.03.017 |
| [14] |
CO2 Hydrogenation to methanol over Pd/In2O3: Effects of Pd and oxygen vacancy
[J]. Appl Catal B:Environ, 2017, 218: 488–497.
DOI:10.1016/j.apcatb.2017.06.069 |
| [15] |
Hydrogenation of CO2 to methanol over Pd-Cu/CeO2 catalysts
[J]. Mol Catal, 2017, 434: 146–153.
DOI:10.1016/j.mcat.2017.02.005 |
| [16] |
Atomic Pd-promoted ZnZrOx solid solution catalyst for CO2 hydrogenation to methanol
[J]. Appl Catal B:Environ, 2022, 304: 120994.
DOI:10.1016/j.apcatb.2021.120994 |
| [17] |
Shape effect of Pd-promoted Ga2O3 nanocatalysts for methanol synthesis by CO2 hydrogenation
[J]. J Phys Chem C, 2014, 118(42): 24452–24466.
DOI:10.1021/jp5063379 |
| [18] |
Recent advances in the application of Metal-Organic Frameworks (MOFs)-based nanocatalysts for direct conversion of carbon dioxide (CO2) to value-added chemicals
[J]. Coordin Chem Rev, 2023, 474: 214853.
DOI:10.1016/j.ccr.2022.214853 |
| [19] |
State of the art and prospects in Metal–Organic Framework (MOF)-based and MOF-derived nanocatalysis[J]. Chem Rev, 2020, 120(2): 1438–1511.
DOI:10.1021/acs.chemrev.9b00223 |
| [20] |
Exceptional chemical and thermal stability of zeolitic imidazolate frameworks[J]. PNAS, 2006, 103(27): 10186–10191.
DOI:10.1073/pnas.0602439103 |
| [21] |
Cu@ZIF-8 Derived inverse ZnO/Cu catalyst with sub-5 nm ZnO for efficient CO2 hydrogenation to methanol
[J]. Catal Sci Technol, 2019, 9(10): 2673–2681.
DOI:10.1039/C8CY02546K |
| [22] |
Confinement of subnanometric PdZn at a defect enriched ZnO/ZIF-8 interface for efficient and selective CO2 hydrogenation to methanol
[J]. J Mater Chem A, 2019, 7(41): 23878–23885.
DOI:10.1039/C9TA03410B |
| [23] |
Exploring the effect of morphology and surface properties of nanoshaped Pd/CeO2 catalysts on CO2 hydrogenation to methanol
[J]. Appl Catal A:Gen, 2021, 627: 118394–118399.
DOI:10.1016/j.apcata.2021.118394 |
| [24] |
Imparting functionality to a Metal-Organic Framework Material by controlled nanoparticle encapsulation[J]. Nat Chem, 2012, 4(4): 310–316.
DOI:10.1038/nchem.1272 |
| [25] |
Wang Yan-hua(王艳华), Zhang Jing-chang(张敬畅), Xu Heng-yong(徐恒泳), et al. Reduction of Pd/ZnO catalyst and its catalytic process of methanol steam reforming for hydrogen production(Pd/ZnO催化剂的还原及其催化甲醇水蒸气重整制氢)[J]. Chin J Catal(催化学报), 2007, 28(3): 234−238.
|
| [26] |
Spillover in heterogeneous catalysis: New insights and opportunities[J]. ACS Catal, 2021, 11(5): 3159–3172.
DOI:10.1021/acscatal.0c05567 |
| [27] |
Yin Ya-zhi(尹雅芝), Hu Bing(胡 兵), Liu Guo-liang(刘国亮), et al. ZnO@ZIF-8 Core-shell structure as host for highly selective and stable Pd/ZnO catalysts for hydrogenation of CO2 to methanol(利用ZnO@ZIF-8 核壳结构构建高选择性、高稳定性的Pd/ZnO 催化剂用于CO2 加氢制甲醇)[J]. Acta Phys-Chim Sin(物理化学学报), 2019, 35 (3): 327–336.
|
| [28] |
Controlling morphologies and tuning the related properties of nano/microstructured ZnO crystallites[J]. J Phys Chem C, 2009, 113(2): 584–589.
DOI:10.1021/jp808233e |
| [29] |
Synergism of oxygen vacancy and carbonaceous species on enhanced photocatalytic activity of electrospun ZnO-carbon nanofibers: Charge carrier scavengers mechanism[J]. Appl Catal A:Gen, 2013, 466: 153–160.
DOI:10.1016/j.apcata.2013.06.024 |
| [30] |
Hydrogen production by oxidative methanol reforming on Pd/ZnO: Catalyst deactivation[J]. Appl Catal A:Gen, 2006, 299: 58–65.
DOI:10.1016/j.apcata.2005.10.012 |
| [31] |
The synergistic effect of graphitic N and pyrrolic N for the enhanced photocatalytic performance of nitrogen-doped graphene/TiO2 nanocomposites
[J]. Appl Catal B:Environ, 2016, 181: 810–817.
DOI:10.1016/j.apcatb.2015.08.049 |
| [32] |
Pd@zeolitic imidazolate framework-8 derived PdZn alloy catalysts for efficient hydrogenation of CO2 to methanol
[J]. Appl Catal B:Environ, 2018, 234: 143–152.
DOI:10.1016/j.apcatb.2018.04.024 |
| [33] |
The role of Al doping in Pd/ZnO catalyst for CO2 hydrogenation to methanol
[J]. Appl Catal B:Environ, 2020, 263: 118367–118375.
DOI:10.1016/j.apcatb.2019.118367 |
 2023, Vol. 37
2023, Vol. 37


