2. 华东师范大学 化学与分子工程学院, 上海, 200062
2. School of Chemistry and Molecular Engineering, East China Normal University, Shanghai 200062, China
氢甲酰化反应是指烯烃与合成气(CO和H2)在催化剂的作用下生成比原烯烃多一个碳原子醛的过程. 近年来, 化学工业一直利用烯烃的氢甲酰化反应合成各类醛. 由于醛可以方便地进一步转化为成醇、酸、酯、Aldol缩合产物、缩醛等化学品[1−2], 而这些化学品是生产各种洗涤剂、表面活性剂、医药和香料等高附加值精细化学品的主要原料, 所以氢甲酰化已发展成为迄今为止最重要的工业均相催化反应之一. 此外, 氢甲酰化反应原子经济、环境友好, 符合绿色化学和双碳理念, 目前, 工业上每年通过氢甲酰化反应生产的醛类化合物已达到107 t.
脂肪族二醛是常见的工业化学品中间体, 其中1,9-壬二醛作为一种长链二醛, 其还原胺化产物1,9-壬二胺是高温特种尼龙PA9T的关键单体[3], PA9T因其具有成型性好、吸水率极低、机械强度高、韧性好、尺寸稳定性高和耐化学腐蚀等优点, 在电子电气、汽车工业等领域有着不可替代的应用价值[4−5]; 其氧化产物1,9-壬二酸可作为外用抗菌剂[6−8], 通过抑制细胞增殖减少丙酸杆菌类细菌的繁殖; 其还原产物1,9-壬二醇常用于医药中间体、香料、润滑油、油墨、涂料、化妆品、增塑剂、添加剂和光敏剂[9−11]的开发等. 因此, 1,9-壬二醛的合成显得尤为重要.
1961年, Walter等[12]报道了使用1,9-双(3,5-二甲基-1H-吡唑-1-基)壬烷-1,9-二酮为原料, 通过还原脱除咪唑环合成1,9-壬二醛的方法, 收率为76%(图1(a)), 该方法的原料合成步骤复杂, 制备成本较高. 2001年, Botteghi等[13]报道了以1,6-庚二烯为原料, RhH(CO)(PPh3)3/Xantphos为催化剂, 通过氢甲酰化反应得到1,9-壬二醛, 收率和直链选择性均>99%(图1(b)). 该反应使用1% (摩尔分数)的铑催化剂, 反应时间为120 h, 催化剂用量较大, 反应效率较低, 难以应用于工业生产. 此外, 1,6-庚二烯并不是大宗石油化工产品. 尽管可以由环戊烯与乙烯通过烯烃复分解得到, 但是环戊烯价格昂贵. 20世纪90年代, 可乐丽公司报道了以大宗石油化工产品丁二烯为原料, 依次经过水合二聚[14]、异构化[15−17]得到7-辛烯醛, 7-辛烯醛经氢甲酰化[18−20]反应得到1,9-壬二醛, 三步总收率为63%~75% (图1(c)). 该路线成功产业化并应用于PA9T的生产. 该方法原料易得低成本, 反应高效, 但工艺要求较高, 7-辛烯醛氢甲酰化合成步骤使用的双亚磷酸酯配体合成工艺较复杂, 生产成本较高. 因此, 1,9-壬二醛的高效、低成本合成方法仍有待进一步开发.

|
图 1 1,9-壬二醛的合成方法报道 Fig.1 Report on the synthesis method of 1,9-nonanedial |
我们研究了使用膦配体与铑(I)组成的催化剂, 以丁二烯下游中间体—7-辛烯醛为原料, 通过氢甲酰化合成1,9-壬二醛的反应, 考察了不同膦配体对7-辛烯醛氢甲酰化反应的影响, 研究了不同反应条件对7-辛烯醛氢甲酰化反应的影响, 并对反应工艺条件进行了优化. 最后, 探究了其氢甲酰化过程的反应机理和副产物的生成机理.
1 实验部分 1.1 试剂和仪器Rh(acac)(CO)2供应商为Alfa; Xantphos供应商为Adamas; 氢气和一氧化碳供应商为液化空气(昆山)气体科技有限公司; 甲苯经布劳恩溶剂纯化系统干燥纯化处理后使用; 其余试剂通过市售渠道购买后, 未经纯化直接使用.
核磁共振波谱仪(Bruker 400 MHz或600 MHz 型); 气相-质谱联用仪(ESI, Agilent 7890B/5977B型); 气相色谱仪(Agilent 8890B型); 无水无氧操作在布劳恩手套箱中进行; 氢甲酰化反应在100 mL×6多通道高压反应釜设备(安徽科幂仪器有限公司)中进行.
1.2 实验方法7-辛烯醛原料的合成:
使用了实验室易于实施、条件温和的化学合成方法大量制备7-辛烯醛. 7-辛烯醛(4)合成路线包括如下步骤(图2): 1) 8-溴-1-辛烯(1)与醋酸盐通过取代反应生成乙酸-7-辛烯-1-酯(2)[21]; 2) 在碱性条件下, 乙酸-7-辛烯-1-酯(2)水解得到7-辛烯-1醇(3)[11]; 3) 7-辛烯-1-醇(3)在氧化剂作用下, 选择性氧化得到7-辛烯醛(4)[22].

|
图 2 7-辛烯醛的合成路线 Fig.2 Synthesis of oct-7-enal |
乙酸-7-辛烯-1-酯(2)的合成: 室温下, 向5 L圆底烧瓶中依次加入429 g乙酸钠(5.230 mol)、3.0 L DMF、500 g 8-溴-1-辛烯(1)(2.615 mol), 85 ℃下搅拌20 h. 冷却后, 加水(3 L)、乙酸乙酯萃取(3×3 L). 合并有机相, 减压除去部分溶剂, 饱和食盐水(3 L)洗涤. 减压除去溶剂, 得到乙酸-7-辛烯-1-酯(2)粗品.
7-辛烯-1-醇(3)的合成: 向上一步得到的乙酸-7-辛烯-1-酯(2)粗品中依次加入5 L甲醇和1.6 L氢氧化钠溶液(2 mol∙L−1), 室温下搅拌48 h. 确认原料水解完全后, 减压除去甲醇, 水相用甲基叔丁基醚(3×1.5 L)萃取. 合并有机相, 无水Na2SO4干燥. 过滤, 减压除去溶剂, 得到7-辛烯-1-醇(3)粗品.
7-辛烯醛(4)的合成: 冰水浴条件下, 向上一步得到的7-辛烯-1-醇(3)粗品中, 加入二氯甲烷(4.5 L), 分多次加入1 109 g (2.615 mol) Dess-Martin试剂, 缓慢回到室温, 搅拌过夜. 确认原料基本反应完全后, 饱和NaHCO3溶液淬灭, 并调节pH为6~8. 滤去不溶物, 分液, 水相用二氯甲烷(3×2 L)萃取. 合并有机相, 减压除去大部分二氯甲烷, 再次用NaHCO3饱和溶液洗涤至无气体生成, 以尽可能除去其中的乙酸. 分液, 有机相用Na2SO4干燥. 过滤, 减压除去溶剂, 残余物减压蒸馏分离, 得到无色液体7-辛烯醛(4) 244.5 g, 3步总收率为74%, 纯度为98%. 蒸馏残余物主要为7-辛烯醛(4)的二分子羟醛缩合产物.
氢甲酰化反应(图3): 无水无氧条件下, 向反应瓶中加入指定摩尔比的Rh(acac)(CO)2、膦配体和甲苯, 室温下搅拌5 min, 配制均相催化剂溶液. 向100 mL容积的反应釜中, 依次加入甲苯、上述催化剂溶液和7-辛烯醛(4). 反应釜密闭后, 氢气置换3次, 依次充入氢气和一氧化碳至指定压力, 例如充入1.0 MPa压力的 H2和 1.0 MPa压力的CO, 则反应压力条件记为H2/CO (1.0/1.0 MPa). 升温到反应温度后, 保持一定时间, 停止反应, 待反应釜冷却至室温. 反应体系降至常压, 对反应液进行GC分析, 使用外标法计算原料转化率和各产物收率. 随后, 使用减压蒸馏分离得到1,9-壬二醛(5a).

|
图 3 7-辛烯醛合成1,9-壬二醛 Fig.3 Synthesis of 1,9-nonanedial from oct-7-enal |
产物核磁数据如下:
乙酸-7-辛烯-1-酯(2): 无色液体; 1H NMR (400 MHz, CDCl3) δ 5.86-5.71 (m, 1H), 5.04-4.88 (m, 2H), 4.05 (t, J = 6.8 Hz, 2H), 2.12-2.00 (m, 5H), 1.67-1.56 (m, 2H), 1.45-1.28 (m, 6H). 13C NMR (101 MHz, CDCl3) δ 170.61, 138.50, 114.03, 64.17, 33.39, 28.49, 28.43, 28.31, 25.51, 20.57.
7-辛烯-1-醇(3): 无色液体; 1H NMR (600 MHz, CDCl3) δ 5.87-5.71 (m, 1H), 5.03-4.90 (m, 2H), 3.61 (t, J = 6.7 Hz, 2H), 2.48 (s, 1H), 2.13-1.97 (m, 2H), 1.63-1.48 (m, 2H), 1.44-1.28 (m, 6H); 13C NMR (151 MHz, CDCl3) δ 139.00, 114.19, 62.72, 33.67, 32.62, 28.87, 28.83, 25.58.
7-辛烯醛(4): 无色液体; 1H NMR (600 MHz, CDCl3) δ 9.76 (t, J = 1.8 Hz, 1H), 5.87-5.74 (m, 1H), 4.99 (dq, J = 17.1, 1.7 Hz, 1H), 4.94 (ddt, J = 10.2, 2.1, 1.2 Hz, 1H), 2.43 (td, J = 7.4, 1.8 Hz, 2H), 2.05 (q, J = 7.0 Hz, 2H), 1.71-1.57 (m, 2H), 1.48-1.28 (m, 5H). 13C NMR (151 MHz, CDCl3) δ 202.56, 138.49, 114.32, 43.64, 33.34, 28.43, 28.42, 21.75.
1,9-壬二醛(5a): 无色液体; 1H NMR (400 MHz, CDCl3) δ 9.76 (t, J = 1.8 Hz, 2H), 2.43 (td, J = 7.3, 1.8 Hz, 4H), 1.68-1.58 (m, 4H), 1.37-1.30 (m, 6H). 13C NMR (101 MHz, CDCl3) δ 202.45, 43.52, 28.80, 28.62, 21.67.
1.3 分析方法采用气相色谱仪对氢甲酰化反应产物进行分析. 色谱柱型号: HP-INNOWax. 采取程序升温: 初温40 ℃, 保温1 min; 10 ℃·min−1升温至60 ℃, 保持2 min; 5 ℃·min−1升温至110 ℃, 保持1 min; 10 ℃·min−1升温至170 ℃, 保持2 min; 20 ℃·min−1升温至250 ℃, 保持3 min. 进样口温度为250 ℃. 柱流速为2.2 mL·min−1. FID温度为260 ℃.
保留时间: 7-辛烯醛(4)、1,9-壬二醛(5a)、2-甲基-1,8-辛二醛(5b)、1-壬醛(5a)、6-辛烯醛(7a)、5-辛烯醛(7b)、4-辛烯醛(7c)和3-辛烯醛(7d)分别为11.09、23.23、21.86、9.60、11.39、11.79、10.68和10.84 min.
2 结果与讨论 2.1 膦配体对反应的影响配体的空间结构与电子效应是影响催化剂性能的重要因素, 因此首先考察了不同配体对7-辛烯醛氢甲酰化反应的影响, 结果如表1所示. 使用单膦配体三苯基膦时, 原料几乎转化完全, 但直链醛(5a, 下同)选择性较差, 正异比(5a/5b, 下同)仅为2.6(表1, Entry 1). 不同的双膦配体DPPB、BINAP、DPEphos、Xantphos(表1, Entry 2−5)中, 使用Xantphos的催化效果最佳, 原料转化率为99%, 直链醛收率为90%, 支链醛(5b, 下同)收率为2.5%, 正异比为36, 氢化产物(6, 下同)收率为1.9%, 异构化产物(7, 下同)收率为3.5%(表1, Entry 5). Xantphos表现出优秀的直链选择性, 这是由于该配体具有较大的咬合角(111.4°)[23−24], 更易得到直链产物. 使用与Xantphos结构相似的富电子双膦配体Cy-Xantphos时, 原料几乎不反应(表1, Entry 6). 使用贫电子双膦配体Ni-Xantphos时, 尽管产物正异比更高, 但直链醛收率更低, 氢化产物和异构化产物较多, 因此最终配体优选为Xantphos.
| 表 1 膦配体对氢甲酰化反应的影响a Table 1 Effect of phosphine ligands on hydroformylationa |
以Rh(acac)(CO)2为铑前体, Xantphos为膦配体, H2/CO各1.0 MPa, 甲苯为溶剂, 85 ℃下反应16 h, 考察不同Rh(I)/L比例对7-辛烯醛氢甲酰化反应的影响, 结果如表2所示. Rh(I)/L比例由1/1.2降低到1/3时, 原料转化率由47%逐渐升高到79%, 醛产物正异比由28逐渐升高到51, 直链醛收率由39%逐渐升高到71%, 氢化产物收率由1.0%升高到3.4%, 异构化产物收率由5.5%降低到3.3%(表2, Entry 1−3); 继续降低Rh(I)/L比例到1/10, 原料转化率由79%逐渐降低到50%, 醛产物正异比由51逐渐降低到33, 直链醛收率由71%逐渐降低到43%, 氢化产物收率由3.4%降低到1.2%, 异构化产物收率由3.3%降低到1.2%(表2, Entry 3−5). 这是由于反应体系中金属和配体的比例会因为配位平衡影响其活性催化物种的数量分布, 从而影响其反应性和区域选择性[25−26]. Xantphos与Rh(I)的配位是可逆的, 反应过程中, 需要与CO(主要)和H2竞争有限的Rh配位点. 稍过量的Xantphos配体可能有利于保持反应体系具有较多数量的反应活性催化物种; 而大大过量的Xantphos配体可能争抢Rh(I)的反应配位点, 影响氢甲酰化反应进行. 综合实验结果, 当Rh(I)/L比例为1/3时, 反应效果最佳.
| 表 2 Rh(I)/L比例对氢甲酰化反应的影响a Table 2 Effect of Rh(I)/L ratio on hydroformylationa |
在Rh(I)/L为1/3, 铑催化剂用量为原料的1/10 000, H2/CO各1.0 MPa, 85 ℃下反应16 h, 考察不同溶剂对7-辛烯醛氢甲酰化反应催化剂性能的影响, 结果如表3所示. 使用非极性甲苯为溶剂时, 反应效果最佳, 原料转化率为79%, 醛产物正异比为51, 直链醛收率为71%(表3, Entry 1). 使用非极性溶剂正己烷、极性溶剂THF、DMF或质子性溶剂MeOH时, 原料转化率、醛产物正异比和直链醛收率具有不同程度下降(表3, Entry 2−5). 因此, 优选甲苯为溶剂进行后续条件筛选.
| 表 3 溶剂对氢甲酰化反应的影响a Table 3 Effect of solvent on hydroformylationa |
在Rh(I)/L为1/3, H2/CO各1.0 MPa, 甲苯为溶剂, 反应时间16 h的条件下, 铑催化剂用量为原料的1/10 000时, 考察反应温度在85~120 ℃范围内对7-辛烯醛氢甲酰化反应催化剂性能的影响(表4, Entry 1−3). 当反应温度为85 ℃时, 原料转化率为79%, 此时醛产物正异比为51. 反应温度升高, 原料转化率提高, 直链醛收率升高, 醛产物正异比降低. 反应温度120 ℃时, 原料转化率达到99%, 直链醛收率达到90%(表4, Entry 3).
| 表 4 反应温度和铑催化剂用量对氢甲酰化反应的影响a Table 4 Effect of reaction temperature and Rh catalyst dosage on hydroformylationa |
为了考察催化剂的催化活性, 在120 ℃下将铑催化剂用量降低至原料的1/20 000, 原料转化率为99%, 直链醛收率和正异比基本保持不变(表4, Entry 4). 继续降低铑催化剂用量至原料的1/50 000时, 原料转化率为99%, 但直链醛收率仅为76%, 异构化副产物收率大幅增加到17%(表4, Entry 5). 氢甲酰化反应中, 原料的异构化是主要的竞争反应之一. 铑催化剂用量降低时, 氢甲酰化反应速率减慢, 导致生成醛的速率降低, 原料异构化产物增加. 保持铑催化剂用量为原料的1/50 000, 考察了反应温度在120~150 ℃范围内的实验结果. 随着反应温度升高, 原料转化率保持99%, 直链醛收率在130~140 ℃升高到最大值85%(表4, Entry 6−7), 而在150 ℃下直链醛收率降低至75%, 异构化副产物收率大幅提高到17%(表4, Entry 8), 且反应液中有铑黑生成, 表明高温下铑催化剂失活, 阻碍了氢甲酰化反应的进行. 并且推测在无Rh(I)存在下, 异构化反应也可以进行[27−28]. 为此, 我们设计了如图4所示的实验, 在没有铑催化剂的存在下, 将辛烯醛和甲苯混合, 在H2/CO压力为1.0/1.0 MPa, 120 ℃下反应16 h, 结果生成得到大量异构化产物, 表明了在高温和H2/CO存在下, 没有Rh催化物种原料也可异构化. 即在反应温度提高时(120~140℃), 异构化反应速率的提高慢于氢甲酰化反应, 从而减少异构化产物的生成(表4, Entry 5−7); 反应温度进一步提高至150 °C, 铑催化剂失活, 直链醛收率下降(表4, Entry 8), 而异构化过程继续进行, 导致异构化产物增加. 综合实验结果, 在铑催化剂用量为原料1/50 000时, 反应温度最佳为130 ℃, 此时TON达49 500.

|
图 4 7-辛烯醛的异构化反应 Fig.4 Isomerization of oct-7-enal |
7-辛烯醛氢甲酰化反应过程中, H2和CO不断消耗, 反应釜内压力会逐步降低, 此外氢化副反应也会消耗H2, 但占比较小(<4%), 而异构化副反应不消耗H2和CO. 因此, 通过反应体系压力的降低速率可以初步判断氢甲酰化反应的速率. 为进一步研究反应温度对氢甲酰化反应的影响, 我们比较了不同反应温度下反应体系压力随反应时间的变化, 如图5所示. 不同反应温度下(120~150 ℃), 反应初期(约20 min)反应体系压力从3.0 MPa升高3.4~3.6 MPa, 这是反应体系升温导致. 之后反应体系压力快速降低, 反应温度越高, 反应体系压力降低速率越快, 这是氢甲酰化反应和氢化反应速率与反应温度成正相关所致, 结合实验结果(表4, Entry 4−7), 氢甲酰化反应为主要因素. 一定时间后, 反应体系压力基本保持稳定. 反应温度120 °C时, 约12 h后反应压力稳定于1.26 MPa; 反应温度130~140 ℃时, 约10 h后反应压力稳定于1.14 MPa; 反应温度为150 ℃时, 约4 h后反应压力稳定于1.42 MPa. 在不同温度下(表4, Entry 5−8), 尽管原料均转化完全, 但120和150 ℃反应结束的压力要高于130和140 ℃时的结果, 这是因为120和150 ℃时, 反应的异构化副产物较多, 而原料异构化过程不消耗H2和CO.
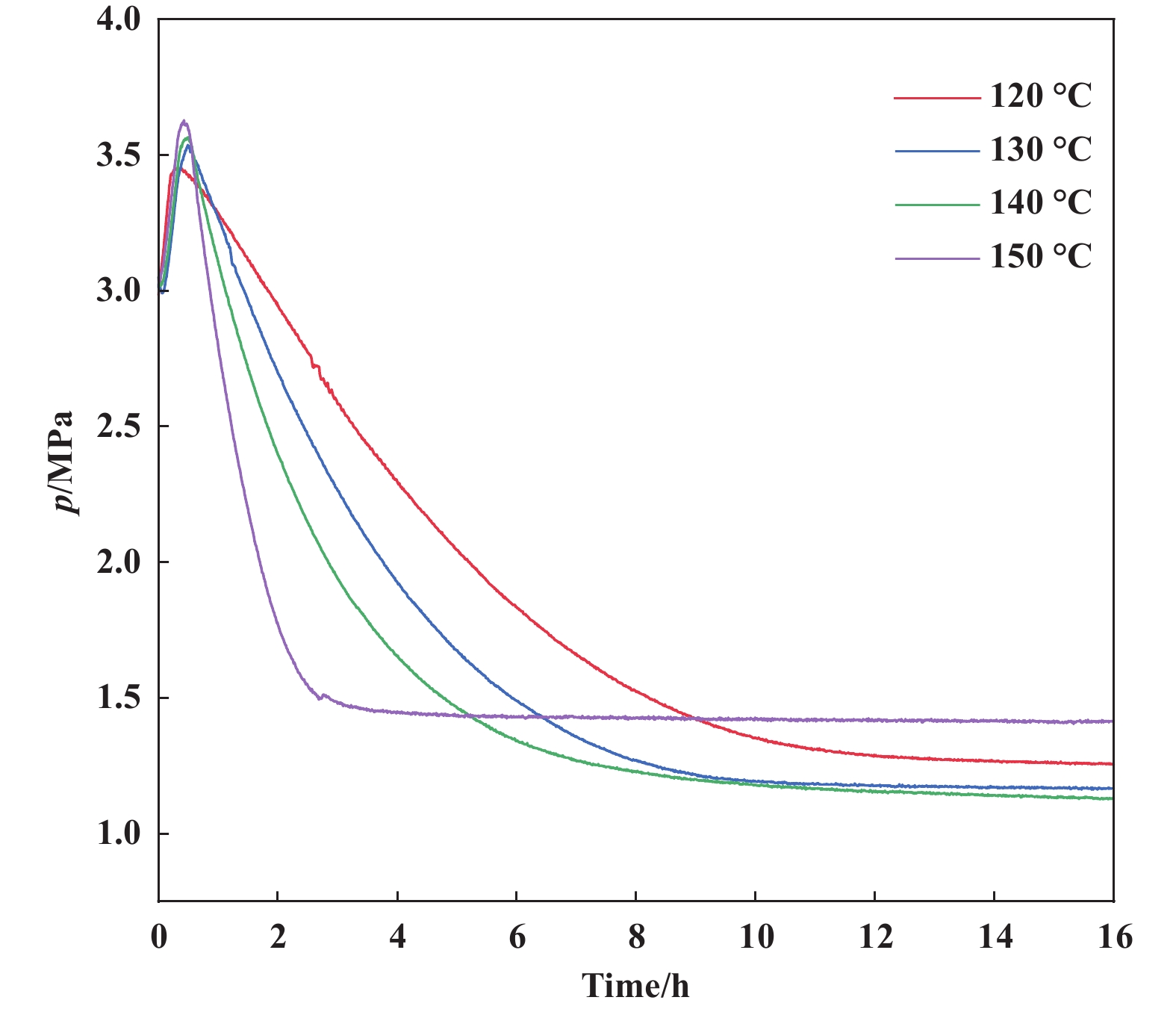
|
图 5 不同反应温度下反应体系压力随反应时间的变化 Fig.5 The variation of reaction system pressure with reaction time at different reaction temperatures Reaction conditions: Oct-7-enal (50 mmol), Rh(acac)(CO)2 (0.001 mmol), Xantphos (0.003 mmol), H2/CO (1.5/1.5 MPa), toluene (20 mL), 16 h. Determined by GC |
在Rh(I)/L为1/3, 铑催化剂用量为原料的1/50 000, 甲苯为溶剂, 130 ℃下反应16 h, 考察H2和CO压力对反应的影响, 结果如表5所示. 首先考察不同H2压力对7-辛烯醛氢甲酰化反应的影响. 保持CO压力为1.5 MPa, 当氢气压力为1.0 MPa时, 原料转化率为97%, 直链醛收率仅65%, 异构化产物收率达28%(表5, Entry 1). 氢气压力较低会大幅影响氢甲酰化反应进行. 当氢气压力为1.5 MPa时, 原料几乎转化完全, 直链醛收率为85%, 异构化产物收率为9.1%(表5, Entry 2). 当H2压力由1.5 MPa逐渐提高到2.5 MPa(表5, Entry 2−4), 直链醛收率降低, 氢化副产物收率提高, 因此选择1.5 MPa为最优氢气压力. 保持H2压力为1.5 MPa, CO压力从1.5 MPa逐渐提高到2.5 MPa(表5, Entry 2, 5−6), 醛产物正异比由28降低到25, 直链醛收率由85%提高到86%, 氢化副产物收率由2.0%降低到1.1%, 异构化产物收率由9.1%降低到5.2%. 但当CO压力增加到3.0 MPa, 直链醛收率降低到84%, 异构化收率升高到6.4%(表5, Entry 7). 如图6不同CO压力下, 反应体系压降(实时压力p−初始压力p0)随反应时间的变化所示, CO压力增加, 反应速率逐渐降低, 表明催化剂活性逐渐下降, 推测CO与膦配体竞争配位Rh(I)导致催化活性组分减少. CO压力为1.5~2.5 MPa时, 反应体系的压降为1.58~1.88 MPa; CO压力为3.0 MPa时, 反应体系的压降为1.07 MPa, 明显低于CO压力为1.5~2.5 MPa时反应体系的压降, 表明CO压力过高会阻碍氢甲酰化反应的进行. 综合实验结果, 当H2/CO压力为1.5/2.0 MPa时, 反应效果最佳.
| 表 5 H2和CO压力对氢甲酰化反应的影响a Table 5 Effect of H2 and CO pressure on hydroformylationa |
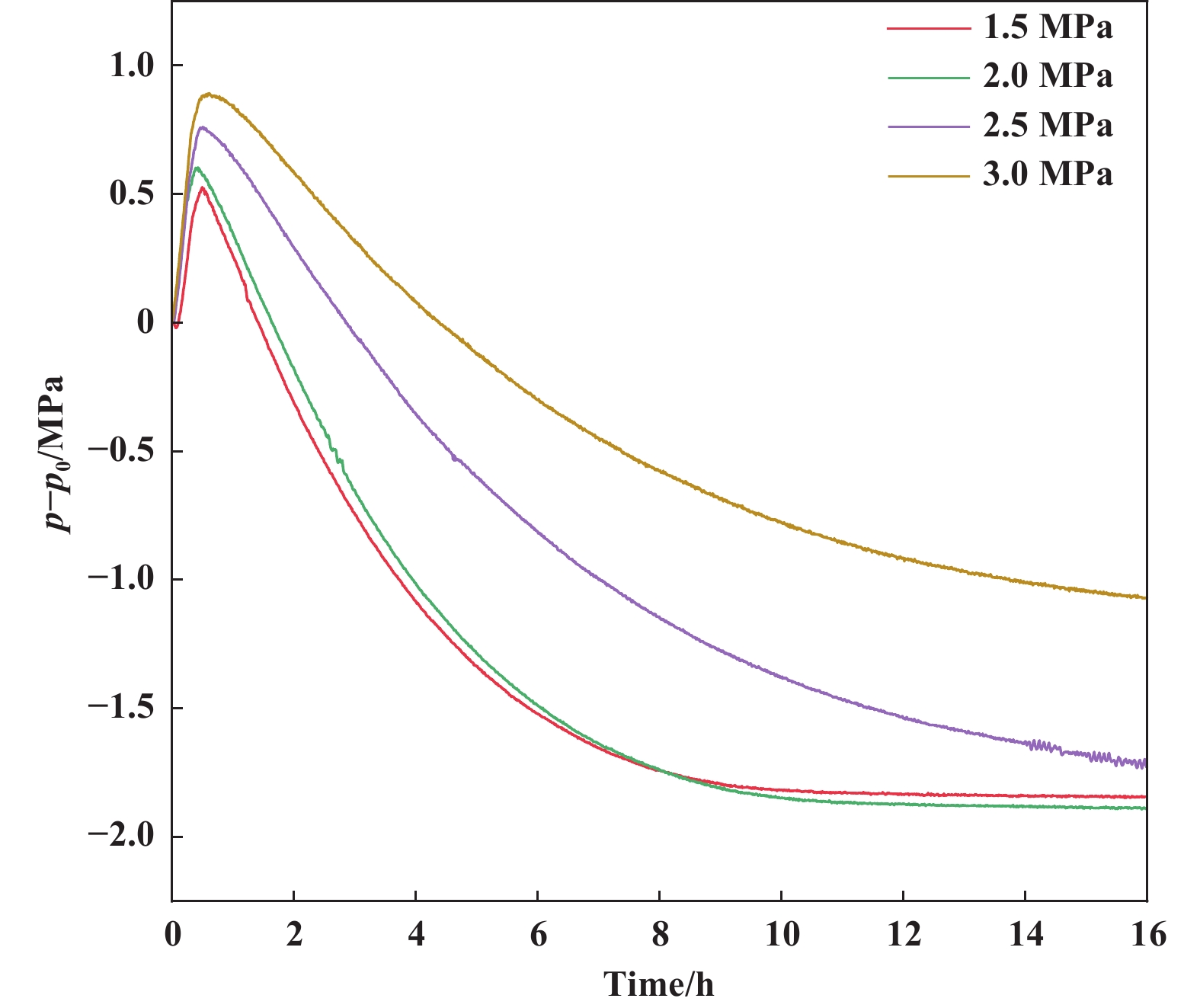
|
图 6 不同CO压力下反应体系压降(实时压力p−初始压力p0)随反应时间的变化 Fig.6 The variation of pressure drop (real-time pressure p − initial pressure p0) of the reaction system with reaction time under different CO pressures Reaction conditions: Oct-7-enal (50 mmol), Rh(acac)(CO)2 (0.001 mmol), Xantphos (0.003 mmol), H2 (1.5 MPa), toluene (20 mL), 130 ℃, 16 h. Determined by GC |
在Rh(I)/L为1/3, 铑催化剂用量为原料1/50 000, H2/CO压力为1.5/2.0 MPa, 甲苯为溶剂, 130 ℃下反应16 h, 考察不同7-辛烯醛浓度对反应的影响, 结果如表6所示. 当7-辛烯醛浓度为1.0 mol∙L−1时, 原料转化率为82%, 直链醛收率为72%, 支链醛收率为2.6%, 氢化产物收率为1.8%, 异构化产物收率为5.4%(表6, Entry 1); 当7-辛烯醛浓度为1.75 mol∙L−1时, 原料几乎转化完全, 醛产物正异比为27, 直链醛收率为86%, 支链醛收率为3.2%, 氢化产物收率为2.1%, 异构化产物收率为8.6%(表6, Entry 2). 继续将7-辛烯醛浓度从1.75逐渐提高5.88 mol∙L−1, 醛产物正异比从27降低到14, 直链醛收率从86%下降到58%, 异构化产物收率从8.6%大幅增加到35%(表6, Entry 3−6). 因此, 7-辛烯醛的浓度优选为1.75 mol∙L−1.
| 表 6 7-辛烯醛浓度对氢甲酰化反应的影响a Table 6 Effect of oct-7-enal concentration on hydroformylationa |
在7-辛烯醛原料浓度为1.75 mol∙L−1, Rh(I)/L为1/3, 铑催化剂用量为原料的1/50 000, H2/CO压力为1.5/2.0 MPa, 甲苯为溶剂, 反应温度为130 °C的条件下, 考察了反应时间对反应的影响, 结果如表7所示. 当反应时间为6 h, 原料转化率为79%, 醛产物正异比为28, 直链醛收率为69%, 支链醛收率为2.5%, 氢化产物为1.5%, 异构化产物为5.6%(表7, Entry 1). 随着反应时间从6 h逐渐延长到14 h, 原料逐渐反应完全, 醛产物正异比几乎不变, 直链醛收率从69%提高到86%, 支链醛收率从2.5%提高到3.2%, 氢化产物收率从1.5%略提高到1.9%, 异构化产物收率从5.6%提高到8.5%(表7, Entry 1−5). 当反应时间为12 h, 原料几乎转化完全, 此时醛产物的正异比为27, 直链醛收率为86%, 支链醛收率为3.2%, 氢化产物为1.9%, 异构化产物为8.5%(表7, Entry 4).
| 表 7 反应时间对氢甲酰化反应的影响a Table 7 Effect of reaction time on hydroformylationa |
结合文献报道[29−31]和实验结果, 7-辛烯醛氢甲酰化可能的反应机理和副产物生成机理如图7所示. 首先, Rh(acac)(CO)2/Xantphos在H2作用下, 生成铑催化物种A, 铑催化物种A离去1分子CO形成有1个空配位点的催化物种B, 随后底物的烯基配位到铑中心上, 形成中间体C; 中间体C插入碳碳双键生成烯基的α或β碳原子直接键连到铑中心的直链中间体D1和支链D2; CO插入并与铑中心配位形成中间体E1或E2; H2对中间体E1或E2氧化加成得到中间体F1或F2; 中间体F1或F2经还原消除生成直链醛或支链醛产物, 同时铑催化剂还原为催化物种B, 进入下一个催化循环过程.

|
图 7 7-辛烯醛氢甲酰化反应及副反应的可能机理 Fig.7 Proposed hydroformylation and side reaction mechanism of oct-7-enal |
在催化循环中, 烯烃插入的区域选择性, 主要受热力学稳定性和动力学稳定性因素影响. 对于铑中间体D1和D2, 与Rh相连的碳供电子能力越强, 与正电荷的Rh(I)成键后, 热力学上更加稳定, 故生成的支链中间体D2能量比直链中间体D1更低. 使用小位阻磷配体时, Rh周围空间屏蔽较少, 中间体C转化为中间体D1和D2的能垒相近, 故更容易得到热力学稳定的支链中间体D2; 若使用大位阻磷配体, Rh周围空间屏蔽较多, 位阻较大的烯基β-碳插入到Rh―H键的能垒比插入位阻较小的烯基端位碳的能垒更高, 故动力学上更容易得到直链中间体D1.
催化循环中的异构化产物的来源主要包括两种途径: (1) Rh催化物种中间体D2的β-H消除; (2) 如前文图4实验所示, 7-辛烯醛原料在微量酸催化下的双键迁移. 在高温导致铑催化物种生成铑黑失活后, 剩余原料通过途径(2)生成异构化产物. 关于氢化产物的来源, 中间体D1和D2若在CO插入前与H2氧化加成, 则得到中间体G1和G2, 随后还原消除得到催化物种B和氢化产物. H2压力增加, 中间体D1和D2与H2氧化加成速率提高, 氢化产物增加; CO压力增加, 中间体D1和D2插羰反应速率提高, 氢化和异构化副产物减少, 但CO压力过大, CO可能会挤占磷配体配位点, 导致催化活性物种减少, 氢甲酰化的插羰反应减慢, 反而导致异构化产物增加.
3 结论以丁二烯下游中间体—7-辛烯醛为原料, 发展了一种Rh(I)/Xantphos催化的氢甲酰化反应合成1,9-壬二醛的方法. 考察了不同的磷配体对催化剂性能的影响, 对反应工艺条件进行了研究和优化. 在优化的反应条件下(原料浓度1.75 mol∙L−1, Rh(I)/L=1/3, H2/CO压力1.5/2.0 MPa, 甲苯为溶剂, 130 ℃, 反应12 h), 反应效果最佳, 直链壬二醛收率86%, 醛产物正异比为27, TON可达49 500. 该方法具有高转化率, 高直链选择性和高TON等优点, 在1,9-壬二醛的合成中表现出良好的应用潜力. 反应的可能机理探究了各产物的生成机理, 为7-辛烯醛氢甲酰化的工艺优化提供了理论支持.
| [1] |
Synthesis and characterization of poly(ethylene terephthalamide/hexamethylene terephthalamide)[J]. J Macromol Sci A, 2012, 49(1): 67–72.
DOI:10.1080/10601325.2012.630950 |
| [2] |
Polymer composites for tribological applications[J]. Adv Ind Eng Polym Res, 2018, 1(1): 3–39.
DOI:10.1016/j.aiepr.2018.05.001 |
| [3] | |
| [4] |
Progress in semicrystalline heat-resistant polyamides[J]. e-Polymers, 2018, 18(5): 373–408.
DOI:10.1515/epoly-2018-0094 |
| [5] | |
| [6] |
Azelaic acid. A review of its pharmacological properties and therapeutic efficacy in acne and hyperpigmentary skin disorders[J]. Drugs, 1991, 41: 780–98.
DOI:10.2165/00003495-199141050-00007 |
| [7] |
Azelaic acid: Potential as a general antitumoral agent[J]. Med Hypotheses, 1999, 52(3): 221–226.
DOI:10.1054/mehy.1997.0647 |
| [8] |
Azelaic acid: Properties and mode of action[J]. Skin Pharmacol Physiol, 2014, 27(1): 9–17.
DOI:10.1159/000351349 |
| [9] |
Functional thermoplastics from linear diols and diisocyanates produced entirely from renewable lipid sources[J]. Biomacromolecules, 2010, 11(4): 911–918.
DOI:10.1021/bm901308c |
| [10] |
Photoreactive nanomatrix structure formed by graft-copolymerization of 1, 9-nonandiol dimethacrylate onto natural rubber[J]. J Polym Sci A Polym Chem, 2010, 48: 2418–2424.
DOI:10.1002/pola.24011 |
| [11] |
Koch C, Lange S, Bugdahn N, et al. Compositions with (bio)-alkanediols and cooling agents[P]. WO: 2022122134-A1, 2022-6-16.
|
| [12] |
α-Aminoaldehydes by hydrogenolytic cleavage of N-tosylated α-aminoacyldimethylpyrazoles[J]. Justus Liebigs Ann Chem, 1961, 640: 111–126.
DOI:10.1002/jlac.19616400113 |
| [13] |
Preparation of linear long chain dialdehydes by hydroformylation of linear α,ω-dienes or ω-vinylaldehyde acetals[J]. J Mol Catal A-Chem, 2001, 175(1/2): 17–25.
DOI:10.1016/S1381-1169(01)00174-1 |
| [14] |
Tatsuya Y, Tomoaki T. Method for producing 2, 7-octadien-1-ol[P]. US: 20160046549A1, 2016-2-18.
|
| [15] |
Kei M, Goro A. Method for producing high purity terminal olefin compound[P]. US: 8609886B2, 2013-12-17.
|
| [16] |
Tsuda T. Process for producing 7-octen-1-al[P]. EP: 0908441A1, 1999-4-14.
|
| [17] |
Tomoaki T. Method for producing 7-octenal[P]. US: 20150225328A1, 2015-8-13.
|
| [18] |
Tomoaki T, Masayuki M, Shigeaki S. Lithium rho-diarylphosphinobenzenesulfonates, process for preparation of the same and use thereof[P]. US: 20040249195 A1, 2004-12-09.
|
| [19] |
Tomoaki T. Bisphosphine, process for producing the same, and use thereof[P]. EP: 1489087A1, 2004-12-22.
|
| [20] |
Tatsuya Y, Tomoaki T. Method for producing dialdehyde[P]. US: 2016052852A1, 2016-02-25.
|
| [21] |
Precise sulfite functionalization of polyolefins via admet polymerization[J]. ACS Macro Lett, 2015, 4(6): 624–627.
DOI:10.1021/acsmacrolett.5b00258 |
| [22] |
Duan M, Kazmierski W M, Ji J. HCV inhibitor compounds and methods of use thereof[P]. WO: 2011150190A2, 2011-1-12.
|
| [23] |
New diphosphine ligands based on heterocyclic aromatics inducing very high regioselectivity in rhodium-catalyzed hydroformylation: Effect of the bite angle[J]. Organometallics, 1995, 14(6): 3081–3089.
DOI:10.1021/om00006a057 |
| [24] |
Wide bite angle diphosphines: Xantphos ligands in transition metal complexes and catalysis[J]. Acc Chem Res, 2001, 34(11): 895–904.
DOI:10.1021/ar000060+ |
| [25] |
Low-pressure system for producing normal aldehydes by hydroformylation of α-olefins[J]. J Org Chem, 1969, 34(2): 327–330.
DOI:10.1021/jo01254a015 |
| [26] |
Recent advances on chemo-, regio- and stereoselective hydroformylation[J]. Synthesis, 2001, 1: 1–36.
DOI:10.1055/s-2001-9739 |
| [27] |
Seen A J, Cavell K J, Mau A W H, et al. A unique application of acid-Nafion as a co-catalyst and support[J]. J Chem Soc Dalton Trans, 1992, 8 : 1381− 1385.
|
| [28] |
Protium-deuterium exchange of cyclic and acyclic alkenes in dilute acid medium at elevated temperatures[J]. Can J Chem, 1985, 63(2): 530–533.
DOI:10.1139/v85-086 |
| [29] |
Evans D, Osbom J A, Wilkinson G. Hydroformylation of alkenes by use of rhodium complex catalysts[J]. J Chem Soc A, 1968, 1968 (12): 3133−3142.
|
| [30] |
Brown C K, Wilkinson G. Homogeneous hydroformylation of alkenes with hydridocarbonyltris- (triphenylphosphine)rhodium(I) as catalyst[J]. J Chem Soc A, 1970, 1970 (17): 2753−2764.
|
| [31] |
Recent advances in high-pressure infrared and NMR techniques for the determination of catalytically active species in rhodium- and cobalt-catalyzed hydroformylation reactions[J]. Coordin Chem Rev, 2004, 248(21 / 24): 2393–2407.
DOI:10.1016/j.ccr.2004.04.005 |
 2024, Vol. 38
2024, Vol. 38


