2. 中国科学院兰州化学物理研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州 730000
2. State Key Laboratory of Oxo Synthesis and Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
机械化学, 也被称为机械力化学, 是以机械力研究为主, 并且产生一定化学变化的一门学科. 广义上的机械化学反应包括机械球磨反应, 超声化学反应, 螺杆挤压, 以及离心力的高速涡流反应等[1]. 但在大多数情况下, 机械化学反应多是通过研磨手段促进的固态非均相反应. 和常规溶液环境中进行的热化学反应不同, 机械化学反应利用机械作用过程中的粉碎、破裂特性, 可以有效地促进非均相反应, 特别是高熔点固态物质参与的反应[2].
目前, 机械化学在矿物冶金、药物制剂、有机合成等领域都有着非常广泛的应用. 机械化学的历史十分悠久, 是多种工艺的重要组成部分. 机械化学的独特之处在于机械作用能产生和热化学反应完全不同的化学变化, 大部分的机械能量都会在撞击或者是运动的过程中转化为热量.
机械化学和机械酶催化反应虽然都具有自身的缺陷, 研究进展也存在着一定的滞后性, 但是机械酶催化反应本身却有着很多的优点和长处, 其中机械酶催化反应比较特别的地方就是无溶剂系统, 虽然它的研究进展不是很快, 但是对反应体系、反应效率的影响和改进比较显著, 属于一个全新的领域. 利用机械能可以很好地促进酶催化反应的发生, 可以进一步实现对底物的修饰聚合等. 酶在传统有机溶剂里的溶解度一直是困扰众多学者的问题, 因为溶解度比较有限. 然而, 机械酶催化反应可以有效地克服这一问题, 不仅可以避免使用大量的有机溶剂, 同时还可以有效地控制反应方向, 提高反应速率, 解决底物溶解度的问题, 满足现在绿色发展可持续的发展理念. 机械酶催化反应是在机械化学的基础上提出的, 机械酶催化反应改进了传统方法的不足, 机械酶催化反应在近5年以来, 已经逐渐成为国内研究的热点[3]. 机械酶催化反应中, 常见的酶包括脂肪酶、纤维素酶、蛋白酶等[4]. 相对传统的酶催化反应体系, 机械酶催化反应具有高效、低成本和绿色环保的重要特性. 我们对机械化学、机械酶催化的体系以反应中常见的酶进行了介绍, 为机械酶催化反应提供一些有益的参考.
1 机械化学的起源和发展 1.1 机械化学的起源有关机械化学的文字记载最早可以追溯到公元前三世纪, 在一份题为“On Stone”的文献中记录了在铜制研钵中研磨朱砂制备Hg单质的过程. 在之后的近

|
图 1 机械化学中的一些常见技术: (a)振动球磨; (b)行星球磨; (c)反应挤出[8] Fig.1 Some of the common techniques utilized in mechanochemistry: (a) Shaker ball milling; (b) Planetary ball milling; (c) Reactive extrusion [8] |
Spring首次研究机械化学[9], 从这以后才有了关于机械化学的记载. Lea[10]表明机械研磨可以引起同一系统中的热化学反应发生不同的变化, 难以分解的Ag盐、Hg盐, 都可以通过简单的研磨发生还原反应, 进一步得到金属单质. 机械化学反应包括: 分解反应、氧化还原反应、合成反应等[11]. 机械化学反应和热化学反应的不同主要表现在两个方面: 一方面, 反应的分解产物不同; 另一方面, 有些情况下的机械化学反应速率比正常的热反应速率高很多, 并且机械化学反应很少受外界条件的影响[12].
机械化学, 主要研究对象是聚合物和无机化合物[13]. 机械化学是一种由剪切、摩擦、研磨所引起的化学变化. 机械和化学作用的结合通常会产生很多意想不到的效果, 研磨是属于机械化学变化中比较传统的一种方法, 也是比较古老的一种方法[14]. 机械化学合成可以有效地避免大量溶剂所带来的污染, 也可以节约资金, 避免浪费[15].
1.2 机械化学的发展在1919年, 德国学者 Ostwald提出由机械力诱导的化学反应[16], 但是当时对机械化学的原理并不是十分清楚. 第一个有文献记载的机械化学反应, 是亚里士多德的学生提出的[17], 他观察到, 使用一些铜制的研钵研磨朱砂碎片时, 会产生一些液态的金属液滴[18]. 1997年, Warris等[19]把机械化学方法应用到了黄铁矿上, 给黄铁矿的处理提供了更好的条件和良好的经济活力. 2000年, 李希明等[20]首次把机械化学应用到资源和材料化工上面, 文章主要阐述了机械化学在粉体材料改性、减少有毒废弃物等方面有很大的作用.
Bowden和Tabor提出了第1个用来解释摩擦过程中金属表面快速氧化的“hot-spot”理论[21], 各类机械研磨设备的出现逐渐将机械化学反应从手工研磨中解放出来, 也为之后的高能机械化学研究发展提供了可能性[22]. Thiessen课题组以及苏联新西伯利亚研究所, 在1984 年成立了IMA, 并且定期举办机械化学和机械合金化国际论坛[23]. 在进入21世纪后, 机械有机合成才逐渐被有机合成领域所接受. 经过近20年的发展, 机械化学已成为绿色有机化学研究的一个重要组成部分[24].
近些年来, 机械化学的重要性日益增加, 应用机械化学方法可以解决很多问题. 例如: 以苯胺盐酸盐和过硫酸钾为原材料, 通过机械化学反应合成了聚苯胺. 球磨目前作为提供机械力的工具, 可以大幅度地缩短反应时间, 使用球磨的二步机械化学方法, 可以在不使用大量有机溶剂的情况下, 从相对廉价的氯化铱水合物里面快速地高效合成各种三环金属铱配合物. 在部分情况下, 机械化学发生的同时, 可以加一些助溶剂, 比如在合成Al2O3纳米颗粒的时候, 可以添加一定量的硬脂酸辅助合成, 可以有效地改善颗粒之间的烧结现象[25].
2 机械酶催化及其反应体系在机械研磨的过程中, 由于机械力的作用会产生比较高的热量, 可以激活2个氨基酸使其发生偶联反应, 但是反应条件又足够的温和, 可以防止合成肽的变性, 能够合成要求比较高的多肽结构. 多肽主要是氨基酸经过脱水缩合后形成的产物, 可以在机械力和酶的催化作用下, 展现出更好的对映体转化率. 机械酶催化反应是在机械化学的基础上发展出来的, 是属于机械化学的一个分支. 机械酶催化反应有很多种, 其中, 机械酶催化的第一个反应是1983年Hakulin等[26]在双螺杆挤压机里使用淀粉酶对淀粉进行糖化和液化时提出的. 机械酶催化反应, 是在无溶剂条件下进行的, 无溶剂系统可以模拟酶的自然环境[27]. 2015年, Barbosa等[28]研究了酶在机械力的作用下, 能够从固定的载体中分离, 会导致催化活性逐渐丧失. 2021年, Zhang等[29]用机械酶催化的方法高效地制备了纳米微晶纤维素. 和传统的方法相比, 机械酶催化方法可以显著避免大量溶剂的使用, 提高效率, 从而降低生产成本. 2023年, Ambrose-Dempster等[30]提出将机械酶催化应用到PET(聚对苯二甲酸乙二醇酯)的水解上, 利用反应性老化的球磨循环将全细胞PETase酶降解PET的产率提高了27倍, 此方法与其他的降解方法相比, 需要的溶剂减少了
机械酶催化体系, 相比较传统的方法来说, 有很多的优势. 传统的方法, 通常都是在有溶剂中发生的, 但是机械酶催化反应打破了这一弊端, 提出了一种无溶剂系统, 机械酶催化反应可以很大程度上减少废物的产生, 使得原子经济最大化, 同时很大程度上避免有毒产品的形成, 可以生产出安全无毒的产品, 最大程度地减少添加物质, 降低了生产成本. 对于一些很贵的物质, 机械酶催化反应可以提高昂贵物质的合成效率, 以可以降低成本[31].
无溶剂机械化学技术已经应用到了酶促转化方面, 产生了一个新的领域, 称为机械酶学. 除了已经提到的优点之外, 使用酶的净研磨或LAG(液体辅助研磨技术)[32]提供了额外的好处. 最重要的是, 与普遍存在的稀溶液环境相比较, 不存在大量水可以更好地模拟酶的自然环境.
2.1 低共融体系在机械酶催化反应中, 酶在非常规介质中有着显著的抗性, 例如离子液体、低共熔溶剂等[33]. 在球磨机里面, 用南极假丝酵母脂肪酶B(CALB酶)进行对映选择性拆分, 在2005年的时候, 谢尔顿就提出了“最好的溶剂是没有溶剂”这一观点, 利用了一些反应物在环境温度下就是液体的这一事实, 可以使反应物更加均匀地混合[34].
在糖脂合成的反应中, 应用生物催化和机械化学相结合, 是一个全新的反应体系, 单酰化的模型化合物葡萄糖-6-O-葵酸酯的合成, 在球磨机的辅助条件下, 使用2种不同的非常规的溶解反应系统. 为了提高生产葡萄糖单葵酸酯的生物催化能力, 合成糖脂的性能, 在球磨机的作用下, 进一步使用脂肪酶制剂催化糖和乙烯基化脂肪酸中的酯进行交换, 在降低水分含量的条件下进行合成, 通过这种方法来逆转脂肪酶的水解活性, 有机溶剂、乙酸乙酯、低共熔溶剂同时在无溶剂条件下进行使用[35].
低共熔溶剂的特点有很多, 例如不挥发、无毒、可生物降解等. 它是由氢键的受体和氢键的供体组成的, 通过氢键之间的相互作用, 进而会形成超分子结构, 在室温下是液体. 天然存在和普遍存在的植物代谢物, 都是可以作为氢键的供体和受体, 例如,薄荷醇、糖等. 相关的研究指出, 低共熔溶剂对酶有一定的稳定作用[36], 同时还有着很高的溶解能力. 低共熔溶剂也存在一定的缺点, 与水和有机溶剂相比, 它本身的粘度相对来说比较高. 不过, Hollenbach等[37]认为用机械酶体系, 可以解决它本身的高粘度性质的问题和在不同溶剂系统中底物的溶解问题. 不过, 机械酶学的成功是和溶解度无关的. 在使用球磨机生产葡萄糖单葵酸酯时, 将效率和对流加热进行比较, 评估了不同溶剂系统下的反应, 在优化参数以后, 提出了一种无溶剂的方法, 并且与有机溶剂制成的溶解体系进行比较[38]. 在不添加活化的脂肪酸的低共熔溶剂中, 生产葡萄糖单葵酸酯比在有机溶剂中生产的产率更高, 底物率是低共熔溶剂中的一个重要参数.
在低共熔体系中, 通过机械力提供的球磨装置, 可以实现非常高的产量, 这也说明了低共熔体系是机械酶催化体系中很重要的一个方面, 机械酶催化法可以成功克服半固体的问题[39]. 虽然使用低溶剂反应介质是具有优势的, 但是应该调节这些介质与生物催化和底物之间的相互作用. 在共融体系中, 使用CALB酶或来自米黑根毛霉的脂肪酶作为生物催化剂, 月桂酸底物∶共溶剂(90∶10, φ)的混合物中的叔丁醇可以导致高水平的生物转化率. CALB酶固定化载体, 生物相容性的增加有利于生物转化的进行, 球磨的极性底物表面积扩大, 可以提高果糖的可用性, 进一步提高了生产率. 在通过CALB酶催化的反应中, 使用浓度为0.2 mol∙L−1的果糖, 扩大了碳水化合物脂肪酸酯的酶促合成. 底物在酶微环境中的溶解度和可用性, 可以限制CFAE的产生. 低溶剂介质可以很大程度上减少溶剂的浪费, 避免反应产物的纯化, 进一步的提高反应速率[40−41].
2.2 助溶剂添加体系微量的液体添加剂可以进一步提供一种加速、引导的化学反应性手段, 即液体辅助研磨技术(LAG), 也就是添加少量甚至是微量的离子液体(ILS)或者低共熔溶剂(DES), 来提高反应物混合的均匀度、机械反应性、反应速度, 增强反应性能等, 这个反应和反应物的溶解度没有关系. 参数η通常代表着液体体积和反应物质量的比值, η=0时, 此反应是无溶剂反应; η>10 μL∙mg−1时, 此反应是溶液反应. 江之江等认为当η值在0~1 μL∙mg−1时为标准的LAG反应, 而Kaabel S认为普遍接受的η值范围是0~2 μL∙mg−1. Hammerer等将特定温度下的静态孵育酶促转化过程称为反应性老化, 简称Raging. 液体的极性、碱度以及添加量对机械酶催化反应机理都有十分重要的影响[42].
在机械化学反应中, 主要包括加成、取代、缩合及多组分反应. 在反应中,助溶剂的添加可以明显加快化学反应速率, 可放大性显著增强, 同时可以明显改善反应活性[43], 这个反应会产生很多种的酰胺衍生物, 同时还可以用来合成很多化合物, 例如, 肽、聚合物等. 在此反应中, 适量助溶剂的添加对于反应的发生是至关重要的. Pérez-Venegas等[44]研究了在球磨机里面的CALB酶去拆分苄基化氨基酸酯的办法, 拆分的这个过程是不需要在有机溶剂条件下进行的, 不过需要在反应的过程中添加适量的水作为助溶剂. 反应不需要额外的加热, 而且这个机械酶促反应的产率和有溶剂的条件相比, 产率并没有发生变化, 而且还减少了副产物的形成. 很大程度上减少了反应时间, 并且在这个反应过程中, 不仅让这个反应的工艺优化不止一个数量级, 同时, 也避免酶和原料的浪费, 这个反应过程的酶可以循环利用. 机械酶催化反应中的无溶剂系统能够很好的模拟酶的天然环境. Pérez-Venegas等人研究了机械酶催化方法对手性胺的拆分, 在实验过程中, 添加了二氧六环作为一种研磨助剂, 手性胺是一个很重要的结构单元, 如图2所示[45].
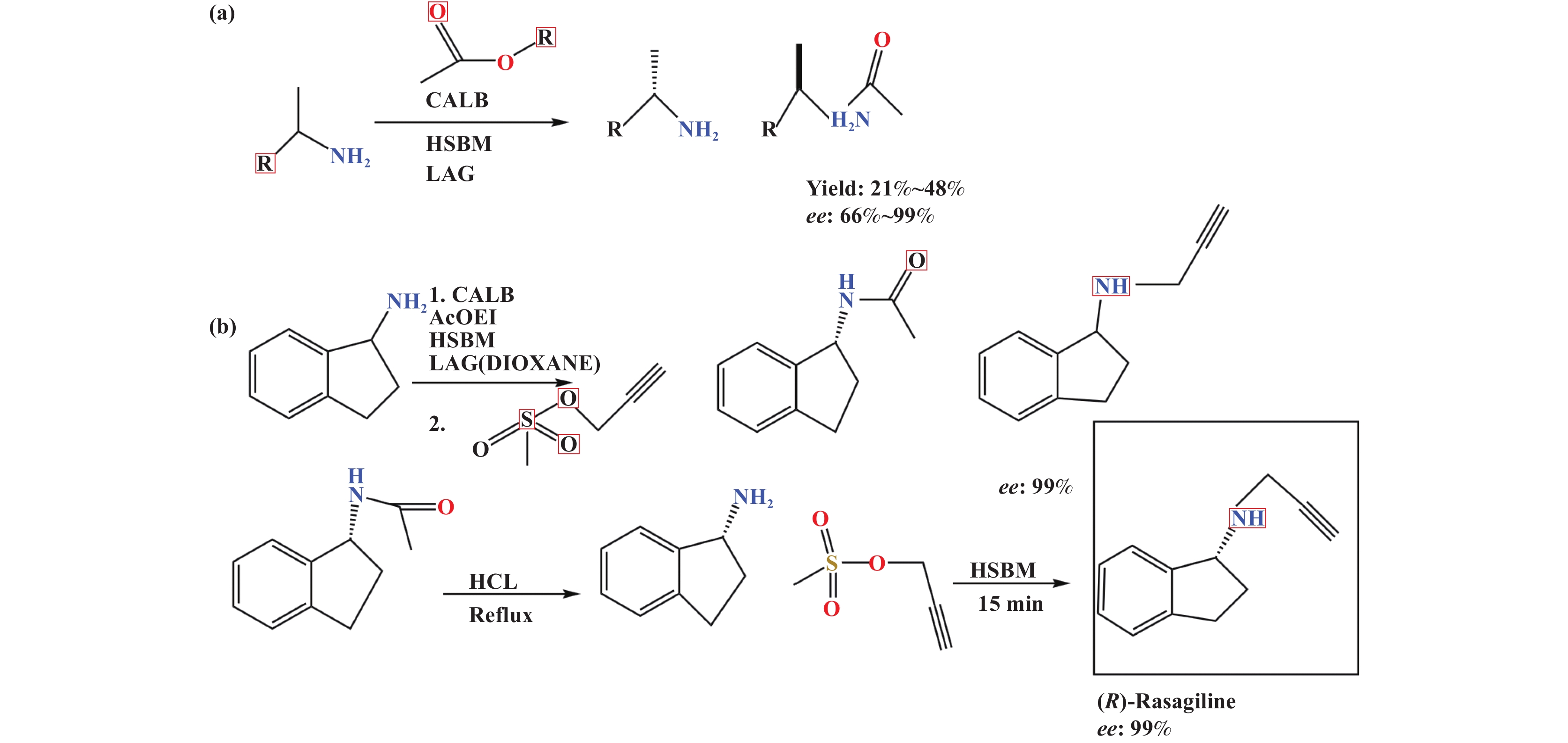
|
图 2 手性胺的机械酶法拆分(a)和两种对映体的合成(b) [45] Fig.2 Mechanoenzymatic resolution of chiral amines (a) and synthesis of both enantiomersiline of Rasag (b) [45] |
LAG技术[46], 通过使用少量的添加剂就可以有效地控制反应的性质, 例如, 改变反应速率, 可以加快或者是减慢反应的发生, 这是机械酶催化体系中比较常见的一种方法. 在机械酶催化的过程中, 研磨是比较常见的一种处理方法, 在研磨的过程中加入一些助溶剂, 可以显著改变物质的生物活性. Mack等通过研究证明了LAG可以改变反应发生的途径. 2014年, Dayaker等[47]进行了磺酰脲类机械的合成开创性研究, 对甲苯磺酰胺与异氰酸正丁酯5% (x) CuCl催化剂存在下, 通过机械球磨可以使反应顺利的进行. 加入CH3NO2作为LAG助溶剂后, 与不添加助溶剂相比, 甲苯磺丁脲的产率在2 h中增加到了90%. 通过这个反应, 我们可以看到了添加助溶剂对反应影响的重要性. LAG在药物合成中也非常重要, 是一种新的合成药性活性化合物的可替代途径. LAG和其他合成条件有着很大的区别, 它本身就是一种非常清洁并且十分有效的反应途径, 而且它的存在, 可以改变很多溶剂不能发生反应的弊端[48], 在化学反应中, 提供了全新的解决方案.
同时还有很多反应未涉及到, 需要我们更加积极地去进行探索. 当一些反应在无溶剂条件下难以反应, 或者在反应速率上并没有明显的优势时, 人们发现引入微量液体可以明显改善反应活性[49], 比如在上述多肽合成反应中, 加入微量EtOAc 能够使反应速率显著增强. 向机械化学反应中加入微量液体可以模拟溶液环境, 为反应提供更为适合的微环境. 在无机化学领域[50], 微量液体的加入提高了MOF等无机材料[51]的制备速度.
在部分LAG促进的有机合成反应中, LAG添加剂对反应的影响, 和它的物理化学性质有着显著的相关性. 如何从反应机理角度解释该类反应中出现的LAG效应, 可能会成为解释有机反应中普遍存在的溶剂效应的一个强有力证据, 进而成为理解有机反应中普遍存在溶剂效应的关键. 通过LAG技术, 可以对化学反应中的溶剂分子进行下一步的研究, 探讨反应过程中是否会需要液体分子的辅助, 并且能够测定促进反应完成所需要的液体用量. 得到的结果或许可以促进高毒性、高挥发性溶剂的研究, 或者是通过它和绿色溶剂进一步混合了, 进一步得到保持反应活性的安全反应溶剂体系[52].
3 机械酶催化反应中常用的酶在机械酶的催化反应中, 不是所有的酶都可以应用在这个体系里面的. 目前, 在机械酶催化体系中, 比较常见的酶有纤维素酶、几丁质酶、脂肪酶、淀粉酶、蛋白酶、果胶酶等. 机械酶催化的特点是无溶剂体系, 有些酶只能是在有机溶剂的系统下才可以发挥作用, 在无溶剂系统里面可能会丧失原有的活性. 并且在机械力(剪切、研磨、振荡等)的作用下, 有些酶会因为机械作用力破坏掉酶本来的活性, 导致失去原有的催化能力. 机械酶催化能够促进酶催化反应的发生, 进一步实现对底物的修饰、聚合反应, 并且机械酶催化可以充分发挥酶的选择性和专一性. 在传统的反应中, 酶在有机溶剂中的溶解度有限, 但是在机械酶催化反应里面, 可以有效地克服这个弊端. 酶和机械能的结合, 不仅可以减少有机溶剂用量, 同时还可以有效地加快反应的速率, 解决底物的溶解度问题, 降低成本, 实现绿色化学等. 机械力促进酶反应, 是机械酶催化体系最重要的特点之一, 酶在机械力的作用条件下, 可以导致酶的活性发生改变, 这其中的原因可能是在机械力的挤压下, 会导致酶的空间结构发生改变, 进一步导致催化中心暴露. 机械酶催化的效率可以通过调节机械力的频率、反应时间、反应温度来控制. 机械力的强度和作用时间能够使蛋白质发生不同程度的折叠和展开, 会导致蛋白质恢复原始构象的能力不同, 从而影响酶的催化活性. 氨基酸在机械力的作用下作为催化剂促进醛醇反应, 这一过程证明了氨基酸在机械力的作用下具有较高的稳定性及立体选择性.
机械酶的催化机理是我们最应该关心的问题, 很多学者都对这一方面进行了详细展开和论述[52]. 酶在受到机械力的作用后仅会显示出一些表观结构轻微的损伤, 分子大小并没有减小, 并且保留了75%的催化活性. 利用X射线光谱对其进行氮含量分析, 最后证实了酶催化活性的降低不是酶变性所导致, 而是由于酶发生局部降解、蛋白质转变为肽或者氨基酸等所致. 机械酶促反应后, 在回收过程中与有机溶剂接触是导致酶失活的原因. 利用圆二色谱证明了有机溶剂能够使CALB的二级结构丢失, 导致酶活性降低. 利用可溶性II型猪胰脂肪酶对酶促反应动力学结果研究发现[53]: 酶在有机溶液中没有表现出活性, 但当反应在机械化学条件下进行时, 检测到显著的非对映选择性的酰化产物转化, 说明机械力可以诱导所需的生物转化, 机械能的外加作用有利于增强酶的催化活性. 有很多的酶被发现可在机械力的作用下激活酶本身的活性, 从而推动了机械酶催化领域的不断发展. 脂肪酶是最早应用在机械酶学催化反应上的酶, 主要利用其催化合成反应及外消旋化合物的拆分等. 近年来利用纤维素酶对高分子聚合物进行解聚及回收的研究逐渐增多, 此外还有几丁质酶、淀粉酶等.
3.1 纤维素酶纤维素酶的降解条件比较温和、高效, 它本身在纤维素的转化利用中有着广泛的应用价值[54]. 纤维素酶在食品行业的应用有很多, 例如在啤酒生产中, 纤维素酶可以增强过滤的性能, 进一步提高啤酒产率. 在白酒生产中, 纤维素酶可以降解原料中的大量纤维素, 最终可以生成小分子的葡萄糖, 进一步提高原料中纤维素的利用率. Hammerer等[55]探索黑曲霉纤维素酶和里氏木霉纤维素酶在η=0.95 µL·mg–1时酶促反应动力学,证明了2种酶都符合酶促反应双曲线模型,酶添加量达到某一点后并不能与水解产率呈正向相关,可能是因为纤维素表面的酶过量,不利于反应的发生.
植物中含有丰富的木质纤维素, 它是由纤维素、半纤维素以及木质素紧密交织形成的, 如图3所示[56], 纤维素是一种线性葡萄糖聚合物, 半纤维素是一种支化木糖杂聚物, 木质素是一种异质多酚支化聚合物.
纤维素酶通常来自于微生物, 比如细菌、真菌等. 纤维素酶包括3种不同活性的酶, 例如, 内切葡聚糖酶、外切葡聚糖酶和β-葡糖苷酶. 这3种酶作为糖基水解酶, 通常作为水分存在于含有纤维素材料的表面. 由此就提出了无溶剂的机械酶方法应用在纤维素糖化领域, 进一步避免了纤维素在溶剂里面受溶解度限制的问题. Hammerer等[56]研究已经表明, 冻干纤维素酶、微晶纤维素和水的混合物, 球磨30 min, 11%的纤维素会完成水解, 这说明了3种类型的纤维素酶都对球磨有弹性[57].
反应性老化产生的葡萄糖比在水的存在下产生的葡萄糖要多出3倍, 纤维素酶反应性老化反应后剩余的纤维素主要是纤维素纳米晶体, 它可以用作医疗器械的包装材料[58]. 在机械酶催化的过程中, 无溶剂的条件下, 更能够模拟纤维素酶的自然选择的条件, 可以实现结晶纤维素或者是天然物质的快速、清洁、高效地水解.
3.2 几丁质酶甲壳素是地球上含量最丰富的一种含氮生物聚合物, 它可以作为一种食品生产过程中的补充剂. 几丁质酶水解, 从几丁质生物质中生产高纯度N-乙酰氨基葡萄糖, 如图4. 不过这个过程可能会有裂解得不溶性、非反应性得聚合物和所需的试剂比较苛刻等问题[59]. 在水性的悬浮液里面使用几丁质分解酶或者是几丁质酶可以提供一种更加环保的途径, 但是这个途径的反应速度是缓慢的, 还需要对生物质进行化学预处理. Therien等[60]证明了几丁质酶在没有大量水的情况下, 不仅可以使反应效率提高很多倍, 还可以提高选择性, 几丁质酶会产生高度浓缩的N-乙酰葡糖胺产物. 在反应性老化条件下, 仅需要0.7% (质量分数)的几丁质酶就能达到>30%的几丁质水解率, 其中92%是N-乙酰葡糖胺. 在缓冲液进行的反应中可以得到低5倍的N-乙酰葡糖胺产率. 和纤维素酶不同的是, 几丁质酶优化的反应性老化条件里面需要进行5 min的研磨, 然后是进行12 h的老化反应, 并且需要重复很多次的循环. 最重要的是, 在反应性老化条件下的几丁质酶反应, 是不需要化学预处理的商业纯化几丁质[61]. 几丁质酶最适宜的反应条件是不存在大量水的时候, 机械酶催化反应是在无溶剂系统或者存在少量溶剂下发生的, 正适宜几丁质酶反应, 并且反应的速率还比传统条件下高出来很多倍.
3.3 脂肪酶脂肪酶是工业界和学术界很常用的一种生物催化剂, 脂肪酶有着很好的区域选择性、立体选择性和底物特异性. 脂肪酶在介质中很稳定, 并且在离子液体和超临界液体里的应用十分广泛. 将脂肪酶固定在惰性的不溶性载体上可以进一步提高脂肪酶的活性和稳定性, 同时还可以方便回收生物催化剂[61].
固定在丙烯酸树脂上的来自南极假丝酵母的脂肪酶B是最常用的生物催化剂之一, 它主要用于酯化、酯交换和水解反应等. CALB酶催化ω-十五内酯开环聚合[62], 通过反应挤出得到ω-十五内酯. 在90~130 ℃的反应温度下, 通过在甲苯中的反应性挤出得到了大于99%的产率, 并且与溶液中方法相比, 这个方法所达到的聚合度更高. Hammerer等[63]首次报道了脂肪酶在机械酶催化反应中的应用, 证明固定化CALB对机械力的高抵抗力. 随后又使用CALB作为生物催化剂和乙酸异丙烯脂作为了酰化剂进行α-甲基苯甲醇的去消旋化[64], 说明了脂肪酶很适用于机械酶催化领域.
3.4 蛋白酶蛋白酶是一种可以通过水解肽键来催化蛋白质分解的酶, 蛋白酶可以催化水解或者是酰胺键的形成. 在球磨过程中, 可以利用蛋白酶介导肽键的合成, 如图5所示. 蛋白酶反应的平衡有利于肽的水解, 在添加有机共溶剂的情况下, 平衡可能会向肽合成的方向进行转移[65]. 寡肽和二肽是比较常见的肽, 添加肽的药物可以用于治疗骨质疏松症、糖尿病、免疫系统疾病等. 在酶促肽合成中, 将氨基酸和未被保护的侧链进行偶联, 不需要在苛刻的反应条件下进行. 为了避免蛋白酶的竞争性、水解活性, 酶的稳定性和溶解度就变成了一个需要解决的问题. 机械化学反应通常在不存在溶剂或者是存在少量液体添加剂的条件下发生, 这是一个控制蛋白酶的反应活性的新方案[66]. 2017年, Hernández等[67]拓展了机械酶促反应中酶的适用范围, 用蛋白酶催化形成酰胺键, 产生了α和α/β二肽. 酶在2 h的球磨处理后仍然保持活性, 并且反应的效率很高, 可以看出机械酶催化不限于固定化酶, 少量的蛋白酶激活剂L-半胱氨酸, 可以发现木瓜蛋白酶在肽键形成中的活性有所增加, 就像水合物引入反应混合物中一样. 在双螺杆挤出机里面, 将氨基酸酯、木瓜蛋白酶、L-半胱氨酸和一定量的Na2CO3·10H2O混合, 与在球磨中观察到的趋势可以很好地吻合, 其中氨基酸酯在有水的情况下会导致较低的转化率. 蛋白酶可以在不存在溶剂的情况下有效地促进肽键的形成. 机械化学方法提供了一种新的手段来限制肽的水解, 例如寡肽的无溶剂机械酶促合成. 机械酶学可以减轻与溶解度的限制, 进一步通过SPPS合成或通过天然蛋白质裂解分离的较大肽片段的酶促缩合的有用技术. 在机械酶催化反应体系中, 可以有效地控制蛋白酶活性, 同时蛋白酶在机械能的作用下还可以生物催化氨基酸寡聚, 并且表现出比较高的聚合度.
3.5 淀粉酶淀粉酶的研究已经进行了很长的一段时间. 1978年, Linko等[68]研究发现, 在温和的挤压条件下, α-淀粉酶的活性可以完全保留在小麦、黑麦里. Linko等研究发现, 如果淀粉在135 ℃和150 r∙min−1下, 用热稳定的Thermany1α-淀粉酶(η = 1.0 μL∙mg−1)挤出液化为低聚物, 那么大麦淀粉的糖化会进行的更快. 上述反应也可以在挤出机中进行, 将葡萄糖淀粉酶加入到螺杆里面可以使该反应发生, 不过这个过程的反应速率相对来说是缓慢的. 在反应性老化期间[69], 淀粉酶可以把几丁质酶制剂里面的冷冻保护剂水解变成葡萄糖, 这说明淀粉酶是可以和反应性老化这一条件相容的. 淀粉酶在机械的挤压条件下, 是可以完全保留它本身的活性的, 并且在挤压的条件下还可以进一步加快反应速率, 使反应容易进行, 所以淀粉酶是很适用于机械酶催化反应的.
4 总结与展望机械化学经过了数十年的研究, 已在无机化学、药物、冶金等方面都有很好的应用, 机械化学的出现完成很多之前很难发生的反应. 机械作用虽然有很大的剪切力, 但经研究证明, 许多酶, 例如蛋白酶、脂肪酶、纤维素酶、几丁质酶、葡萄糖苷酶、聚对苯二甲酸乙二酯酶等在机械作用下仍然可以保持自身的活性. 在机械酶学的背景下, 进一步提高蛋白质的稳定性是很有必要的, 进而可提高产量和促进酶的回收. 机械力对酶促反应有着很好的增强作用, 同时疏水性和研磨条件、研磨强度等都会影响酶的稳定性. 从原理上来说, 任何的物理混合方法都可以应用在机械酶学方面. 通过在研磨和老化期之间循环来调整机械化学反应是一种有前途的策略, 可以进一步加速酶促反应, 同时还可以减少能量的使用并防止酶变性. 固定化酶的彻底研磨对机械化学过程中的生物催化剂的还原活性没有直接的影响, 不过, 有研究表明活化以后的酶活性几乎是增加了一个数量级. 机械酶学已经产生了立体选择性、区域选择性、立体特异性等. 机械酶催化反应并不是万能的, 在球磨处理的时候, 可能也会存在机械力过强引起酶失活或者底物被破坏等问题. 我们对这个反应的研究还远远不够, 例如, 在机械力过强时的酶机制, 以及它们在溶液中的酶功能是怎样的, 这些都是未知的. 经典的酶动力学方法和模型不适用于无溶剂混合物, 需要新的技术和理论来解决这些问题, 只有更好地理解机械酶学, 才可以有效地解决上述问题. 分子动力学模拟(MD)是一种利用牛顿力学理论通过计算机模拟来评估反应过程中变化的有效手段, 可以有效将计算机科学与“机械酶学”领域交叉融合, 能够为机械条件下酶催化反应的机理提供数据支撑. 酶在机械力的作用下如何能够从产物中分离, 增加其重复使用次数也是需要考虑的因素之一. 机械酶学, 具有为更加可持续的未来做出贡献的巨大的潜力, 怎样能够充分掌握它、利用它, 需要更多的研究人员继续进行探索. 机械酶催化是一个不断发展的体系, 已经受到了越来越多学者的关注, 带来了很多新的挑战和机会, 未来还需要我们继续探索, 以发掘出新的优势.
| [1] |
Rapid fractionation of pseudo-lignin with high yield by chemical and mechanochemical methods[J]. Ind Crops Prod, 2024, 214: 118499.
DOI:10.1016/j.indcrop.2024.118499 |
| [2] |
Solvent-free synthesis of zeolite catalysts[J]. Sci China Chem, 2015, 5(8): 6–13.
DOI:10.1007/s11426-014-5252-2 |
| [3] |
Mechanochemistry and organic synthesis: From mystical to practical[J]. Green Chem, 2018, 20(7): 1435–1443.
DOI:10.1039/C7GC03797J |
| [4] |
Microwave mediated lipase-catalyzed synthesis of n-butyl palmitate and thermodynamic studies[J]. Biocatal Agric Biotechnol, 2020, 29: 101741.
DOI:10.1016/j.bcab.2020.101741 |
| [5] |
Ultra-fast mechanochemical strategy to obtain stable colloidal dispersions of MWCNT in hydrophilic media: Never has been so easy[J]. J Mol Liq, 2024, 401: 124703.
DOI:10.1016/j.molliq.2024.124703 |
| [6] |
Preparation of Fe3Si-Al2O3 nanocomposite powders by mechanochemical reaction of Fe3O4-Si-Al powder mixtures[J]. Int J Appl Ceram Technol, 2013, 10(6): 900–907.
DOI:10.1111/ijac.12008 |
| [7] |
Mechanochemical synthesis of fluoride-ion conducting glass and glass-ceramic in ZrF4-BaF2 binary system[J]. Sci Rep, 2024, 14(1): 8808.
DOI:10.1038/s41598-024-59040-4 |
| [8] |
Mechanoenzymatic transformations in the absence of bulk water: A more natural way of using enzymes[J]. ChemBioChem, 2020, 21(6): 742–758.
DOI:10.1002/cbic.201900567 |
| [9] |
Song Xiao-lan(宋晓岚), Qiu Guan-zhou(邱冠周), Yang Hua-ming(杨华明). Progress in mechanochemistry and its applications(机械化学及其应用研究进展)[J]. Metal Mine(金属矿山), 2004, 4 (11): 34−38.
|
| [10] |
On endothermic decompositions obtained by pressure; Part Ⅱ, transformations of energy by shearing stress[J]. Am J Sci, 1893, s3-46(276): 413–420.
DOI:10.2475/ajs.s3-46.276.413 |
| [11] |
Mechanical alloying: Technology and properties of prepared materials[J]. Key Eng Mater, 1993, 81(6): 17–24.
DOI:10.4028/www.scientific.net/KEM.81-83.17 |
| [12] |
Mechanochemistry: Opportunities for new and cleaner synthesis[J]. Chem Soc Rev, 2012, 41(1): 413–447.
DOI:10.1039/C1CS15171A |
| [13] |
Relevant parameters for the mechanochemical synthesis of bimetallic supported catalysts[J]. Crystals, 2023, 13(12): 1685.
DOI:10.3390/cryst13121685 |
| [14] |
The historical development of mechano-chemistry[J]. Chem Soc Rev, 2013, 42(18): 7649–7659.
DOI:10.1039/c2cs35442j |
| [15] |
Study of a mechanochemical transformation in iron pyrite[J]. J Alloys Compd, 2000, 298(1/2): 306–309.
DOI:10.1016/S0925-8388(99)00659-3 |
| [16] |
The photoregulation of a mechanochemical polymer scission[J]. Nat Commun, 2018, 9(1): 350–354.
DOI:10.1038/s41467-017-02724-5 |
| [17] |
Mechanochemical synthesis: Mechanical and chemical factors[J]. J Mater Synth Process, 2000, 8(3/4): 205–211.
DOI:10.1023/A:1011316227193 |
| [18] |
Aqua (benzene-1,3-dicarboxylato) zinc (II)[J]. Acta Crystallogr C, 2001, 57(6): 704–705.
DOI:10.1107/S0108270101004772 |
| [19] |
Mechanochemical treatment of refractory pyrite[J]. Miner Eng, 1997, 10(10): 1119–1125.
DOI:10.1016/S0892-6875(97)00098-8 |
| [20] |
Li Xi-ming(李希明), Cheng Jia-yong(陈家镛). Application of mechanical chemical industry in resource and material chemical industry and environmental protection(机械化学在资源和材料化工及环保中的应用)[J]. Eng Chem Metall(化工冶金), 2000, 21 (4): 443−448.
|
| [21] |
Selective extraction of flavonoids from Sophora flavescens Ait by mechano-chemistry[J]. Molecules, 2016, 21(8): 989.
DOI:10.3390/molecules21080989 |
| [22] |
Mechanochemistry of inorganic and organic systems: What is similar, what is different?[J]. Chem Soc Rev, 2013, 42(18): 7719–7738.
DOI:10.1039/c3cs60052a |
| [23] |
Towards medicinal mechanochemistry: Evolution of milling from pharmaceutical solid form screening to the synthesis of active pharmaceutical ingredients[J]. Chem Commun, 2016, 52(50): 7760–7781.
DOI:10.1039/C6CC02015A |
| [24] |
Green chemistry: Principles and practice[J]. Chem Soc Rev, 2010, 39(1): 301–312.
DOI:10.1039/B918763B |
| [25] |
Nickel catalysis in a high speed ball mill: A recyclable mechano-chemical method for producing substituted cyclooctatetraene compounds[J]. ACS Sustain Chem Eng, 2016, 4(5): 2464–2469.
DOI:10.1021/acssuschemeng.6b00363 |
| [26] |
Enzymatic conversion of starch in twin-screw HTST-extruder[J]. Starch, 1983, 35(12): 411–414.
DOI:10.1002/star.19830351203 |
| [27] |
Mechanistic enzymology in non-aqueous media[J]. Pure Appl Chem, 1992, 64(8): 1157–1163.
DOI:10.1351/pac199264081157 |
| [28] |
Strategies for the one-step immobilization-purification of enzymes as industrial biocatalysts[J]. Biotechnol Adv, 2015, 33(5): 435–456.
DOI:10.1016/j.biotechadv.2015.03.006 |
| [29] |
High yielding, one-step mechano-enzymatic hydrolysis of cellulose to cellulose nanocrystals without bulk solvent[J]. Bioresour Technol, 2021, 331: 125015.
DOI:10.1016/j.biortech.2021.125015 |
| [30] |
Mechanoenzymatic reactions for the hydrolysis of PET[J]. RSC Adv, 2023, 13(15): 9954–9962.
DOI:10.1039/D3RA01708G |
| [31] |
Investigations of thermally controlled mechanochemical milling reactions[J]. ACS Sustain Chem Eng, 2019, 7(19): 16301–16309.
DOI:10.1021/acssuschemeng.9b03319 |
| [32] |
Recent applications of mechanochemistry in enantioselective synthesis[J]. Tetrahedron Lett, 2019, 60(27): 1749–1757.
DOI:10.1016/j.tetlet.2019.05.065 |
| [33] |
Organic synthesis by twin screw extrusion (TSE): Continuous, scalable and solvent-free[J]. Green Chem, 2017, 19(6): 1507–1518.
DOI:10.1039/C6GC03413F |
| [34] |
Green solvents for sustainable organic synthesis: State of the art[J]. Green Chem, 2005, 7(5): 267–278.
DOI:10.1039/b418069k |
| [35] |
Lipase-mediated mechanoenzymatic synthesis of sugar esters in dissolved unconventional and neat reaction systems[J]. ACS Sustain Chem Eng, 2022, 10(31): 10192–10202.
DOI:10.1021/acssuschemeng.2c01727 |
| [36] |
Ternary deep eutectic solvents for effective biomass deconstruction at high solids and low enzyme loadings[J]. Bioresour Technol, 2019, 27(9): 281–286.
DOI:10.1016/j.biortech.2019.01.126 |
| [37] |
Enzymatic synthesis of glucose monodecanoate in a hydrophobic deep eutectic solvent[J]. Int J Mol Sci, 2020, 21(12): 4342.
DOI:10.3390/ijms21124342 |
| [38] |
Liquid structrue of the chloride-urea deep eutectic solvent(reline) from neutron diffraction and atomistic modelling[J]. Green Chem, 2016, 18(4): 276–285.
DOI:10.1039/c5gc02914g |
| [39] |
Mechanochemical and mechanoenzymatic synthesis of pharmacologically active compounds: A green perspective[J]. ACS Sustain Chem Eng, 2020, 8(24): 8881–8893.
DOI:10.1021/acssuschemeng.0c01645 |
| [40] |
Mechanoenzymatic reactions-challenges and perspectives[J]. ChemCatChem, 2023, 15(21): e202300656.
DOI:10.1002/cctc.202300656 |
| [41] |
Wei Lu(韦 露), Fan You-jun(樊友军). Progress of deep eutectic solvents and their applications(低共熔溶剂及其应用研究进展)[J]. Chemistry(化学通报), 2011, 74 (4): 333−339.
|
| [42] |
Solvent-assisted mechanochemistry[J]. Chem Commun, 2013, 49(4): 334–348.
DOI:10.1039/C2CC35694E |
| [43] |
Environmentally benign peptide synthesis using liquid-assisted ball-milling: Application to the synthesis of Leu-enkephalin[J]. Green chemistry, 2013, 15(5): 1116–1120.
DOI:10.1039/c3gc40302e |
| [44] |
Mechanochemical enzymatic resolution of N-benzylated-β3-amino esters[J]. Beilstein J Org Chem, 2017, 13(1): 1728–1734.
DOI:10.3762/bjoc.13.167 |
| [45] |
Mechanoenzymatic resolution of racemic chiral amines, a green technique for the synthesis of pharmaceutical building blocks[J]. Tetrahedron, 2018, 74(44): 6453–6458.
DOI:10.1016/j.tet.2018.09.029 |
| [46] |
Jiang Zhi-jiang(江之江). Liquid-accelerated mechano- chemical C—Cl bond activation and cross-coupling reactions(微量液体加速的机械化学 C—Cl 键活化与交叉偶联反应)[D]. Hangzhou(杭州): Zhejiang University of Technology(浙江工业大学), 2019.
|
| [47] |
Catalytic room-temperature C—N coupling of amides and isocyanates by using mechanochemistry[J]. ChemSusChem, 2020, 13(11): 2966–2972.
DOI:10.1002/cssc.201902576 |
| [48] |
Current topics in mechanistic enzymology[J]. Biochemistry, 2019, 58(52): 5197–5197.
DOI:10.1021/acs.biochem.9b01082 |
| [49] |
Mechanochemical oxidative mannich reaction: Evaluation of chemical and mechanical parameters for the mild and chemoselective coupling of N‐tert‐butoxycarbonyltetrahydroquinolines and ketones[J]. Eur J Org Chem, 2016, 3(2): 5340–5344.
DOI:10.1002/ejoc.201600987 |
| [50] |
Mechanoenzymology: State of the art and challenges towards highly sustainable biocatalysis[J]. ChemSusChem, 2021, 14(13): 2682–2688.
DOI:10.1002/cssc.202100624 |
| [51] |
In situ monitoring of the mechanosynthesis of the archetypal metal-organic framework HKUST-1: Effect of liquid additives on the milling reactivity[J]. Inorg Chem, 2017, 56(11): 6599–6088.
DOI:10.1021/acs.inorgchem.7b00707 |
| [52] |
A high-throughput assay platform for next-generation mechanistic enzymology and application[J]. Biophys J, 2020, 118(3): 535A.
DOI:10.1016/j.bpj.2019.11.2935 |
| [53] |
Mechanoenzymatic reactions involving polymeric substrates or products[J]. ChemSusChem, 2022, 15(7): e202102084.
DOI:10.1002/cssc.202102084 |
| [54] |
Biomass pretreatment with reactive extrusion using enzymes: A review[J]. Ind Crops Prod, 2018, 12(2): 329–339.
DOI:10.1016/j.indcrop.2018.05.069 |
| [55] |
Solvent-free enzyme activity: Quick, high-yielding mechanoenzymatic hydrolysis of cellulose into glucose[J]. Angew Chem Int Ed, 2018, 130(10): 2651–2654.
DOI:10.1002/ange.201711643 |
| [56] |
Lignin valorization through catalytic lignocellulose fractionation: A fundamental platform for the future biorefinery[J]. ChemSusChem, 2016, 9(13): 1544–1558.
DOI:10.1002/cssc.201600237 |
| [57] |
Mechanical treatment effect on the cellulolytic specimen activity[J]. Russ J Appl Chem, 2010, 8(3): 1106–1108.
DOI:10.1134/S1070427210060388 |
| [58] |
Cellulose biomaterials for tissue engineering[J]. Front Bioeng Biotechnol, 2019, 7(11): 45.
DOI:10.3389/fbioe.2019.00045 |
| [59] |
Enzymatic properties of β-N-acetylglucosaminidases[J]. Appl Microbiol Biotechnol, 2018, 10(2): 93–103.
DOI:10.1007/s00253-017-8624-7 |
| [60] |
Mechanoenzymatic breakdown of chitinous material to N‐acetylglucosamine: The benefits of a solventless environment[J]. ChemSusChem, 2019, 12(15): 3481–3490.
DOI:10.1002/cssc.201901310 |
| [61] |
Solvent-free esterifications mediated by immobilized lipases: A review from thermodynamic and kinetic perspectives[J]. Catal Sci Technol, 2021, 11(17): 5696–5711.
DOI:10.1039/D1CY00696G |
| [62] |
Novozym 435: The “perfect” lipase immobilized biocatalyst[J]. Catal Sci Technol, 2019, 9(10): 2380–2420.
DOI:10.1039/C9CY00415G |
| [63] |
Towards con-trolling the reactivity of enzymes in mechanochemistry: Inert surfaces protect β‐glucosidase activity during ball milling[J]. ChemSusChem, 2020, 13(1): 106–110.
DOI:10.1002/cssc.201902752 |
| [64] |
From synthesis of amino acids and peptides to enzymatic catalysis: A bottom‐up approach in mechanochemistry[J]. ChemSusChem, 2018, 11(9): 1410–1420.
DOI:10.1002/cssc.201800113 |
| [65] |
Mechanochemical enzymatic kinetic resolution of secondary alcohols under ball‐milling conditions[J]. ChemCatChem, 2016, 8(10): 1769–1772.
DOI:10.1002/cctc.201600455 |
| [66] |
Mechanochemically driven transformations in organotin chemistry: Stereochemical rearrangement, redox behavior and dispersion-stabilized complexes[J]. J Am Chem Soc, 2018, 140(46): 15934–15942.
DOI:10.1021/jacs.8b09862 |
| [67] |
Mechanoenzymatic peptide and amide bond formation[J]. Green Chem, 2017, 19(11): 2620–2625.
DOI:10.1039/C7GC00615B |
| [68] |
Retention of amylolytic activity in HTST-extrusion cooking[J]. Kemia-Kemi, 1978, 5(12): 691–698.
|
| [69] |
Efficient enzymatic hydrolysis of biomass hemicellulose in the absence of bulk water[J]. Molecules, 2019, 24(23): 420–432.
DOI:10.3390/molecules24234206 |
 2024, Vol. 38
2024, Vol. 38





