布洛芬是一种重要的非甾体抗炎药, 具有镇痛、退热等作用, 可以缓解风湿性关节炎和骨关节炎等[1-2].布洛芬分子中存在一个手性中心, 故具有一对对映体: S-布洛芬和R-布洛芬[3].药理实验表明, 布洛芬的药理活性主要由S-型体现, 而R-型则可引起红疹、胃灼热、恶心呕吐等副作用[4-5].在临床上, 使用S-布洛芬不仅可降低诱发潜在毒性的可能性, 而且可减少缓释剂、控释剂等制剂的使用[6].所以对外消旋布洛芬进行手性拆分, 在减少用药量和毒副作用等方面具有重要意义.
布洛芬的拆分有两种途径:布洛芬的选择性酯化和布洛芬酯的选择性水解[7-9], 通过布洛芬的酯化反应进行拆分的报道较多[10-12], 而通过选择性水解反应进行布洛芬拆分的报道还很有限, 且拆分效果也较差[13-15].
酶促拆分法因其对映体选择性好、反应条件温和、对环境友好等优点而备受关注[16-18]; 利用脂肪酶的立体选择性对外消旋布洛芬进行手性拆分是获得单一对映体的有效途径之一[19-21].基于此, 我们以布洛芬酯为反应底物, 缓冲溶液为主要反应介质, 脂肪酶为生物催化剂, 通过对布洛芬酯的结构、表面活性剂、缓冲溶液pH、反应温度及添加有机溶剂等反应条件的优化, 大大提高了通过布洛芬乙酯的选择性水解反应进行布洛芬拆分的效果.
1 实验部分 1.1 试剂与仪器布洛芬(质量分数98%)、曲拉通X-100、南极假丝酵母脂肪酶(CAL-B, 固定在来自酵母的重组体的免疫珠150上), 上海阿拉丁生化科技股份有限公司; 正己烷(色谱纯)、异丙醇(色谱纯), 西陇科学股份有限公司; 其它试剂均为国产分析纯.所有试剂使用前未经任何处理.
高效液相色谱(HPLC, Waters-2707), 江苏迪沃特仪器设备科技有限公司.
1.2 布洛芬乙酯的合成[22]将2 g布洛芬和5 mL乙醇加入25 mL具塞锥形瓶中, 滴加3~5滴浓硫酸, 于60 ℃恒温培养振荡器(200 r/min)中反应4 h, 旋蒸除去乙醇; 粗产物通过柱层析分离纯化〔洗脱剂为V(乙酸乙酯):V(石油醚)=1:5〕得到目标产物.
1.3 布洛芬乙酯的水解反应在10 mL具塞锥形瓶中分别加入0.1 mmol(0.0234 mg)布洛芬乙酯、15 mg CAL-B、80 mg曲拉通X-100、50 μL二氯甲烷和950 μL缓冲溶液(硼砂-硼酸, pH 9.0), 于30 ℃恒温培养振荡器(200 r/min)中反应48 h, 反应结束后用乙酸乙酯萃取, 萃取液用高效液相色谱仪测定剩余S-布洛芬乙酯的含量和光学纯度.
1.4 分析方法色谱柱: Chiralpak AD-H(Daicel chemical, 4.6 mm×250 mm), 流动相:正己烷-异丙醇(体积比为99:1), 流速: 1 mL/min, 检测器波长: 225 nm, 柱温: 25 ℃. S-布洛芬乙酯剩余率(C)和对映体过量值(ees)的计算公式如下:
| $ \begin{aligned} &\mathrm{C}=\frac{S}{S_{0}}\\ &\mathrm{ee}_{\mathrm{s}}=\frac{S-R}{S+R} \end{aligned} $ |
式中, S0为水解反应前S型布洛芬乙酯的量; S和R为水解反应后, S和R型布洛芬乙酯的剩余量.
2 结果与讨论 2.1 表面活性剂对酶促拆分布洛芬乙酯效果的影响在反应体系中分别加入了不同的表面活性剂, 考察其对CAL-B催化拆分布洛芬乙酯的转化率和对映体选择性的影响, 结果如表 1所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 10 mg CAL-B, 100 mg表面活性剂, 1 mL缓冲溶液(pH=7.0), 30 ℃反应3 d.
| 表 1 表面活性剂对酶促拆分布洛芬乙酯效果的影响 Table 1 Effect of surfactants on enzymatic resolution of ibuprofen ethyl ester |
由表 1可知, 加入曲拉通X-100时的拆分效果最好, 得到了83%的C和60%的ees值; 吐温60和吐温20的效果也较好, 分别得到了52%和54%的ees值, 但C较低, 分别为20%和24%.而聚乙二醇800和聚乙二醇10 000的效果则较差, 加入聚乙二醇辛基苯基醚后则基本没有对映体选择性.因此, 选择曲拉通X-100为最佳的表面活性剂.
接下来又考察了曲拉通添加量(50~200 mg)对水解拆分效果的影响.由图 1可知, 当曲拉通的用量为80 mg时, C和ees值分别为76%和68%;当曲拉通的用量低于80 mg时, 尽管ees值有所提高, 但C却大幅降低; 而当曲拉通的用量高于80 mg时, C有所提高, 但其ees值却明显降低.因此, 综合考虑C值和ees值, 选择80 mg为曲拉通的最佳用量.
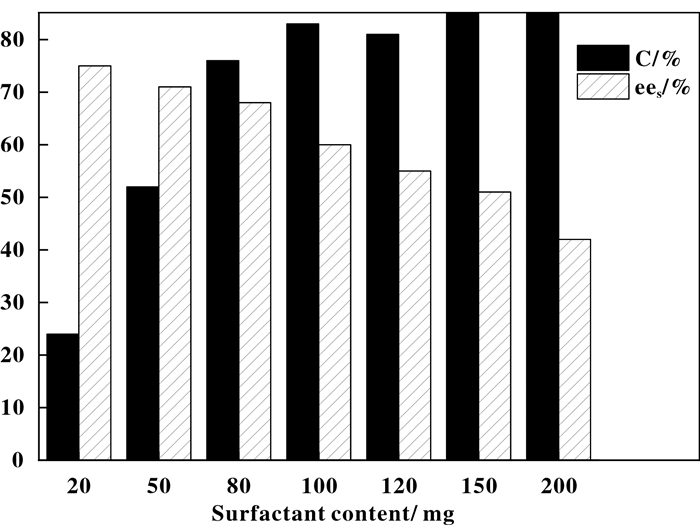
|
图 1 表面活性剂用量对酶促拆分效果的影响 Fig.1 Effect of surfactant dosage on enzymatic resolution |
反应介质对酶促反应影响极大, 不仅影响酶的活性, 还会影响反应底物及酶的溶解度.因此向缓冲溶液中加入不同的有机溶剂来考察反应介质对水解拆分效果的影响, 结果如表 2所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 10 mg CAL-B, 80 mg曲拉通X-100, 50 μL有机溶剂, 950 μL缓冲溶液(pH=7.0), 30 ℃反应3 d.
| 表 2 添加有机溶剂对酶促拆分效果的影响 Table 2 Effect of adding organic solvent on enzymatic resolution |
由表 2可知, 加入二氯甲烷的酶促拆分效果较好, 得到了85%C值和68%的ees值; 加入正己烷后S-布洛芬乙酯的剩余率较低; 而添加其它溶剂后, 水解反应几乎不能发生.紧接着又考察了二氯甲烷添加量(20~300 μL)对酶促拆分效果的影响; 由表 3可知, 当添加50 μL二氯甲烷时, 拆分效果较好, 因此选择添加50 μL二氯甲烷进行后续研究.
| 表 3 二氯甲烷添加量对酶促拆分效果的影响 Table 3 Effect of the amount of CH2Cl2 on the enzymatic resolution |
接下来考察了CAL-B用量对拆分效果的影响, 结果如图 2所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 5~18 mg CAL-B, 80 mg曲拉通X-100, 50 μL二氯甲烷, 950 μL缓冲溶液(pH=7.0), 30 ℃反应3 d.

|
图 2 CAL-B用量对酶促拆分效果的影响 Fig.2 Effect of enzyme loading on the enzymatic resolution |
由图 2可得, 随着CAL-B用量的增加, C值逐渐减少, 而ees值则在酶量为15 mg时取得最高值87%.综合考虑C值和ees值, 选择15 mg为CAL-B最佳用量.
2.4 温度对酶促拆分效果的影响温度不仅影响水解反应速率, 还会影响酶的结构和活性.因此, 进一步考察了温度对酶促拆分效果的影响, 结果如图 3所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 10 mg CAL-B, 80 mg曲拉通X-100, 50 μL二氯甲烷, 950 μL缓冲溶液(pH=7.0), 20~60 ℃反应3 d.
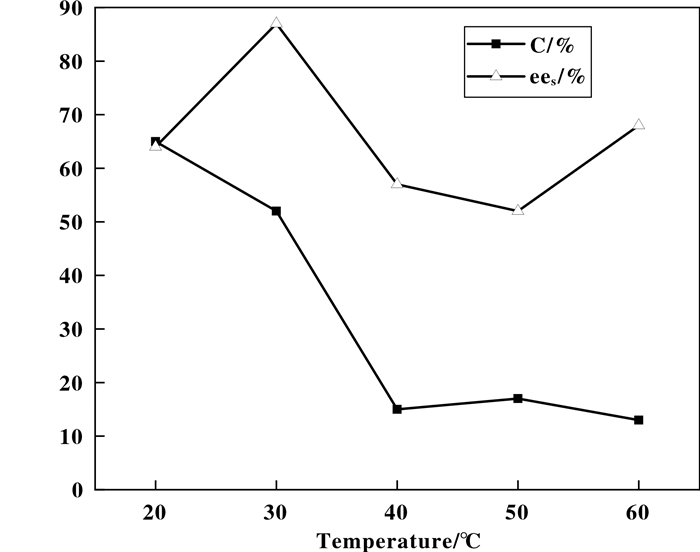
|
图 3 温度对酶促拆分效果的影响 Fig.3 Effect of temperature on enzymatic resolution |
综合考虑C值和ees值, 最终选择30 ℃为最适反应温度.
2.5 pH对酶促拆分效果的影响缓冲溶液的pH也是影响拆分效果的重要因素, 因此探索了pH对水解拆分效果的影响, 结果如表 4所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 15 mg CAL-B, 80 mg曲拉通X-100, 50 μL二氯甲烷, 950 μL缓冲溶液(pH=6.0~10.0), 30 ℃反应3 d.
| 表 4 pH对酶促拆分效果的影响 Table 4 Effect of pH on enzymatic resolution |
由表 4可知, 当pH为9.0时, ees值最高, 可达到98%, 但C值仅有37%;当pH大于或小于9.0时, 虽然其C值较大, 但ees值却较低, 因此, 选择pH 9.0为缓冲溶液的最佳pH值.
2.6 反应时间对酶促拆分效果的影响最后对反应时间进行优化, 结果如图 4所示.反应条件: 0.0234 g(0.1 mmol)布洛芬乙酯, 15 mg CAL-B, 80 mg曲拉通X-100, 50 μL二氯甲烷, 950 μL缓冲溶液(pH=9.0), 30 ℃反应12~96 h.

|
图 4 反应时间对酶促拆分效果的影响 Fig.4 Effect of reaction time on enzymatic resolution |
随着反应时间的延长, C值逐渐降低, ees值则逐渐增大; 当反应48 h时, ees值为94%, C值为63%;继续增加反应时间, ees值虽然有所提高, 最高可达到98%, 但S-布洛芬乙酯的剩余率却较低.因此, 最终选择48 h为最佳反应时间.
综上所述, CAL-B催化拆分布洛芬乙酯的最佳反应条件为:在950 μL缓冲溶液(pH=9.0)中加入0.0234 g(0.1 mmol)布洛芬乙酯、15 mg CAL-B、80 mg曲拉通X-100和50 μL二氯甲烷, 于30 ℃恒温培养振荡器中反应48 h(200 r/min), ees值可达94%, C值为63%(图 5).

|
图 5 反应体系的高效液相色谱图 Fig.5 High performance liquid chromatogram of reaction system Peak 1: S-ibuprofen ethyl ester; Peak 2: R-ibuprofen ethyl ester; Peak 3: S-ibuprofen; Peak 4: R-ibuprofen |
底物结构也是影响酶促反应立体选择性的一个重要因素.在确定了酶促拆分的最佳条件后, 又选取了一系列的布洛芬酯进行酶促水解反应, 结果如表 5所示.由表 5可知, CAL-B仅对布洛芬乙酯的拆分效果较好, 对布洛芬甲酯和布洛芬丙酯的拆分效果较差; 而其它结构的布洛芬酯, 水解反应几乎不发生.因此, 我们仅选择布洛芬乙酯作为酶促水解拆分的底物.
| 表 5 不同结构布洛芬酯的酶促拆分效果 Table 5 Enzymatic resolution of ibuprofen esters with different structures |
我们建立了一种通过布洛芬乙酯的立体选择性酶促水解反应拆分布洛芬的方法.选择了多种结构的布洛芬酯作为酶促反应底物, 但只有布洛芬乙酯的拆分效果较好, 而供试脂肪酶中也只有CAL-B展现出较好拆分活性.在对拆分工艺进行优化时发现, 向950 μL的pH 9.0缓冲溶液中加入80 mg曲拉通X-100作为表面活性剂时, 拆分效果明显改善; 再添加50 μL二氯甲烷后, 拆分效果可达到最佳.
| [1] |
Gi Jin-Song(吉金松), Li Ren-Bao(李仁宝). Study on symmetric synthesis of (S)-(+)-ibuprofen by immobilized enzyme(Study on symmetric synthesis of (S)-(+)-ibuprofen by immobilized enzyme)[J]. J Mol Catal (China)(分子催化), 1997, 11(6): 417–420.
|
| [2] |
Li Ting-ting(李婷婷), Zhao Le-le(赵乐乐), Zhang Min(张敏), et al. Study on preparation and in vitro release of acid-montmorillonitedrug delivery sustained-release systems(Study on preparation and in vitro release of acid-montmorillonitedrug delivery sustained-release systems)[J]. Fine Chem(精细化工), 2018, 35(1): 87–92.
|
| [3] |
Cao Ya-qing(曹雅晴), Tang Lu-hong(汤鲁宏). Green synthesis process of ibuprofen methyl ester(Green synthesis process of ibuprofen methyl ester)[J]. Fine Chem(精细化工), 2013, 30(1): 56–60.
|
| [4] |
Marszałł M P, Tomasz Siódmiak. Immobilization of Candida rugosa lipase onto magnetic beads for kinetic resolution of (R, S)-ibuprofen[J]. Catal Commun, 2012, 24: 80–84.
DOI:10.1016/j.catcom.2012.03.027 |
| [5] |
Evans A M. Comparative pharmacology of S-(+)- ibuprofen and (R, S)- ibuprofen[J]. Clin Rheum, 2001, 20(1): 9–14.
|
| [6] |
Ali I, Gaitonde V D, Aboul-Enein H Y, et al. Chiral separation of β-adrenergic blockers on cellu coat column by HPLC[J]. Talanta, 2009, 78(2): 458–463.
DOI:10.1016/j.talanta.2008.11.043 |
| [7] |
Rotticci D. Understanding and engineering the enantioselectivity of Candida antarctica lipase B towards sec-alcohols[D]. Kemi, 2000.
|
| [8] |
Zhang Yu-xia(张玉霞), Zhao Ji-hua(赵继华), Du Zhong-yu(杜中玉), et al. Enzymatic activity of candida rugosa lipasein an AOT/Triton X-100 mixed reverse micellarsystem(Enzymatic activity of candida rugosa lipasein an AOT/Triton X-100 mixed reverse micellarsystem)[J]. Acta Phys-Chim Sin(Acta Phys-Chim Sin), 2007, 23(9): 1483–1486.
DOI:10.3866/PKU.WHXB20070934 |
| [9] |
王婷婷. Enzymatic separation of ibuprofen esters and polymer prodrugsynthesis[D]. Zhejiang University, 2012.
Wang Ting-ting. Enzymatic separation of ibuprofen esters and polymer prodrugsynthesis[D]. Zhejiang University, 2012.
|
| [10] |
Won K, Hong J K, Kim K J, et al. Lipase-catalyzed enantioselective esterification of racemic ibuprofen coupled with pervaporation[J]. Proce Biochem, 2006, 41(2): 264–269.
DOI:10.1016/j.procbio.2005.07.006 |
| [11] |
Sánchez A, Valero F, Lafuente J, et al. Highly enantioselective esterification of racemic ibuprofen in a packed bed reactor using immobilisedRhizomucormiehei lipase[J]. Enzy Micro Technol, 2000, 27(1): 157–166.
|
| [12] |
Patrícia de O Carvalho, Contesini F J, Bizaco R, et al. Optimization of enantioselective resolution of racemic ibuprofen by native lipase fromAspergillusniger[J]. J Indus Micro & Biotechnol, 2006, 33(8): 713–718.
|
| [13] |
Memarpoor-Yazdi M, Karbalaei-Heidari H R, Doroodmand M M. Enantioselective hydrolysis of ibuprofen ethyl ester by a thermophilic immobilized lipase, ELT, from, Rhodothermusmarinus[J]. Biochem Eng J, 2018, 130: 55–65.
DOI:10.1016/j.bej.2017.11.016 |
| [14] |
Yang G S, Ying L, Ou Z M, et al. Resolution of ibuprofen ester by catalytic antibodies in water-miscible organic-solvents[J]. Chin J Chem Eng, 2009, 17(3): 506–512.
DOI:10.1016/S1004-9541(08)60238-4 |
| [15] |
Gonawan F N, Yon L S, Kamaruddin A H, et al. Effect of co-solvent addition on the reaction kinetics of the lipase-catalyzed resolution of ibuprofen ester[J]. J Chem Technol & Biotechnol, 2013, 88(4): 672–679.
|
| [16] |
Gao B, Li Y, Chen L. Surface molecularly-imprinted material for enantiomericresolution of ibuprofen: preparation and study on chiral recognition and resolution property[J]. Inter J Poly Mater Polym Biomater, 2018, 67(10): 635–645.
DOI:10.1080/00914037.2017.1383253 |
| [17] |
Carla José, María Victoria Toledo, Briand L E. Enzymatic kinetic resolution of racemic ibuprofen: past, present and future[J]. Crit Rev Biotechnol, 2015, 36(5): 891–903.
|
| [18] |
Yousefi M, Mohammadi M, Habibi Z. Enantioselective resolution of racemic ibuprofen esters using different lipases immobilized on octylsepharose[J]. J Mol Catal B: Enzym, 2014, 104: 87–94.
DOI:10.1016/j.molcatb.2014.03.005 |
| [19] |
Li X, Huang S S, Xu L, et al. Improving activity and enantioselectivity of lipase via immobilization on macroporous resin for resolution of racemic 1-phenylethanol in non-aqueous medium[J]. BMC Biotechnol, 2013, 13(1): 92–103.
DOI:10.1186/1472-6750-13-92 |
| [20] |
Siódmiak , Tomasz , Ziegler-Borowska M, et al. Lipase-immobilized magnetic chitosan nanoparticles for kinetic resolution of (R, S)-ibuprofen[J]. J Mol Catal B: Enzym, 2013, 94(10): 7–14.
|
| [21] |
Zhao D, Yue H, Chen G, et al. Enzymatic resolution of ibuprofen in an organic solvent under ultrasound irradiation[J]. Biotechnol Appl Biochem, 2014, 61(6): 655–659.
DOI:10.1002/bab.1229 |
| [22] |
Lorincz , László , Bánsághi , et al. Diastereomeric salt precipitation based resolution of ibuprofen by gas antisolventmethod[J]. J Super Flu, 2016, 118: 48–53.
DOI:10.1016/j.supflu.2016.07.021 |
 2019, Vol. 33
2019, Vol. 33


