2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, China
多取代烯烃作为自然界中一种常见的有机化合物, 该结构单元在药物分子、天然产物以及材料合成等领域中有着重要的地位[1-6].然而多取代烯烃的传统合成方法往往存在诸多不足, 如常需要制备结构特殊的底物, 同时为了控制反应的立体选择性, 常常需要使用各种活泼有机金属化合物[7-11].近年来, 随着烯基偕二硼化合物的出现, 其为高立体选择性制备多取代烯烃提供了强有力的手段.同时, 相比有机金属化合物, 烯基偕二硼类化合物还具备稳定性高、毒性低等优点.化学工作者对烯基偕二硼的探索和研究不断取得突破.在制备方法上, 从早期的无过渡金属催化方法发展到后来的过渡金属催化, 并采用均多相催化相结合的方式, 这些都极大拓展了烯基偕二硼的合成方法; 在应用研究上, 烯基偕二硼主要可以用来高立体选择性地制备多取代烯烃化合物, 而该类化合物往往较难通过其他合成方法得到[12-14].我们将对烯基偕二硼化合物的合成及具体应用作详细的阐述.
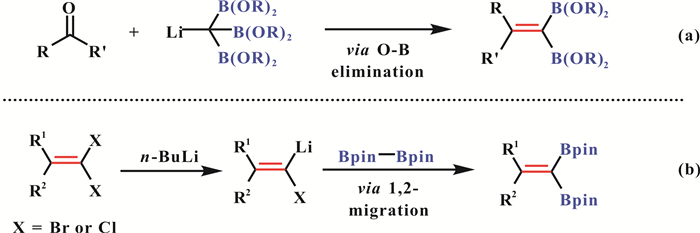
1 无过渡金属催化的烯基偕二硼合成1975年, Matteson课题组[15]首次实现了无过渡金属参与的烯基偕二硼化合物的合成.该方法首先通过四硼酸酯甲烷与碱作用得到碳负离子中间体, 随后与亲电试剂醛或酮反应, 最后发生B-O消除得到烯基偕二硼化合物(图 1, a). 2001年, Hiyama和Shimizu课题组[16]报道了通过1, 1-二卤代烯烃或1-卤代烯烃在锂试剂的作用下和联硼试剂反应, 并经过1, 2迁移反应高效制备烯基偕二硼的方法(图 1, b).此外, 当使用联硅硼试剂代替联硼试剂时, 该反应还可以用于制备烯基偕硅硼化合物.
|
图 1 无过渡金属催化的烯基偕二硼的合成 Fig.1 The synthesis of 1, 1-diborylalkene by transition-metal-free condition |
除了烯烃底物外, 2014年, 金铁男课题组[17]报道了一种利用炔基硼化合物来制备烯基偕二硼的新方法(图 2).该方法通过羧酸催化炔基硼酸酯和频哪醇硼烷反应, 可以高立体选择性地得到烯基偕二硼类化合物.该反应底物兼容性广, 不论是烷基或芳基炔都能很好的参与反应.

|
图 2 羧酸催化的烯基偕二硼的合成 Fig.2 Carboxylic acid catalyzed synthesis of 1, 1-diborylalkene |
随后, Sawamura和Ohmiya等[18]报道了LiOtBu催化不同取代末端炔烃与联硼反应合成各种官能化烯基偕二硼的方法, 而该类产物往往很难通过其他方法制备(图 3).该反应可能的机理如下:炔烃在LiOtBu作用下脱质子得到叔丁醇与炔基锂配位的中间体A, 紧接着中间体A作为亲核试剂对联硼试剂进攻形成四配位硼与叔丁醇配位的中间体B, 随后B中硼基对炔烃发生1, 2-迁移得到中间体C, 最后中间体C快速异构化得到烯基偕二硼.值得一提的是该反应巧妙地利用了LiOtBu作为催化剂并通过简单的质子转移巧妙地完成催化循环.该方法也为烯基偕二硼化合物的合成提供了新的思路.

|
图 3 叔丁醇锂催化的烯基偕二硼的合成 Fig.3 LiOtBu catalyzed gem-diborylation of alkynes |
尽管无过渡金属参与的烯基偕二硼化合物的合成已取得了一定的发展, 但其反应种类和数量仍然相对较少.相比较而言, 过渡金属由于其种类繁多, 其催化的烯基偕二硼的合成方法相对更加成熟.因此, 接下来我们将对该部分内容进行详细阐述.
2.1 烯烃作为烯基源过渡金属催化的烯烃与联硼试剂反应制备烯基偕二硼时, 通常经历两次过渡金属-硼(M-B)物种对烯烃双键的迁移插入和β-H消除过程从而得到最终产物(图 4), 且产物主要是以β-芳基类化合物为主.

|
图 4 过渡金属催化烯烃偕二硼化的一般过程 Fig.4 General procedure for transition- metal-catalyzed gem-diborylation of alkenes |
Iwasawa课题组[19-20]分别在2011和2013年报道了3种特定结构的烯烃在[PSiP-Pincer-Pd]催化剂和三乙基铝的作用下制备烯基偕二硼化化合物的方法.当选择苯乙烯、二茂铁乙烯、N-乙烯基邻苯二酰亚胺等三类烯烃底物时, 该反应通过调控催化剂苯环上的取代基和硼源的当量就可以分别高选择性地制备烯基偕二硼和烯基硼化合物(图 5, a).值得一提的是, 不同于芳基取代烯烃, 当使用烷基烯烃时, 在相同反应条件下主要得到1, 2-二硼烯烃化合物.

|
图 5 烯烃作为烯基源制备烯基偕二硼的反应 Fig.5 The synthesis of 1, 1-diborylalkene by using alkene as substrate |
2017年, 黄正课题组[21]报道了苯乙烯类化合物和联硼试剂在催化剂[tBuPNN-Co]的作用下可以分别高选择性地合成烯基硼和烯基偕二硼类化合物.相比之前Iwasawa报道的方法, 该方法通过使用Pincer-Co催化剂, 仅需改变碱的用量就能控制生成不同单一结构的产物.该方法底物兼容性广, 反应条件温和, 还可以用于复杂结构底物, 如雌酮的偕二硼化.此外, 对于烷基取代烯烃, 同样可以得到1, 2-二硼烯烃产物(图 5, b).
Marder课题组[22]在研究trans-[Rh (Cl)(CO)(PPh3)2]催化苯乙烯类化合物脱氢硼化生成烯基硼时, 发现当溶剂中含有乙腈时, 通过增加联硼试剂用量, 就能够较高选择性地得到烯基偕二硼化合物.该机理尚未明确, 但作者认为CH3CN的存在是生成烯基偕二硼的关键, 主要原因可能是乙腈的强配位能力加快了β-H消除反应的速率(图 5, c).
除了均相催化过程, 最近, Yamaguchi和Jin等[23]使用非均相催化的方法, 通过使用Al2O3负载Cu(OH)2作为催化剂实现了烯基偕二硼的高效合成.该方法利用金刚烷酮作为氢接受体, 同时该催化剂还能重复利用3~5次(图 5, d).此外, 通过调整催化剂载体和HBpin接受体种类, 该方法还可以用来制备烯基单硼化合物.
最近, Hosoya和Niwa等[24]通过使用烯基硫醚作为反应原料, 发展了一种以Rh为催化剂合成烯基偕二硼的方法(图 6).该方法经历的催化过程如下:催化剂Rh和B2pin2作用后得到Rh-Bpin物种, 之后对烯烃发生迁移插入, 并经历β-S消除得到烯基单硼, 随后再经历一次Rh-Bpin迁移插入和β-H消除过程, 最终得到烯基偕二硼产物.

|
图 6 烯基硫醚的脱硫偕二硼化反应 Fig.6 The desulfanylativegem-diborylation of 2-arylvinylsulfides |
过渡金属催化烯烃的偕二硼化过程大多先经历金属硼物种对烯烃的迁移插入和随后的β-H消除过程, 最终得到烯基偕二硼化合物; 而炔烃由于其不饱和度更高、亲电性更强, 经历的催化过程也与烯烃不尽相同.下面将对几种过渡金属催化炔烃的偕二硼化反应进行详细的描述.
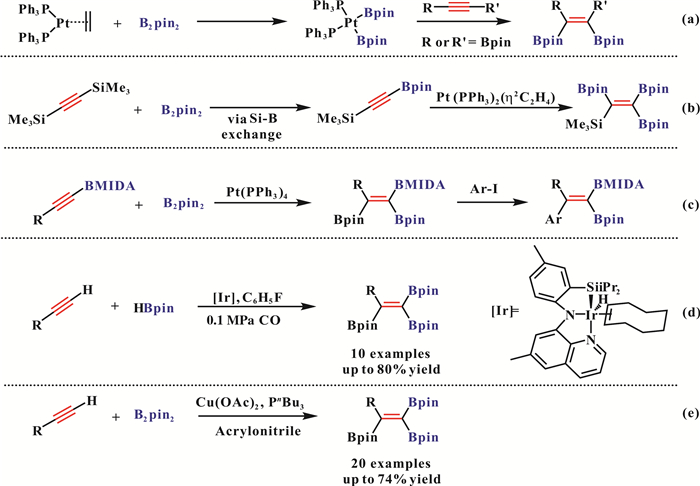
上世纪九十年代, Smith课题组[25-26]发现过渡金属Pt可以作为催化剂使炔烃和联硼试剂作用, 得到联硼对炔烃加成的产物(1, 2-二硼基烯烃)(图 7, a).此外作者通过单晶表征实验证明了反应的中间体为金属Pt-B物种.随后, Marder课题组[27]发现当使用双(三甲基硅基)乙炔时, 底物会首先和联硼发生Si-B交换, 再在Pt催化剂的作用下进一步反应得到目标产物, 这也是第一次用炔烃作为反应物制备烯基偕二硼类化合物的方法(图 7, b).
|
图 7 炔烃的三硼化反应 Fig.7 Synthesis of triborylalkenes from alkynes |
2013年, Nishihara课题组[28]使用BMIDA取代的苯乙炔作为底物, 同样利用Pt催化剂制备了1, 1, 2-三硼基取代苯乙烯类化合物, 随后通过使用Pd催化剂使该产物和碘苯进行Suzuki偶联反应高选择性地制备烯基偕二硼化合物(图 7, c).而该类化合物往往很难通过传统合成方法制备得到.
2015年, Ozerov课题组[29]报道了一例Ir催化的端炔三硼化反应.反应首先通过端炔和HBpin试剂在常温下发生C-H硼化等到炔基硼化合物.随后加热至55 ℃得到的是单硼和多硼取代的混合物; 有意思的是, 将反应体系脱气后充入CO再于55 ℃反应就可以得到二硼和三硼取代的烯烃产物(图 7, d).遗憾的是, 该反应中CO的具体作用机制尚不清楚.
最近, Marder课题组[30]报道了一种Cu(OAc)2/ nBu3P体系催化端炔制备三硼基烯烃的方法(图 7, e).相比较Ir、Pt等贵金属, 该方法使用廉价易得醋酸铜作为催化剂, 且底物兼容性更好.
2017年, Chirik课题组[31]报道了Co催化末端炔烃和联硼试剂反应高选择性制备烯基偕二硼化合物的方法(如图 8).该方法除了条件温和、底物兼容性好, 当选择非对称联硼试剂时, 同样可以获得很好的反应结果, 这为产物进一步高选择性转化提供了可能.该反应可能的机理如下:首先炔烃和Co催化剂作用得到炔基钴中间体A, 并释放出甲烷, 随后中间体A和B2pin2发生氧化加成得到中间体B, 中间体B发生还原消除后得到炔基硼和Co-B物种, 随后Co-B物种对炔烃发生迁移插入得到中间体D, 最后D和端炔作用发生质子解得到最终产物烯基偕二硼.

|
图 8 Co催化的炔烃制备烯基偕二硼反应 Fig.8 Co-catalyzed gem-diborylation of alkynes |
最近, Ingleson课题组[32]报道了一种通过NHC-Zn催化剂实现端炔和HBpin反应得到烯基偕二硼化合物的方法(图 9).该反应可能的机理如下:首先催化剂前体和HBpin发生转金属化得到催化活性物种X, 随后和端炔作用脱氢得到炔基Zn中间体A, 随后中间体A和HBpin发生转金属化得到炔基硼, 再与Zn-H物种发生炔烃插入得到中间体B, 并与HBpin作用后最终得到烯基偕二硼产物(图 9).

|
图 9 Zn催化端炔的偕二硼化反应 Fig.9 Zn-catalyzed gem-diborylation of alkynes |
烯基偕二硼以硼基为反应位点, 可以发生各种官能化转化. 2001年, Shimizu课题组[33]报道了烯基偕二硼化合物和溴代烯基锂试剂作用后并发生1, 2-迁移得到共轭二烯类化合物的方法(图 10, a).此外, 烯基偕二硼还可以顺利地转化为相应的羧酸、烯基偕二卤化物和三硼化合物等(图 10, b)[31, 34-35].最近, Meek课题组[36]报道了一种Rh催化烯基偕二硼高对映选择性合成手性4-氧代烯基硼的方法, 该产物还可以进一步氧化得到手性1, 4-二羰基化合物(图 10, c).该方法也为1, 4-二羰基化合物的高对映选择性合成和复杂分子的手性构筑提供了新的思路.

|
图 10 烯基偕二硼的合成应用 Fig.10 The synthetic application of 1, 1-diborylalkenes |
Antilla课题组[37-38]曾报道了烯丙基硼和醛在手性磷酸的诱导下, 无需过渡金属催化就可以经过六元环过渡态生成了手性的高烯丙醇化合物(Antilla allylation).最近Murakami和Miura课题组[39]报道了烯基偕二硼化合物在Pd催化剂和手性磷酸的作用下和醛反应生成了反式手性高烯丙醇烯基硼化合物(图 10, d).作者发现Pd催化剂能够诱导烯基偕二硼的双键发生移位生成少量烯丙基偕二硼, 并和醛迅速作用, 随后在常温下实现高烯丙醇烯基硼的高立体选择性合成.
由于烯基偕二硼强大的官能团转化能力, 其在复杂药物分子的合成中也有着重要作用. 2005年, Shimizu课题组[40]报道了利用烯基偕二硼的立体选择性交叉偶联反应来制备四取代烯烃(图 11, a).在Pd催化剂作用下烯基偕二硼和碘代芳烃发生两次Suzuki-Miyaura偶联反应, 成功制备了单一构型的药物分子顺式他莫西芬(Z-Tamoxifen).该药物作为抗乳腺癌药物已应用于临床研究.该方法也为他莫西芬的选择性合成提供了一个重要的手段.随后Nishihara课题组[41]从硅基取代的烯基偕二硼出发实现了四芳基取代烯烃的高效合成(图 11, b).由于四芳基取代烯烃是药物合成和光电材料研究的热门分子, 因此该方法有着潜在的应用价值. 2017年, Chirik课题组[31]利用哌啶甲酸取代的烯基偕二硼原料成功地制备了Tiagabine盐酸盐(图 11, c), 该化合物具有抗惊厥作用, 是一类有效的治疗癫痫的药物.

|
图 11 烯基偕二硼在药物分子合成上的应用 Fig.11 The synthetic application of 1, 1-diborylalkenes in pharmaceutical synthesis |
自从1975年Matteson首次实现烯基偕二硼化合物的合成至今, 该类化合物得到了越来越多化学工作者的关注, 其合成意义及应用价值也被广泛地研究. Hiyama、Sawamura、Marder等课题组对该化合物的合成及应用作了系统的研究工作, 发展了一系列制备烯基偕二硼合成的方法, 并实现了对多取代烯烃、共轭二烯等衍生物的转化.近年来, 伴随着过渡金属催化的发展, 烯基偕二硼的合成方法得到了极大地丰富, 包括从贵金属催化(铂、铱、铑)逐渐发展到廉价金属催化(铜、钴、锌), 从均相催化过渡到均多相结合等.
尽管如此, 目前烯基偕二硼化合物在合成上仍然诸多问题, 如反应的底物大多局限于烯烃和炔烃, 反应通常需要使用过量联硼化合物, 从而导致反应原子经济性较低、应用价值不高等.当前, 化学工作者的主要精力集中在寻找和设计更加经济、高效、绿色的催化反应体系, 从而进一步探索合成烯基偕二硼化合物及其应用价值的新方法.
| [1] |
Aziz J, Brachet E, Hamze A, et al. Synthesis, biological evaluation, and structure-activity relationships of tri- and tetrasubstituted olefins related to isocombretastatin A-4 as new tubulin inhibitors[J]. Org Biomol Chem, 2013, 11(3): 430–442.
|
| [2] |
Tran V, Minehan T G. Lewis acid catalyzed intramolecular condensation of ynol ether-acetals. Synthesis of alkoxycycloalkene carboxylates[J]. Org Lett, 2012, 14(23): 6100–6103.
DOI:10.1021/ol303026v |
| [3] |
Görmen M, Pigeon P, Top S, et al. Synthesis, cytotoxi- city, and COMPARE analysis of ferrocene and[J]. Chem Med Chem, 2010, 5(12): 2039–2050.
DOI:10.1002/cmdc.201000286 |
| [4] |
Banerjee M, Emond S J, Lindeman S V, et al. Practical synthesis of unsymmetrical tetraarylethylenes and their application for the preparation of[J]. J Org Chem, 2007, 72(21): 8054–8061.
DOI:10.1021/jo701474y |
| [5] |
Li H. High regio- and stereo-selective synthesis of polysubstituted alkenes and indane derivatives using N-benzylic sulfonamides as alkylating agents[J]. Chin J Org Chem, 2015, 35(12): 2568–2574.
DOI:10.6023/cjoc201504022 |
| [6] |
He S, Wu Y, Luo F, et al. Nickel-catalyzed coupling of 1, 2-diarylthio-1, 2-diarylalkenes with grignard reagents for synthesis of multi-substituted alkenes[J]. Chin J Org Chem, 2019, 39: 2946–2951.
DOI:10.6023/cjoc201904050 |
| [7] |
Rao S A, Knochel P. Stereospecific preparation of polyfunctional olefins by the carbometalation of alkynes with polyfunctional zinc-copper organometallics. Stereospecific preparation of five-membered carbocycles by intramolecular carbocupration[J]. J Am Chem Soc, 1991, 113(15): 5735–5741.
DOI:10.1021/ja00015a030 |
| [8] |
Ikeda S I, Sato Y. Synthesis of stereodefined enynes by the nickel-catalyzed coupling reaction of alkynyltins, alkynes, and enones[J]. J Am Chem Soc, 1994, 116(13): 5975–5976.
DOI:10.1021/ja00092a061 |
| [9] |
Montgomery J, Savchenko A V. Nickel-catalyzed cyclizations of alkynyl enones with concomitant stereoselective tri- or tetrasubstituted alkene introduction[J]. J Am Chem Soc, 1996, 118(8): 2099–2100.
DOI:10.1021/ja952026+ |
| [10] |
Alexakis A, Coulentianos C, Normant J F. Alkenyl copper reagents-18:Carbocupration of acetylenic acetals and ketals synthesis of manicone, geranial and (E, Z)-2, 4-dienals[J]. Tetrahedron, 1984, 40: 715–731.
DOI:10.1016/S0040-4020(01)91100-7 |
| [11] |
Ishikura M, Takahashi N, Yamada K, et al. A palladium-catalyzed tandem cyclization-cross-coupling reaction using indolylborate as a transfer agent[J]. Tetrahedron, 2006, 62(50): 11580–11591.
DOI:10.1016/j.tet.2006.09.065 |
| [12] |
Marek I J F. Normant synthesis and reactivity of sp3-ge- minated organodimetallics[J]. Chem Rev, 1996, 96(8): 3241–3268.
DOI:10.1021/cr9600161 |
| [13] |
Marek I. Synthesis and reactivity of sp2 geminated organobismetallic derivatives[J]. Chem Rev, 2000, 100(8): 2887–2900.
DOI:10.1021/cr990288e |
| [14] |
Normant J F. 1, 1-Dimetallic reagents for the elaboration of stereoselectively di- or trisubstituted linear substrates[J]. Acc Chem Res, 2001, 34(8): 640–644.
DOI:10.1021/ar000043k |
| [15] |
Matteson D S. Methanetetraboronic and methanetriboronic esters as syntheticintermediates[J]. Synthesis, 1975, 1975(3): 147–158.
DOI:10.1055/s-1975-23686 |
| [16] |
Hiyama T, Shimizu M, Hata T, et al. Geminal difunctionalization of alkenylidene type carbenoids by using interelement compounds[J]. Angew Chem Int Ed, 2001, 40(4): 790–792.
DOI:10.1002/1521-3773(20010216)40:4<790::AID-ANIE7900>3.0.CO;2-T |
| [17] |
Ho H E, Asao N, Yamamoto Y, et al. Carboxylic acid-catalyzed highly efficient and selective hydroboration of alkynes with pinacolborane[J]. Org Lett, 2014, 16(17): 4670–4673.
DOI:10.1021/ol502285s |
| [18] |
Morinaga A, Nagao K, Ohmiya H, et al. Synthesis of 1, 1-diborylalkenes through a bronsted base catalyzed reaction between terminal alkynes and bis(pinacolato)diboron[J]. Angew Chem Int Ed, 2015, 54(52): 15859–15862.
DOI:10.1002/anie.201509218 |
| [19] |
Takaya J, Kirai N, Iwasawa N. Efficient synthesis of diborylalkenes from alkenes and diboron by a new PSiP-pincer palladium-catalyzed dehydrogenative borylation[J]. J Am Chem Soc, 2011, 133(33): 12980–12983.
DOI:10.1021/ja205186k |
| [20] |
Kirai N, Iguchi S, Ito T, et al. PSiP-Pincer type palladium-catalyzed dehydrogenative borylation of alkenes and 1, 3-dienes[J]. Bull J Chem Soc Jpn, 2013, 86(7): 784–799.
DOI:10.1246/bcsj.20130004 |
| [21] |
Wen H, Zhang L, Zhu S, et al. Stereoselective synthesis of trisubstituted alkenes via cobalt-catalyzed double dehydrogenative borylations of 1-alkenes[J]. ACS Catal, 2017, 7(10): 6419–6425.
DOI:10.1021/acscatal.7b02104 |
| [22] |
Coapes R B, Souza F E, Thomas R L, et al. Rhodium catalysed dehydrogenative borylation of vinylarenes and 1, 1-disubstituted alkenes without sacrificial hydrogenation——a route to 1, 1-disubstituted vinylboronates[J]. Chem Commun, 2003, 2003(5): 614–615.
|
| [23] |
Yoshii D, Jin X, Mizuno N, et al. Selective dehydrogenative mono- or diborylation of styrenes by supported copper catalysts[J]. ACS Catal, 2019, 9(4): 3011–3016.
DOI:10.1021/acscatal.9b00761 |
| [24] |
Uetake Y, Isoda M, Niwa T, et al. Synthesis of (2, 2-diborylvinyl)arenes by rhodium-catalyzed desulfanylative gem-Diborylation of 2-arylvinyl sulfides[J]. Org Lett, 2019, 21(13): 4933–4938.
DOI:10.1021/acs.orglett.9b01253 |
| [25] |
Iverson C N, Smith M R. Reactivity of organoplatinum complexes with C6H4O2B-BO2C6H4-syntheses of a platinum diboryl complex with, and without, metathesis of boron boron and metal-carbon bonds[J]. J Am Chem Soc, 1995, 117(15): 4403–4404.
DOI:10.1021/ja00120a025 |
| [26] |
Iverson C N, Smith M R. Mechanistic investigation of stoichiometric alkyne insertion into Pt-B bonds and related chemistry bearing on the catalytic diborylation of alkynes mediated by platinum(Ⅱ) diboryl complexes[J]. Organometallics, 1996, 15(24): 5155–5165.
DOI:10.1021/om960123l |
| [27] |
Lesley G, Nguyen P, Taylor N J, et al. Synthesis and characterization of platinum(Ⅱ)-bis(boryl) catalyst precursors for diboration of alkynes and diynes:Molecular structures of cis-(PPh(3))(2)Pt(B-4-Bu(t)cat)(2), cis-(PPh(3))(2)Pt(Bcat)(2), cis-(dppe)Pt(Bcat)(2), cis-(dppb)Pt(Bcat)(2), (E)-(4-MeOC(6)H(4))C(Bcat)=CH(Bcat), (Z)-(C6H5)C(Bcat)=C(C6H5)(Bcat), and (Z, Z)-(4-MeOC(6)H(4))C(Bcat)=C(Bcat)C(Bcat)=C(4-MeOC(6)H(4))(Bcat) (cat equals 1, 2-O2C6H4; dppe equals Ph(2)PCH(2)CH(2)PPh(2); dppb equals Ph(2)P(CH2)(4)PPh(2))[J]. Organometallics, 1996, 15(24): 5137–5154.
DOI:10.1021/om950918c |
| [28] |
Hyodo K, Suetsugu M, Nishihara Y. Diborylation of alkynyl MIDA boronates and sequential chemoselective suzuki-miyaura couplings:A formal carboborylation of alkynes[J]. Org Lett, 2014, 16(2): 440–443.
DOI:10.1021/ol403326z |
| [29] |
Lee C I, Shih W C, Zhou J, et al. Synthesis of triborylalkenes from terminal alkynes by iridium-catalyzed tandem C-H borylation and diboration[J]. Angew Chem Int Ed, 2015, 54(47): 14003–14007.
DOI:10.1002/anie.201507372 |
| [30] |
Liu X, Ming W, Friedrich A, et al. Copper-catalyzed triboration of terminal alkynes using B2 pin2:Efficient synthesis of 1, 1, 2-triborylalkenes[J]. Angew Chem Int Ed, 2019, 59(1): 304–309.
|
| [31] |
Krautwald S, Bezdek M J, Chirik P J. Cobalt-catalyzed 1, 1-diboration of terminal alkynes:Scope, mechanism, and synthetic applications[J]. J Am Chem Soc, 2017, 139(10): 3868–3875.
DOI:10.1021/jacs.7b00445 |
| [32] |
Procter R J, Uzelac M, Cid J, et al. Low-coordinate NHC-zinc hydride Complexes catalyze alkyne C-H borylation and hydroboration using pinacolborane[J]. ACS Catal, 2019, 9(6): 5760–5771.
DOI:10.1021/acscatal.9b01370 |
| [33] |
Shimizu M, Kurahashi T, Hiyama T. Novel synthesis of 2, 3-bisboryl-1, 3-dienes from 1-bromo-1-lithioethene and 1, 1-bisborylalkenes[J]. Synlett, 2001, 2001: 1006–1008.
DOI:10.1055/s-2001-14647 |
| [34] |
Marder T B. Rhodium(I) catalysed diboration of (E)-styrylboronate esters:Molecular structures of (E)-p-MeO-C6H4-CH〇CH-B(1, 2-O2C6H4) and p-MeO-C6H4-CH2C{B(1, 2-O2C6H4)}3[J]. J Org Chem, 2002, 652(1/2): 77–85.
|
| [35] |
Hiyama T, Shimizu M, Kurahashi T, et al. Geminal dimetalation of alkylidene-type carbenoids with silylboranes and diborons[J]. Tetrahedron, 2002, 58: 6381–6395.
DOI:10.1016/S0040-4020(02)00648-8 |
| [36] |
Liang M Z, Meek S J. Catalytic enantioselective synthesis of 1, 4-keto-alkenylboronate esters and 1, 4-dicarbonyls[J]. Angew Chem Int Ed, 2019, 58(40): 14234–14239.
DOI:10.1002/anie.201907757 |
| [37] |
Jain P, Antilla J C. Chiral brønsted acid-catalyzed allylboration of aldehydes[J]. J Am Chem Soc, 2010, 132(34): 11884–11886.
DOI:10.1021/ja104956s |
| [38] |
Antilla J, Jain P. Allylboration of aldehydes[J]. Synfacts, 2010, 10: 1187.
|
| [39] |
Miura T, Oku N, Murakami M. Diastereo- and enantioselective synthesis of (E)-delta-boryl-substituted anti-homoallylic alcohols in two steps from terminal alkynes[J]. Angew Chem Int Ed, 2019, 58(41): 14620–14624.
DOI:10.1002/anie.201908299 |
| [40] |
Shimizu M, Nakamaki C, Hiyama T, et al. Stereoselective cross-coupling reaction of 1, 1-diboryl-1-alkenes with electrophiles:A highly stereocontrolled approach to 1, 1, 2-triaryl-1-alkenes[J]. J Am Chem Soc, 2005, 127: 12506–12507.
DOI:10.1021/ja054484g |
| [41] |
Jiao J, Hyodo K, Hu H, et al. Selective synthesis of multisubstituted olefins utilizing gem- and vic-diborylated vinylsilanes prepared by silylborylation of an alkynylbo-ronate and diborylation of alkynylsilanes[J]. J Org Chem, 2014, 79(1): 285–295.
DOI:10.1021/jo4024057 |
 2020, Vol. 34
2020, Vol. 34


