2. 中国科学院兰州物理化学研究所 羰基合成与选择氧化国家重点实验室, 甘肃 兰州730000
2. State Key Laboratory for Oxo Synthesis & Selective Oxidation, Lanzhou Institute of Chemical Physics, Chinese Academy of Sciences, Lanzhou 730000, China
阿魏酸(Ferulic acid, 4-羟基-3-甲氧基肉桂酸)是一种常见于多种水果、蔬菜、谷物和植物成分中的酚类化合物, 具有抗氧化、抗癌、抗炎、保护心脏和神经等多种生理学功能[1−3]. 但是由于其所具有的低疏水性、低亲水性以及低稳定性等问题, 极大地限制了阿魏酸在食品、制药、化妆品等行业的应用[4−5]. 阿魏酸衍生物的开发能够通过改变阿魏酸的理化性质, 拓宽其应用范围, 阿魏酸甘油酯就是其中一种常见衍生物. 脂肪酶是制备阿魏酸甘油酯最常用的酶, 不仅能催化酰基甘油酯、硫醇酯、酰胺等物质的水解, 还可在有机溶剂或无溶剂体系中催化酯化合成和转酯反应[6−8]. Xin等[9]尝试利用Candida Antarctica lipase B (N435)脂肪酶为催化剂进行阿魏酸和三油酸甘油的酯交换反应, 分别在有机相、无溶剂体系条件下进行合成反应, 得到最大收率约为51.3%, 并且发现在有机相中进行反应时脂肪酶对体系水活度的要求较高, 水活度较大时酶活性损失较快. 为解决这一问题, Cumming H等[10]以碳酸丙烯酯为溶剂, 在80 ℃的真空条件下以固定化的N435脂肪酶和固定化的Thermomyces lanuginosus lipase (TLL)为催化剂进行咖啡酸甘油酯的合成, 研究表明该方法有助于消除副产物水带来的不利影响, 并且脂肪酶在重复使用4次后仍能保持较高的转化率. 尽管产物的转化率有所提升, 但是底物多羟基甘油的较强极性对脂肪酶的活性有所影响, 脂肪酶的活性及稳定性仍是亟待解决的问题, 并且利用游离酶进行催化合成的过程中, 酶的重复利用也成为一个难题[11−14].
随着纳米技术的不断发展进步, 利用纳米材料的特殊性能进行脂肪酶的杂化修饰成为一种新兴的提高脂肪酶活性和稳定的有效手段[15−16]. 金纳米颗粒(AuNPs)具有良好的比表面积和生物相容性, 因此可作为脂肪酶杂化的金属骨架. Barros H R等[17]将Candida antarctica fraction B (CALB)脂肪酶与纳米金通过不同方式(原位还原法和物理吸附发)进行杂化, 利用荧光光谱、圆二色谱分析杂化后脂肪酶构象的变化, 期望能够阐述纳米材料与酶分子之间的相互作用, 研究表明纳米金在一定程度上能够稳定酶的活性, 并且纳米金的浓度对脂肪酶色氨酸的荧光特性有明显影响. 杂化方法是影响杂化酶活性和稳定性的一个关键因素, 酶与纳米颗粒之间的相互作用会影响酶结构的完整性, 进而影响酶的活性和稳定性. Hinterwirth H等[18]针对胰蛋白酶和纳米金颗粒的生物偶联活、稳定性和重复性进行了系统研究, 研究表明杂化后胰蛋白酶的活性取决于纳米金颗粒的大小和间隔物的长度.
为了进一步提高脂肪酶的活性和稳定性, 利用硼氢化钠法原位还原纳米金制备NaBH4@ AuNPs-CRL杂化酶, 通过控制杂化过程中硼氢化钠的浓度、杂化时间、杂化温度等条件因素, 在脂肪酶分子间和分子内部形成纳米金小颗粒, 通过FTIR、TEM、XPS等方法对杂化酶进行结构的表征, 通过批式操作实验探究杂化酶的批式反应稳定性, 为纳米杂化酶的合成提供一种新思路.
1 材料与方法 1.1 实验材料与设备皱褶假丝酵母脂肪酶(Candida rugosa lipase, CRL, 700 U∙mg−1, 购自美国Sigma公司, U 为酶活性的国际标准单位); 氯金酸(纯度99.9%, 购自国药集团上海试剂公司); 阿魏酸(纯度>99%, 购自苏州畅通化学品有限公司); 甘油(分析纯, 购自天津市天力化学试剂有限公司); 阿拉伯树胶粉(生化试剂, 购自天津市致远化学试剂有限公司); 橄榄油(分析纯, 购自上海源叶生物科技有限公司); 无水乙醇、氢氧化钠等均为分析纯试剂, 购自天津市天力化学试剂有限公司.
ZD-85A气浴恒温振荡器(常州金坛精达仪器制造有限公司); FDU-1200真空冷冻干燥机(东京理化器械株式会社); LRH-70F生化培养箱(上海一恒科学仪器有限公司); UV-2550紫外-可见分光光度计(日本岛津); F-7000荧光分光光度计(日本日立); PerkinElmer 100傅里叶变换红外光谱仪(美国PerkinElmer); Ultimate 3000高效液相色谱仪(Thermo Scientific); Jasco-j810圆二色谱仪(日本Jasco); JEOL 2100透射电镜(日本JEOL).
1.2 CRL脂肪酶催化的阿魏酸甘油酯的合成在反应开始之前, 酶和反应底物需在水活度恒定的密封环境中预平衡2 d, 恒定的水活度由0.3 nm分子筛(aw<0.01)保持. 称取一定量的阿魏酸和甘油置于50 mL的具塞三角瓶中, 向其中添加5 mL二甲基亚砜溶液, 置于30 ℃的摇床中混合30 min后加入一定量的CRL脂肪酶, 密封后置于50 ℃、150 r∙min−1的摇床中进行催化反应, 反应一定时间后, 4 500 r∙min−1的条件下离心20 min去除脂肪酶, 取上清液进行检测. 以底物阿魏酸的转化率和产物产率为指标考察反应时间、底物摩尔比、反应温度、酶添加量等因素的影响, 进行反应体系的优化, 实验平行3次, 利用SPSS 20和Origin 2021进行绘图和数据分析.
NaBH4@AuNPs-CRL杂化酶制备好后, 在底物(阿魏酸/甘油)摩尔比为1∶1、反应时间48 h、温度50 ℃、NaBH4@AuNPs-CRL杂化酶的添加量为50 mg的条件下催化合成阿魏酸单甘油酯, 利用高效液相色谱法测定剩余底物及产物的含量.
1.3 NaBH4@AuNPs-CRL杂化酶的制备方法取50 mL具塞锥形瓶, 向其中分别加入10 mg∙mL−1的CRL酶液10 mL、不同含量浓度为10 mmol∙L−1的NaBH4溶液、0.1 mg∙mL−1的HAuCl4溶液4 mL, 震荡混匀后密封, 置于一定温度的8 000 r∙min−1的摇床中进行原位还原反应, 反应结束后取出酶液倒入截留分子量为12 000 MD透析袋中透析2 h, 经真空冷冻干燥后获得NaBH4@AuNPs-CRL杂化酶粉末(如图1). 以杂化后脂肪酶的比活性为指标, 分别考察NaBH4添加量、杂化时间、杂化温度等因素对杂化酶比活性的影响, 进行NaBH4@AuNPs-CRL杂化酶制备的条件优化, 实验平行3次, 利用SPSS 20和Origin 2021进行绘图和数据分析.

|
图 1 NaBH4@AuNPs-CRL杂化酶催化的阿魏酸甘油酯合成的示意图 Fig.1 Schematic illustration of synthesis of glycerol ferulate catalyzed by NaBH4@AuNPs-CRL hybridase |
荧光光谱检测: 取1 mL 浓度为1 mg∙mL−1 CRL酶液和1 mL 10 mmol∙L−1 NaBH4溶液置于荧光比色皿中, 每隔5 min添加50 μL 1 mg∙mL−1的HAuCl4溶液, 设置激发波长为280 nm, 激发狭缝与发射狭缝为5 nm, 发射波长范围300~700 nm, 电压为700 V, 扫描速度为2 400 nm∙min−1.
红外光谱检测: 分别取商品酶和待测的NaBH4@AuNPs-CRL杂化酶各2 mg, 放入傅里叶变换红外光谱仪中, 先扫描空白背景, 再扫样品(第1次扫描使测力计值达到20, 第2次再扫描即为样品的红外图谱). 扫描范围4 000~400 cm−1, 分辨率4 cm−1. 用PeakFit 4.12软件对其酰胺Ⅰ带(1 700~1 600 cm−1)部分的数据进行分峰, 然后用Gauss函数进行拟合, 得出各子峰的面积和各二级结构的含量, 通过柱状图进行对比分析.
X-射线光电子能谱: NaBH4@AuNPs-CRL杂化酶的X-射线光电子能谱利用美国Thermo Scientific公司的ESCALAB-250Xi型X-射线光电子能谱仪进行分析, 用XPS PeakFit 4.0分峰软件对Au元素的原始数据进行分峰拟合处理.
透射电子显微镜: 将待测的NaBH4@AuNPs-CRL杂化酶溶液滴在具膜的3 mm铜网上, 晾干成膜后进行透射电镜检测, 利用Nano Measurer 1.2软件分析纳米颗粒的大小和粒径分布.
1.5 阿魏酸的转化率和产物产率的计算方法采用高效液相色谱法进行转化率的计算. 取0.5 mL反应后的待测液, 用丙酮稀释10倍, 再用甲醇稀释20倍, 过0.45 μm滤膜后至于样品瓶中待测. 液相色谱柱为C18反相柱, 流动相A液为0.1%冰乙酸, B液为100%甲醇, 柱温35 ℃, 流速1 mL∙min−1, 进样量10 μL, 检测器为紫外检测器, 检测波长为254 nm, 以50%A + 50%B为流动相进行洗脱, 洗脱时间为10 min. 阿魏酸转化率η(%)由公式η (%) = (C0−C1)∕C0 × 100%计算, 其中C0为阿魏酸的初始浓度(mol∙L−1), C1为反应后阿魏酸浓度(mol∙L−1).
1.6 脂肪酶比活性测定采用橄榄油乳化法测定脂肪酶的比活性, 利用去离子水配制质量浓度为50 g∙L−1的阿拉伯树胶粉溶液, 将其与橄榄油以3∶1的体积比混匀, 置于磁力搅拌器上搅拌成乳状液. 取4 mL乳状液和pH为7.5、浓度为0.025 mol∙L−1 PBS溶液5 mL混合后加入10 mg酶, 放入40 ℃电热恒温水浴锅中进行反应, 10 min后加入15 mL无水乙醇终止反应, 加3滴1%无水乙醇-酚酞指示剂, 用0.05 mol∙L−1 NaOH溶液滴定至红色, 保持30 s不褪色后, 记录消耗的NaOH溶液体积. 脂肪酶比活性A (U∙mg−1)由公式 A = (V1 −V2)/(t × 10) × 50的计算得到, 其中V1是待测酶所消耗的NaOH体积量(mL), V2是空白样品所消耗的NaOH体积量(mL), t为反应时间(min).
1.7 CRL酶蛋白杂化效率和残余活性的测定杂化效率是指在杂化过程中成功杂化的酶蛋白占总蛋白的比例. NaBH4@AuNPs-CRL杂化酶制备结束后于4 500 r∙min−1的条件下离心20 min, 上清液是剩余的杂蛋白, 下层沉淀是杂化酶, 将下方沉淀经冷冻干燥处理, 通过橄榄油乳化法测定酶活性, 测定的结果与初始酶活的比值即为酶蛋白的杂化效率.
2 结果与分析 2.1 脂肪酶催化阿魏酸甘油酯合成条件的优化以二甲基亚砜为溶剂进行脂肪酶催化的酯化反应, 以底物阿魏酸转化率和产率为指标, 考察杂化前脂肪酶催化合成阿魏酸甘油酯的最佳合成条件, 结果如图2所示. 从图中可以看出, 反应时间、底物摩尔比、温度和酶用量均显著影响阿魏酸的转化率. 随着反应时间的延长, 副产物的积累导致转化率在48 h后逐渐下降; 反应过程中添加过多的甘油, 可能会加强极性羟基对脂肪酶的影响, 使酶的活性下降; 适当的温度有利于提高分子运动的速度, 降低反应活化能, 过高温度会破坏酶的空间结构, 使酶蛋白部分失活; 在底物含量不变的条件下, 适当增加酶用量能够提高底物转化率和产物产率. 综上, 通过单因素实验得到游离脂肪酶催化合成阿魏酸甘油酯的最佳合成条件为: 底物摩尔比(阿魏酸/甘油, mol/mol)为1∶1, 反应时间48 h, 温度50 ℃, 酶添加量50 mg, 最佳条件下阿魏酸的转化率为96.25%.

|
图 2 阿魏酸甘油酯合成条件的单因素优化 Fig.2 The one-factor optimisation of the conditions for the synthesis of glycerol ferulate (a) Reaction time(1∶1 (ferulic acid/glycerol), 50 ℃, 50 mg CRL); (b) Substrate molar ratio(48 h, 50 ℃, 50 mg CRL); (c) Temperature(1∶1 (ferulic acid/glycerol), 48 h, 50 mg CRL); (d) Amount of CRL(1∶1 (ferulic acid/glycerol), 48 h, 50 ℃) |
将NaBH4作为还原剂添加到含有氯金酸的脂肪酶溶液中, 在适当的条件下进行原位还原反应, NaBH4的添加量、杂化温度、杂化时间会显著影响形成纳米金的粒径和形态, 进而影响杂化后脂肪酶的活性. 因此以脂肪酶的比活性为指标考察了NaBH4的添加量、温度、时间对NaBH4@AuNPs-CRL杂化酶比活性的影响, 结果如图3所示. 研究表明在反应时间相同的条件下, NaBH4的添加量不同影响原位还原形成的晶核数量, 晶核数量与脂肪酶的接触面积及脂肪酶在不同粒径大小的纳米金表面的相对曲率是影响杂化后脂肪酶活性的主要因素[19]. 适当数量的纳米金与脂肪酶的接触面积较大, 能够显著增加杂化酶的比活性. 当杂化温度小于35 ℃时, NaBH4@AuNPs-CRL杂化酶的比活性随温度的升高而增加, 此时分子热运动速度逐渐加快, 有利于脂肪酶活性的提高. 当杂化温度大于35 ℃时, 杂化酶活性迅速下降, 一方面温度较高时纳米金增长的速度加快, 较大粒径的纳米金破坏了脂肪酶的空间结构, 另一方面高温使酶蛋白结构变形、蛋白失活. 随着反应时间的延长, 纳米金不断形成, 增加了脂肪酶催化过程中的电子传递速度, 导致杂化酶的比活性增加. 而当杂化时间超过24 h时, 杂化酶的比活性呈下降趋势, 可能是反应时间过长导致形成的纳米金粒径过大, 破坏了酶蛋白的空间结构. 因此用于合成杂化酶的10 mmol∙L−1 NaBH4的最佳添加量为3 mL、最佳杂化温度应为35 ℃、最佳杂化时间为24 h, 最佳条件下杂化酶的比活性为4.91 ± 0.12 U∙mg−1, 与游离酶(游离酶的比活性为2.95 ± 0.33 U∙mg−1)相比提高了66.44%.

|
图 3 NaBH4@AuNPs-CRL杂化酶制备过程的条件优化 Fig.3 The optimisation of the preparation of NaBH4@AuNPs-CRL hybridases (a) Amount of NaBH4 (10 mL 10 mg∙mL−1 CRL, 30 ℃, 24 h); (b) Temperature (10 mL mg∙mL−1 CRL, 3 mL mmol∙L−1 NaBH4, 24 h); (c)Time(10 mL 10 mg∙mL−1 CRL, 3 mL 10 mmol∙L−1 NaBH4, 35 ℃) |
荧光光谱分析: 借助荧光光谱能够得到原位还原过程中脂肪酶与纳米金之间的相互作用. 图4是激发波长为280 nm时CRL酶液的荧光光谱图, 图中可以看出在352 nm波长处出现了脂肪酶的荧光发射峰, 为CRL脂肪酶结构中的色氨酸产生的荧光效应. 当在固定浓度的酶和NaBH4混合溶液中持续加入HAuCl4溶液时, 发现荧光强度显著降低, 几乎完全猝灭. 产生这种现象的原因可能与原位合成的纳米金有关, 随着HAuCl4浓度的增加, 原位还原合成的纳米金也在持续增加, 而AuNPs粒子与酶之间存在较强的相互作用, 酶与AuNPs的结合导致了荧光的减弱. 除此之外, 在荧光峰中也观察到约5 nm的红移(347 →352 nm), 这可能是由于杂化过程中产生的纳米金使脂肪酶Trp残基附近的微环境发生了变化, 进而影响了杂化酶的催化性能.

|
图 4 NaBH4@AuNPs-CRL杂化酶制备过程的荧光光谱图 Fig.4 The fluorescence spectra of the preparation of NaBH4@AuNPs-CRL hybridases |
红外光谱检测: 图5是游离酶和杂化酶的红外光谱图. 图中3 295 cm−1处为O—H的伸缩振动峰; 1 654 cm−1为C=C伸缩振动峰; 1 531 cm−1处为δN—H弯曲振动峰; 1 122和944 cm−1处为C—N 或C—S伸缩振动峰; 531 cm−1处为—S—S— 的伸缩振动峰. 通过对比发现杂化酶在530 cm−1处对应于S—S键的峰强度明显减弱, 表明二硫键发生断裂, 形成Au—S键, 金硫键是脂肪酶和纳米金之间的主要键合方式. 图中3 295、2 928、1 107 cm−1处伸缩振动的轻微偏移可能是由CRL/NaBH4和AuNPs之间的相互作用引起的.
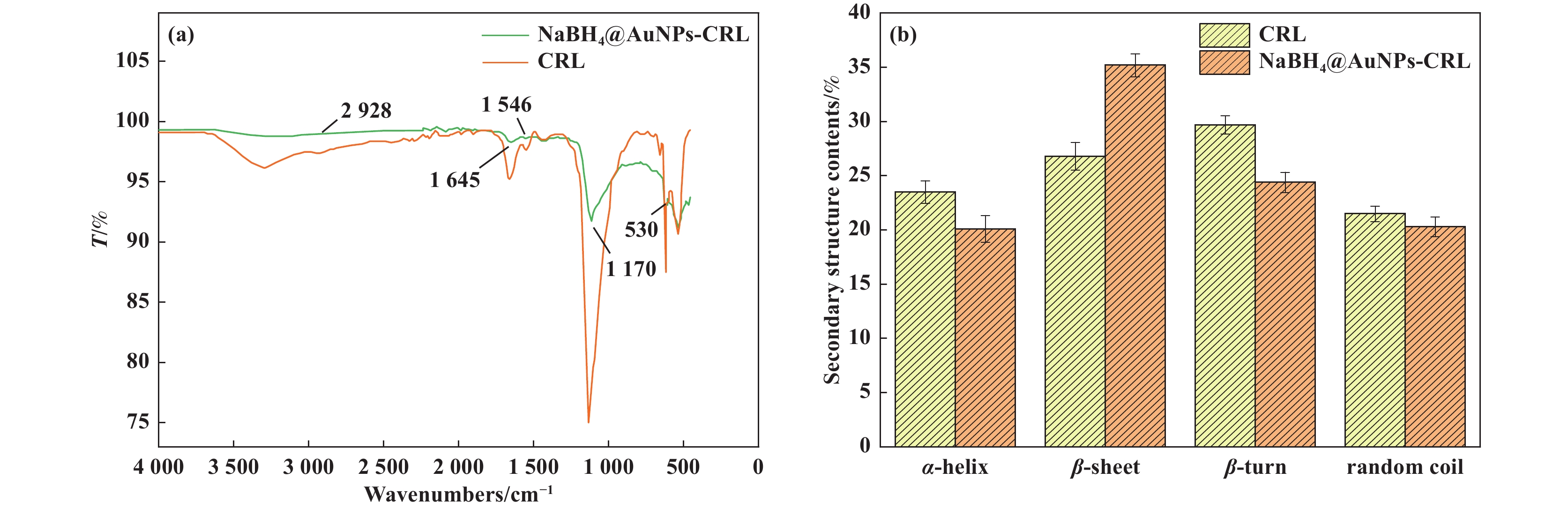
|
图 5 NaBH4@AuNPs-CRL杂化酶的红外光谱图(a)以及各二级结构含量(b) Fig.5 The FTIR spectra of NaBH4@AuNPs-CRL hybridase(a) and the contents of secondary structure(b) |
采用Origin 2021软件对酰胺I带振动区进行二阶求导和傅立叶去卷积处理, 结合二阶导谱和去卷积谱得到的子峰峰位, 进行相应的二级结构构象指认. 将得到的数据绘制成柱形图进行对比分析, 发现杂化后脂肪酶的α-螺旋含量减少了2.3%, β-折叠含量增加了9.3%, β-转角含量降低, 无规则卷曲基本不变, 说明杂化后脂肪酶酶结构变得更加刚性, 这可能是脂肪酶活性提高的主要原因.
X-射线光电子能谱分析: X-射线光电子能谱使检验物质元素组成的有效手段. 图6是最佳条件下合成的杂化酶利用XPS peak分峰软件拟合Au的4f 轨道分峰拟合图及XPS全谱图. XPS能谱显示在84.15和87.8 eV出现了两个Au 4f信号峰, 分别对应Au(0) 4f7/2和4f5/2, 两峰之间的分裂能为3.65 eV, 原始峰与拟合峰重叠度良好, 表明拟合效果较好. XPS数据证明杂化酶中有金单质形成.
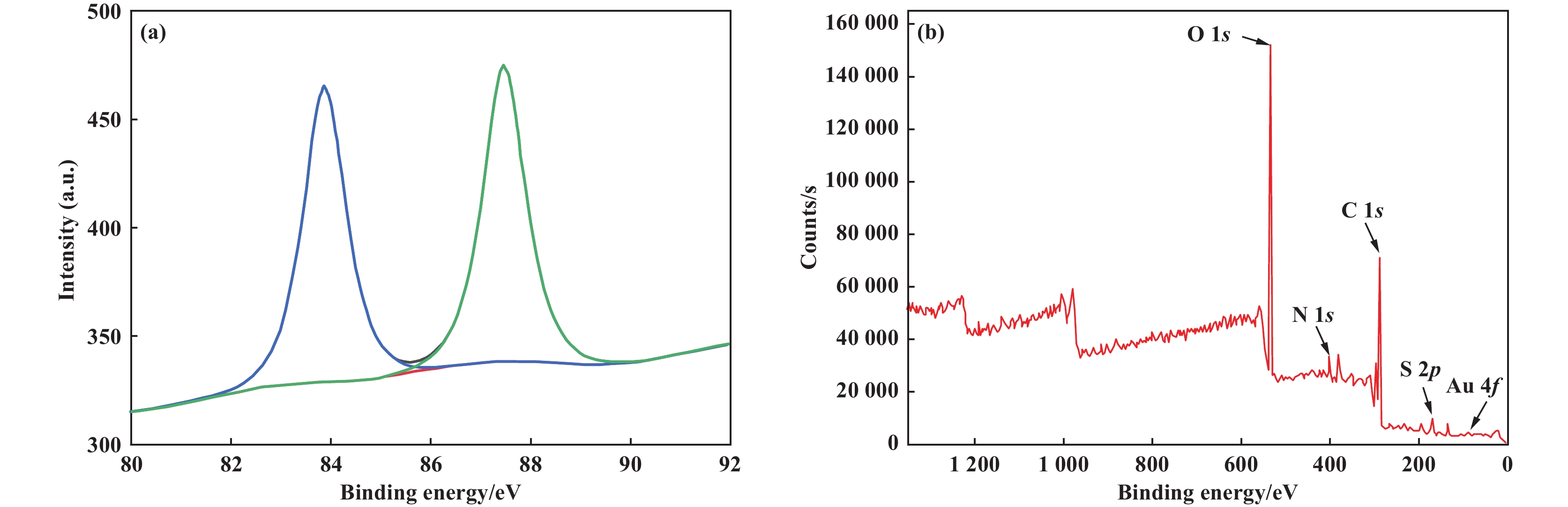
|
图 6 NaBH4@AuNPs-CRL杂化酶的XPS Au 4f 轨道分峰拟合图(a)及全谱图(b) Fig.6 XPS Au 4f orbit peak fitting (a) and full spectra (b) of NaBH4@AuNPs-CRL hybridase |
杂化酶的透射电镜检测: 透射电镜能够直观的检测到纳米金的生成及表面亚显微结构. 图7是NaBH4还原法制备的杂化酶的TEM图, 从图中可以看出, 原位还原形成的纳米金随机分布在体系及脂肪酶内部, 大体上呈圆形或椭圆形, 具有良好的分散性且具有明显的晶格结构, 晶格间距为0.235 nm. 通过纳米金的粒径分布图可以得到最佳条件下合成的纳米金平均粒径为1.29 nm ± 0.5 nm.

|
图 7 NaBH4@AuNPs-CRL杂化酶的透射电镜图及粒径分布图 Fig.7 TEM of NaBH4@AuNPs-CRL hybridase and diagram of particle size distribution |
经实验验证NaBH4@AuNPs-CRL杂化酶与游离酶的最适温度和pH与游离酶相差不大, 因此在游离酶的最佳合成条件下进行在底物摩尔比(阿魏酸/甘油, mmol/mmol)为1∶1、反应时间48 h、温度50 ℃、NaBH4@AuNPs-CRL杂化酶的添加量为50 mg的条件下催化合成阿魏酸单甘油酯, 经过定量计算底物阿魏酸的转化率为98.39% ± 3.65%.
2.5 CRL酶蛋白杂化效率和和残余活性结果分析经测定, 上清液的蛋白浓度为0.121 mg∙mL−1、体积为15.5 mL, 计算可得, 用于杂化的酶的含量占总酶量的25.02%, 游离酶残余活性为60%. 分析杂化效率较低的原因可能与杂化方法有关, 杂化过程中为较好的保证杂化酶的活性, 需要严格控制氯金酸和硼氢化钠的添加量以及杂化时间, 因此该条件下不能促使所有游离酶发生杂化反应, 但是剩余的游离酶可继续添加氯金酸和硼氢化钠来进行杂化, 通过反复杂化后杂化效率有显著提升. 杂化效率较低、杂化过程酶活性损失是本方法的弊端, 后续会针对该问题进一步研究.
2.6 杂化酶的重复利用性分析重复使用稳定性是判断杂化酶性能的一个重要的手段, 因此研究了游离酶与杂化酶的批式反应操作稳定性, 结果如图8所示. 与NaBH4@AuNPs-CRL杂化酶相比, 游离酶在使用4次后其催化阿魏酸的转化率呈现了下降趋势, 而NaBH4@AuNPs-CRL杂化酶能够重复利用7次以上活性都没有明显变化. 在催化阿魏酸和甘油的合成反应用, 含有多羟基的甘油和极性的反应体系在一定程度上抑制酶的催化活性, 使脂肪酶活性下降, 重复使用8次后酶活性下降为原来的55%. 而NaBH4原位还原产生的小粒径纳米金通过金硫键、离子键和吸附作用与脂肪酶紧密结合, 通过对蛋白质二级结构的微调提高酶蛋白催化的活性与稳定性. 重复使用8次后, 转化率下降为原来的89%, 证明NaBH4@ AuNPs-CRL杂化酶表现出了良好的操作稳定性, 并且易于重复利用.
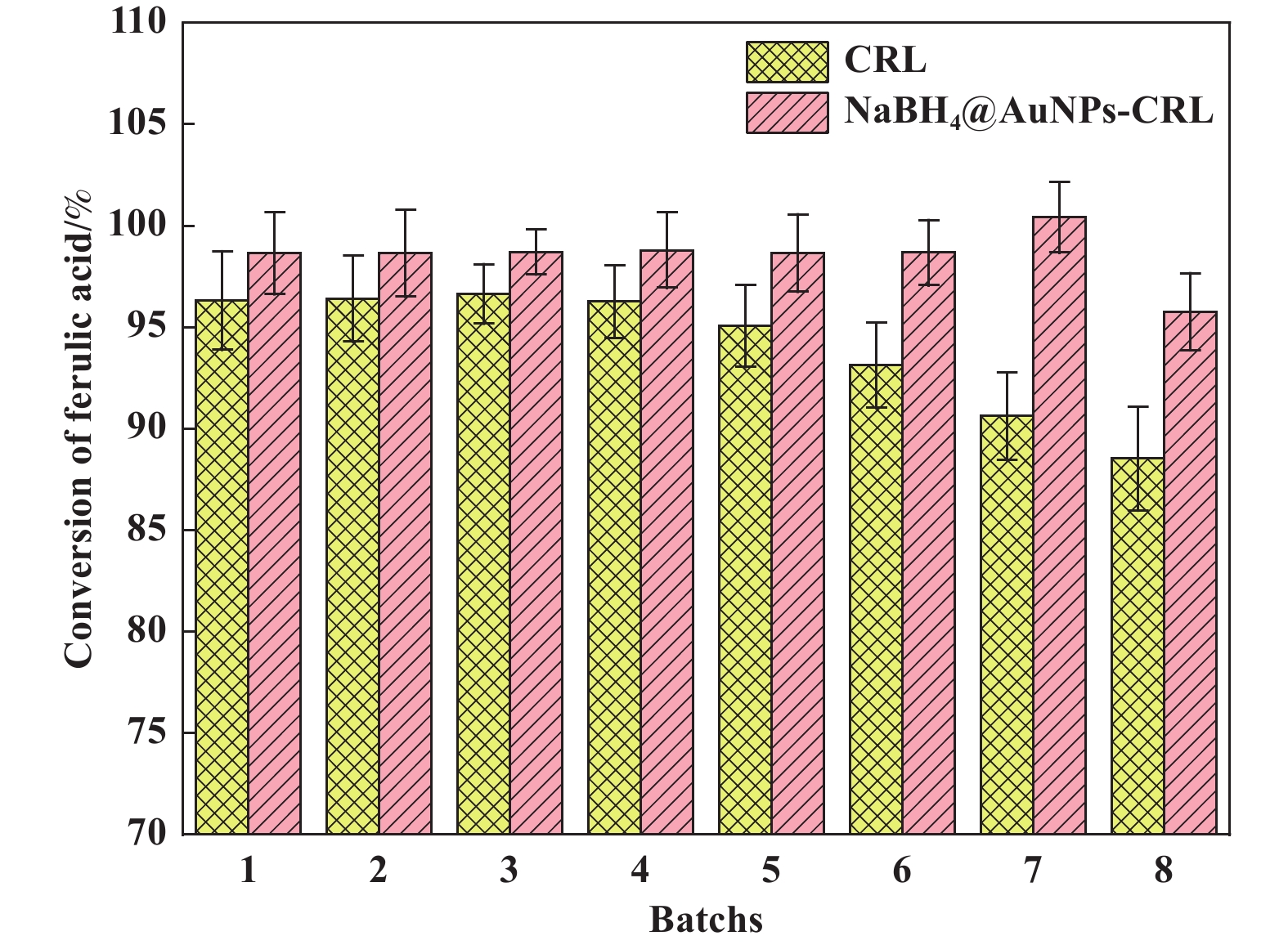
|
图 8 NaBH4@AuNPs-CRL杂化酶的批式反应操作稳定性 Fig.8 The operational stability of the batch reaction of NaBH4@AuNPs-CRL hybridases |
我们以NaBH4作为还原剂, 原位还原氯金酸成功合成了NaBH4@AuNPs-CRL杂化酶, 以杂化酶的比活性为指标对杂化条件进行优化, 得到了最佳杂化条件: 向10 mL 10 mg∙mL−1的CRL酶液中添加4 mL浓度为0.1 mg∙mL−1的HAuCl4溶液和3 mL浓度为10 mmol∙L−1的NaBH4溶液, 混匀后置于35 ℃的摇床中杂化24 h. 利用XPS、TEM、红外、荧光等手段对杂化酶结构进行了表征, 证明杂化酶中有纳米金生成, 杂化过程使酶蛋白的二级结构发生了改变, α-螺旋减小, β-折叠结构增加, 酶蛋白结构向刚性转变. 在最佳条件下利用杂化酶进行阿魏酸甘油酯的合成反应, 得到阿魏酸的转化率为98.39% ± 3.65%. 批式反应的操作稳定性试验显示, 重复使用8次后NaBH4@ AuNPs-CRL杂化酶活性保留了原来的89%. 杂化后酶的活性、稳定性皆有所提高, 为纳米金杂化酶催化阿魏酸酯提供了一种新思路.
| [1] |
Ferulic acid: Pharmaceutical functions, preparation and applications in foods[J]. J Sci Food Agric, 2004, 84(11): 1261–1269.
DOI:10.1002/jsfa.1873 |
| [2] |
Antioxidant properties of ferulic acid and its possible application[J]. Skin Pharmacol Phys, 2018, 31(6): 332–336.
DOI:10.1159/000491755 |
| [3] |
Ferulic acid: A review of its pharmacology, pharmacokinetics and derivatives[J]. Life Sci, 2021, 284: 119921.
DOI:10.1016/j.lfs.2021.119921 |
| [4] |
Extracellular secretion of feruloyl esterase derived from lactobacillus crispatus in escherichia coli and its application for ferulic acid production[J]. Bioresource Technol, 2019, 288: 121526.
DOI:10.1016/j.biortech.2019.121526 |
| [5] |
Ferulic acid in cereals-a review[J]. Czech J Food Sci, 2015, 33(1): 1–7.
DOI:10.17221/401/2014-CJFS |
| [6] |
Lipase-catalysed synthesis of esters of ferulic acid with natural compounds and evaluation of their antioxidant properties[J]. J Mol Catal B-Enzym, 2009, 56(4): 277–282.
DOI:10.1016/j.molcatb.2008.05.017 |
| [7] |
Solvent role in the lipase-catalysed esterification of cinnamic acid and derivatives. Optimisation of the biotransformation conditions[J]. Tetrahedron, 2021, 81: 131873.
DOI:10.1016/j.tet.2020.131873 |
| [8] |
Lipase catalysed transesterification of palm stearin with ferulic acid in solvent-free media[J]. Biocatal Biotransfor, 2022, 40(5): 378–385.
DOI:10.1080/10242422.2021.1949001 |
| [9] |
Chen L L, Xin J Y. Lipase-catalysed synthesis of ferulyl oleins and evaluation of their radical scavenging activity. Proceedings of the 4th International Conference on Bioinformatics and Biomedical Engineering, Chengdu, PR China, Jun 18−20, 2010[C]. New York: IEEE, 2010.
|
| [10] |
Lipase-catalysed synthesis of mono-and di-acyl esters of glyceryl caffeate in propylene carbonate and their antioxidant properties in tuna oil[J]. J Biotechnol, 2021, 325: 217–225.
DOI:10.1016/j.jbiotec.2020.10.021 |
| [11] |
Ultrasound irradiation promoted enzymatic alcoholysis for synthesis of monoglyceryl phenolic acids in a solvent-free system[J]. Ultrason Sonochem, 2018, 41: 120–126.
DOI:10.1016/j.ultsonch.2017.09.016 |
| [12] |
Hydrophilic glyceryl ferulates preparation catalyzed by free lipase b from candida antartica[J]. J Oleo Sci, 2020, 69(1): 43–53.
DOI:10.5650/jos.ess19283 |
| [13] |
Sun Shang-de (孙尚德). Enzymatic synthesis of ferulyl fatty acyl structural ester(酶法合成阿魏酰基脂肪酰基结构酯的研究)[D]. Wuxi (无锡): Jiangnan University(江南大学), 2009.
|
| [14] |
Solvent-free enzymatic preparation of feruloylated monoacylglycerols optimized by response surface methodology[J]. J Agr Food Chem, 2008, 56(2): 442–447.
DOI:10.1021/jf0728911 |
| [15] |
Augmenting apoptosis-mediated anticancer activity of lactoperoxidase and lactoferrin by nanocombination with copper and iron hybrid nanometals[J]. Sci Rep-Uk, 2022, 12(1): 13153.
DOI:10.1038/s41598-022-17357-y |
| [16] |
Nano metal‐organic framework‐derived inorganic hybrid nanomaterials: synthetic strategies and applications[J]. Chem - Eur J, 2017, 23(24): 5631–5651.
DOI:10.1002/chem.201604703 |
| [17] |
Physicochemical study of the interaction between gold nanoparticles and lipase from candida sp. (CALB): Insights into the nano-bio interface[J]. J Brazil Chem Soc, 2019, 30: 2231–2242.
|
| [18] |
Bioconjugation of trypsin onto gold nanoparticles: Effect of surface chemistry on bioactivity[J]. Anal Chim Acta, 2012, 733: 90–97.
DOI:10.1016/j.aca.2012.04.036 |
| [19] |
Small surface, big effects, and big challenges: Toward understanding enzymatic activity at the inorganic nanoparticle–substrate interface[J]. Langmuir, 2018, 35(22): 7067–7091.
|
 2024, Vol. 38
2024, Vol. 38


